中国海洋湖沼学会主办。
文章信息
- 吴金浩, 杜静, 张玉凤, 吴景, 王召会, 田甲申, 宋伦. 2018.
- WU Jin-Hao, DU Jing, ZHANG Yu-Feng, WU Jing, WANG Zhao-Hui, TIAN Jia-Shen, SONG Lun. 2018.
- 海水中苯系物的衰减及其微生物降解的贡献
- ATTENUATION OF BENZENE SERIES IN SEAWATER AND THE CONTRIBUTION OF MICROBIAL DEGRADATION
- 海洋与湖沼, 49(6): 1243-1250
- Oceanologia et Limnologia Sinica, 49(6): 1243-1250.
- http://dx.doi.org/10.11693/hyhz20180100015
-
文章历史
- 收稿日期:2018-01-23
- 收修改稿日期:2018-05-23
2. 辽宁省海洋环境监测总站 大连 116023
2. Liaoning ocean environment monitoring station, Dalian 116023, China
苯系物是指一些常见易挥发的单环芳香烃化合物, 通常包括苯、甲苯、乙苯、对二甲苯、间二甲苯、邻二甲苯以及苯乙烯等多种化合物, 它们在环境中广泛存在, 并且会对人类和环境造成不同程度的危害(范亚维等, 2008)。近些年来, 陆源排污输入、石化企业沿海布局以及海上溢油事故频发等致使苯系物通过各种途径进入海洋, 海洋环境面临着直接威胁。目前受污染海域苯系物的迁移转化和衰减过程研究是海洋环境化学领域急需解决的问题。进入海洋的苯系物可以通过挥发进入大气, 但目前对海水中苯系物挥发动力学却知之甚少(Fingas, 2012); 另一方面海洋微生物种类繁多, 其中存在大量能够降解苯系物的微生物(Yen, 1975; Kasai et al, 2002; Harayama et al, 2004), 且海水温度、光照、溶解氧、营养盐含量等因素各不相同, 使得海水中苯系物的微生物降解过程差异显著(Delille et al, 2009; 苏燕等, 2014)。此外, 海水中苯系物含量对于海上油气勘探具有指示作用, 准确测定海水中痕量苯系物对于海上石油资源勘探具有重要意义(Zhang et al, 2009), 而由于海水中微生物降解, 也一定程度上干扰海水中苯系物含量的准确测定。因此, 开展海水中苯系物挥发、降解等衰减过程研究对于明确海水中苯系物的样品采集、保存和准确测定至关重要, 同时也可为海上石油资源勘探、突发性危化品海上泄漏应急处置提供重要依据和技术参考。然而目前国内外对于苯系物挥发、降解研究主要集中在地下水、土壤等领域(Johnston et al, 1998; You et al, 2013), 对于海水中苯系物微生物降解过程及其对衰减贡献程度的研究尚不多见。因此, 本文利用吹扫捕集-气相色谱质谱分析方法准确测定海水基样品中苯系物含量, 并通过对比模拟实验, 研究不同环境条件下海水中苯系物挥发、降解过程, 并对海洋微生物对苯系物降解贡献率进行了分析探讨。
1 材料与方法 1.1 仪器设备与器皿气质联用仪: Aglient 6890-5975C型, 美国安捷伦公司; 吹扫捕集仪: Tekmar Aqutek100, 美国安普公司; 磨口棕色玻璃瓶: 2L, 烧杯: 2L。
1.2 标准与试剂苯系物混合标准物质(500.0μg/mL, 溶剂为甲醇):由苯、甲苯、乙苯、对二甲苯、间二甲苯、邻二甲苯以及苯乙烯7种组成, 购自北京百灵威科技有限公司; 用纯净水将苯系物标准配置成浓度为2000μg/L的标准使用液。
实验所用海水为天然海水, 取自辽宁省大连市黑石礁近岸海域(38°52.00′N, 121°33.30′E)。首先取一份天然海水, 不作处理, 储存于磨口棕色玻璃瓶中, 备用。而后制备灭活海水, 天然海水用0.22μm醋酸纤维滤膜过滤, 然后煮沸5—10min, 确保海水里微生物被灭活, 之后储存于磨口棕色玻璃瓶中, 冷却, 待用。
1.3 实验方法为区分海水基样品中苯系物挥发和降解两种作用, 采用对比模拟实验来研究海水中苯系物的衰减过程。分别准确量取2份2.0L灭活海水转移到磨口棕色玻璃瓶和烧杯中, 并移取4.0mL苯系物标准使用液, 加入到磨口棕色玻璃瓶和烧杯中, 轻轻混匀, 共配制4份灭活海水基样品, 其苯系物浓度均为4000ng/L, 重复上述步骤用天然海水配置相同浓度的天然海水基样品4份, 分别装在2个相同体积的磨口棕色玻璃瓶和烧杯中。磨口棕色玻璃瓶密封保存模拟底层海水环境, 烧杯敞口保存模拟静态海水, 为研究不同温度下海水中各种苯系物的挥发降解过程, 采取在低温4℃和室温23℃条件下同时进行比较实验, 共配制8组样品, 详见表 1。具体为:天然海水基样品4℃密封保存, 灭活海水基样品4℃密封保存, 天然海水基样品4℃敞口保存, 灭活海水基样品4℃敞口保存; 天然海水基样品23℃密封保存, 灭活海水基样品23℃密封保存, 天然海水基样品23℃敞口保存, 灭活海水基样品23℃敞口保存。磨口棕色玻璃瓶放入密封袋中, 密封保存时, 样品瓶内顶空与密封袋内充高纯氮气, 隔绝空气。
| 实验温度 | 海水类型 | 苯系物初始浓度(ng/L) | 保存方式 | 主要考察衰减方式 |
| 低温4℃ | 天然海水 | 4000 | 密封保存 | 微生物降解 |
| 灭活海水 | 4000 | 密封保存 | 对照空白 | |
| 天然海水 | 4000 | 敞口保存 | 静态挥发+微生物降解 | |
| 灭活海水 | 4000 | 敞口保存 | 静态挥发 | |
| 室温23℃ | 天然海水 | 4000 | 密封保存 | 微生物降解 |
| 灭活海水 | 4000 | 密封保存 | 对照空白 | |
| 天然海水 | 4000 | 敞口保存 | 静态挥发+微生物降解 | |
| 灭活海水 | 4000 | 敞口保存 | 静态挥发 |
将8份海水基样品分别每隔一段时间同时进行取样, 利用吹扫捕集-气相色谱质谱法测定苯系物含量, 每个样品平行测定3次, 计算平均值。
1.5 仪器分析条件 1.5.1 吹扫捕集条件吹扫捕集以高纯氮气(纯度: 99.999%)为吹扫载气, Trap Vocarb3000捕集阱; 吹扫温度为20℃, 吹扫流量为40mL/min, 吹扫时间为7.0min; 解吸温度为250℃, 时间为1.0min; 烘焙温度为280℃, 时间为2.0min; 样品瓶: 40mL, 吹扫管: 10mL, 样品定量环: 5mL, 自动进样。
1.5.2 色谱条件色谱柱: VP—WAXms毛细管柱(30m×0.25mm×0.25μm); 载气:高纯氦气, 载气流速为1.0mL/min; 升温程序:初始温度35℃, 以5℃/min升至80℃; 进样口温度: 180℃; 进样方式:分流进样, 分流比60︰1。
1.5.3 质谱条件离子源: EI源, 电子能量70ev; 离子源温度230℃, 四级杆温度150℃; 溶剂延迟2min; 扫描方式:选择离子扫描。
基于以上分析条件, 苯系物各组分能够实现有效分离, 且灵敏度较高。2000ng/L标准样品选择离子色谱图如图 1所示。
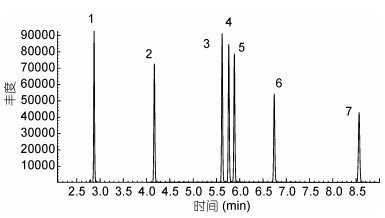 |
| 图 1 苯系物标准选择离子色谱图 Fig. 1 Selected ion chromatograms of benzene series 注: 1.苯; 2.甲苯; 3.乙苯; 4.对二甲苯; 5.间二甲苯; 6.邻二甲苯; 7.苯乙烯 |
按照上述实验条件, 制作浓度为100—5000ng/L标准溶液的标准曲线。7种苯系物线性关系良好, 线性系数均大于0.999, 满足定量分析要求。用灭活海水进行加标实验, 苯系物混合溶液加标浓度为4000ng/L分别进行6次测定, 计算回收率和相对标准偏差, 7种苯系物平均加标回收率为96%—97%, 相对标准偏差为2.1%—3.3%, 加标回收率和精密度良好。仪器分析方法结果满足模拟实验苯系物检测要求, 能够准确测定海水中苯系物浓度。
2 结果与讨论 2.1 灭活海水和天然海水的验证检测天然海水和灭活海水, 经验证未检测出苯系物残留, 利用两者进行实验样品配制合理可行。
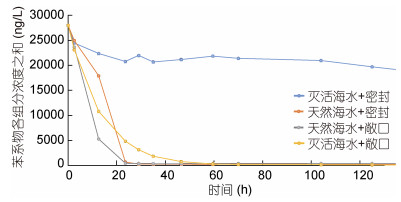
2.2 不同环境条件下苯系物的衰减过程为阐述海水中苯系物衰减过程, 以苯系物各组分浓度之和为纵坐标, 时间为横坐标分别绘制在不同环境条件下灭活海水和天然海水中苯系物浓度之和随时间的变化曲线, 如图 2和图 3所示。
 |
| 图 2 低温4℃条件下海水中7种苯系物浓度之和随时间的变化曲线 Fig. 2 The temporal variation in the total concentration of 7 benzene series in seawater at 4℃ |
 |
| 图 3 室温23℃条件下海水中7种苯系物浓度之和随时间的变化曲线 Fig. 3 The temporal variation in the total concentration of 7 benzene series in seawater at room temperature of 23℃ |
灭活海水中不含降解苯系物的微生物, 所以灭活海水中苯系物衰减是由苯系物挥发引起的。由图 2、图 3可以看出, 低温4℃和室温23℃下密封保存的灭活海水由于阻断了苯系物挥发, 又没有微生物降解, 其苯系物浓度相对比较稳定, 基本不发生变化; 而敞口保存的灭活海水中苯系物衰减则是由静态挥发导致的, 其浓度随时间变化符合挥发动力学一级和零级模型(Liss et al, 1974), 低温4℃和室温23℃条件下, 灭活海水中苯系物各组分浓度之和随时间变化的拟合方程分别为y = 22203e–0.022 x (R= 0.9642)和y = -740.43x + 24604 (R= 0.9219)。室温23℃条件下苯系物挥发更快, 在实验进行60h后, 灭活海水中苯系物的挥发基本结束, 浓度降为最低且不再发生变化, 而低温4℃条件下, 灭活海水中苯系物的浓度变化呈指数下降, 直到125h后才基本结束。
与灭活海水不同, 天然海水中苯系物浓度衰减除静态挥发以外, 同时存在微生物降解作用, 实验中设置样品敞口保存主要是考察海水中苯系物挥发和降解的共同作用, 而密封保存更多是单纯考察海水中苯系物的微生物降解过程。
从实验结果来看(图 2, 图 3), 低温4℃敞口保存条件下, 天然海水与灭活海水中苯系物浓度随时间的变化趋势基本一致, 因此, 该条件下天然海水中苯系物的生物降解几乎不存在, 苯系物浓度衰减是静态挥发导致的, 实验进行至125h左右苯系物浓度基本降为最低值, 苯系物浓度不再发生明显变化。而在室温23℃敞口保存条件下, 天然海水中苯系物浓度降低明显比灭活海水中的快, 除静态挥发以外, 微生物降解作用有所显现, 实验进行24h后, 天然海水中苯系物浓度便迅速降为最低, 而后随时间不再发生明显变化。通过比较分析可以看出, 对于敞口保存条件下天然海水中苯系物的衰减主要是静态挥发导致的。
而密封保存条件下低温4℃时, 天然海水中苯系物浓度在24h之内相对比较稳定, 基本没有发生变化, 之后苯系物发生微生物降解, 苯系物浓度开始呈抛物线状下降, 且其下降速率逐渐加快, 约125 h后天然海水中苯系物浓度几乎降为零, 苯系物浓度值基本不再发生变化。相同条件下室温23℃时, 天然海水中苯系物浓度衰减更剧烈, 在24 h后基本衰减为零, 之后不再发生变化。因此, 海水中微生物的降解对密封保存条件下的天然海水中苯系物浓度变化起了关键作用。
2.3 天然海水中苯系物各组分衰减差异性实验结果表明, 7种苯系物性质十分相似, 在不同保存环境条件下, 天然海水基样品中7种苯系物浓度随时间的变化趋势大体一致, 如图 4所示。低温4℃敞口保存下(图 4a), 天然海水中7种苯系物浓度随时间变化曲线基本保持一致, 初期衰减速率较快, 后期降低, 逐渐趋近于零, 间二甲苯、对二甲苯、乙苯、邻二甲苯、甲苯以及苯乙烯等组分衰减速率相差不大, 苯的衰减速率最小, 大部分苯系物组分浓度在125h左右降到最低; 室温23℃敞口保存下(图 4b), 天然海水中7种苯系物浓度的衰减受到静态挥发和微生物降解共同作用, 7种苯系物浓度随时间变化趋势也基本一致, 大部分苯系物组分在24h左右衰减基本完成, 但苯系物衰减速率呈现先快后慢的趋势, 其衰减速率大小顺序大体表现为间二甲苯 > 邻二甲苯 > 乙苯 > 甲苯 > 苯乙烯 > 对二甲苯 > 苯。
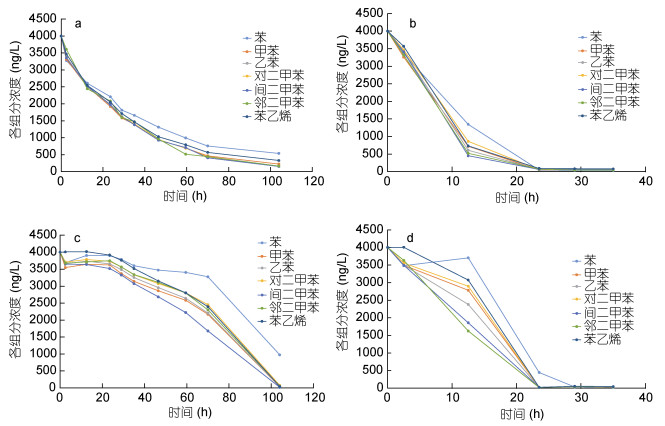 |
| 图 4 不同保存条件下天然海水基样品中7种苯系物浓度的变化曲线 Fig. 4 The variation in concentration of the benzene series in natural seawater under different preservation conditions 注: a.低温4℃敞口保存; b.室温23℃敞口保存; c.低温4℃密封保存; d.室温23℃密封保存 |
与敞口保存不同, 密封保存条件下天然海水中苯系物各组分浓度随时间变化的差异性更加明显。低温4℃密封保存下(图 4c), 天然海水中7种苯系物浓度衰减主要是微生物降解导致的, 大部分苯系物组分在125h左右降解基本完成, 初期7种苯系物浓度变化趋势比较一致, 后期各组分浓度差异逐渐拉大, 其降解率大小顺序大体表现为间二甲苯 > 甲苯 > 乙苯 > 邻二甲苯 > 苯乙烯 > 对二甲苯 > 苯; 室温23℃密封保存下(图 4d), 天然海水中7种苯系物浓度的衰减同样主要是微生物降解导致的, 但大部分苯系物在24 h左右降解完成, 明显比4℃下加快, 苯系物降解速率呈现先慢后快的趋势, 微生物对各组分降解的选择性更加突出, 浓度差异变化更加明显, 其降解率大小顺序大体表现为邻二甲苯 > 间二甲苯 > 乙苯 > 甲苯 > 对二甲苯 > 苯乙烯 > 苯。整体来看, 天然海水基样品中间二甲苯、邻二甲苯相对来说更容易挥发或降解, 而苯乙烯、苯则相对滞后一些。其中苯降解速率相对较慢的结论与国内外很多研究结果较为一致(Lovley, 1997; 胡志峰, 2007)。
2.4 温度对海水中苯系物衰减的影响有研究指出有机物的挥发主要取决于其本身的热力学状态和物理性质, 如水中溶解度、蒸气压、亨利定律常数和扩散系数等, 环境因子也会影响有机溶剂的挥发量, 温度改变苯系物的饱和蒸气压也会改变, 通常温度增加苯系物饱和蒸气压会增加(Cohen et al, 1978; 胡志峰, 2007)。而苯系物各组分在海水水面均匀分布, 其挥发动力来自于液体的蒸汽压与该液体周围空气中的蒸汽压之差, 温度越高, 其挥发动力越大(Nielsen et al, 1995)。通过对比本实验结果可以看出, 海水中苯系物挥发过程受温度影响显著, 室温23℃条件下比低温4℃条件下海水中苯系物浓度降低更快。较高的温度会影响气液分配系数, 加快海水中苯系物各组分的挥发, 室温23℃条件下, 苯系物各组分的气液分配系数高于低温4℃条件, 同样的挥发时间内, 敞口保存下海水中苯系物挥发量较高, 其浓度降低明显。
另一方面, 温度对微生物的生长代谢有着重要的影响, 低温会使微生物降解菌数量增长缓慢, 且生长缓慢代谢活性差, 不利于微生物对苯系物的降解(Price et al, 2004)。实验结果表明, 较高的温度更有利于微生物降解, 室温23℃条件下, 密封保存的天然海水中苯系物浓度迅速下降, 在实验进行至24h后全部得到降解, 而低温4℃条件下, 海水中苯系物全部降解则需要约125h。
进一步分析可以看出, 相同温度下, 不论是敞口保存还是密封保存天然海水中苯系物的衰减期基本相同, 温度为4℃时苯系物衰减完毕时间约125h, 而温度为23℃时时间仅为24h。实验初期, 敞口保存下的天然海水中苯系物浓度下降速率明显比密封保存更快, 海水中苯系物的浓度变化更多的是受挥发作用支配, 但随着时间的推移, 敞口条件下天然海水中苯系物浓度下降速率逐渐放缓, 而密封的天然海水中微生物降解开始发挥作用, 苯系物浓度下降逐步加快并超过敞口条件下, 最终两者几乎同时降为最低值。因此, 温度对于海水中苯系物的挥发以及微生物降解均具有重要影响。
2.5 微生物降解苯系物的贡献率研究指出地表水(包括海水)中大部分苯系物主要以挥发的形式直接进入大气, 少部分苯系物通过生物降解作用去除(Borden et al, 2002), 但有关微生物降解对于苯系物衰减贡献率的估算却研究的较少。海洋中存在多种能够降解苯系物的菌群(Xue et al, 2015), 常见的有: Marinobacter菌属(Huu et al, 1999)、Thalassospira菌属(Plotnikova et al, 2011)、Pseudoalteromonas菌属(Arenghi et al, 2001)、Aestuariibacter菌属(王琳, 2006)、Brevibacterium菌属等(Hendrickx et al, 2006)。苯系物在有氧条件下可以发生微生物降解(孙文静, 2009), 此外, 海水中存在大量的NO3–、SO42–等电子受体, 当深海或底层海水中溶解氧含量较低或氧化还原电位较低时, 海洋环境中的苯系物也可以发生厌氧微生物降解(Daghio et al, 2015; King et al, 2015)。本文实验所用天然海水取自辽宁省大连市周边海域, 已有研究表明Alcanivorax菌属以及Marinobacter菌属为该海域石油烃类物质降解群的主要优势菌(张荣秋, 2013), 同时已有研究曾利用该海域海水培养出多株苯系物降解菌(关晓燕等, 2013, 2016), 确定了该降解菌苯系物降解活性明显。本文实验结果也证明了微生物降解对海水中苯系物浓度衰减具有重要贡献。在扣除相同条件下灭活海水中苯系物挥发损失量的基础上, 给出了不同保存条件下天然海水中苯系物微生物降解贡献率随时间的变化曲线, 如图 5所示。
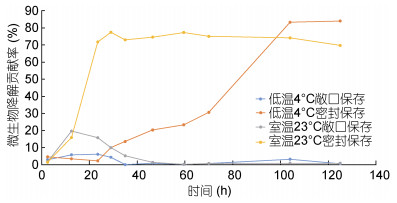 |
| 图 5 不同保存条件下天然海水中苯系物微生物降解贡献率随时间的变化曲线 Fig. 5 The temporal variation in contribution rate of microbial degradation of the benzene series in natural seawater under different preservation conditions |
敞口保存条件下, 天然海水中苯系物衰减是由挥发和微生物降解共同引起的。实验结果表明, 敞口保存条件下, 天然海水中溶解氧含量相对充足, 此时, 苯系物各组分发生好氧微生物降解, 但微生物降解贡献率相对于挥发作用而言比较小, 尤其是低温4℃时苯系物微生物降解受到抑制贡献不明显, 海水中苯系物浓度降低是由挥发作用主导的, 微生物降解贡献率随着时间的推移呈现先增高后降低的趋势, 低温4℃和室温23℃下微生物降解贡献率均在实验进行至12h后达到最高, 贡献率分别为6%和20%, 随着实验进行, 挥发量逐渐加大, 微生物降解贡献率不断降低, 两种温度下最终贡献率均维持在1%左右。因此, 本实验敞口保存条件下海水中苯系物衰减是由其静态挥发主导的, 好氧微生物降解贡献率很小。
密封保存条件下, 海水中溶解氧得不到补充, 苯系物在微生物作用下更容易发生厌氧降解, 在没有挥发作用的情况下微生物降解贡献率明显高于敞口保存时, 室温23℃时, 苯系物微生物降解贡献率快速提升, 海水中苯系物浓度衰减很快结束, 在实验进行至24h后基本达到稳定状态, 最终维持在73%左右。苯系物微生物降解过程受温度影响明显, 低温4℃时, 苯系物微生物降解贡献率相对于室温23℃下增长放缓, 微生物对苯系物的降解受到一定程度的抑止, 在实验24h之内, 苯系物微生物降解贡献率维持在较低水平, 与低温4℃敞口保存条件下较为一致, 但随着时间的进行, 密封保存的天然海水中溶解氧逐渐被微生物消耗并得不到补充, 海水中氧化环境电位迅速下降, 此时海水中的厌氧菌逐渐发挥作用, 厌氧微生物开始快速降解苯系物, 在实验进行至125 h后苯系物微生物降解贡献率基本达到最高值83%, 比室温23℃时苯系物降解更完全。这也进一步验证了其它环境领域利用厌氧菌降解去除苯系物效果更好的结论(Lueders, 2017)。
由此可见, 正常条件下, 天然海水中苯系物浓度衰减主要以挥发为主, 微生物降解贡献较小, 但在适宜温度和厌氧条件下天然海水中厌氧微生物降解对于海水中苯系物去除将起到至关重要的作用, 这对于海上苯系物污染去除具有一定指导意义。
3 结论基于吹扫捕集-气相色谱质谱分析方法, 研究不同环境条件下海水中苯系物的挥发、降解等衰减过程, 结果表明: 7种苯系物性质相似, 在不同保存条件下, 其苯系物各组分浓度随时间的变化趋势基本一致。整体来看, 天然海水中间二甲苯、邻二甲苯相对更容易挥发或降解, 而苯乙烯、苯则相对滞后。海水中苯系物的挥发、降解过程受温度影响显著。不论是密封保存还是敞口保存, 室温23℃条件下比低温4℃条件下海水中各苯系物浓度降低更快。低温4℃时苯系物衰减完毕时间约125h, 而室温23℃时仅为24h。此外, 敞口保存条件下, 天然海水中苯系物的衰减主要是静态挥发导致的, 微生物降解贡献率相对较小; 但在密封保存条件下, 苯系物更易发生微生物厌氧降解, 微生物降解贡献率可高达83%, 室温23℃下微生物降解苯系物时间更短, 但低温4℃微生物降解苯系物更彻底。在适宜的温度和厌氧条件下天然海水中厌氧微生物降解对于海水中苯系物的去除将起到更加重要的作用。
致谢 本实验的分析测试工作由利曼中国技术工程师邵云鹏等协助完成, 在此表示感谢。| 王琳, 2006.海洋苯系物降解菌的多样性及降解特性的初步研究.厦门: 国家海洋局第三海洋研究所硕士学位论文, 10-11 |
| 关晓燕, 董颖, 王摆, 等, 2013. 1株海洋石油降解菌的筛选鉴定及其固定化研究. 辽宁师范大学学报(自然科学版), 36(3): 400–405 |
| 关晓燕, 董颖, 王摆等, 2016-04-13.一株海洋柴油降解菌QPH-9及其固定化方法: 中国, CN105483037A |
| 孙文静, 2009. BTEX降解菌的驯化及其好氧降解规律的研究.天津: 天津大学硕士学位论文, 10-11 |
| 苏燕, 孙超, 赵勇胜, 等, 2014. BTEX污染含水层中氧化还原环境的空间变化. 土木建筑与环境工程, 36(2): 126–130 |
| 张荣秋, 2013.大连湾石油烃降解菌以及白令海和楚科齐海表层沉积物中多环芳烃降解菌多样性研究.厦门: 厦门大学硕士学位论文, 45-52 |
| 范亚维, 周启星, 2008. BTEX的环境行为与生态毒理. 生态学杂志, 27(4): 632–638 |
| 胡志峰, 2007.土-水系统中苯系物的化学和生物行为研究.青岛: 中国海洋大学博士学位论文, 4-5 |
| Arenghi F L G, Berlanda D, Galli E, et al, 2001. Organization and regulation of meta cleavage pathway genes for toluene o-Xylene derivative degradation in Pseudomonas stutzeri OX1. Applied and Environmental Microbiology, 67(7): 3304–3308 DOI:10.1128/AEM.67.7.3304-3308.2001 |
| Borden R C, Black D C, McBlief K V, 2002. MTBE and aromatic hydrocarbons in North Carolina stormwater runoff. Environmental Pollution, 118(1): 141–152 DOI:10.1016/S0269-7491(01)00204-4 |
| Cohen Y, Cocchio W, Mackay D, 1978. Laboratory study of liquid-phase controlled volatilization rates in presence of wind waves. Environmental Science & Technology, 12(5): 553–558 |
| Daghio M, Vaiopoulou E, Patil S A, et al, 2015. Anodes stimulate anaerobic toluene degradation via sulfur cycling in marine sediments. Applied & Environmental Microbiology, 82(1): 297–307 |
| Delille D, Pelletier E, Rodriguez-Blanco A, et al, 2009. Effects of nutrient and temperature on degradation of petroleum hydrocarbons in sub-Antarctic coastal seawater. Polar Biology, 32(10): 1521–1528 DOI:10.1007/s00300-009-0652-z |
| Fingas M F, 2012. Studies on the evaporation regulation mechanisms of crude oil and petroleum products. Advances in Chemical Engineering and Science, 2(2): 246–256 DOI:10.4236/aces.2012.22029 |
| Harayama S, Kasai Y, Hara A, 2004. Microbial communities in oil-contaminated seawater. Current Opinion in Biotechnology, 15(3): 205–214 DOI:10.1016/j.copbio.2004.04.002 |
| Hendrickx B, Junca H, Vosahlova J, et al, 2006. Alternative primer sets for PCR detection of genotypes involved in bacterial aerobic BTEX degradation:distribution of the genes in BTEX degrading isolates and in subsurface soils of a BTEX contaminated industrial site. Journal of Microbiological Methods, 64(2): 250–265 DOI:10.1016/j.mimet.2005.04.018 |
| Huu N B, Denner E B M, Ha D T C, et al, 1999. Marinobacter aquaeolei sp. nov., a halophilic bacterium isolated from a Vietnamese oil-producing well. International Journal of Systematic and Evolutionary Microbiology, 49(2): 367–375 |
| Johnston C D, Rayner J L, Patterson B M, et al, 1998. Volatilisation and biodegradation during air sparging of dissolved BTEX-contaminated groundwater. Journal of Contaminant Hydrology, 33(3-4): 377–404 DOI:10.1016/S0169-7722(98)00079-5 |
| Kasai Y, Kishira H, Harayama S, 2002. Bacteria belonging to the genus Cycloclasticus play a primary role in the degradation of aromatic hydrocarbons released in a marine environment. Appl Environ Microbiol, 68(11): 5625–5633 DOI:10.1128/AEM.68.11.5625-5633.2002 |
| King G M, Kostka J E, Hazen T C, et al, 2015. Microbial responses to the Deepwater horizon oil spill:from coastal wetlands to the deep sea. Annual Review of Marine Science, 7: 377–401 DOI:10.1146/annurev-marine-010814-015543 |
| Liss P S, Slater P G, 1974. Flux of gases across the air-sea interface. Nature, 247(5438): 181–184 DOI:10.1038/247181a0 |
| Lovley D R, 1997. Potential for anaerobic bioremediation of BTEX in petroleum-contaminated aquifers. Journal of Industrial Microbiology and Biotechnology, 18(2-3): 75–81 DOI:10.1038/sj.jim.2900246 |
| Lueders T, 2017. The ecology of anaerobic degraders of BTEX hydrocarbons in aquifers. FEMS Microbiology Ecology, 93(1): fiw220 DOI:10.1093/femsec/fiw220 |
| Nielsen F, Olsen E, Fredenslund A, 1995. Prediction of isothermal evaporation rates of pure volatile organic compounds in occupational environments-a theoretical approach based on laminar boundary layer theory. The Annals of Occupational Hygiene, 39(4): 497–511 DOI:10.1016/0003-4878(95)00032-A |
| Plotnikova E G, Anan'ina L N, Krausova V I, et al, 2011. Thalassospira permensis sp. nov., a new terrestrial halotolerant bacterium isolated from a naphthalene-utilizing microbial consortium. Microbiology, 80(5): 703 DOI:10.1134/S0026261711050109 |
| Price P B, Sowers T, 2004. Temperature dependence of metabolic rates for microbial growth, maintenance, and survival. Proceedings of the National Academy of Sciences of the United States of America, 101(13): 4631–4636 DOI:10.1073/pnas.0400522101 |
| Xue J L, Yu Y, Bai Y, et al, 2015. Marine oil-degrading microorganisms and biodegradation process of petroleum hydrocarbon in marine environments:a review. Current Microbiology, 71(2): 220–228 DOI:10.1007/s00284-015-0825-7 |
| Yen T F, 1975. Genesis and degradation of petroleum hydrocarbons in marine environments. ACS Symposium Series, 18: 231–266 DOI:10.1021/symposium |
| You Y, Shim J, Cho C H, et al, 2013. Biodegradation of BTEX mixture by Pseudomonas putida YNS1 isolated from oil-contaminated soil. Journal of Basic Microbiology, 53(5): 469–475 DOI:10.1002/jobm.v53.5 |
| Zhang Y, Meng X J, Sun P, et al, 2009. BTEX anomalies used as indicators of submarine oil and gas reservoirs. Acta Oceanologica Sinica, 28(4): 50–56 |
 2018, Vol. 49
2018, Vol. 49


