中国海洋湖沼学会主办。
文章信息
- 李中石, 汪岷, 罗志祥, 刘璐, 夏骏, 宫政, 姜勇, 邵红兵, 陈洪涛, 田纪伟. 2018.
- LI Zhong-Shi, WANG Min, LUO Zhi-Xiang, LIU Lu, XIA Jun, GONG Zheng, JIANG Yong, SHAO Hong-Bing, CHEN Hong-Tao, TIAN Ji-Wei. 2018.
- 马里亚纳海沟浮游病毒垂直分布及动态变化
- VERTICAL DISTRIBUTION AND DYNAMIC VARIATION OF VIRIOPLANKTON IN THE MARIANA TRENCH
- 海洋与湖沼, 49(6): 1251-1258
- Oceanologia et Limnologia Sinica, 49(6): 1251-1258.
- http://dx.doi.org/10.11693/hyhz20180400105
-
文章历史
- 收稿日期:2018-04-27
- 收修改稿日期:2018-08-04
2. 中国海洋大学海洋生物多样性与进化研究所 青岛 266003;
3. 中国海洋大学化学化工学院 青岛 266100;
4. 物理海洋教育部重点实验室(中国海洋大学) 青岛 266003;
5. 青岛海洋科学与技术国家实验室 青岛 266003
2. Institute of Evolution and Marine Biodiversity, Ocean University of China, Qingdao 266003, China;
3. College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China;
4. Key Laboratory of Physical Oceanography(Ocean University of China), Ministry of Education, Qingdao 266003, China;
5. Qingdao National Laboratory for Marine Science and Technology, Qingdao 266003, China
自然海洋中深度超过6000m的深海区域主要存在于深渊海沟区域, 地形上的相对隔离使得这些深渊海沟环境条件独特。之前的研究表明在海沟区域内, 除海沟底部极高的静水压力(最深处高达11197db)外, 温度、盐度等多数物理化学因子并未表现出较明显的差异(Taira et al, 2005; Jamieson et al, 2010)。独特而极端的环境状况使得深渊海沟成为研究深海生态系统最佳区域。挑战者深渊(Challenger Deep)位于马里亚纳海沟, 作为世界上最深的区域, 数十年前就受到了深海研究者的广泛关注。有研究发现马里亚纳海沟底部沉积物中存在极高的微生物碳循环率(Glud et al, 2013); 而海沟中新分离的嗜压菌种则表现出与浅层海水中的近亲极为不同的基因组成(Lauro et al, 2007); 浅层海水与深渊区域海水微生物群落也表现出明显的差异性(Nunoura et al, 2015)。但是, 和其他区域相比, 深渊海沟的生态学研究依然有很大的空缺。
海洋浮游病毒, 作为海洋中数量最为丰富的类群, 在全球海洋生态系统中扮演着至关重要的角色(Wommack et al, 2000; Suttle, 2005)。关于海洋浮游病毒的研究越来越受到关注, 但是却很少涉及深海极端环境下的浮游病毒。有报道表明数千米海底的沉积物中, 病毒通过提供活性有机物质对沉积物中的生物化学循环起到重要作用(Danovaro et al, 2008; Dell’Anno et al, 2015)。Nunoura等(2015)对于马里亚纳海沟的研究也揭示了深渊海沟水体中存在较高的病毒丰度以及较高的VBR(virus-bacteria rate, 病毒细菌比)。为了更全面地揭示浮游病毒在深渊海沟极端环境下的生态动力学特征, 本文对马里亚纳海沟挑战者深渊水体浮游病毒丰度以及浮游病毒生产力进行了研究, 并分析了浮游病毒裂解宿主的营养物质释放及浮游病毒与环境因子间的相关关系。
1 材料与方法 1.1 研究区域本研究的海水样品于2015年12月采集自马里亚纳海沟最深处挑战者深渊(11.34830°N, 142.19160°E), 调查站位如图 1。共采集6个层次样品, 水深分别为0、991、1759、3699、5367及8727m。海水温度、盐度、深度等环境参数由船载CTD(SBE19-CTD)测得。
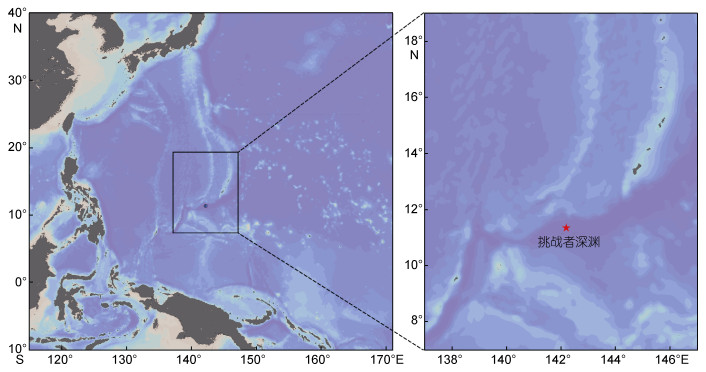 |
| 图 1 马里亚纳海沟研究站位示意图 Fig. 1 The research station in the Mariana Trench |
对于微微型浮游植物丰度样品, 采集3.5mL海水样品加入多聚甲醛溶液使终浓度为1%。对于细菌和浮游病毒丰度样品, 采集4.9mL海水样品加入终浓度为0.5%戊二醛溶液。两类样品均暗置30min固定后, 使用液氮进行速冻, 保存于-80℃冰箱中。丰度测定使用Beckman公司FC500 MPL型流式细胞仪, 微微型浮游植物丰度样品加入荧光微球内参后直接进行测定, 浮游病毒、细菌丰度样品使用SYBR Green Ⅰ核酸染剂染色后进行测定(Marie et al, 1999)。
1.3 病毒生产力裂解性病毒生产力使用稀释培养法(dilution technique)进行测定(Wilhelm et al, 2002, 2010)。600mL海水样品过20μm孔径筛绢后, 使用0.22μm孔径聚偏二氟乙烯(PVDF)膜包切向流系统处理, 对海水样品中的细菌进行浓缩, 同时过滤得到无菌海水。再使用30kDa孔径切向流膜包对无菌海水进行处理得到无病毒海水。将无病毒海水与浓缩细菌海水混合得到稀释培养体系, 每层分装于三个50mL离心管中作为平行样品。使用恒温金属浴在原位海水温度下对培养体系进行避光培养24h, 并从0h起每3h取样一次, 每个培养体系取样4.9mL, 所取样品的处理和测试方法同病毒丰度样品。
裂解性浮游病毒生产力的计算方法公式如下, 其中VP代表病毒生产力(viral production), Vmaxn与Vminn分别代表在第n个病毒丰度净增长过程中病毒丰度的最大值和最小值, tmaxn与tminn分别代表第n个病毒丰度净增长过程结束和开始的时间:
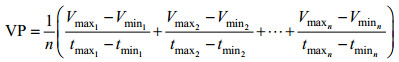
计算得到培养体系中的裂解性病毒生产力后根据培养体系与原位海水中的细菌丰度换算为原位海水的裂解性病毒生产力。
1.4 VMM及有机物质释放量病毒导致的细菌死亡率(VMM, virus-mediated bacteria mortality)由裂解性浮游病毒生产力除以裂解量(burst size)得到。本研究根据Parada等(2006)的数据假定研究站位平均病毒裂解量为18。每小时病毒导致的浮游细菌的折损率通过VMM除以原位海水中的浮游细菌丰度得到。病毒裂解宿主的碳释放量及氮释放量通过VMM乘细菌平均碳含量及氮含量得到。根据Fukuda等人(1998)的测定结果, 本研究中假定研究区域的细菌平均碳含量为12.8fg/cell, 平均氮含量为1.8fg/cell。
1.5 统计分析本文对病毒生产力以及浮游病毒丰度与生物因子和环境因子之间的相关关系进行了分析, 使用的方法为斯皮尔曼等级相关(Spearman correlation), 使用的软件为SPSS statistics V22。结果中P值小于0.05判定为显著相关。
2 结果 2.1 环境因子马里亚纳海沟环境因子垂直分布情况如图 2a—2j。其中温度从表层的28℃到3699m降低到1.5℃, 在更深的海沟区域内变化较小。盐度随深度整体表现出轻微的上升趋势, 而溶解氧在991m处降低到2.77mg/L后在5367m明显升高。磷酸盐在991m处明显降低到最低值后又随深度逐渐升高; 硅酸盐的最低点出现在3699m处, 在海沟区域内同样表现出随深度升高的趋势; 而硝酸盐在991m以深表现出较高的水平, 但是在3699m处出现波动。
 |
| 图 2 马里亚纳海沟环境因子及微微型浮游植物丰度垂直分布 Fig. 2 Vertical distribution of environmental parameters and picoplankton abundance in the Mariana Trench |
微微型浮游植物丰度垂直分布状况如图 2k, 2l所示。表层聚球藻丰度为1133.3cells/mL, 微微型真核藻类丰度为111.1cells/mL, 而在991m以深的海水中并未观察到明显的聚球藻和微微型真核藻类分布。聚球藻和微微型真核藻类表现出相似的趋势, 即从表层到991m骤然降低后在极低的范围内波动。微微型浮游植物的分布主要依赖于光照强度, 而在数千米深的深渊海沟区域则为完全无光照的环境, 也就导致结果中几乎检测不到微微型浮游植物存在。
浮游细菌及浮游病毒丰度垂直分布状况如图 3所示。其中浮游细菌丰度随水深变化幅度较大, 各层平均浮游细菌丰度为7.34×104cells/mL最高值出现在表层, 为2.32×105cells/mL。随后在991m处大幅降低后在1759m处出现小幅的高值后继续降低, 最低值2.12×104cells/mL出现在5367m处, 而在深渊海沟内部则表现出轻微的上升趋势。
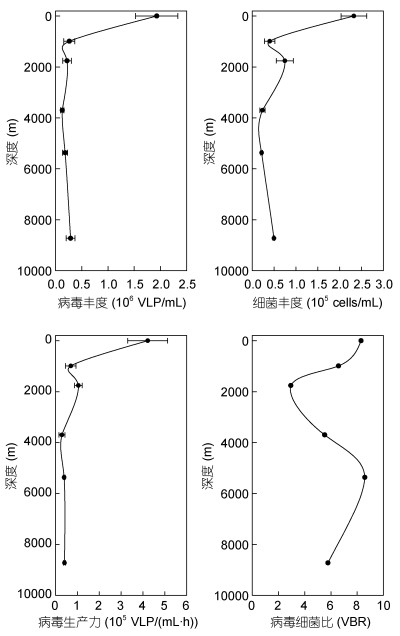 |
| 图 3 浮游细菌丰度、浮游病毒、病毒生产力以及VBR垂直分布 Fig. 3 Vertical distribution of bacterioplankton, virioplankton, viral production and VBR in the Mariana Trench |
浮游病毒丰度变化趋势与浮游细菌基本一致, 同样在表层出现最高值, 为1.93×106VLP/mL, 随后病毒丰度逐渐降低, 在3699m处出现最低值1.27× 105VLP/mL, 而在深渊海沟区域内则表现出均匀的上升趋势, 最深处8727m丰度为2.85×105VLP/mL, 各层次平均病毒丰度为0.50×106 VLP/mL(图 3)。在西太平洋不同深度海水中浮游病毒丰度要普遍高于其他大洋, 而本文表层浮游病毒丰度与其他太平洋海域进行的浮游病毒调查结果处于同一水平(Wommack et al, 2000; Corinaldesi et al, 2003), 而深海环境中浮游病毒分布受到上层海水环流、横向平流, 浮游病毒的不同生活等多重因素影响, 往往表现出较大的差异性(Magagnini et al, 2007; Parada et al, 2007)本研究在海沟深层的病毒丰度结果略小于Nunoura等(2015)在马里亚纳海沟的结果, 但是深渊海沟区域内变化趋势均表现为小幅的上升趋势。
病毒与细菌丰度比值(virus-bacteria rate, VBR)是衡量浮游病毒和宿主相互关系的重要指标, 通常在3—10之间, 一般VBR较高值往往出现在表层海水中营养盐丰富, 初级生产力较高的海域(Arístegui et al, 2009)。马里亚纳海沟各水层VBR变化幅度较大, 范围为2.93—8.58, 并呈现从表层到深层先降低后增加的趋势, 最深处海水中VBR值为5.76。有研究表明在大西洋中心区域VBR随深度增加而升高, 在3500m深海区域甚至达到100以上(Parada et al, 2007), 而Nunoura等(2015)的结果也在数千米的深渊海沟区域内检测到了较高的VBR值(> 10), 这与本文深海区域研究结果略有差异。
2.3 浮游病毒生产力马里亚纳海沟裂解性浮游病毒生产力垂直分布情况如图 3所示。各层次平均生产力为1.17×105VLP/ (mL·h), 其中生产力最高值4.21×105VLP/(mL·h)出现在表层, 而最低值2.86×104VLP/(mL·h)出现在3699m处。从表层到最深层, 病毒生产力表现出与浮游病毒丰度、浮游细菌丰度较为一致的变化趋势, 即从表层到991m大幅降低, 而在1759m小幅升高后继续降低到3699m的最低点, 在深渊海沟区域内病毒生产力表现出随深度轻微的升高趋势, 但是变化幅度相对较小, 最深处8727m病毒生产力为4.08×104VLP/ (mL·h)。本研究中浅层浮游病毒生产力结果与西太平洋其他研究结果基本一致(Rowe et al, 2012), 而深海病毒生产力略低于已有研究(Li et al, 2014)。
病毒周转时间(virus turnover time)如表 1, 由原位病毒丰度除以病毒生产力计算得到, 可以大致反应一个区域内浮游病毒的相对活跃度。病毒周转时间在研究站位的不同深度差异较大, 其中最低值出现在1759m层, 仅为2.09h, 而最深层8727m则出现了最高的病毒周转时间, 为6.99h。3699m以深的病毒周转时间均在4h以上且逐渐升高, 表明深渊海沟深处浮游病毒活跃度相对较低。
| 深度(m) | 病毒周转时间(h) | 细菌死亡率 VMM (104 cells/ (mL×h)) |
每小时细菌折损率(%) | 碳释放量 [μg/(L·h)] |
氮释放量 [μg/(L·h)] |
| 0 | 4.575 | 2.341 | 10.1 | 2.997 | 0.421 |
| 991 | 3.759 | 0.386 | 9.7 | 0.494 | 0.069 |
| 1759 | 2.087 | 0.580 | 7.8 | 0.742 | 0.104 |
| 3699 | 4.454 | 0.159 | 6.9 | 0.203 | 0.029 |
| 5367 | 4.630 | 0.218 | 10.3 | 0.279 | 0.039 |
| 8727 | 6.989 | 0.227 | 4.6 | 0.290 | 0.041 |
VMM以及病毒导致的有机物质释放量如表 1。由于VMM根据裂解性病毒生产力和平均病毒裂解量计算得到, 其随深度的变化趋势与病毒生产力一致, 变化范围为1.59×103—2.34×104cells/(mL·h), 平均为6.52×103cells/(mL·h)。每小时病毒导致的浮游细菌的折损率可以在一定程度上表现出浮游病毒对于宿主数量的动态影响, 其在研究站位最高值10.3%出现在海沟区域内的5367m, 而最低值4.6%则为更深处的8727m;该结果随深度的变化趋势与病毒生产力及细菌丰度略有不同, 除了5367m处的高值外, 基本表现出从表层到底层逐渐降低的趋势。
溶解有机碳(DOC)及溶解有机氮(DON)的释放量变化趋势与VMM和病毒生产力一致, DOC释放量变化范围为0.49—7.19μg/(L·d), 平均为2.02μg/(L·d); 而DON释放量变化范围为0.07—1.01μg/(L·d), 平均为0.28μg/(L·d)。该结果与Evans等(2012)在南大洋进行的研究结果一致[0.02—7.5μg/(L·d)]。而根据王泽华等(2018)关于马里亚纳海沟溶解有机物的研究结果计算, 每天病毒裂解宿主的DOC释放量平均约占总DOC的0.5%左右, 其中最低值出现在5367m处, 约为0.1%, 最高值出现在表层, 约为1.0%, 而最深处8727m则略有上升, 约为0.2%。由于深海环境中溶解有机碳多为惰性碳, 并不参与微食物环的物质能量流动(Jiao et al, 2010), 而这或许导致了深海区域病毒裂解释放的有机碳在总DOC中较低的占比。
2.5 浮游病毒丰度、病毒生产力与环境因子和生物因子的相关关系浮游病毒丰度、裂解性病毒生产力与各环境因子及生物因子间的相关性分析结果见表 2。其中浮游病毒丰度与浮游细菌丰度以及亚硝酸盐表现出较为显著的正相关关系, 与硅酸盐则表现出显著的负相关关系(P < 0.05)。而病毒丰度与温度、深度等环境因子及微微型真核藻类丰度等生物因子则并未表现出明显的相关性。
| 病毒丰度 | 病毒生产力n | ||||
| Rs | P | Rs | P | ||
| 深度 | -0.371 | 0.234 | -0.714 | 0.055 | |
| 温度 | 0.638 | 0.087 | 0.880 | 0.014 | |
| 盐度 | -0.464 | 0.177 | -0.754 | 0.042 | |
| 溶解氧 | 0.314 | 0.272 | 0.086 | 0.436 | |
| 酸碱度pH | -0.143 | 0.394 | 0.086 | 0.436 | |
| 微微型真核藻类丰度 | 0.551 | 0.129 | 0.841 | 0.018 | |
| 聚球藻丰度 | 0.543 | 0.133 | 0.829 | 0.021 | |
| 细菌丰度 | 0.771 | 0.036 | 0.886 | 0.009 | |
| 磷酸盐 | -0.314 | 0.272 | -0.086 | 0.436 | |
| 硝酸盐 | -0.371 | 0.234 | -0.257 | 0.311 | |
| 亚硝酸盐 | 0.886 | 0.009 | 0.543 | 0.133 | |
| 铵盐 | 0.2 | 0.352 | 0.429 | 0.198 | |
| 硅酸盐 | -0.829 | 0.021 | -0.943 | 0.002 | |
| 注: Rs为相关系数; P为相关性结果的显著度。其中相关性结果表现显著(P < 0.05)的加粗表示。 | |||||
裂解性病毒生产力的相关性分析结果表明, 病毒生产力与温度和浮游细菌丰度表现出较高的正相关关系。海水温度、病毒粒子浓度以及宿主细胞浓度的升高都将导致病毒粒子与相应宿主细胞接触概率的增大, 也就在一定程度上意味着较高的病毒生产力。同时微微型浮游植物也表现出与病毒生产力较高的正相关关系, 这一点与两者纵向分布的相似趋势相吻合。同时病毒生产力也表现出了与硅酸盐有较为明显的负相关关系。本研究结果中一些相关性分析结果却很难明确原因, 比如硅酸盐与浮游病毒丰度和病毒生产力之间显著的负相关关系, 这一点在一些其他海洋浮游病毒研究结果中同样存在(Li et al, 2014), 但是其产生原因却并不清楚。
3 讨论海洋浮游病毒的生存主要依赖对宿主细胞的侵染和裂解, 其分布及活跃程度与宿主细胞的浓度和生态系统的营养状况息息相关。研究表明在寡营养的开阔大洋区域及温度较低的深海区域, 浮游病毒丰度相对较低, 且基本呈现随深度逐渐降低的趋势(Lara et al, 2017)。本文中0—3699m的浮游病毒丰度结果与之相符, 但是在深渊海沟区域内则观察到浮游病毒丰度的上升趋势, 这可能是由于海沟相对封闭的生态环境下, 通过长期进化而形成了适应极端环境的独特微生物群落和相应病毒群落。本文在5000m以下的深渊海沟区域内检测到了裂解性病毒生产力略微上升的趋势, 但是相对于浮游细菌丰度以及浮游病毒丰度的增加, 生产力水平仍然较低。较低的生产力水平与较高的病毒丰度在一定程度上表明该区域的病毒死亡率(viral decay)较低, 这一点与之前文献中观察到的深海中较低的病毒死亡率相符(Parada et al, 2007), 这可能与深渊海沟内部更低的温度以及更封闭和保守的海水环境有关(Wei et al, 2018)。最深层较长的病毒周转时间以及较低的每小时病毒导致的细菌折损率表明, 在极深环境下浮游病毒对细菌的裂解并不活跃, 这可能是由于在深海极端环境下, 细菌本身代谢活动并不活跃, 或者浮游病毒主要以溶源性侵染形式存在, 这在之前的研究中也有提到(Weinbauer, 2004)。由于深海有机碳主要来源于上层海水颗粒有机碳的沉降作用, 但是有机碳的沉降随深度逐渐降低(Lamborg et al, 2008), 而在深渊海沟区域内, 仅仅通过沉降作用作为碳源已经很难维持异养生物的代谢活动(Burd et al, 2010)。本研究在5367m以深的海沟内部观察到病毒裂解释放的碳含量在总DOC中所占比例的小幅上升, 这或许说明了浮游病毒在深渊环境中对物质能量循环具有更高的贡献度。但是在整个水柱中, 深层海水病毒裂解释放的碳在总DOC中占比的整体水平相比于表层更低, 这可能与深海环境中本身较低的裂解性浮游病毒生产力与深海DOC中较高比例的惰性有机碳含量有关(Jiao et al, 2010)。对于浮游病毒丰度及生产力与环境因子的相关性分析结果表明, 病毒生产力与宿主细胞浓度以及温度关系密切, 这可能由于病毒粒子接触相应宿主细胞概率的增大以及宿主细胞本身代谢活动活跃导致。
4 结论浮游病毒丰度在整个水柱变化范围为1.27× 105—1.93×106VLP/mL, 表层最高, 而在3699m以深的深渊区域内浮游病毒丰度呈现出小幅上升的趋势, 最深层病毒丰度为2.85×105VLP/mL。裂解性浮游病毒生产力的变化范围为2.86×104—4.21×105VLP/ (mL·h), 从表层到深层变化趋势与病毒丰度基本一致, 但在深渊区域内上升幅度较小, 8727m最深处裂解性病毒生产力为4.08×104VLP/ (mL·h)。病毒周转时间变化范围为2.09—6.99h, 在3699m以深病毒周转时间较长且随深度略有升高; 而病毒导致的浮游生物折损率基本表现出从表层到深层逐渐降低的趋势, 这都表明浮游病毒的侵染裂解行为在深渊内相对并不活跃, 可能是由于极端环境中浮游病毒多以溶源性侵染形式存在。而病毒导致的DOC释放量在海水总DOC中的占比在表层观察到1%的相对高值, 深层则在较低水平波动(0.2%), 这或许与深层海水中大比例的惰性有机碳含量有关。在深渊海沟内部, 较高的病毒丰度以及较低的生产力水平表明该水域中病毒死亡率较低, 这可能是由于海沟内温度极低且环境相对封闭, 导致该水域生态相对稳定但活跃度较低。
| 王泽华, 邹立, 陈洪涛, 等, 2018. 马里亚纳海沟水体溶解有机物的垂直分布特征. 中国海洋大学学报, 48(2): 85–90 |
| Arístegui J, Gasol J M, Duarte C M, et al, 2009. Microbial oceanography of the dark ocean's pelagic realm. Limnology and Oceanography, 54(5): 1501–1529 DOI:10.4319/lo.2009.54.5.1501 |
| Burd A B, Hansell D A, Steinberg D K, et al, 2010. Assessing the apparent imbalance between geochemical and biochemical indicators of meso-and bathypelagic biological activity:what the@$#! is wrong with present calculations of carbon budgets?. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 57(16): 1557–1571 DOI:10.1016/j.dsr2.2010.02.022 |
| Corinaldesi C, Crevatin E, Del Negro P, et al, 2003. Large-scale spatial distribution of virioplankton in the Adriatic Sea:testing the trophic state control hypothesis. Applied and Environmental Microbiology, 69(5): 2664–2673 DOI:10.1128/AEM.69.5.2664-2673.2003 |
| Danovaro R, Dell'Anno A, Corinaldesi C, et al, 2008. Major viral impact on the functioning of benthic deep-sea ecosystems. Nature, 454(7208): 1084–1087 DOI:10.1038/nature07268 |
| Dell'Anno A, Corinaldesi C, Danovaro R, 2015. Virus decomposition provides an important contribution to benthic deep-sea ecosystem functioning. Proceedings of the National Academy of Sciences of the United States of America, 112(16): E2014–E2019 DOI:10.1073/pnas.1422234112 |
| Evans C, Brussaard C P D, 2012. Regional variation in lytic and lysogenic viral infection in the southern ocean and its contribution to biogeochemical cycling. Applied and Environmental Microbiology, 78(18): 6741–6748 DOI:10.1128/AEM.01388-12 |
| Fukuda R, Ogawa H, Nagata T, et al, 1998. Direct determination of carbon and nitrogen contents of natural bacterial assemblages in marine environments. Applied and Environmental Microbiology, 64(9): 3352–3358 |
| Glud R N, Wenzhöfer F, Middelboe M, et al, 2013. High rates of microbial carbon turnover in sediments in the deepest oceanic trench on Earth. Nature Geoscience, 6(4): 284–288 DOI:10.1038/ngeo1773 |
| Jamieson A J, Fujii T, Mayor D J, et al, 2010. Hadal trenches:the ecology of the deepest places on Earth. Trends in Ecology & Evolution, 25(3): 190–197 |
| Jiao N Z, Herndl G J, Hansell D A, et al, 2010. Microbial production of recalcitrant dissolved organic matter:long-term carbon storage in the global ocean. Nature Reviews Microbiology, 8(8): 593–599 DOI:10.1038/nrmicro2386 |
| Lamborg C H, Buesseler K O, Valdes J, et al, 2008. The flux of bio-and lithogenic material associated with sinking particles in the mesopelagic "twilight zone" of the northwest and North Central Pacific Ocean. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 55(14-15): 1540–1563 DOI:10.1016/j.dsr2.2008.04.011 |
| Lara E, Vaqué D, Sà E L, et al, 2017. Unveiling the role and life strategies of viruses from the surface to the dark ocean. Science Advances, 3(9): e1602565 DOI:10.1126/sciadv.1602565 |
| Lauro F M, Chastain R A, Blankenship L E, et al, 2007. The unique 16S rRNA genes of piezophiles reflect both phylogeny and adaptation. Applied and Environmental Microbiology, 73(3): 838–845 DOI:10.1128/AEM.01726-06 |
| Li Y, Luo T, Sun J, et al, 2014. Lytic viral infection of bacterioplankton in deep waters of the western Pacific Ocean. Biogeosciences, 11(9): 2531–2542 DOI:10.5194/bg-11-2531-2014 |
| Magagnini M, Corinaldesi C, Monticelli L S, et al, 2007. Viral abundance and distribution in mesopelagic and bathypelagic waters of the Mediterranean Sea. Deep Sea Research Part Ⅰ:Oceanographic Research Papers, 54(8): 1209–1220 DOI:10.1016/j.dsr.2007.05.006 |
| Marie D, Cpd B, Thyrhaug R, et al, 1999. Enumeration of marine viruses in culture and natural samples by flow cytometry. Applied and Environmental Microbiology, 65(1): 45–52 |
| Nunoura T, Takaki Y, Hirai M, et al, 2015. Hadal biosphere:insight into the microbial ecosystem in the deepest ocean on Earth. Proceedings of the National Academy of Sciences of the United States of America, 112(11): E1230–E1236 DOI:10.1073/pnas.1421816112 |
| Parada V, Herndl G J, Weinbauer M G, 2006. Viral burst size of heterotrophic prokaryotes in aquatic systems. Journal of the Marine Biological Association of the United Kingdom, 86(3): 613–621 DOI:10.1017/S002531540601352X |
| Parada V, Sintes E, van Aken H M, et al, 2007. Viral abundance, decay, and diversity in the meso-and bathypelagic waters of the north Atlantic. Applied and Environmental Microbiology, 73(14): 4429–4438 DOI:10.1128/AEM.00029-07 |
| Rowe J M, DeBruyn J M, Poorvin L, et al, 2012. Viral and bacterial abundance and production in the Western Pacific Ocean and the relation to other oceanic realms. FEMS Microbiology Ecology, 79(2): 359–370 DOI:10.1111/fem.2011.79.issue-2 |
| Suttle C A, 2005. Viruses in the sea. Nature, 437(7057): 356–361 DOI:10.1038/nature04160 |
| Taira K, Yanagimoto D, Kitagawa S, 2005. Deep CTD casts in the challenger deep, Mariana trench. Journal of Oceanography, 61(3): 447–454 DOI:10.1007/s10872-005-0053-z |
| Wei W, Zhang R, Peng L, et al, 2018. Effects of temperature and photosynthetically active radiation on virioplankton decay in the western Pacific Ocean. Scientific Reports, 8(1): 1525 DOI:10.1038/s41598-018-19678-3 |
| Weinbauer M G, 2004. Ecology of prokaryotic viruses. FEMS Microbiology Reviews, 28(2): 127–181 DOI:10.1016/j.femsre.2003.08.001 |
| Weinbauer M G, Rowe J M, Wilhelm S W, 2010. Determining rates of virus production in aquatic systems by the virus reduction approach. In: Wilhelm S W, Weinbauer M G, Suttle C A eds. Manual of Aquatic Viral Ecology. Waco: American Society of Limnology and Oceanography |
| Wilhelm S W, Brigden S M, Suttle C A, 2002. A dilution technique for the direct measurement of viral production:a comparison in stratified and tidally mixed coastal waters. Microbial Ecology, 43(1): 168–173 DOI:10.1007/s00248-001-1021-9 |
| Wommack K E, Colwell R R, 2000. Virioplankton:viruses in aquatic ecosystems. Microbiology and Molecular Biology Reviews, 64(1): 69–114 DOI:10.1128/MMBR.64.1.69-114.2000 |
 2018, Vol. 49
2018, Vol. 49


