中国海洋湖沼学会主办。
文章信息
- 甄毓, 贺惠, 傅亮, 刘乾, 毕乃双, 杨作升. 2018.
- ZHEN Yu, HE Hui, FU Liang, LIU Qian, BI Nai-Shuang, YANG Zuo-Sheng. 2018.
- 南海三沙永乐龙洞古菌群落结构与多样性特征
- ARCHAEAL DIVERSITY AND COMMUNITY STRUCTURE IN THE YONGLE BLUE HOLE, XISHA, SOUTH CHINA SEA
- 海洋与湖沼, 49(6): 1259-1267
- Oceanologia et Limnologia Sinica, 49(6): 1259-1267.
- http://dx.doi.org/10.11693/hyhz20180100011
-
文章历史
- 收稿日期:2018-01-16
- 收修改稿日期:2018-07-11
2. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室 青岛 266071;
3. 中国海洋大学环境科学与工程学院 青岛 266100;
4. 中国海洋大学海洋生命学院 青岛 266003;
5. 三沙航迹珊瑚礁保护研究所 三沙 573199;
6. 中国海洋大学海洋地球科学学院 青岛 266100
2. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China;
3. College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, China;
4. College of Marine Life Science, Ocean University of China, Qingdao 266003, China;
5. Sansha Trackline Institute of Coral Reef Environment Protection, Sansha 573199, China;
6. College of Marine Geosciences, Ocean University of China, Qingdao 266100, China
海洋蓝洞(Blue Hole)是碳酸盐岩体中洞口出露海面的水下洞穴, 其洞口呈现为深邃的蓝色, 与周边浅色海水形成强烈反差。海洋蓝洞是特殊的海洋地理单元, 在世界各大洋海域中均有发现, 特别是在沿海地区。我国南海的三沙永乐龙洞(Yongle Blue Hole)是世界最深的海洋蓝洞, 其次是巴拿马的迪恩蓝洞(Dean’s Blue Hole)及伯利兹大蓝洞(Great Blue Hole)等(刘焱雄等, 2017; 杜军, 2017)。
作为一种独特的地貌单元, 蓝洞除了受旅游者和潜水爱好者关注外, 也一直广受国内外学者重视。蓝洞内的水循环一般较弱, 一定深度后水体处于缺氧状态, 因此无法支持大部分海洋生物的生存。但大量生物通过形态、行为、生理、生化等途径形成了适应环境的各种特征, 发展出独特的生物群落与生态系统。因此, 研究蓝洞内特殊的生物群落结构与生态系统特征对于了解蓝洞的形成、保护与开发具有重要意义。
已有学者对蓝洞内的浮游植物、浮游动物、底栖生物等进行了大量研究(Iliffe, 2000, 2004; Bishop et al, 2004; Gerovasileiou et al, 2016), 获得了许多新物种与新认识, 但是由于受研究手段所限, 对于微生物的研究则明显不足。近几年来, 高通量测序技术的不断完善与发展为微生物群落结构分析提供了有力支持。本研究利用Illumina高通量测序技术首次对我国西沙永乐龙洞水体和沉积物中的古菌群落结构及多样性进行分析, 以揭示龙洞内古菌群落结构与多样性变化, 为进一步分析蓝洞独特的生态系统提供微生物方面的依据。
1 材料与方法 1.1 样品采集与保存2016年10月于西沙永乐龙洞洞口水面搭建工作浮台, 利用采水器采集500mL水样, 采样深度分别为0m、10m和90m。10m和90m水体在涨落潮时各采样一次。另外, 搭乘琼海渔03138号调查船采集龙洞外0m和30m水体500mL。采样完成后, 立即将水体通过200目筛绢过滤, 所得滤液再经0.22μm滤膜过滤, 取下滤膜放入冻存管中, 置于液氮保存用于核酸提取。采样信息如表 1。
| 样品类型 | 样品编号 | 采样层次(m) |
| 龙洞内涨潮水体 | ZS1 | 0 |
| 龙洞内涨潮水体 | ZS2 | 10 |
| 龙洞内涨潮水体 | ZS4 | 90 |
| 龙洞内落潮水体 | XS2 | 10 |
| 龙洞内落潮水体 | XS4 | 90 |
| 龙洞外水体 | WS1 | 0 |
| 龙洞外水体 | WS2 | 30 |
| 龙洞内侧壁沉积物 | C1 | 2 |
| 龙洞内侧壁沉积物 | C3 | 8 |
| 龙洞内侧壁沉积物 | C4 | 13 |
| 龙洞内平台沉积物 | C5 | 150 |
潜水员采集龙洞侧壁沉积物样品, 采样深度为2m、8m、13m。另外, 利用水下机器人采集龙洞水下150m平台处沉积物样品。所得样品放入封口袋, 置于液氮保存用于核酸提取。样品信息如表 1。
1.2 环境因子分析利用CTD多参数温盐深仪对龙洞内各层水的温度、盐度、浊度、溶解氧浓度、叶绿素a浓度等理化参数进行现场测定。
1.3 微生物基因组DNA提取将滤膜从液氮中取出, 用灭菌过的剪刀剪碎后置于2.0mL的离心管中, 用CTAB法提取水样中的总DNA, 得到的DNA保存于–20℃冰箱中待用。CTAB法提取DNA的步骤如下:
将滤膜加入1000μL CTAB裂解液中, 65℃水浴充分裂解后, 离心取950μL上清液, 加入等体积的酚:氯仿:异戊醇(25︰24︰1), 混匀后12000r/min离心10min。取上清, 加入等体积的氯仿:异戊醇(24︰1), 混匀后12000r/min离心10min后, 吸取上清至1.5mL离心管中, 加入上清液3/4体积的异丙醇, –20℃沉淀后, 12000r/min离心10min, 倒出液体。用1mL 75%乙醇洗涤沉淀2次, 加入51μL ddH2O溶解DNA。加入RNaseA 1μL消化RNA, 37℃放置15min。
将大约0.25g沉积物解冻混匀后, 用试剂盒(PowerSoil® DNA Isolation Kit)提取沉积物中的总DNA, 得到的DNA保存于–20℃冰箱中待用。
1.4 古菌群落组成、结构及多样性分析 1.4.1 Illumina高通量测序通过琼脂糖凝胶电泳和超微量紫外分光光度计检测得到的DNA浓度和纯度。将检测合格的总DNA样本送至北京诺禾致源生物信息科技有限公司进行高通量测序。使用带有测序标签barcode的特异引物U519F (5′-CAG YMG CCR CGG KAA HAC C)/806R (5′-GGA CTA CNS GGG TMT CTA AT) (Porat et al, 2010; Shehab et al, 2013)扩增古菌16S rRNA V4区基因。PCR产物使用2%琼脂糖凝胶电泳检测, 根据产物浓度进行等量混样后, 纯化目的条带。采用试剂盒进行扩增子文库构建, 文库检测合格后, 使用Illumina Hiseq平台进行上机测序。
1.4.2 原始数据拼接及序列质量控制将下机序列删除barcode和引物序列后, 使用FLASh (Fast Length Adjustment of Short reads)软件利用重叠区域将双末端测序得到的成对reads拼接成一条序列, 并对其测序质量进行筛选, 删除碱基质量分数较低的序列和长度较低的序列等, 得到高质量序列, 进行后续的生物信息学分析。
1.4.3 OTU聚类使用Uparse在0.97相似度下对古菌16S rRNA基因序列进行聚类, 对聚类后的序列进行嵌合体过滤后, 得到用于物种分类的OTU, 每个OTU代表一个物种。从每个OTU中挑选出一条序列作为该OTU的代表序列, 与SILVA数据库比对, 对每个OTU进行物种注释, 并分析物种的相对丰度。根据代表序列的注释信息, 对核心菌群进行分析。
1.4.4 生物信息学分析利用Quantitative Insights into Microbial Ecology (QIIME) (Version 1.9.0)软件计算样品的Alpha多样性指数, 包括Chao 1、Shannon指数等, 并进行稀释曲线分析, 评价不同样品中微生物群落的物种丰富度和多样性情况。使用R软件中VennDiagram程序包绘制韦恩图, 以分析不同样品中的共有、特有物种。通过聚类分析和非度量多维尺度分析(Non-metric Multidimensional Scaling, NMDS)反映不同样品间是否具有显著的群落差异。核心菌群由Qiime软件compute_core_microbiome.py命令分析得到。
1.5 环境因子对古菌群落结构的影响分析采用Canoco for Windows 4.5软件对古菌群落丰度与环境数据进行分析, 并通过Monte Carlo检验对排序结果进行统计学验证。
2 结果与分析 2.1 环境因子特征5个采样点的环境因子如表 2所示。盐度在33.19—34.39之间变化, 温度在21.03—29.51℃之间变化。涨潮时叶绿素a浓度的范围为0.01—0.39μg/L, 落潮时其值在0.25—0.66μg/L之间变化。涨潮时溶解氧浓度的变化范围是1.11—7.64mg/L, 落潮时溶解氧浓度的变化范围是0.80—6.29mg/L, 且均是90m处溶解氧浓度最低。浊度在涨潮时表现出随水深增加而增加的趋势; 对于落潮时的浊度来说, 也表现出同样的趋势, 均在90m处检测到浊度最大值。
| 样品编号 | 水深 (m) |
盐度 (PSU) |
温度 (℃) |
溶解氧浓度 (μg/L) |
浊度 (FTU) |
叶绿素a浓度 (mg/L) |
| ZS1 | 0 | 33.93 | 29.51 | 7.64 | 0.09 | 0.01 |
| ZS2 | 10 | 33.79 | 27.82 | 6.62 | 0.30 | 0.39 |
| ZS4 | 90 | 34.39 | 21.09 | 1.11 | 0.47 | 0.16 |
| XS2 | 10 | 33.19 | 27.99 | 6.29 | 0.43 | 0.66 |
| XS4 | 90 | 33.73 | 21.03 | 0.80 | 0.50 | 0.25 |
对11个采样点获得的古菌16S rRNA基因进行Illumina高通量测序, 共获得561249条序列(表 3), 每个样品序列条数介于20238与87906条之间。按照0.97相似性水平进行OTU聚类, 共得到3623个OTUs, 每个样品的OTU个数介于228与2138之间。
| 样品类型 | 样品编号 | 序列条数 | OTU个数 | Chao 1 | Shannon | Coverage(%) |
| 水体样品 | ZS1 | 32789 | 445 | 452.4 | 5.4 | 99.8 |
| ZS2 | 20238 | 228 | 250.6 | 4.6 | 99.9 | |
| ZS4 | 77153 | 534 | 539.4 | 2.4 | 99.3 | |
| XS2 | 34944 | 882 | 1005.9 | 6.3 | 98.8 | |
| XS4 | 87906 | 586 | 532.0 | 2.2 | 99.3 | |
| WS1 | 27841 | 687 | 854.9 | 5.9 | 99.0 | |
| WS2 | 22214 | 558 | 797.4 | 5.8 | 99.1 | |
| 沉积物样品 | C1 | 54782 | 1582 | 1630.7 | 5.4 | 97.7 |
| C3 | 50044 | 1523 | 1625.1 | 4.4 | 97.7 | |
| C4 | 68255 | 1434 | 1479.6 | 4.2 | 97.9 | |
| C5 | 85083 | 2138 | 1977.0 | 7.1 | 97.3 |
Chao 1指数可以表征群落的丰富度情况。由表 3可知, 龙洞沉积物样品中古菌丰富度普遍高于水体样品, 特别是在龙洞水下150m平台处达到最高值。而水体中的古菌丰富度则在落潮10m水层处达到最大值。
Shannon指数用于衡量群落多样性情况。由表 3可知, 龙洞表层水体样品中古菌群落多样性与洞外水体相差不大, 但随深度增加, 洞内水体中古菌群落多样性显著降低, 而洞外变化则并不明显。对于沉积物而言, 龙洞内侧壁沉积物中古菌群落多样性随深度增加显著降低, 而150m平台处古菌多样性远高于侧壁沉积物, 也远高于水体中古菌群落多样性。
11个样品的覆盖度均高于97%, 表明本研究中的测序数量足以反映样品中绝大多数古菌群落信息。沉积物样品的稀释曲线仍有一定的上升趋势(图 1), 表明研究海域沉积物中古菌群落丰富度和多样性较高, 蕴藏着更为丰富的微生物资源。
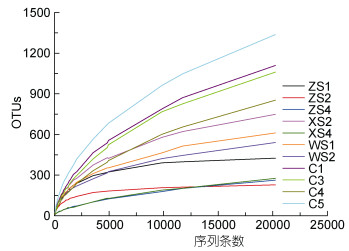 |
| 图 1 古菌群落的稀释曲线 Fig. 1 Rarefaction curves of the archaeal community |
本研究中检测到的古菌类群可归为4门、21纲、29目、42科、45属。每个采样点检测到的古菌类群见表 4。每个分类阶元均存在未确定分类地位的古菌类群, 且分类阶元越低, 未确定分类地位的古菌类群所占比例越高(0.02%—87.84%), 表明随着分类水平的逐步精细, 数据库中能进行比对分类的信息减少, 大量未知的微生物资源有待深入研究。
| 样品类型 | 样品编号 | 门 | 纲 | 目 | 科 | 属 |
| 水体样品 | ZS1 | 2 | 6 | 8 | 10 | 12 |
| ZS2 | 2 | 5 | 8 | 9 | 10 | |
| ZS4 | 2 | 9 | 11 | 17 | 18 | |
| XS2 | 2 | 7 | 9 | 16 | 17 | |
| XS4 | 3 | 9 | 12 | 17 | 18 | |
| WS1 | 3 | 11 | 14 | 20 | 21 | |
| WS2 | 2 | 10 | 14 | 20 | 21 | |
| 沉积物样品 | C1 | 3 | 13 | 17 | 27 | 28 |
| C3 | 3 | 13 | 18 | 29 | 31 | |
| C4 | 3 | 13 | 17 | 29 | 30 | |
| C5 | 3 | 14 | 17 | 29 | 30 |
将所得的序列与SILVA数据库进行比对可知, 所有序列可归为广古菌门(Euryarchaeota)、奇古菌门(Thaumarchaeota)、极少量的Ancient Archaeal Group (AAG)和少量未确定分类地位的序列(图 2)。广古菌和奇古菌是本研究中丰度最高的两种古菌。特别在龙洞较深处, 无论在水体中还是沉积物中, 奇古菌的优势地位均更为明显。
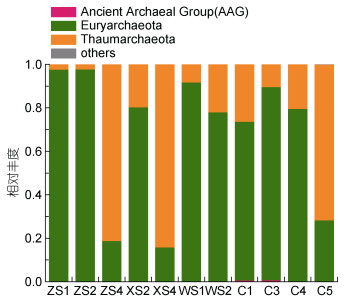 |
| 图 2 门分类水平上古菌的相对丰度 Fig. 2 Relative abundance of archaea at phylum level |
在纲分类水平上(图 3), 广古菌门的盐杆菌纲(Halobacteria, 15.39%—97.69%)和奇古菌门的Marine Group Ⅰ (MGI, 0.85%—83.53%)丰度较高, 为本研究的优势类群。总体来看, 盐杆菌的相对丰度在较浅的水层和沉积物中相对丰度较高, 而随着深度的增加, MGI的相对丰度显著提高。除此之外, 沉积物中发现了水中较少的古菌类群, 如Miscellaneous Crenarchaeotic Group (MCG, 0%—52.88%)、Group C3 (0%—3.37%), 特别是沉积物中古菌MCG的相对丰度随深度的增加显著上升。
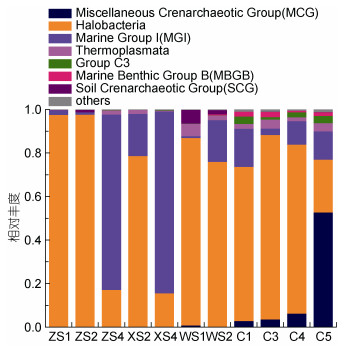 |
| 图 3 纲分类水平上古菌的相对丰度 Fig. 3 Relative abundance of archaea at class level |
在科分类水平上(图 4), 嗜盐杆菌科(Halobacteri aceae)和Deep Sea Hydrothermal Vent Group (DHVEG- 6)丰度较高, 是本研究的优势类群。无论是上层还是深层的水体或沉积物中, 均存在DHVEG-6, 但在深层水体或沉积物中, DHVEG-6的相对丰度明显提高。另外, 我们可以发现, 随着深度的增加, 目前尚未确定分类地位的古菌类群明显增多。
 |
| 图 4 科分类水平上古菌的相对丰度 Fig. 4 Relative abundance of archaea at family level |
根据代表序列的信息, 所有采样点的核心菌群共有42种, 其中3种属于奇古菌, 剩余的39种全部属于广古菌。能成功注释到科或属分类水平上的核心菌群为41种。选取排名前十位的核心微生物进行分析发现, 只有1个OTU属于MGI(OTU1), 剩余的9个OTUs均属于嗜盐菌。上述10个OTUs在各样品中所占比例如表 5。
| OTU ID | 物种信息 | ZS1 | ZS2 | ZS4 | XS2 | XS4 | WS1 | WS2 | C1 | C3 | C4 | C5 |
| OTU1 | MGI | 0.01 | 0.67 | 60.06 | 3.49 | 67.12 | 0.51 | 18.12 | 1.39 | 0.53 | 0.77 | 1.92 |
| OTU10 | Halobacteria | 14.36 | 31.33 | 0.01 | 5.04 | 0.01 | 0.83 | 0.36 | 0.05 | 0.05 | 0.03 | 0.03 |
| OTU2 | Halobacteria | 6.74 | 0.94 | 0.32 | 5.18 | 0.56 | 8.07 | 5.16 | 37.31 | 54.97 | 48.38 | 0.48 |
| OTU21 | Halobacteria | 0.10 | 2.31 | 0.01 | 7.72 | 0.19 | 0.14 | 0.15 | 0.08 | 0.09 | 0.08 | 0.02 |
| OTU31 | Halobacteria | 0.24 | 0.35 | 0.03 | 0.07 | 0.01 | 6.33 | 3.33 | 0.06 | 0.10 | 0.11 | 0.02 |
| OTU42 | Halobacteria | 0.63 | 0.97 | 0.05 | 0.16 | 0.01 | 0.08 | 9.60 | 0.02 | 0.04 | 0.02 | 0.01 |
| OTU45 | Halobacteria | 1.79 | 6.92 | 0.08 | 0.93 | 0.08 | 1.02 | 3.39 | 0.24 | 0.46 | 0.23 | 0.03 |
| OTU57 | Halobacteria | 6.67 | 5.44 | 0.00 | 1.56 | 0.00 | 0.08 | 0.00 | 0.00 | 0.01 | 0.00 | 0.00 |
| OTU8 | Halobacteria | 20.01 | 9.38 | 0.02 | 7.91 | 0.01 | 0.13 | 0.12 | 0.08 | 0.10 | 0.08 | 0.02 |
| OTU9 | Halobacteria | 7.10 | 2.57 | 0.04 | 1.66 | 0.38 | 20.30 | 3.70 | 0.41 | 1.49 | 0.89 | 0.08 |
将龙洞内获得的不同层次水体中的古菌群落进行韦恩图分析(图 5)。涨潮时, 表层、10m层和90m层共有62种古菌, 各层分别特有274、90和423种古菌; 而落潮时10m层和90m层则共有291种古菌, 分别特有591和295种古菌。将不同采样时间同一层次水体中的古菌群落进行比较发现(图 6), 落潮时10m水层中特有的古菌种类数远大于涨潮时, 而90m水层中的古菌种类数则在涨落潮时相差不大。由此可以推测, 落潮时水体的混合可能更为充分, 且水体由底层向上层流动带来了古菌群落结构的改变。
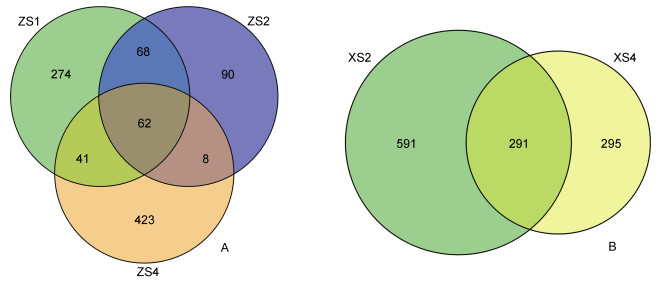 |
| 图 5 龙洞内不同层次水体中古菌群落比较 Fig. 5 Comparison of the archaeal communities at different water layers in the Yongle Blue Hole 注: A.涨潮时; B.落潮时 |
 |
| 图 6 龙洞内不同采样时间同一层次水体中古菌群落比较 Fig. 6 Comparison of the archaeal communities in different time at the same water layers in the Yongle Blue Hole 注: A. 10m层; B. 90m层 |
将龙洞内外水体中的古菌群落进行比较发现(图 7), 洞内水体特有物种1010种, 洞外水体特有物种302种, 二者共有589种古菌。可以看出, 龙洞内有发现大量未知物种的极大可能性。
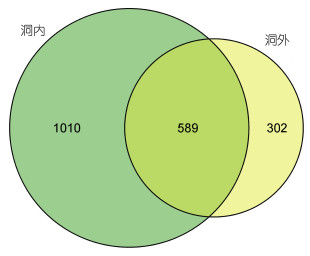 |
| 图 7 龙洞内外水体中古菌群落比较 Fig. 7 Comparison of the archaeal communities in and out of the Yongle Blue Hole |
将龙洞内沉积物中的古菌群落进行比较发现(图 8), 四个不同层次沉积物中共有617种古菌, 2m、8m、13m侧壁处分别特有178、141、138种古菌, 150m处沉积物特有583种古菌。由此可见, 沉降到龙洞平台处的古菌种类远多于上层。
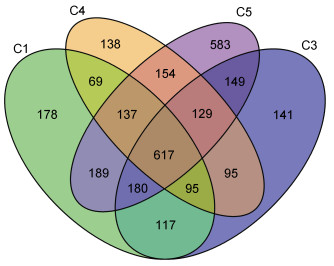 |
| 图 8 龙洞内沉积物中古菌群落比较 Fig. 8 Comparison of the archaeal communities in sediments in the Yongle Blue Hole |
将龙洞内水体和沉积物中的古菌群落进行比较发现(图 9), 水体和沉积物中总共有古菌3404种, 其中53.0%为沉积物中特有物种, 16.8%为水体中特有物种。由此可见, 沉积物生存环境与水体差异巨大, 为大量特殊物种提供了生存空间。
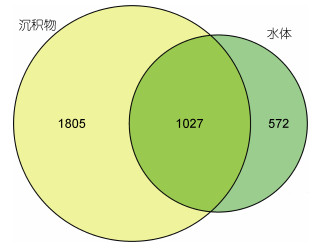 |
| 图 9 龙洞内沉积物和水体中古菌群落比较 Fig. 9 Comparison of the archaeal communities between sediments and water in the Yongle Blue Hole |
基于OTU矩阵对所有样品进行相似性聚类。由图 10可知, 所有样品可划分为3组, 其中所有沉积物样品为一组, 水体样品分为两组。深水层古菌群落结构与浅水层差异显著。
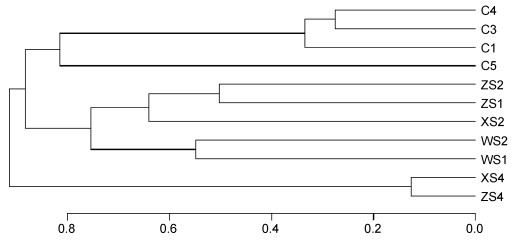 |
| 图 10 古菌群落结构相似性聚类图 Fig. 10 Cluster of the archaeal communities |
进一步对得到的OTU矩阵进行NMDS分析(图 11), 结果发现从古菌群落结构来看, 水体样品和沉积物样品差异显著, 龙洞内外水体样品差异明显, 龙洞内浅层水体与深层水体样品也有很大差异。
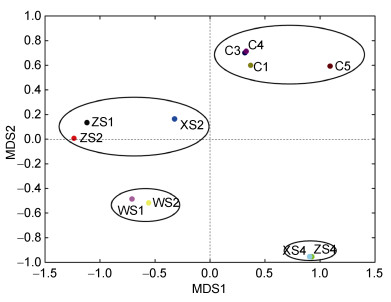 |
| 图 11 古菌群落结构NMDS分析 Fig. 11 NMDS analyses of the archaeal communities |
在OTU分类水平上对龙洞内水体中古菌群落结构与环境因子间的相关性进行分析, 结果如图 12。通过对群落数据的分析发现典范对应分析(canonical correspondence analysis, CCA)更适合用来研究水体中古菌群落组成与环境因子间的相关性。第一与第二排序轴上的环境因子可以解释物种与环境因子间61.7%的累积变量, 且第一排序轴与第二排序轴近似垂直, 相关系数为0.000, 说明排序轴与环境因子间的线性结合程度较好地反映了物种与环境间的关系, 排序结果可靠。蒙特卡洛检验表明, 水温(P < 0.01)对龙洞内水体中的古菌群落结构表现出显著影响, 是解释本研究中古菌群落结构变化的最重要环境因子。
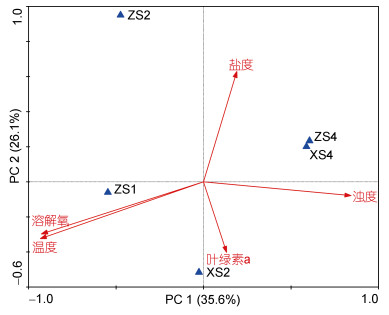 |
| 图 12 古菌群落结构与环境因子的CCA分析 Fig. 12 Canonical correspondence analysis between environmental parameters and the archaeal community structure |
奇古菌定义较晚(Brochier-Armanet et al, 2008; 张丽梅等, 2012), 该类群在碳、氮等生源要素的生物地球化学过程中发挥着重要作用(Munson et al, 1997; Hallam et al, 2006; Nicol et al, 2006; Coolen et al, 2007; Spang et al, 2010)。本研究中广古菌和奇古菌是丰度最高的两种古菌, 尤其对于龙洞较深处而言, 奇古菌的优势地位更为明显, 由此可以说明奇古菌在研究海域水体和沉积物的生源要素循环过程中均发挥了重要作用。
作为一种独特的地貌单元, 龙洞为微生物提供了特殊的生存环境, 具有丰富的微生物资源(Iliffe, 2000; Bishop et al, 2004; Seymour et al, 2007)。本研究从古菌角度证实了西沙永乐龙洞内外的古菌物种差异显著, 龙洞内有发现大量未知物种的可能性。而从群落结构的角度也可以看出(表 6), 西沙永乐龙洞内水体和沉积物中的古菌多样性均高于我国近海其他海域, 特别是沉积物中更为明显。
| 研究区域 | Chao 1 | Shannon | 参考文献 | |
| 水体 | 龙洞内(本研究) | 556.1 | 4.2 | |
| 珠江口 | 557.7 | 3.8 | Liu et al, 2014a | |
| 沉积物 | 龙洞内(本研究) | 1977.0 | 7.1 | |
| 珠江口 | 1248.9 | 5.5 | Liu et al, 2014b | |
| 长江口 | 1212.0 | 5.7 | Liu et al, 2015 | |
| 黄海 | 1879.8 | 5.8 | Liu et al, 2014b | |
| 渤海 | 2114.0 | 6.0 | Liu et al, 2014b |
龙洞水体样品中古菌群落多样性随深度增加而显著降低, 这与温度变化趋势一致(毕乃双等, 2018)。龙洞内浅层水体的古菌群落与深层水体差异明显, 沉积物中的古菌群落也与水体中有很大差异。环境因子中的盐度、溶解氧、水温等应该对此有一定影响, 特别是90m水深以下, 0浓度的溶解氧会对古菌群落造成很大影响。但在本研究中, 仅发现水温对龙洞内水体中的古菌群落结构有显著影响(P < 0.01), 其他环境因子的影响并不显著, 原因可能是还没有发现具有决定性的环境因子, 如无氧环境中的H2S浓度可能对群落结构的影响更为重要, 进一步的研究有必要从此入手以发现决定古菌群落结构的关键环境因子。
4 结论广古菌和奇古菌是西沙永乐龙洞内水体与沉积物中丰度最高的两种古菌, 其群落有很高的多样性, 其垂向分布与洞内环境多要素的变化密切相关。龙洞内表层水体中古菌群落多样性与洞外水体相差不大, 但随深度增加, 洞内古菌群落多样性显著降低, 深水层古菌群落结构与浅水层差异显著。侧壁沉积物中的古菌群落多样性随深度增加显著降低, 而150m平台处古菌群落多样性则远高于侧壁沉积物。龙洞内沉积物中的古菌生存环境与水体差异巨大, 为大量特殊物种提供了生存空间。
致谢 对在调查过程中三沙航迹珊瑚礁保护研究所提供后勤支持和协助取样的全体成员及协助取样的杨丽标、陈霖等表示衷心感谢。| 毕乃双, 傅亮, 陈洪举, 等, 2018. 南海三沙永乐龙洞关键水体环境要素特征及其影响因素. 科学通报, 63 |
| 刘焱雄, 杜军, 吴志霞, 等, 2017. 西沙永乐龙洞探秘前期调查工作综述. 海洋科学进展, 35(3): 305–316 DOI:10.3969/j.issn.1671-6647.2017.03.001 |
| 杜军, 2017. 全球最深海洋蓝洞——中国三沙永乐龙洞调查策略. 海洋科学进展, 35(4): 593–595 DOI:10.3969/j.issn.1671-6647.2017.04.015 |
| 张丽梅, 贺纪正, 2012. 一个新的古菌类群——奇古菌门(Thaumarchaeota). 微生物学报, 52(4): 411–421 |
| Bishop R E, Kakuk B, Torres J J, 2004. Life in the hypoxic and anoxic zones:metabolism and proximate composition of Caribbean troglobitic crustaceans with observations on the water chemistry of two anchialine caves. Journal of Crustacean Biology, 24(3): 379–392 DOI:10.1651/C-2459 |
| Brochier-Armanet C, Boussau B, Gribaldo S, et al, 2008. Mesophilic crenarchaeota:proposal for a third archaeal phylum, the Thaumarchaeota. Nature Reviews Microbiology, 6(3): 245–252 DOI:10.1038/nrmicro1852 |
| Coolen M J L, Abbas B, van Bleijswijk J, et al, 2007. Putative ammonia-oxidizing Crenarchaeota in suboxic waters of the Black Sea:a basin-wide ecological study using 16S ribosomal and functional genes and membrane lipids. Environmental Microbiology, 9(4): 1001–1016 DOI:10.1111/emi.2007.9.issue-4 |
| Gerovasileiou V, Martínez A, Álvarez F, et al, 2016. World Register of marine Cave Species (WoRCS):a new thematic species database for marine and anchialine cave biodiversity. Research Ideas and Outcomes, 2: e10451 DOI:10.3897/rio.2.e10451 |
| Hallam S J, Mincer T J, Schleper C, et al, 2006. Pathways of carbon assimilation and ammonia oxidation suggested by environmental genomic analyses of marine Crenarchaeota. PLoS One, 4(12): e437 |
| Iliffe T M, 2000. Anchialine cave ecology. In: Wilkens H, Culver D C, Humphreys W F eds. Ecosystems of the World: Subterranean Ecosystems. Amsterdam: Elsevier, 30: 59-76 |
| Iliffe T M, 2004. Anchialine caves, biodiversity. In: Culver D C, White W B eds. Encyclopedia of Caves. Burlington, MA: Elsevier, 24-30 |
| Liu J W, Liu X S, Wang M, et al, 2015. Bacterial and archaeal communities in sediments of the north Chinese marginal seas. Microbial Ecology, 70(1): 105–117 DOI:10.1007/s00248-014-0553-8 |
| Liu J W, Yang H M, Zhao M X, et al, 2014b. Spatial distribution patterns of benthic microbial communities along the Pearl Estuary, China. Systematic and Applied Microbiology, 37(8): 578–589 DOI:10.1016/j.syapm.2014.10.005 |
| Liu J W, Yu S L, Zhao M X, et al, 2014a. Shifts in archaeaplankton community structure along ecological gradients of Pearl Estuary. FEMS Microbiology Ecology, 90(2): 424–435 |
| Munson M A, Nedwell D B, Embley T M, 1997. Phylogenetic diversity of Archaea in sediment samples from a coastal salt marsh. Applied and Environmental Microbiology, 63(12): 4729–4733 |
| Nicol G W, Schleper C, 2006. Ammonia-oxidising Crenarchaeota:important players in the nitrogen cycle?. Trends in Microbiology, 14(5): 207–212 DOI:10.1016/j.tim.2006.03.004 |
| Porat I, Vishnivetskaya T A, Mosher J J, et al, 2010. Characterization of archaeal community in contaminated and uncontaminated surface stream sediments. Microbial Ecology, 60(4): 784–795 DOI:10.1007/s00248-010-9734-2 |
| Seymour J R, Humphreys W F, Mitchell J G, 2007. Stratification of the microbial community inhabiting an anchialine sinkhole. Aquatic Microbial Ecology, 50: 11–24 DOI:10.3354/ame01153 |
| Shehab N, Li D, Amy G L, et al, 2013. Characterization of bacterial and archaeal communities in air-cathode microbial fuel cells, open circuit and sealed-off reactors. Applied Microbiology and Biotechnology, 97(22): 9885–9895 DOI:10.1007/s00253-013-5025-4 |
| Spang A, Hatzenpichler R, Brochier-Armanet C, et al, 2010. Distinct gene set in two different lineages of ammonia-oxidizing archaea supports the phylum Thaumarchaeota. Trends in Microbiology, 18(8): 331–340 DOI:10.1016/j.tim.2010.06.003 |
 2018, Vol. 49
2018, Vol. 49


