中国海洋湖沼学会主办。
文章信息
- 陈和平, 朱建林, 张德民, 祝翔宇, 郑凯宏, 王凯. 2018.
- CHEN He-Ping, ZHU Jian-Lin, ZHANG De-Min, ZHU Xiang-Yu, ZHENG Kai-Hong, WANG Kai. 2018.
- 象山港2013年夏季浮游细菌群落的时空分布特征
- TEMPORAL AND SPATIAL DISTRIBUTION OF BACTERIOPLANKTON COMMUNITY IN THE XIANGSHAN BAY IN SUMMER 2013
- 海洋与湖沼, 49(6): 1268-1278
- Oceanologia et Limnologia Sinica, 49(6): 1268-1278.
- http://dx.doi.org/10.11693/hyhz20180300057
-
文章历史
- 收稿日期:2018-03-19
- 收修改稿日期:2018-07-21
2. 宁波大学建筑工程与环境学院 宁波 315211;
3. 宁波市象山港海洋环境监测站 宁波 315010;
4. 象山县海洋与渔业局 象山 315700
2. Faculty of Architectural, Civil Engineering and Environment, Ningbo University, Ningbo 315211, China;
3. Ocean and Fishery Information Monitoring Center of Ningbo, Ningbo 315010, China;
4. Xiangshan County Marine and Fisheries Bureau, Xiangshan 315700, China
近岸港湾在区域经济建设和社会发展中具有极其重要的战略地位, 港湾生态系统的安全和稳定关系到周边地区的可持续发展。港湾生态系统易受人类活动(养殖业、渔业等)和陆源输入的影响, 其生态系统结构和功能较脆弱, 特别是养殖和陆源输入的大量营养物质和污染物, 可通过改变生物群落结构, 进而影响食物网结构及其能量传递效率。因此, 港湾内生物群落对环境变化和干扰的响应模式是广受关注的科学问题(黄小平等, 2016)。
海洋浮游细菌广泛参与物质循环和能量流动, 在海洋生态系统中发挥着重要的生态作用。港湾作为典型近岸生态系统, 处于陆地与海洋之交的枢纽地带, 是相对独立的半封闭生态系统。港湾或河口环境通常具有明显的盐度梯度, 同时伴随较高浓度的营养盐和有机质, 为浮游细菌提供了比较特殊的生境, 浮游细菌生物量呈现由湾内向湾外、由近岸向离岸递减的规律(周凯等, 2013)。浮游细菌的数量和多样性不但与生境中的生物因子(如浮游植物)及温度、光照强度、营养物质、溶解氧、盐度等非生物因子密切相关, 还受陆源性淡水和有机质输入及水体滞留时间的影响(乔宗赟等, 2015)。同时, 在河口及港湾内进行开发利用活动引起的环境变化造成的生态影响也不容忽视(Kan et al, 2008; 阚金军等, 2011; 乔宗赟等, 2015)。有研究表明位于象山港内的西沪港网箱养殖活动显著地改变了浮游细菌的群落结构(胡常巨等, 2015), 黄河入海口浮游细菌群落结构受到入海河水及石油开采释放的污染物的影响(位光山等, 2017)。通过研究港湾水文环境变化及人为干扰对海区浮游细菌多样性、结构和关键类群的影响, 可以评估港湾环境扰动的微生态效应, 进而为促进港湾区合理开发、保护海湾生态健康提供基础数据。
象山港是浙江北部沿海一个半封闭狭长型港湾, 其口门水体交换良好, 90%水交换周期为5天左右, 而港顶90%水交换周期长达80天(董礼先等, 1999)。作为浙江省重要的水产养殖基地之一, 象山港内养殖面积大、养殖品种多、持续时间长, 其水环境要素及生态功能的变化关系到该海区的可持续开发利用(陈明明等, 2014; 林军等, 2015; 胡常巨等, 2015; 黄秀清, 2015)。以往对象山港生物群落的研究多以浮游动植物和底栖、游泳动物为主(姜亚洲等, 2014; 廖一波等, 2014; 杜萍等, 2015; 毛硕乾等, 2016), 并已发现象山港浮游及底栖动物存在空间异质性(杜萍等, 2015; 毛硕乾等, 2016), 且可划分为不同生态分区(魏永杰等, 2015)。但是, 目前对象山港细菌群落结构的研究主要针对局部水体及沉积物(王海丽等, 2011; 陈明明等, 2014; 胡常巨等, 2015; 陈梦齐等, 2016), 缺乏对整个象山港内浮游细菌群落分布特征的研究。本研究利用16S rRNA基因扩增子测序, 通过夏季的两个航次, 探究象山港内不同海区中表层浮游细菌群落的分布特征和关键影响因子, 为全面了解和评价象山港生态系统健康和环境安全提供基础数据。
1 材料与方法 1.1 海水样品采集及理化因子测定本研究结合象山港海洋环境监测站常规监测站位及历年理化因子分布情况, 共设置12个站位, 分属四个海区:口门部(海区Ⅰ)、中部(海区Ⅱ)、中偏底部(海区Ⅲ)、港顶(海区Ⅳ)(图 1)。在2013年7月2日(0702)和16日(0716)的两个航次中, 每个站位采集表层(0.5m)水样4L;取1L水样经100μm孔径的灭菌尼龙网预过滤, 再用0.2μm孔径的聚碳酸酯膜(Millipore, 美国)过滤, 滤膜置于干冰盒中带回实验室后于-80℃冰箱保存, 待提取DNA; 剩余水样用于水质指标测定。水温、盐度、pH值使用奥立龙3-STAR现场测定, 其他水质指标测定方法参照《海洋监测规范》(GB17378.4-2007):溶解氧(dissolved oxygen, DO)采用碘量法; 化学需氧量(chemical oxygen demand, COD)采用碱性高锰酸钾法; 叶绿素a(chlorophyll a, chl a)采用丙酮萃取分光光度法; 铵氮(NH4+)采用次溴酸钠氧化法; 亚硝酸盐(NO2-)分析采用重氮-偶氮法; 硝酸盐(NO3-)采用锌镉还原法; 总氮(total nitrogen, TN)与总磷(total phosphorus, TP)采用过硫酸钾氧化法; 磷酸盐(PO43-)采用抗坏血酸还原磷钼蓝法。
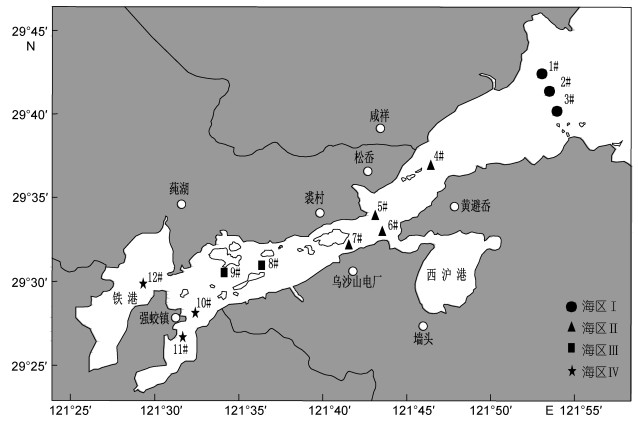 |
| 图 1 象山港采样站位示意图 Fig. 1 Sampling stations in the Xiangshan Bay |
用无菌剪刀剪碎滤膜后, 用Power Soil DNA试剂盒(MOBIO, 美国)提取总DNA, 用Nano Drop ND-1000型分光光度计测定DNA浓度和纯度, 于-80℃保存备用。利用通用引物27F: AGAGT TTGATCMTGGCTCAG和519R: GWATTAC CGCGG CKGCTG扩增16S rRNA基因的V1—V3可变区, 其中正向引物上带有长10个碱基的Barcode序列, 用于区分不同样品。每个样品设置3个PCR重复, 以降低扩增造成的偏差。PCR反应条件如下: 94℃变性30s, 55℃退火30s, 72℃延伸30s, 30个循环, 72℃延伸10min。PCR产物经凝胶电泳检测扩增出预期大小的片段且没有非特异性条带后, 将每个样品的重复扩增产物混合后用PCR产物纯化试剂盒(TaKaRa, 日本)纯化。最后将所有样品的PCR产物等摩尔量混合, 混合产物在Roche FLX 454平台(Roche, 美国)上分析。
利用QIIME 1.7.0对下机测序数据进行质控并去除嵌合体(Caporaso et al, 2010a)。利用UCLUST将相似性大于97%的序列归为同一个可操作分类单元(Operational Taxonomic Units, OTUs)(Caporaso et al, 2010b)。选取每个OTU中丰度最高的序列作为代表序列, 与Greengenes 13.8数据库比对获得分类信息。随后, 使用脚本filter_taxa_from_otu_table.py去除叶绿体、古菌及全部样品中只出现1次的序列(Singletons)。为避免测序深度不同造成的偏差, 每个样品随机抽取3400条序列(基于所有样品中的最低测序深度)进行后续分析。
1.3 统计分析利用Origin 9.1绘制环境因子变化趋势图及各个站位优势浮游细菌组成图。用R软件(V.3.2.1)中vegan软件包计算浮游细菌群落的香农指数(Shannon- Wiener index)、丰富度指数Chao 1和均匀度指数(Pielou’s evenness)。采用SPSS 19.0软件对优势类群(门、纲、OTU水平)与水环境因子进行Spearman相关性分析。利用R中的vegan软件包将细菌物种数据先进行去趋势对应分析(Detrended correspondence analysis, DCA)以选择最适宜的排序模型, 最终选择冗余分析(Redundancy analysis, RDA)(Šmilauer et al, 2014), 并利用“envfit”函数检验环境因子与细菌群落结构是否显著相关(当P < 0.01时, 该环境因子入选); 利用PRIMER-E(v.5.0)软件进行双因素交叉相似性分析(two-way crossed analysis of similarity)来检验不同海区及航次中浮游细菌群落结构的差异是否显著(Clarke et al, 2001)。在PAST软件中通过相似性百分比(similarity percentage, SIMPER)分析造成不同海区浮游细菌群落结构差异的主要贡献类群(贡献度排前三的OTUs), 并利用R绘制上述主要贡献物种的相对丰度的气泡图。采用线性判别式分析效应值(linear discriminant analysis effect size, LEfSe)(Segata et al, 2011)在线工具分析两个航次中各海区的标志判别类群(最大相对丰度≥1.0%)。
2 结果 2.1 环境因子两个航次的调查都表明, 象山港海域盐度大致沿口门部到港顶逐渐降低, 但PO43-、NO2-、COD及硅酸盐沿口门部到港顶逐渐升高, 均存在较明显的梯度(图 2); 7月2日各站位的温度沿口门部到港顶逐渐升高, 而7月16日中部及顶部站位水温稍高于口门部, 且波动较大。pH值、DO及NO3-浓度整体比较接近, 波动幅度较小; 7月2日各站位的PO43-、硅酸盐及NO3-浓度整体高于7月16日, 但盐度则相反, 7月2日均低于7月16日。港顶NH4+浓度明显高于其余海区。7月2日样品的chl a浓度沿口门到港顶有升高的趋势, 而7月16日样品各个站位chl a浓度除3#站位较高外, 其余站位chl a浓度比较接近。
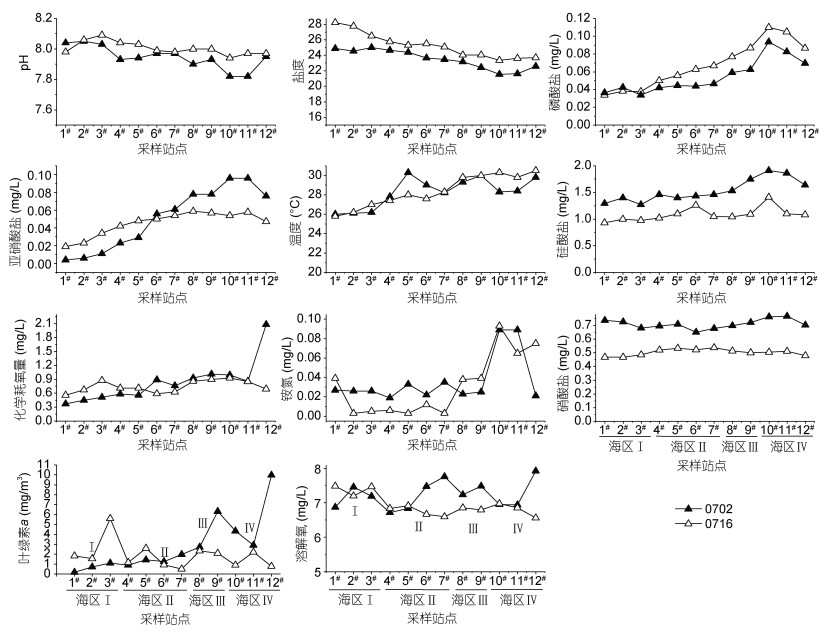 |
| 图 2 水样主要理化因子 Fig. 2 Main physicochemical factors of the water samples |
象山港表层水体主要优势细菌类群(门和变形菌纲)为α-变形菌(Alphaproteobacteria, 平均相对丰度30.8%)、放线菌(Actinobacteria, 19.4%)、γ-变形菌(Gammaproteobacteria, 17.2%)、拟杆菌(Bacteroidetes, 10.3%)、β-变形菌(Betaproteobacteria, 6.8%)、蓝细菌(Cyanobacteria, 6.1%)、δ-变形菌(Deltaproteobacteria, 2.2%)和SAR406(1.3%), 共占总细菌的94.1%(图 3)。同一站位的两次样品中, 蓝细菌(Cyanobacteria)相对丰度自口门到港顶均呈递增趋势。海区Ⅲ的9#、海区Ⅳ的10#、11#、12#站位放线菌(Actinobacteria)的相对丰度在第二航次样品中明显升高。
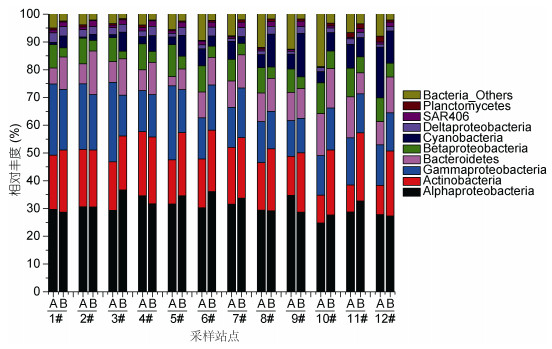 |
| 图 3 各站位的优势菌门和变形菌纲的相对丰度 Fig. 3 Relative abundances of dominant phyla and proteobacterial classes in water samples 注: A: 7月2日; B: 7月16日 |
相关性分析结果表明优势细菌类群的相对丰度大多与多重环境因子显著相关(P < 0.05, 表 1)。其中α-变形菌与温度、盐度呈显著正相关, 与NH4+呈显著负相关; 放线菌与盐度呈显著正相关, 与硅酸盐、DO、NO3-、chl a呈显著负相关; γ-变形菌与温度呈显著正相关, 与COD、PO43-、NO2-、chl a呈显著负相关; β-变形菌与硅酸盐、PO43-、NO3-呈显著正相关, 与pH、盐度呈显著负相关; 蓝细菌与COD、PO43-、NO2-及chl a呈显著正相关, 而拟杆菌仅与COD呈显著正相关。δ-变形菌和SAR406与环境因子的相关性基本一致, 都与pH、盐度呈显著正相关, 而与硅酸盐、PO43-、NO2-呈显著负相关。此外, 在所有检测的环境因子中, 温度与除α-变形菌外的优势细菌类群均无显著相关性, 而浮霉菌与所检测的环境因子均无显著相关性。
| 优势细菌门或纲 | pH | 铵氮 | 硅酸盐 | COD | 磷酸盐 | 溶解氧 | 温度 | 硝酸盐 | 亚硝酸盐 | 盐度 | Chl-a |
| Alphaproteobacteria | 0.284 | –0.682** | –0.183 | –0.256 | –0.395 | –0.107 | 0.501* | –0.005 | –0.219 | 0.434* | –0.054 |
| Actinobacteria | 0.336 | –0.028 | –0.600** | –0.290 | –0.253 | –0.482* | –0.027 | –0.667** | –0.355 | 0.447* | –0.478* |
| Gammaproteobacteria | 0.312 | –0.252 | –0.147 | –0.730** | –0.586** | 0.006 | –0.077 | 0.190 | –0.654** | 0.509* | –0.495* |
| Bacteroidetes | –0.119 | 0.172 | –0.182 | 0.426* | 0.290 | –0.019 | 0.044 | –0.381 | 0.354 | –0.075 | 0.230 |
| Betaproteobacteria | –0.659** | 0.314 | 0.868** | 0.108 | 0.490* | 0.128 | –0.094 | 0.823** | 0.259 | –0.675** | 0.047 |
| Cyanobacteria | –0.206 | 0.291 | –0.006 | 0.666** | 0.512* | 0.030 | 0.237 | –0.297 | 0.591** | –0.389 | 0.565** |
| Deltaproteobacteria | 0.686** | –0.279 | –0.687** | –0.581** | –0.740** | –0.373 | 0.071 | –0.309 | –0.574** | 0.768** | –0.427* |
| SAR406 | 0.687** | –0.505* | –0.871** | –0.336 | –0.581** | –0.496* | 0.290 | –0.719** | –0.443* | 0.792** | –0.318 |
| Planctomycetes | –0.155 | 0.284 | 0.082 | –0.001 | 0.249 | –0.314 | –0.017 | 0.027 | 0.125 | –0.260 | –0.178 |
| 注:**表示在0.01水平上存在极显著差异, *表示在0.05水平上存在显著差异, n=24 | |||||||||||
象山港各海区表层浮游细菌α-多样性指数(香农指数、Chao 1指数), 除7月2日口门部(海区Ⅰ)样品比其余海区高外, 其余几个海区样品浮游细菌α-多样性间无显著差异, 而7月16日所有海区样品间α-多样性指数均无显著差异(图 4)。两个航次的各海区样品中浮游细菌群落均匀度间均无显著差异。
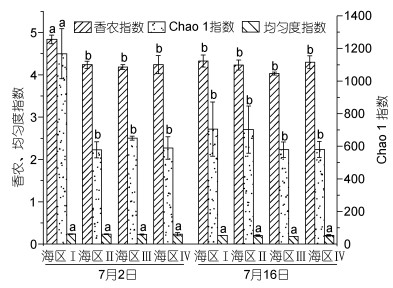 |
| 图 4 浮游细菌群落的α-多样性和均匀度指数 Fig. 4 α-Diversity and evenness of the bacterioplankton communities 注:图中数据为平均值±标准差, n=2—4, 不同字母表示同一指数在不同海区之间(忽略航次)有显著差异(P < 0.05, 基于LSD的方差分析) |
在RDA排序图中, 各站位相对距离可以反映浮游细菌群落结构的差异(图 5)。总体上, 两个航次样品分别聚类在第一轴的上下两侧, 各站位能够按海区进行聚类, 而口门部(海区Ⅰ)与港顶(海区Ⅳ)的站位分别位于第二轴左右两侧。但海区Ⅱ和海区Ⅲ的相对位置在两个航次中有变化, 7月2日样品中, 海区Ⅱ的6#、7#站位与海区Ⅲ站位聚类在一起; 但7月16日样品中, 海区Ⅱ与海区Ⅰ站位聚类在一起。双因子交叉相似性分析(two-way crossed ANOSIM)显示, 总体上, 海区(R=0.784, P=0.001)和航次(R=0.953, P=0.001)间浮游细菌群落结构有显著差异, 而航次间的差异更大, 成对检验进一步表明各海区间浮游细菌群落结构差异均显著(P < 0.05)(表 2)。浮游细菌群落结构与NO3-、NO2-、盐度、PO43-、COD、硅酸盐、温度、pH显著相关(P < 0.01), 其中NO3-、硅酸盐及盐度是造成细菌群落时间演替的主要因子。盐度及pH是塑造海区Ⅰ与其他海区浮游细菌群落差异的主要环境因子, 而海区Ⅳ与其他海区细菌群落结构差异主要与PO43-、COD、温度、NO2-及硅酸盐等环境因子密切相关。
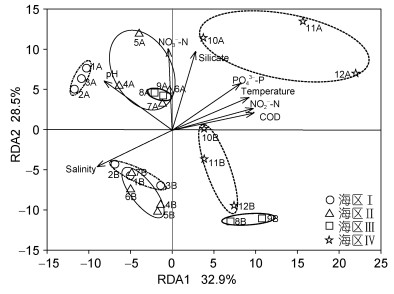 |
| 图 5 基于RDA双向排序图表征浮游细菌群落结构变化与主要环境驱动因子(P<0.01) Fig. 5 The RDA bi-plot showing variation in bacterioplankton community structure and main driving factors (P < 0.01) 注:图中相同形状符号代表同一海区, 数字代表站位号, 字母A代表 7月2日, 字母B代表 7月16日 |
| R | P | 差异性贡献率前三的物种贡献率百分比 | ||||
| OTU639502 | OTU592269 | OTU1016465 | OTU404788 | |||
| 采样海区 | 0.784 | 0.001 | 4.66% | 4.21% | 4.01% | — |
| 海区Ⅰvs.海区Ⅱ | 0.718 | 0.002 | 4.40% | — | 4.50% | 9.03% |
| 海区Ⅰvs.海区Ⅲ | 1.000 | 0.010 | 5.00% | 5.40% | — | 7.03% |
| 海区Ⅰvs.海区Ⅳ | 1.000 | 0.010 | 7.03% | — | 5.69% | 9.74% |
| 海区Ⅱvs.海区Ⅲ | 0.446 | 0.044 | 7.23% | — | 4.99% | 6.72% |
| 海区Ⅱvs.海区Ⅳ | 0.926 | 0.002 | 7.46% | — | 6.85% | 7.07% |
| 海区Ⅲvs.海区Ⅳ | 0.667 | 0.040 | 7.46% | — | 6.85% | 7.07% |
| 采样时间(全局性) | 0.953 | 0.001 | ||||
| 注:加粗字体表示存在显著差异(P<0.01) OUT639502_放线菌门(Actinobacteria)_放线菌纲(Acidimicrobiia)_酸微菌目(Acidimicrobiales)_ OCS155_未分类属 OTU592269_变形菌门(Proteobacteria)_α-变形菌纲(Alphaproteobacteria)_未分类目 OTU404788_蓝细菌门(Cyanobacteria)_集球藻纲(Synechococcophycideae)_集球藻目Synechococcales_聚球藻科(Synechococcaceae)_聚球藻属(Synechococcus) OTU1016465_变形菌门(Proteobacteria)_α-变形菌纲(Alphaproteobacteria)_立克次氏体目_远洋杆菌科(Pelagibacteraceae)_未分类属 |
||||||
通过SIMPER分析得到造成各海区浮游细菌群落差异的主要贡献物种(表 2), 分别为来自聚球藻属(Synechococcus)、酸微菌目的OCS155、远洋杆菌科(Pelagibacteraceae, SAR11)及α-变形菌纲(Alphaproteobacteria)的四个OTUs, 也是象山港平均丰度最高的四个OTUs。7月2日样品中, 聚球藻OTU404788及α-变形菌OTU592269的相对丰度自口门部到港顶均递增; 远洋杆菌科OTU1016465的相对丰度自口门部到港内也有增大的趋势, 但在港顶(海区Ⅳ)突降至最低; OTU639502(OCS155)的相对丰度自口门部到港顶之间海区则比较相似, 但也在港顶突降至最低(图 6)。7月16日样品中, 聚球藻OTU404788的相对丰度自口门部到港顶递增; 远洋杆菌科OTU1016465的相对丰度口门部稍高, 港内相对丰度略低且比较一致, 而α-变形菌OTU592269相对丰度在口门部略低于港内, 属于OCS155的OTU639502的相对丰度在各海区均比较接近。相关性分析表明, OTU639502与pH、盐度呈正相关, 与硅酸盐、PO43-、NO3-、chl a呈负相关(附表 1)。α-变形菌OTU592269与COD、PO43-、温度、NO2-、chl a呈正相关, 而与pH、盐度呈显著负相关; 聚球藻OTU404788与COD、PO43-、温度、NO2-、chl a成正相关。
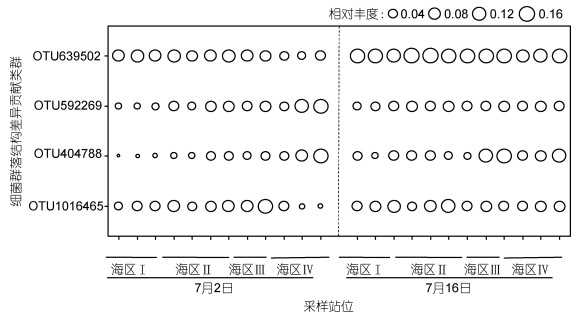 |
| 图 6 海区间浮游细菌群落结构差异度关键贡献OTUs的空间分布 Fig. 6 Spatial distribution of the key OTUs contributing to the variation in bacterioplankton community structure between pairs of sea areas |
| 环境因子 | OTU639502 | OTU592269 | OTU404788 | OTU1016465 |
| pH | 0.577** | –0.340 | –0.208 | 0.095 |
| 铵氮 | –0.300 | –0.050 | 0.354 | –0.416* |
| 硅酸盐 | –0.839** | 0.281 | –0.024 | –0.118 |
| COD | –0.274 | 0.647** | 0.700** | 0.134 |
| 磷酸盐 | –0.450* | 0.536** | 0.561** | –0.063 |
| 溶解氧 | –0.464* | 0.142 | –0.012 | 0.049 |
| 温度 | –0.141 | 0.403 | 0.603** | –0.001 |
| 硝酸盐 | –0.775** | 0.020 | –0.306 | –0.294 |
| 亚硝酸盐 | –0.340 | 0.725** | 0.625** | 0.111 |
| 盐度 | 0.667** | –0.436* | –0.411* | 0.154 |
| Chl-a | –0.311 | 0.550** | 0.561** | 0.157 |
| 注: **表示在0.01水平上显著相关, *表示在0.05水平上显著相关, 样本数n=24 | ||||
根据LefSe分析的结果, 海区Ⅲ未发现相对丰度≥1.0%标志类群, 这也可能与该海区样品较少, 导致统计学强度不够有关。其余三个海区均有标志类群(图 7)。7月2日航次, 在门纲水平上, α-变形菌纲在海区Ⅱ中相对丰度最高, 蓝藻门(Cyanobacteria)和鞘脂杆菌纲(Sphingobacteriia)在海区Ⅳ中相对丰度显著高于其余海区, 海区Ⅰ在门纲水平上无显著差异标志类群; 7月16日航次, 仅海区Ⅳ的β-变形菌、放线菌(Actinobacteria)、浮霉菌(Planctomycetales)与其他海区存在显著差异。
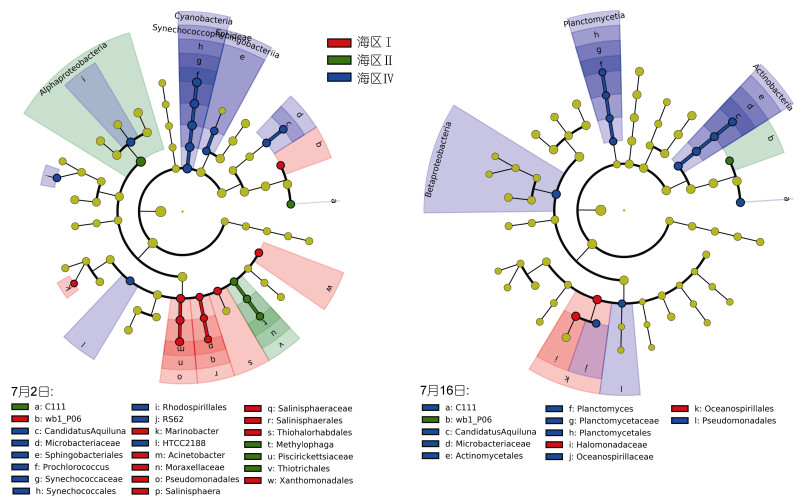 |
| 图 7 四个海区的组间群落差异分析(LDA) (LDA≥2.0, P < 0.05) Fig. 7 Least discriminant analysis (LDA) on the difference in the community structure of the three sea areas (LDA≥2.0, P < 0.05) |
在目及科属水平上, 7月2日航次, 酸微菌目的wb1_P06及γ-变形菌纲的假单胞菌目(Pseudomonadales)、咸水球形菌目(Salinisphaerales)、黄色单胞菌目(Xanthomonadales)、Thiohalorhabdales、海杆菌属(Marinobacter)是海区Ⅰ的标志性类群; 硫发菌目(Thiotrichales)及酸微菌目的C111是海区Ⅱ的标志性类群; 而海区Ⅳ的标志性类群有聚球藻目(Synechococcales)、鞘脂杆菌目(Sphingobacteriales)、红螺菌目(Rhodospirillales)、红细菌目(HTCC, γ-变形菌纲)、微杆菌科(Microbacteriaceae)和丛毛单胞菌科的RS62。7月16日航次, 海洋螺菌目(Oceanospirillales)及其所属的盐单胞菌科Halomonadaceae在海区Ⅰ的相对丰度显著高于其余海区, 酸微菌目的wb1_P06在海区Ⅱ的相对丰度高, 而在海区Ⅳ, 同属于放线菌门的放线菌目(Actinnomycetales)和C111(酸微菌目)、浮霉菌目(Planctomycetales)、假单胞菌目(Pseudomonadales)及海洋螺菌科(Oceanospirillaceae)的丰度与其余海区存在显著差异。在两个航次中, 同一类群的身份在不同海区间摇摆, 如7月2日航次wb1_P06及C111分别在海区Ⅰ、海区Ⅱ相对丰度高, 而7月16日航次, wb1_P06在海区Ⅱ相对丰度高, C111在海区Ⅳ相对丰度高; 也存在两个航次一致的标志性类群, 如属于放线菌门的candidatus Aquiluna rubra均为海区Ⅳ的标志性类群。
3 讨论 3.1 夏季象山港浮游细菌群落α-多样性稳定有研究表明, 在河口和海湾水域, 盐度是影响水体细菌群落α-多样性的主要因素(Campbell et al, 2013; 王朝晖等, 2016; 昝帅君等, 2016), 温度或营养盐的升高也会导致细菌多样性升高(江晓亮, 2013; Wang et al, 2015)。如辽河口水域的浮游细菌群落多样性在低盐淡水区及海水区均较高, 在盐度波动较大的中盐地区较低(昝帅君等, 2016), 而pH接近中性及有机物浓度的升高, 导致三门湾浮游细菌多样性升高(戴文芳等, 2017)。但是, 也有研究发现在富营养化海区细菌丰度较高, 种类数和多样性下降的现象(Xu et al, 2014); 环境因子对细菌多样性及其群落结构组成的影响模式较为复杂, 在中等温度条件下, 营养盐对细菌物种多样性的影响最强, 而在极端营养盐条件下, 温度的影响最强(Wang et al, 2016)。本研究中, 象山港各海区浮游细菌群落的α-多样性无显著性差异, 与特拉华海湾盐度梯度下的细菌群落多样性, 随着盐度增大先降低后升高明显不同(Campbell et al, 2013)。这种不同可能与特拉华海湾盐度梯度远高于象山港有关, 即象山港环境梯度范围相对窄, 不足以引起α-多样性显著变化; 当然, 也可能是象山港多重环境梯度复合影响下, 产生水床效应, 使得各海区表层浮游细菌α-多样性变化不显著。总体上, 象山港表层浮游细菌α-多样性稳定, 特别是港内各海区的浮游细菌α-多样性并没表现出显著差异(图 4)。7月2日航次口门部浮游细菌α-多样性显著高于其余三个海区, 而这可能与口门部的水体交换率高以及采样时的潮汐流影响有关(杜萍等, 2015)。
3.2 象山港浮游细菌群落结构时空变化明显细菌群落结构和优势类群组成会随着环境因子改变而变化(李祎等, 2013), 水体的DO、温度、营养盐、有机质等的波动均可能引起水体浮游细菌群落结构的变化(Ghiglione et al, 2012; Taniguchi et al, 2011)。象山港细菌群落空间变异总体上具有显著性差异(P < 0.01), 营养盐、硅酸盐、盐度及温度是象山港细菌群落空间变异的主要驱动因子。象山港不相邻海区间的细菌群落结构均呈极显著差异(P < 0.01), 而相邻海区中, 海区Ⅰ与海区Ⅱ间具有极显著差异(P=0.002), 其余相邻海区间呈显著差异(P < 0.01)。已有研究发现象山港潮流对浮游动物的空间异质性有明显贡献(杜萍等, 2015), 因此各对相邻海区间的细菌群落差异度不同可能与象山港潮流引起的水体交换有关。
整个象山港海域表层浮游细菌群落结构在半月间的变异超过空间变异, 且时间变异主要受到硝酸盐和硅酸盐影响。所有站位的硅酸盐、NO3-、PO43-浓度及盐度在不同航次整体升高或降低, 同一站位部分环境因子的时间变化甚至超过相邻站位之间的差异, 且硅酸盐、硝酸盐与大多数优势类群门纲的相对丰度呈负相关(表 1), 表明关键环境因子的整体变化很大程度上驱动细菌群落结构随时间演替, 使其时间变异性远超空间变异。
海区Ⅱ的细菌群落在两个航次分别与不同的相邻侧海区样品聚类, 显示海区Ⅱ的表层浮游细菌群落结构可能更多地受到了主港潮汐往复流及支港西沪港进出流的影响(黄秀清等, 2008)。海湾的浮游细菌群落也易受陆源性输入营养物质的影响(周凯等, 2013; 乔宗赟等, 2015), 与其他海区相比, 海区Ⅳ的站点两个航次聚类均相对分散, 由于海区Ⅳ站点分处港顶两个分叉的支港, 而港顶陆域周边城镇聚居集中, 有地表水汇入到港顶海区, 而且海区Ⅳ也是水产养殖和海上旅游餐饮活动较为集中的区域, 而这可能是造成海区Ⅳ内的各站位环境因子波动大的原因; 这些扰动会输入外源浮游细菌, 但由于浮游细菌对环境因子变化响应迅速, 在港顶海区多种环境因子的影响下, 使得海区Ⅳ内各站位最终形成具有差异较大的浮游细菌群落结构。
3.3 夏季象山港各海区标志类群的分布特征象山港属于相对封闭且养殖活动蓬勃的港湾, 营养化程度日趋严重, 有机质含量丰富, α-变形菌纲、放线菌纲与γ-变形菌等几个主要的海洋异养细菌是相对丰度最高的优势细菌类群, 与黄河入海口(位光山等, 2017)、南海南部(白洁等, 2014)、北极王湾(Zeng et al, 2013; 乔宗赟等, 2015)等近岸海域的情况相似。由于象山港营养盐丰富, 而且夏季光照强、水温高, 使得蓝细菌也成为主要优势细菌类群, 且在氮磷营养盐最高的港顶站位, 其相对丰度也达到最高。
我们还发现两个航次中同一海区存在着相同标志类群或功能相近的类群, 如包含降解烷烃潜力类群的假单胞菌目(Pseudomonadales)及海洋螺菌目(Oceanospirillales)分别是港口两个航次中的标志性类群。有研究表明, 2007~2014年间, 象山港石油类平均含量呈现港口>港中>港顶的空间分布特点(吴燕妮等, 2017), 推测港口具有降解烷烃潜力类群相对丰度高可能与该区石油类物质含量较其他海区高有关(郭立梅, 2016)。此外, 港顶在两个航次中具有相同标志性类群candidatus Aquiluna rubra(图 7), 有研究发现candidatus Aquiluna rubra是宁波陆源排放口优势菌(司开学等, 2016), 该类群在港顶相对丰度高, 可能反映出港顶受到陆源水(排污口、溪流)的影响较大。这些不同航次中的拥有相似功能潜力的海区标志性类群的存在, 可能与浮游细菌对相应海区长期干扰特征的响应有关。在以往对象山港浮游细菌的研究中, 也发现浮游细菌对环境扰动具有响应。如王海丽等(2011)对象山港表层海水硝化菌、反硝化细菌的平面分布研究表明, 这些功能菌丰度与营养盐呈显著正相关; 在电厂温排水海区, 嗜温的弧菌科相对丰度与增温幅度正相关(陈梦齐等, 2016); 胡常巨等(2015)的研究则发现从网箱区到非养殖区拟杆菌和放线菌显著降低, 而γ-变形菌显著增加, 这些浮游细菌对网箱养殖活动造成的环境差异具有明显响应。这些研究结果均表明, 象山港浮游细菌对环境扰动存在明显响应。
造成象山港不同海区表层浮游细菌群落结构差异的四个关键OTUs中分别来自聚球藻、SRA11、OCS155和α-变形菌, 其中聚球藻、SAR11分别是海洋中最具有代表性的自养、异养浮游细菌(Lu et al, 2015), 象山港的富营养化为夏季聚球藻的生长提供了良好条件, 而SAR11是全球海洋中最丰富的微生物, 在海洋有机物的分解转化中发挥着重要作用(Lu et al, 2015); OCS155能够利用藻体产生的有机物质, 是整个象山港平均相对丰度最高的类群。这四个关键OTUs在象山港的平均相对丰度最高, 反映了象山港长期富营养化状态对代表性自养、异养浮游细菌生长的促进作用。
细菌生物量也是考察细菌群落动态变化的重要指标, 本研究主要聚焦浮游细菌群落的多样性和结构及其影响因子, 未测定浮游细菌生物量, 在将来的研究中将综合考虑这个指标。在研究中发现, 不同环境因子对象山港优势类群的相对丰度具有叠加影响(表 2, 附表 1)。在将来的研究中, 需要进行多季节甚至月度采样, 更细致地解析各个具体环境因子对浮游细菌群落结构和关键类群的影响和相对重要性。
4 结论(1) 在多种环境梯度下, 象山港夏季各海区表层浮游细菌的α-多样性稳定。
(2) 象山港夏季浮游细菌群落结构存在时空异质性, 其中无机氮盐、PO43-、温度、盐度是驱动群落空间异质性的主要环境因子, PO43-、硅酸盐及盐度是驱动群落时间异质性的主要环境因子, 而潮汐往复流也可能是影响港内细菌群落差异的潜在因素。
(3) 驱动浮游细菌群落结构差异的主要OTUs与营养盐具有显著相关性, 反映出浮游细菌关键类群对象山港长期富营养化状态的响应, 且各海区标志细菌类群也一定程度上反映出相应海区的污染状况。
| 王海丽, 杨季芳, 陈吉刚, 等, 2011. 象山港海域硝化细菌与反硝化细菌的时空分布特征及其与环境因子的关系. 生态学杂志, 30(4): 752–762 |
| 王朝晖, 乔倩, 江晓亮, 等, 2016. 大亚湾浮游细菌的变性梯度凝胶电泳分析. 环境科学学报, 36(4): 1212–1218 |
| 毛硕乾, 林霞, 罗杨, 等, 2016. 象山港小型底栖动物群落结构及其与环境因子的相关性. 生态学报, 36(5): 1442–1452 |
| 白洁, 刘小沙, 侯瑞, 等, 2014. 南海南部海域浮游细菌群落特征及影响因素研究. 中国环境科学, 34(11): 2950–2957 |
| 司开学, 夏长革, 王朝阳, 等, 2016. 宁波沿海陆源排污口放线菌(Actinomycetales sp.)的分布特点. 海洋与湖沼, 47(2): 400–406 |
| 乔宗赟, 曾胤新, 董培艳, 等, 2015. 2011年夏季北极王湾细菌群落结构分析及浮游细菌丰度检测. 极地研究, 27(3): 246–254 |
| 江晓亮, 2013.大亚湾海域浮游细菌群落结构的时空变化.广州: 暨南大学硕士学位论文 |
| 杜萍, 徐晓群, 刘晶晶, 等, 2015. 象山港春、夏季大中型浮游动物空间异质性. 生态学报, 35(7): 2308–2321 |
| 李祎, 杨彩云, 郑天凌, 2013. 自然环境中细菌的生存方式及其群落特征. 应用与环境生物学报, 19(4): 553–560 |
| 吴燕妮, 李冬玲, 叶林安, 等, 2017. 象山港海域水质与沉积物主要污染因子及污染源分析. 海洋环境科学, 36(3): 328–335 |
| 位光山, 张嘉炜, 李明聪, 等, 2017. 黄河入海口水体细菌群落多样性及分布特征. 生物技术通报, 33(10): 199–208 |
| 陈明明, 王少璞, 韦梦, 等, 2014. 象山港网箱养殖区沉积物的古菌空间分布. 生态学报, 34(14): 4099–4106 |
| 陈梦齐, 刘紫丹, 戴文芳, 等, 2016. 象山港电厂温排水增温对浮游细菌群落空间分布的影响. 生态学报, 36(20): 6574–6582 |
| 林军, 闫庆, 陈炳睿, 等, 2015. 象山港滨海电厂温排水对浮游生物的生态影响. 上海海洋大学学报, 24(6): 894–905 |
| 周凯, 章洁香, 张瑜斌, 等, 2013. 深圳湾浮游细菌生物量的时空分布及其影响因素. 热带海洋学报, 32(3): 65–71 DOI:10.3969/j.issn.1009-5470.2013.03.010 |
| 胡常巨, 熊金波, 陈和平, 等, 2015. 象山港网箱养殖区与非养殖区的细菌群落分布. 生态学报, 35(24): 8053–8061 |
| 昝帅君, 樊景凤, 明红霞, 等, 2016. 辽河口浮游细菌和附着细菌群落结构及多样性分析. 海洋环境科学, 35(4): 594–599 |
| 姜亚洲, 林楠, 袁兴伟, 等, 2014. 象山港游泳动物群落功能群组成与功能群多样性. 海洋与湖沼, 45(1): 108–114 |
| 郭立梅, 2016.大连"7.16"溢油事故海域细菌群落的时空变化研究.大连: 大连海洋大学硕士学位论文 |
| 黄小平, 张凌, 张景平, 等, 2016. 我国海湾开发利用存在的问题与保护策略. 中国科学院院刊, 31(10): 1151–1156 |
| 黄秀清, 王金辉, 蒋晓山, 2008. 象山港海洋环境容量及污染物总量控制研究. 北京: 海洋出版社, 61-68 |
| 黄秀清, 齐平, 秦渭华, 等, 2015. 象山港海洋生态环境评价方法研究. 海洋学报, 37(8): 63–75 DOI:10.3969/j.issn.0253-4193.2015.08.006 |
| 董礼先, 苏纪兰, 1999. 象山港水交换数值研究Ⅱ.模型应用和水交换研究. 海洋与湖沼, 30(5): 465–470 DOI:10.3321/j.issn:0029-814X.1999.05.001 |
| 廖一波, 曾江宁, 寿鹿, 等, 2014. 象山港人工鱼礁投放对大型底栖动物群落结构的影响. 海洋与湖沼, 45(3): 487–495 |
| 阚金军, 孙军, 2011. 河口细菌群落多样性及其控制因素:以切萨皮克湾为例. 生物多样性, 19(6): 770–778 |
| 戴文芳, 郭永豪, 郁维娜, 等, 2017. 三门湾近海有机污染对浮游细菌群落的影响. 环境科学, 38(4): 1414–1422 |
| 魏永杰, 何东海, 费岳军, 等, 2015. 象山港海域生态分区研究. 应用海洋学学报, 34(4): 509–517 DOI:10.3969/J.ISSN.2095-4972.2015.04.008 |
| Campbell B J, Kirchman D L, 2013. Bacterial diversity, community structure and potential growth rates along an estuarine salinity gradient. The ISME Journal, 7(1): 210–220 DOI:10.1038/ismej.2012.93 |
| Caporaso J G, Kuczynski J, Stombaugh J, et al, 2010a. QIIME allows analysis of high-throughput community sequencing data. Nature Methods, 7(5): 335–336 DOI:10.1038/nmeth.f.303 |
| Caporaso J G, Bittinger K, Bushman F D, et al, 2010b. PyNAST:a flexible tool for aligning sequences to a template alignment. Bioinformatics, 26(2): 266–267 DOI:10.1093/bioinformatics/btp636 |
| Clarke K R, Warwick R M, 2001. Change in Marine Communities:an Approach to Statistical Analysis and Interpretation. 2 nd ed. Plymouth New York: PRIMER-E, Ltd., 92-689 |
| Ghiglione J F, Murray A E, 2012. Pronounced summer to winter differences and higher wintertime richness in coastal Antarctic marine bacterioplankton. Environmental Microbiology, 14(3): 617–629 DOI:10.1111/emi.2012.14.issue-3 |
| Kan J J, Evans S E, Chen F, et al, 2008. Novel estuarine bacterioplankton in rRNA Operon libraries from the Chesapeake bay. Aquatic Microbial Ecology, 51(1): 55–66 |
| Lu X X, Sun S L, Zhang Y Q, et al, 2015. Temporal and vertical distributions of bacterioplankton at the Gray's reef national marine sanctuary. Applied and Environmental Microbiology, 81(3): 910–917 DOI:10.1128/AEM.02802-14 |
| Segata N, Izard J, Waldron L, et al, 2011. Metagenomic biomarker discovery and explanation. Genome Biology, 12(6): R60 DOI:10.1186/gb-2011-12-6-r60 |
| ŠmilauerP, LepšJ, 2014. Multivariate Analysis of Ecological Data Using CANOCO 5. New York: Cambridge University Press, |
| Taniguchi A, Tada Y, Hamasaki K, 2011. Seasonal variations in the community structure of actively growing bacteria in neritic waters of Hiroshima bay, Western Japan. Japanese Society of Microbial Ecology, 26(4): 339–346 |
| Wang J J, Pan F Y, Soininen J, et al, 2016. Nutrient enrichment modifies temperature-biodiversity relationships in large-scale field experiments. Nature Communications, 7: 13960 DOI:10.1038/ncomms13960 |
| Wang K, Ye X S, Chen H P, et al, 2015. Bacterial biogeography in the coastal waters of northern Zhejiang, East China Sea is highly controlled by spatially structured environmental gradients. Environmental Microbiology, 17(10): 3898–3913 DOI:10.1111/1462-2920.12884 |
| Xu Z H, Guo Z R, Xu X, et al, 2014. The impact of nutrient enrichment on the phytoplankton and bacterioplankton community during a mesocosm experiment in Nan'ao of Daya Bay. Marine Biology Research, 10(4): 374–382 DOI:10.1080/17451000.2013.814792 |
| Zeng Y X, Zhang F, He J F, et al, 2013. Bacterioplankton community structure in the Arctic waters as revealed by pyrosequencing of 16S rRNA genes. Antonie Van Leeuwenhoek, 103(6): 1309–1319 DOI:10.1007/s10482-013-9912-6 |
 2018, Vol. 49
2018, Vol. 49


