
中国海洋湖沼学会主办。
文章信息
- 王仁君, 王建国, 丁宁, 孙萌, 高配科. 2018.
- WANG Ren-Jun, WANG Jian-Guo, DING Ning, SUN Meng, GAO Pei-Ke. 2018.
- 多氯联苯(Aroclor 1242)胁迫下鲤鱼肝脏组织氧化应激
- OXIDATIVE STRESS IN LIVER OF CYPRINUS CARPIOIO EXPOSED TO PCBS AROCLOR 1242
- 海洋与湖沼, 49(6): 1286-1293
- Oceanologia et Limnologia Sinica, 49(6): 1286-1293.
- http://dx.doi.org/10.11693/hyhz20180700170
-
文章历史
- 收稿日期:2018-07-13
- 收修改稿日期:2018-08-31
多氯联苯(polychlorinated biphenyls, PCBs)属于氯代烃类化合物, 是氯化联苯异构体组成的一类有机氯化合物, 根据氯原子取代数目和取代位置的不同, 多氯联苯同分异构体和同系物多达209种(李娜, 2012)。多氯联苯具有低溶性、高介电常数、低蒸汽压、抗热性且绝缘性好等优势, 因此被广泛应用于各种生产领域。1968年日本“米糠油事件”发生后多氯联苯对环境的危害和影响才引起高度重视(虞俊超, 2014)。
多氯联苯理化性质稳定, 自然条件下很难被降解, 具有持久性、高毒性、高蓄积性和远距离迁移性等特征, 属于典型的环境持久性有机污染物(Safe, 1994)。尽管目前多氯联苯在国际上逐渐被禁止生产, 但仍有部分多氯联苯产品在被使用或被填埋, 这些残留物广泛存在于水体、大气和土壤等各种环境介质中。多氯联苯可通过皮肤、呼吸道、消化道等途径进入鱼和其他动物体, 并循环累积, 能够干扰生物体的孵化、内分泌系统及生殖功能, 与生物体内蛋白质、DNA形成加和物而致突变作用, 导致畸形甚至毒性遗传(Giesy et al, 1998; 许友卿等, 2014)。多氯联苯潜在的生物毒性给环境、生态系统乃至人类健康带来潜在威胁(Fattore et al, 2008; Diletti et al, 2018)。
当生物体受到环境不利胁迫时, 机体通常会首先表现出氧化应激现象, 当氧自由基的生成与清除速率失去平衡, 过量积累的活性氧自由基会对细胞造成氧化损伤(奉斌等, 2009; 陈家长等, 2011; Liu et al, 2016)。生物体为了减轻氧化应激过程中过多的自由基对机体所造成的伤害, 会通过抗氧化系统来清除体内过量的自由基。因此, 通过测定抗氧化酶活性及其编码基因的转录表达情况能够有效表征生物体对特定环境胁迫的响应。鲤鱼(Cyprinus carpio)是我国重要经济型鱼类, 具有环境适应性强, 耐寒、耐碱、耐缺氧的特性, 栖息于江河、湖泊、水库等环境的水体底层, 以食底栖生物为主。多氯联苯胁迫下, 鲤鱼氧化应激方面的数据鲜有报道。鉴于鲤鱼的强环境适应性和底栖生活特性, 相较于其他小型水生鱼类, 以鲤鱼为受试生物, 探究多氯联苯的生物毒性具有更高研究价值。因此, 本实验以鲤鱼为受试生物, 将其暴露于Aroclor 1242(高氯代的PCBs混合物)中, 通过静态水质接触染毒方式探究PCBs胁迫下鲤鱼肝脏组织中抗氧化酶[超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)]活性、脂质过氧化水平物(丙二醛malonydialdehyde, MDA)、抗氧化酶编码基因(Cu/Zn-SOD、Mn-SOD和CAT)、应激蛋白HSP70、转录因子Nrf2和芳烃受体AhR2编码基因表达, 以期揭示鲤鱼对多氯联苯的氧化应激, 揭示多氯联苯的潜在毒性机制。
1 材料与方法 1.1 实验用鱼及预处理本实验所用鲤鱼(C. carpio)购自微山湖水产养殖中心, 平均体长为(11.5±0.5)cm, 平均体重为(61.6±10.5)g。实验前先在水族箱中进行驯养7天。驯养期间每日按时喂养自制的饲料并及时清理箱底粪便及剩余饲料。实验前1d停止喂食, 选择大小均匀、体色光泽、食欲好的个体作为实验用鱼。实验器具为90L透明塑料水族箱(60cm×50cm×30cm), 试验用水为曝气3天后除氯的自来水, pH为7.0左右, 水温为(24±1)℃。
1.2 Aroclor 1242实验浓度选择Aroclor 1242在使用前先用一定量的0.05%二甲基亚砜(DMSO)作为助溶剂配成一定浓度的储备液。按等差间距设置为5个浓度梯度实验组和1个对照组, 每个实验组设置3个平行, 每个水族箱放10尾鱼, 分别于12、24、48、72和96h观察和记录死鱼数目, 期间若有鱼死亡, 及时捞出以免污染水质(胡伟华等, 2017)。选择1/40、1/10、1/5和1/2 96h半致死浓度(LC50)值为亚急性毒性试验暴露浓度。
1.3 Aroclor 1242暴露实验用曝气除氯自来水在水族箱中将Aroclor 1242配置成浓度为20、78、156和390μg/L的溶液, 以不加PCBs的作为空白对照组, 以只加DMSO的做溶剂对照组, 所有浓度均设3个平行组, 每个浓度组下含体长重量均相近的鲤鱼20条。试验期间每隔24h更换培养溶液并及时除去死亡的鱼, 基于预实验数据于暴露后第3、6和9天测定鲤鱼肝脏中SOD和CAT活性以及MDA的含量。根据前期实验结果选取能引起氧化应激的浓度(78、156和390μg/L), 在此浓度胁迫下暴露8天, 以只加DMSO的溶剂对照组作为对照, 检测鲤鱼肝脏中相关抗氧化酶编码基因Cu/Zn-SOD、Mn-SOD、CAT和应激蛋白HSP70、转录因子Nrf2、芳烃受体AhR2基因表达变化。
1.4 鲤鱼肝脏组织中SOD、CAT和MDA的测定从预设的每个实验组中随机取出鲤鱼3尾, 用纱布擦干鱼体表面的粘液后用木棍将其敲晕, 将鲤鱼放于冰面上迅速解剖取出肝脏并除去表面附带的结缔组织, 然后用4℃的生理盐水中洗去肝脏组织上的血渍。用滤纸拭干表面的水后准确称取肝脏组织1g转入10mL的匀浆管中, 按重量(g)︰体积(mL)=1︰9的比例先用加入总量2/3预冷(4℃)的匀浆介质(0.01mol/L蔗糖, 0.01mol/L Tris-HCl, 0.0001mol/L Na2EDTA, 0.14mol/L NaCl, pH 7.4)于匀浆管中, 在冰水浴条件下8000—10000r/min匀浆3min, 再将剩余的1/3匀浆介质冲洗残留在匀浆机上的组织, 一并倒入匀浆管, 制成10%的肝脏组织的匀浆液。将所得到的10%鲤鱼肝脏组织匀浆液在4℃预冷离心机上12000g离心15min, 取上清液测定SOD、CAT活性和MDA含量。
SOD活性用SOD试剂盒(黄嘌呤氧化酶法)测定, 操作按试剂盒说明书(碧云天生物技术, 上海, 中国)进行。SOD活性的单位为U/mg prot, U的定义为:每mg蛋白在1mL反应液中SOD抑制率达50%时所对应的SOD量为一个酶活力单位。计算公式为:

CAT活性用CAT试剂盒测定, 操作按试剂盒说明书(碧云天生物技术, 上海, 中国)进行。CAT的单位为U/mg prot, U的定义为:每mg组织蛋白每秒钟分解1μmol的H2O2的量为一个酶活力单位。计算公式为:
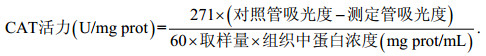
MDA含量测定用MDA试剂盒(TBA法)测定, 操作按试剂盒说明书(碧云天生物技术, 上海, 中国)进行, MDA单位为nmol/mg prot。组织中MDA含量计算公式:

用EasyPure® RNA kit试剂盒提取鲤鱼肝脏组织总RNA:鲤鱼肝脏采集过程同1.4, 总RNA提取过程按照TransGen Biotech公司EasyPure® RNA kit说明书要求进行操作。提取的总RNA通过琼脂糖凝胶电泳观察18S和28S rRNA是否完整, 并测定其A260nm/A280nm的吸光度比值是否在1.8—2.0, 以此评价所提取的RNA质量。cDNA合成参照TransScript® One-Step gDNA Removal and cDNA Synthesis SuperMix说明书进行。
1.6 实时荧光定量实时定量PCR利用LightCycler®480全自动荧光定量PCR系统, 荧光染料为SYBR, 内参基因为β-actin, 实时定量PCR引物序列见表 1︰Cu/Zn-SOD(姜维丹, 2008)、Mn-SOD(姜维丹, 2008)、CAT(姜维丹, 2008)、HSP70(邢厚娟, 2010)、Nrf2(Jiang et al, 2015)、AhR2(Du et al, 2016)。反应体系20μL: 2×ChamQ SYBR Color qPCR Master Mix 10.0μL, Primer 1(20μmol/L) 0.25μL, Primer 2(20μmol/L) 0.25μL, Template DNA/cDNA 1μL, ddH2O 8.5μL。反应条件: 95℃预变性30s; 95℃ 10s, (55—60℃)退火45s, 扩增40个循环, 在延伸时采集荧光信号, 每个样品设置3个重复。相对表达量的计算采用2–ΔΔCT法。
| 基因 | 基因全称 | 引物序列(5′到3′) |
| Cu/Zn-SOD | Cu/Zn superoxide dismutase | F: TGGCGAAGAAGGCTGTTTGT R: TTCACTGGAGACCCGTCACT |
| Mn-SOD | Mn superoxide dismutase | F: CTGCCTGACCTTCCATACGA R: CCTTAGCCAGTGCCTCTTGATA |
| CAT | Catalase | F: CTGGAAGTGGAATCCGTTTG R: CGACCTCAGCGAAATAGTTG |
| HSP70 | heat shock protein 70 | F: CCC CTG TCC CTG GGT ATT G R: CAC CAG GCT GGT TGT CTG AGT |
| Nrf2 | nuclear factor erythroid 2-related factor 2 | F: TTCCCGCTGGTTTACCTTAC R: CGTTTCTTCTGCTTGTCTTT |
| AhR2 | Aryl hydrocarbon receptor 2 | F: ATTCCCTTCCTCAAAAACCGT R: AGTCCAGGATTGGCAGCGT |
试验结果用平均值±标准偏差(Mean±Standard deviation)表示, 运用SPSS17.0统计学分析软件对数据进行统计学分析, 采用方差分析中的在Dunnett’s test检验处理组和对照组之间的差异是否显著性, P < 0.05表示暴露组与对照组差异显著, P < 0.01表示暴露组与对照组差异极显著。
2 结果 2.1 Aroclor 1242对鲤鱼急性毒性实验不同浓度Aroclor1242暴露后, 鲤鱼个体死亡数量随时间的变化情况如表 2所示。通过概率单位法计算得出Aroclor1242对鲤鱼96h半数致死浓度为780μg/L。
| 浓度(μg/L) | 个体数 | 死亡数(24h) | 死亡数(48h) | 死亡数(96h) |
| 30 | 10 | 0 | 0 | 0 |
| 50 | 10 | 0 | 0 | 1 |
| 100 | 10 | 0 | 1 | 2 |
| 200 | 10 | 1 | 0 | 2 |
| 500 | 10 | 1 | 3 | 3 |
| 1000 | 10 | 3 | 5 | 6 |
| 2000 | 10 | 10 | 10 | 10 |
如图 1所示, 不同浓度Aroclor 1242对鲤鱼肝脏SOD活性的影响整体表现为低浓度促进高浓度抑制的趋势。由图可知, 空白对照组和溶剂对照组鲤鱼肝脏组织SOD活性在三个测试时间段内没有发生显著变化(P > 0.05), 表明少量二甲基亚砜(DMSO)作为助溶剂对鲤鱼肝脏组织SOD活性无影响。与对照组相比, 20μg/L Aroclor 1242暴露组鲤鱼肝脏组织SOD活性在第3天和第6天均显著升高, 分别高出对照组18.9%、26.7% (P < 0.05); 156μg/L暴露组鲤鱼肝脏组织SOD活性在第3天和第6天均显著下降, 分别低于对照组31.9%和29.2% (P < 0.05); 390μg/L暴露组鲤鱼肝脏组织SOD活性在第3天、6天和9天均显著下降, 分别降低35.5%、35.1% (P < 0.05)和20.7% (P < 0.01)。以上数据表明, SOD活性表现出低浓度促进高浓度抑制的趋势, 且中高浓度实验组还表现出一定的先下降后上升的趋势。
 |
| 图 1 不同浓度Aroclor 1242对鲤鱼肝脏组织SOD活性的影响 Fig. 1 Effects of different concentrations of Aroclor 1242 on SOD activity in liver tissue of C. carpio |
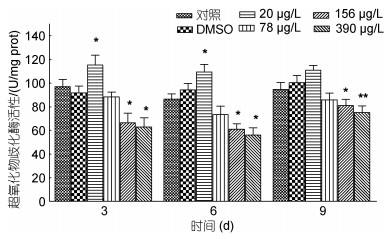
如图 2所示, 不同浓度Aroclor 1242对鲤鱼肝脏CAT活性的影响整体表现为低浓度促进高浓度抑制的趋势。与对照组相比, 20和78μg/L暴露组鲤鱼肝脏组织CAT活性在第3天时显著升高, 分别高于对照组44.1%和46.8% (P < 0.05)。在第9天时CAT活性均有所降低, 其中, 78μg/L暴露组鲤鱼肝脏组织CAT活性低于对照组24.1% (P < 0.05), 156μg/L暴露组鲤鱼肝脏组织CAT活性低于对照组23.2% (P < 0.05), 390μg/L暴露组鲤鱼肝脏CAT活性低于对照组30.4% (P < 0.01)。以上数据表明, CAT活性亦表现出低浓度促进高浓度抑制的趋势, 且中高浓度实验组还表现出一定的先下降后上升的趋势。
 |
| 图 2 不同浓度Aroclor 1242对鲤鱼肝脏组织CAT活性的影响 Fig. 2 Effects of different concentrations of Aroclor 1242 on CAT activity in liver tissue of C. carpio |
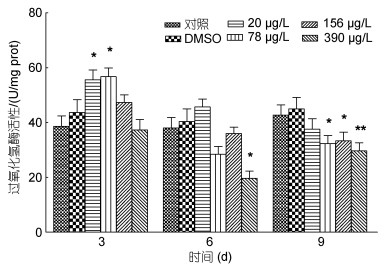
不同浓度Aroclor 1242对鲤鱼肝脏组织MDA含量的影响如图 3所示。与对照组相比, 20μg/L暴露组鲤鱼肝脏组织MDA含量在各个时间段无显著变化(P > 0.05); 78μg/L暴露组鲤鱼肝脏组织MDA含量在第3天、第6天和第9天均呈现升高趋势; 156μg/L暴露组鲤鱼肝脏组织MDA含量在各个时间段内均显著升高, 分别高于对照组54.8%、58.3%和56.9% (P < 0.05); 390μg/L暴露组鲤鱼肝脏组织MDA含量在三个时间段分别高于对照组77.5% (P < 0.05)、92.1% (P < 0.01)和65.1% (P < 0.05)。
 |
| 图 3 不同浓度Aroclor 1242对鲤鱼肝脏组织MDA含量的影响 Fig. 3 Effects of different concentrations of Aroclor 1242 on MDA content in liver tissue of C. carpio |
图 4为不同浓度Aroclor 1242暴露8d后鲤鱼肝脏组织抗氧化相关基因表达情况。78、156和390μg/L Aroclor 1242暴露组Cu/Zn-SOD mRNA比对照组分别显著降低了48%、57%和76%(图 4a, P < 0.05)。与对照组相比, 156和390μg/L Aroclor 1242暴露组Mn-SOD mRNA的表达量分别降低了37%和58%(图 4b, P < 0.05)。与对照组相比, 78μg/L Aroclor 1242暴露组中CAT mRNA的表达量降低了56%(图 4c, P < 0.05), 但高浓度组有所升高。156μg/L Aroclor 1242暴露组HSP70 mRNA的表达量比对照组降低了80%(图 4d, P < 0.05), 390μg/L Aroclor 1242暴露组HSP70 mRNA的表达量降低了90% (P < 0.01)。如图 4e所示, 与对照组相比, 78μg/L暴露组Nrf2 mRNA的表达量升高了120%, 156和390μg/L Aroclor 1242暴露组Nrf2 mRNA的表达量分别降低了50%和70% (P < 0.05)。如图 4f所示, 与对照组相比, 156和390μg/L Aroclor 1242暴露组AhR2 mRNA的表达量分别降低了52%和80% (P < 0.05)。
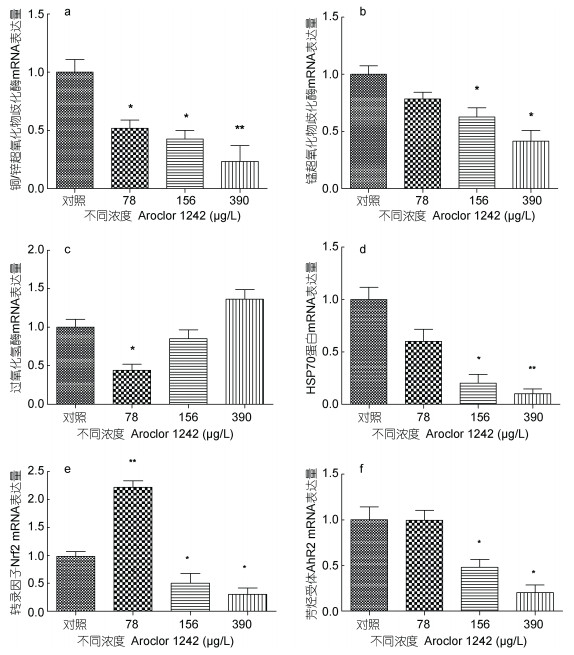 |
| 图 4 Aroclor 1242暴露8d对鲤鱼肝脏组织抗氧化相关基因Cu/Zn-SOD (a)、Mn-SOD (b)、CAT (c)、HSP70 (d)、Nrf2 (e)、AhR2 (f)表达的影响 Fig. 4 Effects of 8-day Aroclor 1242 exposure on the expression of antioxidant related genes Cu/Zn-SOD (a)、Mn-SOD (b)、CAT (c)、HSP70 (d)、Nrf2 (e)、AhR2 (f)in liver tissue of C. carpio 注:对照组只用溶剂暴露。“*”表示P < 0.05, 与对照组相比差异显著; “**”表示P < 0.01, 与对照组相比差异极显著。 |
SOD是生物体内最先参与氧自由基清除作用的酶, 是抗氧化防御系统的第一道防线(Zhang et al, 2014)。在SOD催化下氧自由基被转化生成H2O2和O2, H2O2再经过CAT或谷胱甘肽过氧化物酶(Glutathioneperoxidase, GPx)催化转化为水排出体外, 从而保护机体免受氧化损伤, 并且减少脂质过氧化的发生(梅丹等, 2012; 刘燕等, 2014)。本实验中, 与对照组相比, 20μg/L暴露组鲤鱼肝脏组织中内SOD活性显著被诱导, 表明当外界环境胁迫程度较轻时, 机体内的抗氧化系统会因受到刺激而作出迅速反应, 为了减少氧自由基对机体所造成的伤害, SOD活性往往被诱导。Stebbing(1982)认为由低浓度的污染物引起生物体内酶活性升高的现象是生物体未受到污染物损伤情况下的刺激反应-毒物兴奋效应。后续研究表明, 这一现象适用于大多数生物, 如细菌(程逸飞等, 2018)和海洋微藻(黄健等, 2002)。中高浓度处理组SOD活性还显示出一定的先下降后上升的趋势:随着外界胁迫强度的增加, 如78、156、390μg/L暴露组, 鲤鱼肝脏组织SOD活性在初始阶段(第3和6天)显著降低, 说明当胁迫因子超过生物体所承受范围时, 生物体内抗氧化系统不能清除过量的氧自由基, 氧自由基对细胞造成一定氧化损伤, 致使SOD的活性受到抑制; 在胁迫的第9天, SOD活性略有上升, 这可能与毒物的代谢消耗或者生物体的自我修复调节功能有关。
CAT能够直接将过氧化氢分解为水和氧气, 可清除微粒体中由尿酸酶、黄嘌呤氧化酶、a-羟酸氧化酶等多种酶促反应产生的过氧化氢, 清除线粒体中由超氧化物歧化酶催化自由基·O2-歧化反应所产生的过氧化氢(许友卿等, 2014)。本实验中, CAT活性表现出低浓度促进趋势:与对照组相比, 20和78μg/L暴露组CAT活性在第3天被显著诱导, 进一步表明低浓度Aroclor1242暴露下鱼体内会不断产生氧自由基, 产生的氧自由基会被SOD转化为H2O2, 为保护细胞免受H2O2的氧化损伤, 生物体内的CAT活性会增加来将H2O2催化转化为H2O和O2。同SOD, 中高浓度毒物作用下CAT活性表现出一定的先下降后上升的趋势。
生物膜的主要成分为多不饱和脂肪酸, 当生物体受到外界胁迫时多不饱和脂肪酸会受到细胞内产生的氧自由基的攻击, 造成脂质过氧化作用形成脂质过氧化物丙二醛(MDA), 因此通过测定MDA含量我们能够间接得知细胞受损伤的程度(Brucka-Jastrzebska, 2010; Liu et al, 2016)。在本实验中, 与对照组相比, 随着Aroclor 1242浓度的升高鲤鱼肝脏组织MDA含量呈显著上升趋势, 表明Aroclor 1242达到一定浓度时, 鲤鱼肝脏组织的抗氧化系统已无法及时消除肝脏组织内积累的过量氧自由基, 从而引起脂质过氧化生成MDA。
3.2 Aroclor 1242对鲤鱼肝脏相关抗氧化酶基因的影响穆希岩等(2015)将斑马鱼暴露于1.0mg/L苯醚甲环唑暴露组中, 其肝脏SOD、CAT和GPx的活性显著受到抑制, 且编码这些抗氧化酶的基因表达水平也显著下调。在本实验中, 在中高浓度(78、156和390μg/L)的Aroclor 1242暴露8天后, 鲤鱼肝脏组织抗氧化基因Cu/Zn-SOD、Mn-SOD和CAT的mRNA表达量整体上呈现出不同程度的下调趋势。需要说明的是, 基因的转录、翻译和相关酶作用的时相不同, 以及随着毒物的代谢消耗或者生物体的自我修复调节功能的恢复, 文中出现了部分基因(CAT)的表达量出现在某时间段上升的现象。
生物细胞在遭受某些外界因素如重金属、有机污染物等应激原刺激时, 机体会产生一类具有保护作用的蛋白质—应激蛋白(Heat Shock Proteins, HSPs)来保护细胞免受胁迫损害, 它们不但可以提高细胞的耐受性, 而且对生物细胞具有保护修复的作用。应激蛋白目前已发现10余种, 根据其分子量的大小可分为HSP90、HSP70、HSP60和小分子量应激蛋白4个主要的家族, 而HSP70家族是最保守和最主要的一类应激蛋白, 也是生物体发生应激反应后生成最为显著的一类蛋白。邢厚娟(2010)通过试验发现, 当鱼类暴露于浓度为4.28、42.8、428μg/L的阿特拉津中时, 肝脏组织HSP70基因mRNA的表达水平显著降低, P < 0.05。沈骅等(2004)研究指出, 鲫鱼经过40d Pb2+、Cd2+不同浓度的暴露后, 肝脏内HSP70有显著的诱导(P < 0.05), 但在Cd2+浓度为0.2mg/L有停止表达HSP70的现象, 他认为这可能是由于浓度过高造成了组织病理损伤而破坏了诱导表达机制。本实验中, 在156μg/L和390μg/L Aroclor 1242暴露8天后, 鲤鱼肝脏组织HSP70 mRNA表达与对照组相比显著下调, 表明鲤鱼在较长时间Aroclor 1242胁迫下, 机体肝脏组织可能已出现损伤。
芳烃受体AhR2和核转录因子Nrf2是参与代谢酶系统转录调控的主要转录因子(薄军等, 2010; 殷健, 2014)。AhR2是一种配体激活转录因子, Aroclor 1242与AhR2结合后会转移到细胞核中, 与核芳烃受体2转运蛋白结合, 激活或抑制核内靶基因CYP1A的表达(赵娜等, 2005; 刘仕博, 2012)。Nrf2是生物体的抗氧化防御系统的调控因子, 存在于细胞质中与KEAP1(Kelch-like ECH-associated protein 1)结合, 处于合成与降解的平衡状态。众多研究表明在Keap1-Nrf2通路中, 转录因子Nrf2参与调控下游靶基因表达。已有大量研究表明多环芳烃类化合物通过结合激活芳烃受体2, 从而启动下游靶基因的表达, 例如: CYP1A、GST等(袁立来, 2013; 吴菲力, 2016)。因此, 转录因子Nrf2、AhR2可能参与Aroclor 1242调控抗氧化酶编码基因表达的机制。本实验结果显示, 中高浓度暴露组(156和390μg/L), 鲤鱼肝脏中Nrf2、AhR2基因表达显著下调, 因此从转录水平变化可以推测Nrf2和AhR2可能参与Aroclor 1242暴露下鲤鱼肝脏组织中抗氧化酶编码基因的表达调控。
4 结论(1) Aroclor 1242能够引起鲤鱼肝脏组织中SOD和CAT活性发生显著变化, 表现出低浓度促进高浓度抑制的趋势, 表明Aroclor 1242诱导鲤鱼肝脏组织细胞发生氧化应激反应。
(2) Aroclor 1242能够引起鲤鱼肝脏组织MDA含量显著升高, 表明Aroclor 1242导致肝脏组织脂质过氧化, 膜系统受到损伤。
(3) Aroclor 1242暴露下, 鲤鱼肝脏组织中抗氧化酶编码基因(Cu/Zn-SOD、Mn-SOD、CAT)、应激蛋白70基因和代谢酶系统转录调控的主要转录因子(Nrf2和AhR2)表达量呈现下调趋势。
| 邢厚娟, 2010.阿特拉津和毒死蜱单一及联合暴露对鲤鱼毒理作用的研究.哈尔滨: 东北农业大学博士学位论文 |
| 刘燕, 梁敏, 张玄可, 等, 2014. 铬暴露对草鱼鳃抗氧化酶活性和脂质过氧化作用的影响. 西南大学学报(自然科学版), 36(5): 46–51 |
| 刘仕博, 2012.苯并三唑对黄斑蓝子鱼免疫毒性的研究.长春: 东北师范大学硕士学位论文 |
| 许友卿, 梅婕, 丁兆坤, 等, 2014. 多氯联苯对水生动物抗氧化酶的影响及机理. 水产科学, 33(4): 258–262 DOI:10.3969/j.issn.1003-1111.2014.04.013 |
| 李娜, 2012.多氯联苯在水生食物链中的生物毒性及富集效应研究.广州: 暨南大学硕士学位论文 |
| 吴菲力, 2016. Aroclor 1254诱导稀有鮈鲫氧化应激反应和细胞凋亡相关基因表达的研究.杨凌: 西北农林科技大学硕士学位论文 |
| 沈骅, 王晓蓉, 张景飞, 等, 2004. 低浓度Zn对幼龄鲫鱼肝脏组织应激蛋白HSP70诱导的影响. 农业环境科学学报, 23(3): 441–443 DOI:10.3321/j.issn:1672-2043.2004.03.006 |
| 陈家长, 宋超, 胡庚东, 等, 2011. 微囊藻毒素-LR对罗非鱼肝脏活性氧自由基含量及相关抗氧化酶活性的影响. 农业环境科学学报, 30(8): 1521–1525 |
| 奉斌, 代其林, 王劲, 2009. 非生物胁迫下植物体内活性氧清除酶系统的研究进展. 绵阳师范学院学报, 28(11): 50–53, 77 DOI:10.3969/j.issn.1672-612X.2009.11.014 |
| 赵娜, 张万起, 2005. 芳香烃受体及其介导的二噁英毒性研究进展. 毒理学杂志, 19(1): 67–69 DOI:10.3969/j.issn.1002-3127.2005.01.027 |
| 赵雪松, 任新, 段小月, 等, 2016. 全氟辛烷磺酸盐暴露对斑马鱼胚胎发育毒性与氧化应激的影响. 唐山学院学报, 29(6): 12–16 |
| 胡伟华, 何辉, 袁勇超, 等, 2017. 敌百虫、溴氰菊酯对大鳞副泥鳅仔鱼及多刺裸腹溞的急性毒性实验. 淡水渔业, 47(1): 66–70 DOI:10.3969/j.issn.1000-6907.2017.01.011 |
| 姜维丹, 2008.肌醇对幼建鲤消化吸收能力和免疫能力的影响.雅安: 四川农业大学硕士学位论文 |
| 袁立来, 2013.典型多环芳烃暴露对稀有鮈鲫药物代谢系统相关基因表达的影响.武汉: 华中农业大学博士学位论文 |
| 殷健, 2014.重金属对斑马鱼的毒性效应及作用机制研究.北京: 北京协和医学院博士学位论文 |
| 黄健, 唐学玺, 宫相忠, 等, 2002. 低浓度毒物对海洋微藻生长刺激效应的初步研究. 应用生态学报, 13(11): 1516–1518 DOI:10.3321/j.issn:1001-9332.2002.11.038 |
| 梅丹, 周少奇, 2012. 垃圾渗滤液对斑马鱼的毒性及抗氧化酶活性的影响. 生态环境学报, 21(5): 902–906 |
| 程逸飞, 曾鸿鹄, 于洋, 等, 2018. 磺胺类抗生素对不同革兰氏阴性菌的毒物兴奋效应研究. 生态毒理学报, 13(2): 57–65 |
| 虞俊超, 2014.多氯联苯和短链氯化石蜡在典型区域环境中的分布及迁移转化研究.济南: 山东大学硕士学位论文 |
| 薄军, 吴世军, 李裕红, 等, 2010. 苯并[a]芘(BaP)对真鲷细胞色素P450和芳香烃受体基因表达的影响. 中山大学学报(自然科学版), 49(3): 93–97 |
| 穆希岩, 2015.苯醚甲环唑对斑马鱼毒性及作用机制研究.北京: 中国农业大学博士学位论文 |
| Brucka-Jastrzebska E, 2010. The effect of aquatic cadmium and lead pollution on lipid peroxidation and superoxide dismutase activity in freshwater fish. Polish Journal of Environmental Studies, 19(6): 1139–1150 |
| Diletti G, Scortichini G, Abete M C, et al, 2018. Intake estimates of dioxins and dioxin-like polychlorobiphenyls in the italian general population from the 2013-2016 results of official monitoring plans in food. Science of the Total Environment, 627: 11–19 DOI:10.1016/j.scitotenv.2018.01.181 |
| Dorantes-Aranda J J, Seger A, Mardones J I, et al, 2015. Progress in understanding algal bloom-mediated fish kills:the role of superoxide radicals, phycotoxins and fatty acids. PLoS One, 10(7): e0133549 DOI:10.1371/journal.pone.0133549 |
| Du J L, Cao L P, Liu Y J, et al, 2016. A study of 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin induced liver injury in Jian Carp (Cyprinus carpio var. Jian) using precision-cut liver slices. Bulletin of Environmental Contamination and Toxicology, 96(1): 55–61 DOI:10.1007/s00128-015-1683-5 |
| Fattore E, Fanelli R, Dellatte E, et al, 2008. Assessment of the dietary exposure to non-dioxin-like PCBs of the Italian general population. Chemosphere, 73(S1): S278–S283 |
| Giesy J P, Kannan K, 1998. Dioxin-like and non-dioxin-like toxic effects of polychlorinated biphenyls (PCBs):implications for risk assessment. Critical Reviews in Toxicology, 28(6): 511–569 DOI:10.1080/10408449891344263 |
| Jiang J, Shi D, Zhou X Q, et al, 2015. Effects of glutamate on growth, antioxidant capacity, and antioxidant-related signaling molecule expression in primary cultures of fish enterocytes. Fish Physiology and Biochemistry, 41(5): 1143–1153 DOI:10.1007/s10695-015-0076-3 |
| Liu N, Wen F L, Li F M, et al, 2016. Inhibitory mechanism of phthalate esters on Karenia brevis. Chemosphere, 155: 498–508 DOI:10.1016/j.chemosphere.2016.04.082 |
| Safe S H, 1994. Polychlorinated biphenyls (PCBs):environmental impact, biochemical and toxic responses, and implications for risk assessment. Critical Reviews in Toxicology, 24(2): 87–149 DOI:10.3109/10408449409049308 |
| Stebbing A R D, 1982. Hormesis-the stimulation of growth by low levels of inhibitors. Science of the Total Environment, 22(3): 213–234 DOI:10.1016/0048-9697(82)90066-3 |
| Zhang Q, Chen S, Deng F, 2014. Effect of heavy metals and organic pollutants on antioxidant enzyme activities in zebra fish by polyacrylamide gel electrophoresis. Journal of Chemical & Pharmaceutical Research, 18(9): 68–72 |
 2018, Vol. 49
2018, Vol. 49


