
中国海洋湖沼学会主办。
文章信息
- 李亚芳, 杜飞雁, 王亮根, 宁加佳, 李纯厚. 2018.
- LI Ya-Fang, DU Fei-Yan, WANG Liang-Gen, NING Jia-Jia, LI Chun-Hou. 2018.
- 粤西海陵湾养殖区邻近海域大型底栖动物生态学特征
- ECOLOGY OF MACROBENTHIC FAUNA COMMUNITY IN AQUACULTURE ZONES OF HAILING BAY AND ADJACENT WATERS ALONG THE WESTERN GUANGDONG COAST, CHINA
- 海洋与湖沼, 49(6): 1294-1307
- Oceanologia et Limnologia Sinica, 49(6): 1294-1307.
- http://dx.doi.org/10.11693/hyhz20180300058
-
文章历史
- 收稿日期:2018-03-21
- 收修改稿日期:2018-05-28
2. 中国水产科学研究院南海水产研究所 农业部南海渔业资源开发利用重点实验室 广州 510300
2. Key Lab. of South China Sea Fishery Research Exploitation & Utilization, Ministry of Agriculture; South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China
大型底栖动物移动能力弱, 生活相对稳定, 对环境变化反应敏感, 即使轻微的变化都会导致群落结构的显著变化(Kroncke, 1995)。其群落的生态学特征及其变化, 对环境有良好的指示作用。此外, 大型底栖动物作为海洋生态系统的重要组成部分, 是低能级向高级营养级能量传递过程中的重要环节(Rhoads et al, 1970)。底栖动物作为鱼类、蟹类等水生动物的天然优质饵料, 对渔业资源增殖和养护有着重要作用(黄道明等, 1995)。底栖动物的生态学研究对于全面掌握海洋生态环境状况、了解海洋生态系统特征和资源的持续利用, 均有重要作用。
海陵湾北起阳江县平岗镇南部海边, 西为溪头镇东南海岸, 东南为海陵岛, 是广东省增殖放流的重要水域, 也是典型的养殖海湾(魏晓宇等, 2015; 阳江市海洋与渔业局, 2017)。湾内牡蛎桩架吊养基地面积3517公顷, 产量19.73×104吨, 是全国规模最大的牡蛎养殖基地(阳江市政府网, 2015)。2012年该海域水产品产量已达18.06×106吨, 产值为17亿元(Chen et al, 2015)。然而, 随着养殖规模的不断扩大, 养殖过程中的大量残饵、碎屑和养殖生物粪便直接进入水中, 对养殖海域生态环境造成较大负面影响。如海陵湾内养殖牡蛎从1996年起死亡率达30%—50%, 以及网箱养殖鱼类在2016年发生大面积死亡(丘耀文等, 2006; 刘幸, 2016)。养殖区环境持续恶化是否已影响到邻近海域尚未可知。而海陵岛拥有国内知名的闸坡浴场, 为国家海滨AAAAA级旅游景区(阳江市海陵岛经济开发试验区政务网, 2017)。因此, 开展养殖区环境恶化对周边水域生态环境影响的研究对当地经济的可持续发展, 以及不同产业间协同发展具有重要意义。为此, 本研究根据2014—2016年在粤西海陵湾及邻近海域所获样品, 从养殖区邻近海域大型底栖动物群落对环境响应角度阐述养殖区环境恶化对邻近海域生态造成的影响。
1 材料与方法 1.1 样品采集与分析材料来源于2014年9月、2015年2月、2015年7月和2016年4月粤西海陵湾及邻近海域(21°27′— 21°38′N、111°42′—111°57′E)按季度开展的4个航次调查。调查内容包括大型底栖动物、底层水及沉积物环境特征, 采样站位设置见图 1, 所有站位均位于养殖区邻近水域, 其中S1和S2站位于海陵湾内, S3、S4、S5和S6站则位于湾外滨海旅游区。调查使用取样面积为0.1m2的Van Veen采泥器, 进行大型底栖动物定量采样。每站取样2次, 合并为1个样品, 用双层套筛分选底栖动物样品(上层为1.0mm、下层为0.5mm), 所获取的生物样品用4%甲醛固定后带回实验室进行种类鉴定、个体计数和称重。底层海水及沉积环境除水深和溶解氧现场测定外, 底层海水pH、无机氮、磷酸盐、悬浮物、石油烃以及沉积物有机碳、硫化物, 在现场按调查规范进行前期处理后带至实验室进行分析测定。以上所有样品的采集、处理、保存、计数、称重均参照《海洋调查规范第6部分:海洋生物调查》(中华人民共和国国家质量监督检验检疫总局, 2008a)和《海洋监测规范第4部分:海水分析和海洋监测规范第5部分:沉积物分析》(中华人民共和国国家质量监督检验检疫总局, 2008b, c)进行。
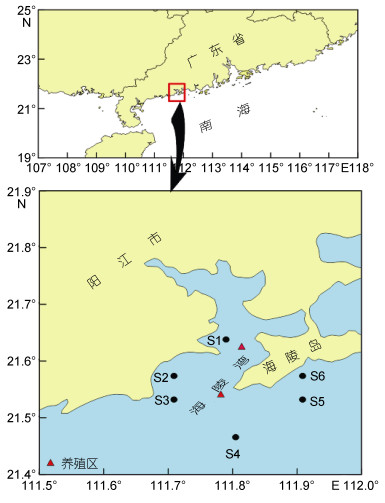 |
| 图 1 海陵湾养殖区邻近海域大型底栖动物采样站位图 Fig. 1 The sampling sites of macrobenthos in the aquaculture zone of Hailing Bay and adjacent waters |
采用Pinkas相对重要性指数(IRI)来确定优势种, 计算公式为: IRI = (W + N)×F, 式中: W为某一种的重量占总生物量的百分比(%); N为该种的丰度占总丰度的百分比(%); F为该种在取样站位的出现频率(%) (Pinkas et al, 1971)。
采用以2为底的Shannon-Wiener物种多样性指数(H′)和Pielou物种均匀度指数(J)综合分析站位种类组成多样性, 以上相关分析均通过PRIMER 6.0获得。
采用SPSS 19.0对理化因子进行以季节和站位为因素的单因素方差分析, 以及与丰度、生物量、Shannon-Wiener物种多样性指数(H′)和Pielou物种均匀度指数(J)相关分析(Li et al, 2012), 并对其显著性进行双侧T检验。
采用PRIMER 6.0并加载PERMANOVA进行等级聚类(CLUSTER)和非度量多维标度排序(MDS)分析来研究大型底栖动物群落结构的时空差异, 在进行分析前底栖动物丰度需进行4次方根转换; 采用ANOSIM(One-Way)进行群落结构的差异性检验; 采用(SIMPER)进行造成空间差异的主要物种分析; 采用基于距离的线性模型(DistLM, distance-based linear models)进行底栖动物群落与环境因子的关系分析, 拟合模型的可视化采用基于距离的冗余分析(dbRDA, distance-based redundancy analysis); 最优环境因子的子集筛选采用逐步回归程序(step-wise), 并结合赤池信息准则(AIC, akaike information criterion)的最小值(Anderson et al, 2008)。
采用Golden Software Surfer 11.0软件绘制调查站位图和底栖动物平面分布图。
2 结果 2.1 海水和沉积物理化环境环境因子的时空分布及单因素方差分析结果如表 1、附录1和附录2所示。湾内S1和S2站, 沉积物类型为细砂, 其余站均为黏土质粉砂(任杰等, 2001; 丘耀文等, 2004; 颜彬, 2011); 水深和沉积物有机碳含量均为湾内显著低于湾外(P < 0.05);沉积物硫化物在湾内各季节间无显著差异, 在湾外为春季显著高于其他季节(P < 0.05);底层无机氮浓度同样在湾内和湾外均为增养殖盛期的春季最高, 在湾内显著高于夏、秋和冬季, 湾外则显著高于夏季和冬季(P < 0.05);底层磷酸盐浓度在湾内为春季显著高于其他季节; 底层悬浮物浓度在湾内各季节间无显著差异, 在湾外秋季最高, 春季最低, 且两者存显著差异(P < 0.05);底层溶解氧浓度和石油烃在湾内和湾外均为冬季显著高于其他季节(P < 0.05);底层海水pH无明显的时空变化。
| 站点 | 经度(°E) | 纬度(°N) | 沉积物类型 |
| S1 | 111.7901 | 21.6382 | 细砂 |
| S2 | 111.709 | 21.5736 | 细砂 |
| S3 | 111.709 | 21.5324 | 黏土质粉砂 |
| S4 | 111.8047 | 21.4659 | 黏土质粉砂 |
| S5 | 111.9087 | 21.5324 | 黏土质粉砂 |
| S6 | 111.9087 | 21.5736 | 黏土质粉砂 |
| 春季 | 夏季 | 秋季 | 冬季 | |
| 水深(m) | ||||
| 湾内 | 8.0—14.0 | 4.0—10.0 | 8.0—11.0 | 5.0—15.0 |
| 均值 | 11.0 | 7.0 | 9.5 | 10 |
| 湾外 | 13.0—24.0 | 7.0—20.0 | 12.0—25.0 | 18.0—24.0 |
| 均值 | 19.8 | 16.5 | 18.0 | 21.3 |
| 溶解氧(%) | ||||
| 湾内 | 4.6—5.0 | 4.3—4.7 | /—4.5 | 7.8—8.0 |
| 均值 | 4.8 | 4.5 | / | 7.9 |
| 湾外 | 5.3—6.3 | 4.0—4.8 | 2.9—5.8 | 7.1—8.1 |
| 均值 | 5.8 | 4.5 | 4.3 | 7.8 |
| pH | ||||
| 湾内 | 7.7—8.0 | 8.3—8.4 | 6.8—7.8 | 8.1 |
| 均值 | 7.9 | 8.4 | 7.3 | 8.1 |
| 湾外 | 8.2—8.4 | 8.2—8.3 | 7.2—7.4 | 8.1—8.2 |
| 均值 | 8.3 | 8.3 | 7.3 | 8.2 |
| 悬浮物(mg/L) | ||||
| 湾内 | 5.6—6.4 | 10.0—16.0 | 7.0—8.0 | 12.0—20.0 |
| 均值 | 6.0 | 13.0 | 7.5 | 16.0 |
| 湾外 | 3.0—5.2 | 4.0—8.0 | 7.0—18.0 | 6.0—14.0 |
| 均值 | 4.2 | 5.5 | 11.3 | 10.0 |
| 无机氮(mg/L) | ||||
| 湾内 | 0.3—0.6 | 0.04—0.11 | 0.2 | 0.1 |
| 均值 | 0.5 | 0.08 | 0.2 | 0.1 |
| 湾外 | 0.1—0.3 | 0.03—0.05 | 0.1—0.3 | 0.1 |
| 均值 | 0.2 | 0.04 | 0.2 | 0.1 |
| 磷酸盐(mg/L) | ||||
| 湾内 | 0.005—0.015 | 0.004—0.005 | 0.001—0.005 | /—0.005 |
| 均值 | 0.01 | 0.005 | 0.003 | / |
| 湾外 | 0.001—0.002 | 0.006 | 0.004—0.008 | 0.002—0.005 |
| 均值 | 0.001 | 0.006 | 0.007 | 0.004 |
| 石油烃(mg/L) | ||||
| 湾内 | 0.02—0.03 | 0.04—0.05 | 0.008—0.02 | /—0.06 |
| 均值 | 0.02 | 0.04 | 0.01 | / |
| 湾外 | 0.01—0.04 | 0.009—0.09 | 0.02—0.03 | 0.08—0.3 |
| 均值 | 0.02 | 0.04 | 0.03 | 0.2 |
| 有机碳(%) | ||||
| 湾内 | 0.2—1.0 | 0.2—0.3 | 0.2—0.5 | 0.2—0.8 |
| 均值 | 0.6 | 0.3 | 0.4 | 0.5 |
| 湾外 | 1.0—1.1 | 0.6—1.0 | 0.7—1.1 | 0.8—1.1 |
| 均值 | 1.1 | 0.8 | 0.9 | 1.0 |
| 硫化物(mg/kg) | ||||
| 湾内 | 1.8—39.9 | 0.9—2.9 | 1.1—1.4 | 0.4—5.7 |
| 均值 | 20.9 | 2.0 | 1.2 | 3.1 |
| 湾外 | 1.7—45.0 | 1.2—3.7 | 2.0—2.7 | 2.6—3.8 |
| 均值 | 24.0 | 2.3 | 2.5 | 3.1 |
| 环境因子 | 站点季节 | SS | df | MS | F | P |
| 有机碳 | 站点 | 1.57 | 5 | 0.31 | 5.71 | 0.00 |
| 季节 | 0.28 | 3 | 0.09 | 0.82 | 0.50 | |
| 硫化物 | 站点 | 7.92 | 5 | 7.92 | 0.05 | 0.83 |
| 季节 | 1897.28 | 3 | 632.43 | 7.44 | 0.002 | |
| 水深 | 站点 | 694.71 | 5 | 138.94 | 11.10 | 0.00 |
| 季节 | 50.13 | 3 | 16.71 | 0.38 | 0.77 | |
| 溶解氧 | 站点 | 7.82 | 5 | 1.56 | 0.37 | 0.87 |
| 季节 | 28.59 | 3 | 9.53 | 2.52 | 0.09 | |
| pH | 站点 | 13.60 | 5 | 2.72 | 0.95 | 0.48 |
| 季节 | 9.16 | 3 | 3.05 | 1.09 | 0.38 | |
| 悬浮物 | 站点 | 65.55 | 5 | 13.11 | 0.49 | 0.78 |
| 季节 | 109.85 | 3 | 36.62 | 1.67 | 0.21 | |
| 无机氮 | 站点 | 0.05 | 5 | 0.01 | 0.45 | 0.81 |
| 季节 | 0.26 | 3 | 0.09 | 8.18 | 0.00 | |
| 磷酸盐 | 站点 | 0.00 | 5 | 0.00 | 0.13 | 0.72 |
| 季节 | 0.00 | 3 | 0.00 | 0.45 | 0.72 | |
| 石油烃 | 站点 | 0.006 | 5 | 0.006 | 1.59 | 0.22 |
| 季节 | 0.04 | 3 | 0.01 | 4.53 | 0.01 | |
| 注: SS为离均差平方和; df为自由度; MS为均方差; F为检验统计量; P为显著水平 | ||||||
海陵湾海域四季共鉴定底栖动物64种, 其中环节动物34种, 软体动物16种, 甲壳动物7种, 棘皮动物3种, 脊索动物1种, 刺胞动物、纽形动物和螠虫动物各1种。春季种类数最高为39种, 其次为夏季27种, 冬季21种居第三位, 秋季最少为17种, 不同季节均以环节动物种类最多, 软体动物次之, 甲壳动物居第三位。
附录3为四季节各自相对重要性指数(IRI)占前5位的种, 结果显示, 该海域不同季节间优势种有所差异, 第一优势种均不相同。其中, 春季为倍棘蛇尾Amphioplus sp., 夏季为菲律宾蛤仔Ruditapes Philippinarum, 秋季为短吻铲荚螠Listriolobus brevirostris, 冬季则为平蛤蜊Mactra mera。四季共有优势种仅1种, 为倍棘蛇尾Amphioplus sp.。
| 种名 | 相对重要性指数IRI | |||
| 春季 | 夏季 | 秋季 | 冬季 | |
| 倍棘蛇尾Amphioplus sp. | 1600 | 423.5 | 101.7 | 163.6 |
| 中华倍棘蛇尾Amphioplus sinicus | 1170 | |||
| 背蚓虫Notomastus latericeus | 757.2 | |||
| 角海蛹Ophelia acuminata | 665.5 | |||
| 欧努菲虫Onuphis eremita | 520.0 | |||
| 海葵Actiniaria sp. | 438.2 | |||
| 豆形短眼蟹Xenophthalmus pinnotheroides | 142.4 | |||
| 菲律宾蛤仔Ruditapes philippinarum | 1136.8 | |||
| 小头虫Capitella capitata | 881.5 | |||
| 短吻铲荚螠Listriolobus brevirostris | 792.1 | 6129.4 | 571.4 | |
| 寄居蟹Coenobitoidea sp. | 364.7 | |||
| 文昌鱼Branchiostoma belcheri | 1181.6 | 650.4 | ||
| 耐污奇异稚齿虫Paraprionospio patiens | 703.7 | |||
| 平蛤蜊Mactra mera | 1673.5 | |||
海陵湾海域底栖动物平均丰度为213ind./m2, 春季最高为248ind./m2, 其次为冬季, 略低于春季, 为240ind./m2, 秋季居第三位, 为198ind./m2, 夏季最低为167ind./m2; 平均生物量为15.4g/m2, 秋季最高为28.0g/m2, 其次为冬季24.1g/m2, 夏季居第三位, 为7.1g/m2, 春季最低为2.4g/m2。
如图 2所示, 各季节底栖动物各类群丰度平面分布存在一定差异。春季, 海陵湾湾内丰度较高, 主要以环节动物、软体动物和甲壳动物构成, 湾外丰度较低, 主要以棘皮动物和环节动物构成; 夏季, 湾外丰度高于湾内, 各类群所占比例有所变化, 湾内和湾外软体动物所占比例均有所上升, 湾外海域仍以环节动物为主; 秋季, 湾外丰度高于湾内, 以环节动物占有较大优势; 冬季, 除湾内外, 其余海域丰度均较低, 湾内主要以软体动物和脊索动物为主, 湾外海域则以环节动物和棘皮动物为主。
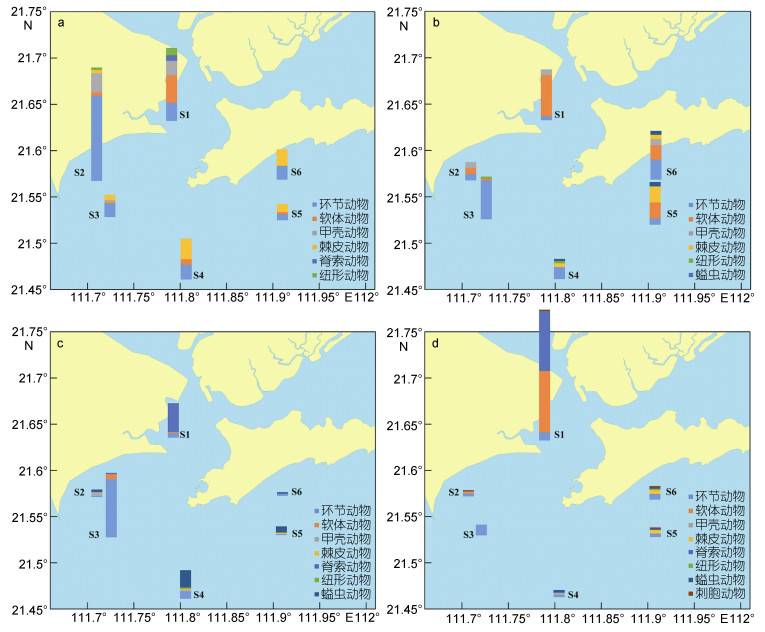 |
| 图 2 海陵湾养殖区邻近海域大型底栖动物丰度(ind./m2)的平面分布 Fig. 2 Spatial distribution of the macrobenthos density (ind./m2) in the aquaculture zone of Hailing Bay and adjacent waters 注: a.春季; b.夏季; c.秋季; d.冬季 |
各季节底栖动物各类群生物量平面分布同样存在较大差异(图 3)。然而, 由于各类群个体大小, 生物量平面分布与丰度有较大不同。春季, 仍以湾内生物量较高, 而软体动物、甲壳动物和环节动物占有较高比例, 湾外海域除S3站以甲壳动物为主外, 其他海域均以棘皮动物为主; 夏季, 不同于丰度的平面分布, 湾内海域高于湾外, S1站以软体动物为主, S2站则以甲壳动物为主, 湾外S3和S4以环节动物为主, S5和S6则以软体动物和螠虫动物为主; 秋季, 湾外海域生物量高于湾内, 湾内以脊索动物生物量较高, 湾外则以螠虫动物为主; 冬季, 与丰度平面分布类似, 除湾内S1站外, 其余海域生物量均较低, 湾内以软体动物、脊索动物和环节动物生物量较高, 湾外则以以螠虫动物和刺胞动物生物量较高。
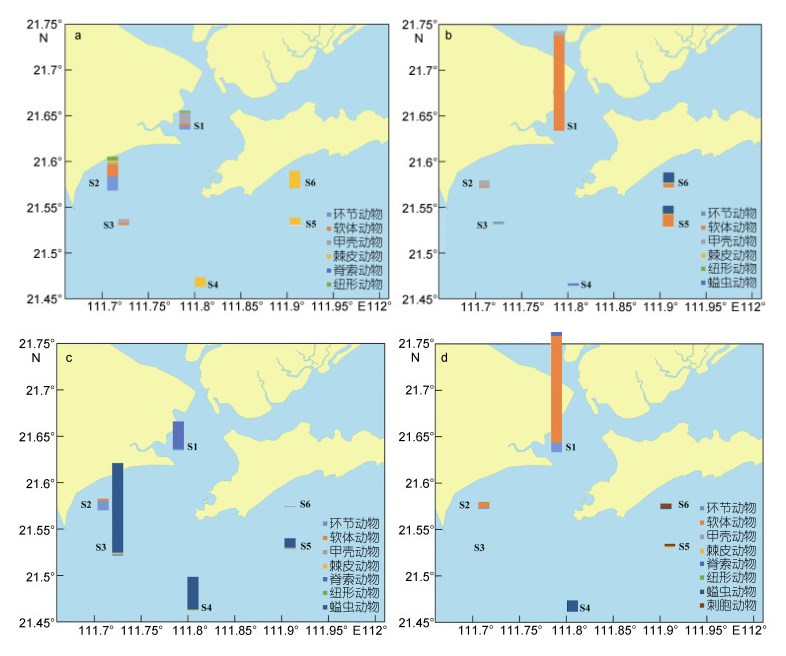 |
| 图 3 海陵湾养殖区邻近海域大型底栖动物生物量(g/m2)的平面分布 Fig. 3 Spatial distribution of the macrobenthos biomass (g/m2) in the aquaculture zone of Hailing Bay and adjacent waters 注: a.春季; b.夏季; c.秋季; d.冬季 |
聚类分析和MDS分析结果显示(图 4), 海陵湾养殖区邻近海域大型底栖动物群落存在显著的时空差异(SIMPROF检验), 可划分为5个差异显著的群落(One-Way ANOSIM, R=0.717, P=0.001)。时间上, 湾内除秋、冬季无显著差异外, 其他季节间均存在显著差异, 春季相对其他季节有较多物种分布, 文昌鱼Branchiostoma belcheri对差异的贡献率最大, 且其丰度在秋、冬季所占比例较高; 湾外春季大型底栖动物与夏季、秋季和冬季存在显著差异, 与湾内相似, 春季同样有较多物种分布, 且滤食性棘皮动物丰度在此季节较高(SIMPER分析, 附录4)。空间上, 位于湾内的S1和S2站与湾外海域的S3、S4、S5和S6站存在显著差异; 造成空间差异的主要物种(SIMPER分析)如附录5所示, 分布在湾内的物种多为滤食性和肉食性物种如文昌鱼Branchiostoma belcheri、豆形短眼蟹Xenophthalmus pinnotheroides、白色吻沙蚕Glycera alba、寄居蟹Coenobitoidea sp.、半褶织纹螺Nassarius semiplicatus、中华倍棘蛇尾Amphioplus sinicus和菲律宾蛤仔等; 湾外海域多为食沉积物者, 如短吻铲荚螠、杰氏内卷齿蚕Aglaophamus jeffreysii、双形拟单指虫Cossurella dimorpha和背毛背蚓虫Notomastus cf. aberans等。
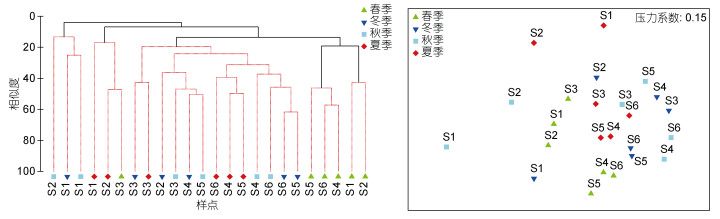 |
| 图 4 海陵湾养殖区邻近海域大型底栖动物的时空分布 Fig. 4 The temporal and spatial distribution of macrobenthos in the aquaculture zone of Hailing Bay and adjacent waters |
| 物种 | 群落Ⅰ 平均丰度 |
群落Ⅱ 平均丰度 |
贡献率(%) | 累计贡献率(%) |
| 湾内群落:春季vs秋、冬季 | ||||
| 文昌鱼Branchiostoma belcheri | 0.00 | 4.28 | 12.60 | 12.60 |
| 欧努菲虫Onuphis eremita | 2.84 | 0.00 | 6.48 | 19.08 |
| 缅甸角沙蚕Ceratonereis burmensis | 2.87 | 0.59 | 5.29 | 24.37 |
| 贪食鼓虾Alpheus avarus | 2.06 | 0.00 | 4.70 | 29.07 |
| 中华半突虫Phyllodoce chinensis | 1.95 | 0.00 | 4.44 | 33.51 |
| 平蛤蜊Mactra mera | 0.00 | 1.55 | 3.78 | 37.29 |
| 耐污奇异稚齿虫Paraprionospio patiens | 1.17 | 1.88 | 3.73 | 41.02 |
| 背蚓虫Notomastus latericeus | 1.33 | 2.59 | 3.50 | 44.52 |
| 脑纽虫Cerebratulina sp. | 1.78 | 0.78 | 3.20 | 47.72 |
| 细丝鳃虫Cirratulus filiformis | 0.00 | 1.43 | 3.17 | 50.89 |
| 红刺尖锥虫Scoloplos rubra | 0.00 | 1.41 | 3.10 | 53.99 |
| 羽鳃栉虫Scxhistocomus hiltoni | 1.33 | 0.00 | 3.05 | 57.04 |
| 矶沙蚕Eunice sp. | 1.26 | 0.00 | 2.85 | 59.89 |
| 小头虫Capitella capitata | 1.17 | 0.00 | 2.65 | 62.54 |
| 中华倍棘蛇尾Amphioplus sinicus | 1.95 | 1.73 | 2.56 | 65.10 |
| 湾内群落:春季vs夏季 | ||||
| 缅甸角沙蚕Ceratonereis burmensis | 2.87 | 0.00 | 6.87 | 6.87 |
| 欧努菲虫Onuphis eremita | 2.84 | 0.00 | 6.80 | 13.67 |
| 角海蛹Ophelia acuminata | 2.84 | 0.00 | 6.79 | 20.46 |
| 寄居蟹Coenobitoidea sp. | 0.00 | 2.23 | 5.35 | 25.80 |
| 贪食鼓虾Alpheus avarus | 2.06 | 0.00 | 4.93 | 30.74 |
| 中华倍棘蛇尾Amphioplus sinicus | 1.95 | 0.00 | 4.66 | 35.40 |
| 中华半突虫Phyllodoce chinensis | 1.95 | 0.00 | 4.65 | 40.05 |
| 脑纽虫Cerebratulina sp. | 1.78 | 0.00 | 4.25 | 44.30 |
| 背蚓虫Notomastus latericeus | 1.33 | 0.00 | 3.21 | 47.51 |
| 羽鳃栉虫Scxhistocomus hiltoni | 1.33 | 0.00 | 3.21 | 50.73 |
| 欧文虫Owenia fusformis | 0.00 | 1.17 | 3.00 | 53.73 |
| 矶沙蚕Eunice sp. | 1.26 | 0.00 | 2.98 | 56.70 |
| 湾内群落:秋、冬季vs夏季 | ||||
| 文昌鱼Branchiostoma belcheri | 4.28 | 0.00 | 12.60 | 12.60 |
| 背蚓虫Notomastus latericeus | 2.59 | 0.00 | 7.28 | 19.88 |
| 寄居蟹Coenobitoidea sp. | 0.00 | 2.23 | 6.42 | 26.30 |
| 平蛤蜊Mactra mera | 1.55 | 0.00 | 4.99 | 31.29 |
| 耐污奇异稚齿虫Paraprionospio patiens | 1.88 | 0.00 | 4.93 | 36.22 |
| 中华倍棘蛇尾Amphioplus sinicus | 1.73 | 0.00 | 4.73 | 40.95 |
| 菲律宾蛤仔Ruditapes philippinarum | 0.00 | 1.81 | 4.70 | 45.65 |
| 细丝鳃虫Cirratulus filiformis | 1.43 | 0.00 | 3.90 | 49.55 |
| 白色吻沙蚕Glycera alba | 1.41 | 0.00 | 3.80 | 53.35 |
| 红刺尖锥虫Scoloplos rubra | 1.41 | 0.00 | 3.80 | 57.15 |
| 欧文虫Owenia fusformis | 0.00 | 1.17 | 3.66 | 60.81 |
| 湾外(邻近海域)群落:春季vs夏、秋、冬季 | ||||
| 背蚓虫Notomastus latericeus | 2.27 | 0.15 | 9.77 | 9.77 |
| 中华倍棘蛇尾Amphioplus sinicus | 1.97 | 0.00 | 8.89 | 18.66 |
| 倍棘蛇尾Amphioplus sp. | 2.45 | 0.94 | 7.66 | 26.32 |
| 双形拟单指虫Cossurella dimorpha | 1.41 | 0.67 | 5.35 | 31.68 |
| 杰氏内卷齿蚕Aglaophamus jeffreysii | 1.43 | 0.77 | 5.17 | 36.85 |
| 短吻铲荚螠Listriolobus brevirostris | 0.00 | 0.95 | 4.13 | 40.97 |
| 角海蛹Ophelia acuminata | 0.59 | 0.36 | 3.87 | 44.84 |
| 中国小铃螺Minolia chinensis | 0.59 | 0.32 | 3.67 | 48.51 |
| 海葵Actiniaria sp. | 0.70 | 0.47 | 3.48 | 52.00 |
| 细丝鳃虫Cirratulus filiformis | 0.00 | 0.67 | 3.23 | 55.23 |
| 热带杂毛虫Poecilochaetus tropicus | 0.59 | 0.15 | 3.06 | 58.29 |
| 小头虫Capitella capitata | 0.00 | 0.76 | 2.88 | 61.17 |
| 物种 | 群落Ⅰ 平均丰度 |
群落Ⅱ 平均丰度 |
贡献率(%) | 累计贡献率(%) |
| 短吻铲荚螠Listriolobus brevirostris | 1.33 | 0.00 | 5.67 | 5.67 |
| 文昌鱼Branchiostoma belcheri | 0.11 | 1.29 | 5.35 | 11.03 |
| 倍棘蛇尾Amphioplus sp. | 1.38 | 0.00 | 5.26 | 16.29 |
| 杰氏内卷齿蚕Aglaophamus jeffreysii | 1.09 | 0.00 | 4.25 | 20.54 |
| 豆形短眼蟹Xenophthalmus pinnotheroides | 0.50 | 0.71 | 3.43 | 23.97 |
| 双形拟单指虫Cossurella dimorpha | 0.90 | 0.00 | 3.25 | 27.21 |
| 耐污奇异稚齿虫Paraprionospio patiens | 0.00 | 0.87 | 3.22 | 30.43 |
| 白色吻沙蚕Glycera alba | 0.44 | 0.67 | 3.05 | 33.48 |
| 寄居蟹Coenobitoidea sp. | 0.13 | 0.56 | 2.99 | 36.47 |
| 海葵Actiniaria sp. | 0.47 | 0.44 | 2.68 | 39.15 |
| 背毛背蚓虫Notomastus cf. aberans | 0.51 | 0.22 | 2.66 | 41.81 |
| 角海蛹Ophelia acuminata | 0.11 | 0.93 | 2.60 | 44.41 |
| 背蚓虫Notomastus latericeus | 0.42 | 0.55 | 2.57 | 46.97 |
| 半褶织纹螺Nassarius semiplicatus | 0.13 | 0.51 | 2.43 | 49.41 |
| 脑纽虫Cerebratulina sp. | 0.56 | 0.44 | 2.32 | 51.72 |
| 小头虫Capitella capitata | 0.57 | 0.29 | 2.26 | 53.99 |
| 欧文虫Owenia fusformis | 0.24 | 0.29 | 2.20 | 56.18 |
| 中华倍棘蛇尾Amphioplus sinicus | 0.37 | 0.49 | 2.08 | 58.26 |
| 菲律宾蛤仔Ruditapes philippinarum | 0.00 | 0.45 | 1.91 | 60.18 |
| 平蛤蜊Mactra mera | 0.00 | 0.58 | 1.87 | 62.05 |
| 细丝鳃虫Cirratulus filiformis | 0.39 | 0.00 | 1.69 | 63.73 |
| 多齿全刺沙蚕Nectoneanthes multignatha | 0.11 | 0.49 | 1.66 | 65.39 |
| 缅甸角沙蚕Ceratonereis burmensis | 0.00 | 0.72 | 1.65 | 67.04 |
| 欧努菲虫Onuphis eremita | 0.00 | 0.71 | 1.63 | 68.66 |
| 中阿曼吉虫Armandia intermedia | 0.00 | 0.44 | 1.45 | 70.11 |
| 贪食鼓虾Alpheus avarus | 0.13 | 0.51 | 1.44 | 71.55 |
| 波纹巴非蛤Paphia undulata | 0.11 | 0.22 | 1.43 | 72.98 |
| 壳砂笔帽虫Pectinaria conchilega | 0.33 | 0.22 | 1.42 | 74.40 |
| 节织纹螺Nassarius hepaticus | 0.00 | 0.31 | 1.39 | 75.79 |
| 中华半突虫Phyllodoce chinensis | 0.11 | 0.49 | 1.32 | 77.11 |
| 羽须鳃沙蚕Dendronereis pinnaticirris | 0.00 | 0.26 | 1.31 | 78.43 |
| 齿吻沙蚕Nephtys sp. | 0.00 | 0.26 | 1.31 | 79.74 |
| 中国小铃螺Minolia chinensis | 0.35 | 0.00 | 1.30 | 81.03 |
| 联球蚶Aandara consociate | 0.00 | 0.29 | 1.24 | 82.27 |
| 团结蛤Abrina sp. | 0.00 | 0.22 | 1.10 | 83.38 |
| 注:群落Ⅰ为海陵湾湾外海域群落; 群落Ⅱ为海陵湾湾内群落 | ||||
海陵湾养殖区邻近海域大型底栖动物均匀度和Shannon-Wiener多样性指数见表 2, 分别为0.95— 1.00和1.56—4.07。其中, 平均均匀度和多样性水平时间分布规律明显, 春季最高, 秋季最低; 空间上, 两者无明显分布差异。
| 站位/季节 | 春季 | 夏季 | 秋季 | 冬季 | |||||||
| 均匀度指数 (J) |
多样性指数 (H′) |
均匀度指数 (J) |
多样性指数 (H′) |
均匀度指数 (J) |
多样性指数 (H′) |
均匀度指数 (J) |
多样性指数 (H′) |
||||
| S1 | 1.00 | 4.07 | 0.98 | 2.53 | 0.96 | 1.93 | 0.96 | 2.87 | |||
| S2 | 0.99 | 3.87 | 1.00 | 1.58 | 0.95 | 2.20 | 1.00 | 2.32 | |||
| S3 | 1.00 | 3.32 | 1.00 | 3.31 | 0.99 | 2.96 | 1.00 | 1.99 | |||
| S4 | 1.00 | 3.45 | 1.00 | 3.00 | 0.98 | 1.56 | 1.00 | 2.32 | |||
| S5 | 1.00 | 2.31 | 1.00 | 2.99 | 0.99 | 1.58 | 1.00 | 2.58 | |||
| S6 | 0.99 | 2.56 | 0.99 | 3.14 | 0.99 | 0.99 | 1.00 | 2.80 | |||
| 平均 | 0.99 | 3.26 | 0.99 | 2.76 | 0.98 | 1.87 | 0.99 | 2.48 | |||
通过大型底栖动物丰度、生物量和多样性指数与环境因子的相关分析可以看出(表 3), 丰度与有机碳、水深和悬浮物呈显著负相关; 生物量仅与有机碳呈显著负相关; 均匀度指数J则与有机碳和水深呈显著正相关; Shannon-wiener多样性指数H′与悬浮物呈显著负相关。运用基于距离的线性模型DistLM对大型底栖动物群落与环境因子的分析则表明(图 5), 以上环境因子共同作用能解释海陵湾大型底栖动物群落分布74.8%的变化, 其中沉积物类型、悬浮物和无机氮为最优的环境因子组合, 然而无机氮影响不显著(P > 0.05)。
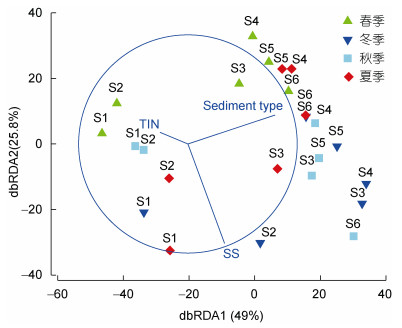 |
| 图 5 大型底栖动物群落与环境因子的相关分析 Fig. 5 The dbRDA plot of macrobenthic fauna community fitted to major predictor variables using step-wise DistLM selection procedure and AIC selection criterion 注: TIN为底层水无机氮浓度; SS为底层水悬浮物浓度; Sediment type为底质类型。 |
| 环境因子 | 丰度(ind./m2) | 生物量(g/m2) | 均匀度指数(J) | 多样性指数(H′) |
| 有机碳 | –0.65** | –0.41* | 0.67** | 0.06 |
| 硫化物 | –0.10 | –0.23 | 0.28 | 0.27 |
| 水深 | –0.55** | –0.29 | 0.42* | –0.14 |
| 无机氮 | 0.09 | –0.07 | 0.03 | 0.33 |
| 磷酸盐 | –2.23 | –2.27 | 0.27 | 0.06 |
| 悬浮物 | –0.41* | –0.17 | 0.12 | –0.50** |
| 石油烃 | –0.34 | –0.23 | 0.37 | –0.07 |
| 溶解氧 | 0.02 | 0.09 | 0.40 | 0.08 |
| pH | –0.06 | –0.31 | 0.57 | 0.02 |
| 注:**. 0.01水平极显著相关; *. 0.05水平显著相关 | ||||
近岸大型底栖动物群落的分布格局与沉积相类型、水深和有机质含量等密切相关(Pearson, 1971; 江锦祥等, 1985; Chardy et al, 1988; Eleftheriou et al, 1989; Ellingsen, 2002; Magni et al, 2008)。其中, 沉积相类型是影响底栖动物群落的重要因素之一, 每种底质都支持着特定的底栖动物群落(Pearson, 1971; Ellingsen, 2002; 李亚芳等, 2016)。
雷州半岛东南部海域和大亚湾与海陵湾纬度大致相当。与海陵湾不同, 雷州半岛东南部海域水动力作用强, 沉积物以较粗砂质为主, 大型底栖动物以双壳类居多, 占总种类的41.0%, 多毛类占25.6%, 与海陵湾的底栖动物种类组成存在较大的差异(李亚芳等, 2016)。海陵湾和大亚湾海域水动力条件均较弱, 沉积物主要以较细的粉砂为主(任杰等, 2001; 丘耀文等, 2004; 颜彬, 2011; 杜飞雁等, 2011)。大亚湾西北部海域大型底栖动物种类组成则与海陵湾较为相似, 同样以多毛类居多, 占总种类的53.0%, 双壳类仅占8.5% (杜飞雁等, 2011)。而任杰等(2001)和丘耀文等(2004)研究发现, 位于湾内的S1和S2站为相对较粗砂质, 而湾外海域则为较细的黏土质粉砂。聚类和MDS及基于距离的线性模型DistLM分析结果均表明, 湾内的S1和S2站与湾外的S3、S4、S5和S6站存在显著差异。此外, 与Carvalho等(2011)和Galkin等(2015)研究结果较一致, 分布在海陵湾湾内粗砂底质区域的物种多为滤食性和肉食性, 如脊索动物文昌鱼、甲壳动物豆形短眼蟹、双壳类及肉食性白色吻沙蚕和半褶织纹螺等; 而湾外软底质区域多为食沉积物物者, 如短吻铲荚螠等。因此, 沉积物组成的差异, 是造成大型底栖动物种类组成差异的主要原因。
除沉积物类型影响外, 有机质是多数底栖动物主要的食物来源, 底栖动物数量分布格局与食物来源密切相关, 在一定范围内, 底质中有机质含量与底栖动物丰度呈正相关(Hagberg et al, 2000; Peeters et al, 2004)。本研究中, 沉积物有机碳含量均符合海洋沉积物质量第一类标准(< 2.0%)(中华人民共和国国家质量监督检验检疫总局, 2002), 为湾内显著低于湾外, 但底栖动物丰度和生物量则呈湾内高于湾外, 相关分析显示有机碳含量与丰度和生物量呈显著负相关。造成这种现象的原因可能为有机质通常与软底质结合, 较细的底质中有机质含量也较高, 其含量受沉积物类型的影响。因此, 可认为有机质并非是底栖动物分布的限制因子, 沉积物类型与有机质间的关系可能是造成其成显著影响因子的原因之一。
此外, 水深是影响底栖动物分布的另一重要因素(江锦祥等, 1985; Chardy et al, 1988)。张敬怀(2014)对珠江口及邻近海域大型底栖动物多样性变化趋势的研究, 发现底栖动物丰度和生物量与水深呈显著的负相关。本研究中所得结论与此相似, 水深与底栖动物丰度呈显著负相关。因此, 沉积物类型和水深可能是影响该海域大型底栖动物种类组成及空间分布的主要原因。
3.2 大型底栖动物群落时间尺度变化的影响因素不同于大型底栖动物群落空间差异的影响因素, 其群落的时间尺度上的变化主要与底层海水无机氮、悬浮物浓度以及捕食压力等相关。
海水无机氮作为衡量富营养化程度的重要指标之一显著影响大型底栖动物的分布(周然等, 2014)。本研究中, 春季为增养殖盛期, 增养殖排废导致该季底层海水无机氮浓度在湾内显著高于夏、秋和冬季, 湾外显著高于夏季和冬季。与此相应, 春季大型底栖动物群落结构在湾内和湾外均与其他季节存在显著差异。有研究表明, 大型底栖动物主要分布在无机氮含量较低的水域, 其含量的增加会造成底栖动物多样性相应降低(张莹等, 2011; 周然等, 2014)。本文结果与其较为不同, 湾内春季具最高的无机氮含量, 多样性水平也最高; 湾外海域, 春季和秋季均具较高的无机氮含量, 而秋季多样性水平最低且远低于春季。通过对比发现, 本研究海域无机氮含量较低, 除春季S1站外, 均符合海水水质第二类标准(国家环境保护局, 2004)。营养盐如无机氮的适量增加能促进浮游植物增殖, 为底栖动物提供丰富的食物来源, 进而提高其多样性水平(刘坤等, 2016; 杨雪等, 2016), 秋季湾外较低的多样性应受其他因素的影响。相关分析表明悬浮物与底栖动物丰度和多样性指数呈极显著负相关。基于距离的线性模型DistLM分析大型底栖动物群落与环境因子关系发现, 悬浮物能显著的解释各季节大型底栖动物群落分布。海水悬浮物浓度可直接或间接的对海洋生物产生影响, 尤其是生活在海洋底层、运动能力较弱的底栖生物(宋伦等, 2012)。高浓度悬浮物会导致底栖生物种类明显减少, 尤其是滤食性且对环境变化敏感的棘皮动物(郑琳, 2006)。秋季, 湾外底层海水悬浮物浓度最高, 且显著高于春季, 大型底栖动物多样性相应最低。聚类分析和MDS分析结果显示, 湾外秋季和春季大型底栖动物群落结构存在显著差异。秋季沉积食性者占绝对优势地位, 如短吻铲荚螠, 而春季滤食性的倍棘蛇尾和中华倍棘蛇尾占较大优势地位。因此, 底层海水无机氮和悬浮物浓度的季节差异是导致该海域春季大型底栖动物群落与其他季节差异的主要原因。
此外, 通过对大型底栖动物群落与环境因子之间的关系分析可知, 所测环境因子共同作用仅能解释该海域大型底栖动物群落分布74.8%的变化, 其群落分布可能受其他未测因素影响。群落结构分析结果显示, 海陵湾内大型底栖动物秋、冬两季无显著差异, 其他季节间均存在显著差异。文昌鱼丰度季节间的差异可能是造成湾内大型底栖动物群落季节差异的主要原因。秋、冬季海陵湾湾内有较多文昌鱼分布, 而春季仅出现少量文昌鱼, 夏季文昌鱼则完全消失。通过同步底拖网渔获量数据可知, 秋冬季渔获量在四季最低, 且以少量杂食性且偏植食性的黄斑篮子鱼Siganus oramin以及以虾、蟹类为食的皮氏叫姑鱼Johnius belengeri出现为主(张军晓, 2008)。而春夏季则出现大量肉食性鱼类, 尤其是以文昌鱼为食的多鳞鱚Sillago sihama仅在春季出现(卢伙胜等, 2008)。因此, 捕食压力的增加可能是文昌鱼在春、夏季数量减少的主要原因。
4 结论(1) 共鉴定大型底栖动物64种, 4季均以环节动物种类数最多, 软体动物次之。不同季节间优势种有所差异, 仅倍棘蛇尾为周年优势种。平均丰度和生物量分别为213ind./m2和15.4g/m2, 其中丰度以春季最高为248ind./m2, 夏季最低为167ind./m2, 而生物量则以秋季最高为28.0g/m2, 春季最低为2.4g/m2; 其平面分布总体呈湾内高于湾外的趋势。底栖动物均匀度和Shannon-Wiener多样性指数分别为0.95—1.00和1.56—4.07, 其中时间分布规律明显, 春季最高, 秋季最低; 空间上, 两者无明显分布差异。
(2) 底栖动物群落结构的时空差异显著。沉积物类型和水深是导致湾内和湾外存显著差异的主要原因; 底层海水无机氮、悬浮物浓度和捕食压力可能是导致季节变化的主要因素。
致谢 中国水产科学研究院南海水产研究所刘永博士、林琳博士、肖雅元、韦芳三和林华剑协助外业调查和实验分析, 谨此致谢!| 中华人民共和国国家质量监督检验检疫总局, 2002. GB 18668-2002海洋沉积物质量.北京: 中国标准出版社 |
| 中华人民共和国国家质量监督检验检疫总局, 2008a. GB/T 12763.6-2007海洋调查规范第6部分: 海洋生物调查.北京: 中国标准出版社, 41-44 |
| 中华人民共和国国家质量监督检验检疫总局, 2008b. GB 17378.4-2007海洋监测规范第4部分: 海水分析.北京: 中国标准出版社, 1-65 |
| 中华人民共和国国家质量监督检验检疫总局, 2008c. GB 17378.5-2007海洋监测规范第5部分: 沉积物分析.北京: 中国标准出版社, 4-55 |
| 卢伙胜, 沈春燕, 冯波, 2008. 茂名大放鸡海域文昌鱼、蛇尾分布及其与底质粒度特征的关系. 中国海洋大学学报, 38(2): 297–302 |
| 丘耀文, 朱良生, 徐梅春, 等, 2006. 海陵湾水环境要素特征. 海洋科学, 30(4): 20–24 DOI:10.3969/j.issn.1000-3096.2006.04.005 |
| 丘耀文, 朱良生, 黎满球, 等, 2004. 海陵湾沉积物重金属与粒度分布特征. 海洋通报, 23(6): 49–53 DOI:10.3969/j.issn.1001-6392.2004.06.008 |
| 任杰, 刘沛然, 戴志军, 2001. 粤西海陵湾底质沉积特征与泥沙输运路径. 台湾海峡, 20(1): 96–100 DOI:10.3969/j.issn.1000-8160.2001.01.019 |
| 刘坤, 林和山, 何雪宝, 等, 2016. 厦门近岸海域大型底栖动物摄食功能群及其与环境因子的关系. 海洋学报, 38(12): 95–105 DOI:10.3969/j.issn.0253-4193.2016.12.010 |
| 刘幸, 2016.阳江海陵湾大面积死鱼事件原因查明.广州日报, http://gd.qq.com/a/20160908/007508.htm |
| 阳江市政府网, 2015.海洋资源.阳江: 阳江市政府网, http://www.yangjiang.gov.cn/zjyj/yjgk/zrzy/201506/t20150617_58380.shtml |
| 阳江市海洋与渔业局, 2017.资源环境.阳江: 阳江市海洋与渔业局, http://www.yjofa.gov.cn/hygl/ziyuanhuanbao/ |
| 阳江市海陵岛经济开发试验区政务网, 2017.海陵概况.阳江: 阳江市海陵岛经济开发试验区政务网, http://www.hailing.gov.cn/SortHtml/1/List_7.html |
| 江锦祥, 黄立强, 孟凡, 等, 1985. 东海大陆架及其邻近海区底栖生物种类组成和分布特点. 台湾海峡, 4(1): 89–98 |
| 杜飞雁, 林钦, 贾晓平, 等, 2011. 大亚湾西北部春季大型底栖动物群落特征. 生态学报, 31(23): 7075–7085 |
| 李亚芳, 杜飞雁, 谷阳光, 等, 2016. 雷州半岛东南部海域春季大型底栖动物群落特征及其与环境因素的关系. 南方水产科学, 12(6): 33–41 DOI:10.3969/j.issn.2095-0780.2016.06.005 |
| 杨雪, 王朝晖, 马长江, 等, 2016. 大亚湾微表层浮游植物对无机氮磷的响应. 生态科学, 35(1): 34–40 |
| 宋伦, 杨国军, 王年斌, 等, 2012. 悬浮物对海洋生物生态的影响. 水产科学, 31(7): 444–448 DOI:10.3969/j.issn.1003-1111.2012.07.012 |
| 张莹, 吕振波, 徐宗法, 等, 2011. 山东半岛南部海湾底栖动物群落生态特征及其与水环境的关系. 生态学报, 31(15): 4455–4467 |
| 张军晓, 2008.硇洲海域文昌鱼食性及其栖息地鱼类营养等级分析.湛江: 广东海洋大学硕士学位论文, 36-39 |
| 张敬怀, 2014. 珠江口及邻近海域大型底栖动物多样性随盐度、水深的变化趋势. 生物多样性, 22(3): 302–310 |
| 国家环境保护局, 2004. GB 3097-1997海水水质标准. 北京: 环境科学出版社, 15-21 |
| 周然, 覃雪波, 彭士涛, 等, 2014. 渤海湾大型底栖动物调查及与环境因子的相关性. 生态学报, 64(1): 50–58 |
| 郑琳, 2006.青岛海洋倾倒区生态环境变化研究.青岛: 中国海洋大学硕士学位论文, 5 |
| 黄道明, 杨汉运, 林永泰, 等, 1995. 福建省水库底栖动物及渔业利用前景. 湖泊科学, 7(2): 164–172 |
| 颜彬, 2011.广东典型海湾沉积物的元素地球化学特征及沉积环境分析.北京: 中国科学院大学硕士学位论文, 19 |
| 魏晓宇, 冯伟忠, 陈强, 等, 2015. 海陵湾台风浪场的数值模拟. 应用海洋学学报, 34(4): 468–475 DOI:10.3969/J.ISSN.2095-4972.2015.04.003 |
| Anderson M J, Gorley R N, Clarke K R, 2008. PERMANOVA+ for PRIMER:Guide to Software and Statistical Methods. PRIMER-E: Plymouth, UK, 154 |
| Carvalho S, Pereira P, Pereira F, et al, 2011. Factors structuring temporal and spatial dynamics of macrobenthic communities in a eutrophic coastal lagoon (Óbidos lagoon, Portugal). Marine Environmental Research, 71(2): 97–110 DOI:10.1016/j.marenvres.2010.11.005 |
| Chardy P, Clavier J, 1988. Biomass and trophic structure of the macrobenthos in the South-west lagoon of New Caledonia. Marine Biology, 99(2): 105–202 |
| Chen H, Liu S, Xu X R, et al, 2015. Antibiotics in the coastal environment of the Hailing Bay region, South China Sea:spatial distribution, source analysis and ecological risks. Marine Pollution Bulletin, 95(1): 365–373 DOI:10.1016/j.marpolbul.2015.04.025 |
| Eleftheriou A, Basford D J, 1989. The macrobenthic infauna of the offshore Northern North Sea. Journal of the Marine Biological Association of the United Kingdom, 69(1): 123–143 DOI:10.1017/S0025315400049158 |
| Ellingsen K E, 2002. Soft-sediment benthic biodiversity on the continental shelf in relation to environmental variability. Marine Ecology Progress Series, 232: 15–27 DOI:10.3354/meps232015 |
| Galkin S V, Vedenin A A, Minin K V, et al, 2015. Macrobenthos of the Southern Part of St. Anna trough and the Adjacent Kara sea shelf. Oceanology, 55(4): 614–622 |
| Hagberg J, Tunberg G G, 2000. Studies on the covariation between physical factors and the long-term variation of the marine soft bottom macrofauna in Western Sweden. Estuarine, Coastal and Shelf Science, 50(3): 373–385 DOI:10.1006/ecss.1999.0578 |
| Kroncke I, 1995. Long-term changes in North Sea benthos. Senckenbergiana Maritima, 26(1-2): 73–80 |
| Li Y F, Xu R L, Wang C F, 2012. The community structure of Molluscs in three different wetland types in the Qi'ao-Dan'gan Island Mangrove Nature Reserve at Qi'ao Island, Pearl River estuary, China. Zoological Studies, 51(6): 745–754 |
| Magni P, de Falco G, Como S, et al, 2008. Distribution and ecological relevance of fine sediments in organic-enriched lagoons:the case study of the Cabras lagoon (Sardinia, Italy). Marine Pollution Bulletin, 56(3): 549–564 DOI:10.1016/j.marpolbul.2007.12.004 |
| Pearson T H, 1971. Studies on the ecology of the macrobenthic fauna of Lochs Linnhe and Eil, West Coast of Scotland:Ⅱ. Analysis of the macrobenthic fauna by comparison of feeding groups. Vie Milieu, 22(S1): 53–91 |
| Peeters E T H M, Gylstra R, Vos J H, 2004. Benthic macroinvertebrate community structure in relation to food and environmental variables. Hydrobiologia, 519(1-3): 103–115 DOI:10.1023/B:HYDR.0000026497.48827.70 |
| Pinkas L, Oliphant M S, Iverson I L K, 1971. Food habits of albacore, bluefin tuna, and bonito in California waters. Fish Bulletin, 152: 1–105 |
| Rhoads D C, Young D K, 1970. The influence of deposit-feeding organisms on sediment stability and community trophic structure. Journal of Marine Research,(28): 150–178 |
 2018, Vol. 49
2018, Vol. 49


