
中国海洋湖沼学会主办。
文章信息
- 马爱军, 崔文晓, 刘志峰, 张金生, 黄智慧, 杨双双, 刘晓菲, 杨凯, 张薇. 2018.
- MA Ai-Jun, CUI Wen-Xiao, LIU Zhi-Feng, ZHANG Jin-Sheng, HUANG Zhi-Hui, YANG Shuang-Shuang, LIU Xiao-Fei, YANG Kai, ZHANG Wei. 2018.
- 广盐性鱼类渗透压适应性与生理可塑性机制研究
- STUDY ON MECHANISMS OF OSMOTIC ORESSURE ADAPTABILITY AND PHYSIOLOGICAL PLASTICITY ON EURYHALINE
- 海洋与湖沼, 49(6): 1308-1317
- Oceanologia et Limnologia Sinica, 49(6): 1308-1317.
- http://dx.doi.org/10.11693/hyhz20171100298
-
文章历史
- 收稿日期:2017-11-27
- 收修改稿日期:2018-04-12
2. 上海海洋大学水产与生命学院 上海 201306;
3. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室 青岛 266071
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China
盐度是影响水生生物生存环境的重要生态因子, 也是影响鱼类各种生理活动的重要非生物因素。盐度变化直接影响鱼类生长甚至生存, 迫使鱼体进行相应的生理活动保持体液渗透压的动态平衡。广盐性鱼类具有较强的渗透压调节能力应对生存环境中大幅度盐度变化, 这种适应性内稳态反应能力对鱼的存活至关重要, 也为人们提供了研究离子渗透调节及分子可塑性的模型。
由感知盐分平衡变化、编码盐度变化方向和大小的信号网络以及渗透压效应器共同组成了广盐性鱼类强大的渗透压调节机制(Lam et al, 2014)。目前, 关于广盐性鱼类的渗透压调节机制的研究主要集中于盐度对广盐性鱼类表观、生态效率、激素、酶、代谢的影响以及盐度相关基因的研究。随着技术的发展, 渗透压调节机制的研究已深入代谢通路和信号转导通路以及转录组学和基因组学等研究领域。但真正结合前人的研究从鱼类渗透压调节过程分析广盐性鱼类的渗透压调节机制的文章尚未见报道。
中国作为水产养殖业大国, 水产养殖业可用总面积达3172万ha, 其中海水养殖可用总面积438万ha, 淡水养殖可用总面积2734万ha; 截止2014年, 全国水产养殖总面积838.636万ha, 其中海水养殖面积230.547万ha, 从2010年至2014年海洋养殖面积逐年增加(图 1), 但增速较小。养殖技术与养殖品种的局限性, 导致海水养殖面积利用率低, 限制了水产养殖业的进一步发展。通过研究鱼的生态效率和表观数据与盐度的关系, 考察盐度对鱼类生长以及体重和肌肉成分的影响(刘贤敏等, 2008), 可以根据当地水文特征选择最优养殖品种; 通过研究广盐性鱼类的盐度相关基因和分子标记结合分子标记辅助育种技术选育耐盐新品种(马爱军等, 2011); 通过对洄游性鱼类的渗透压调节机制的研究, 可以模拟洄游环境进行人工化养殖; 通过研究激素与鱼类渗透压之间的关系(Sakamoto et al, 1997), 了解不同盐度胁迫下激素的表达变化种类和模式以及鱼类耐盐的原因可在生产中尝试用激素来改善鱼类的耐盐能力, 提高养殖效益。因此, 本文结合前人的研究对广盐性鱼类渗透压适应性与生理可塑性机制研究, 有助于研究其环境适应机理, 促进野生鱼种的人工化养殖以及新品种的选育从而提高经济效益、社会效益和生态效益, 对促进水产养殖学进步以及养殖业的发展具有重要意义, 同时, 为研究广盐性鱼类的渗透压调节机制开辟新的研究方向。
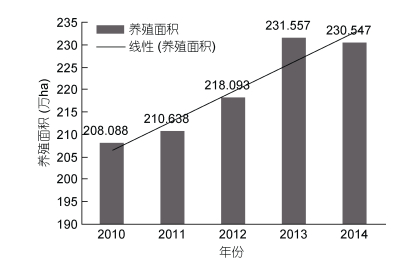 |
| 图 1 我国海水养殖面积走势图 Fig. 1 Marine aquaculture area trend of China |
信号转导是细胞实现通讯的关键过程, 对于多细胞生物细胞间的协调、控制细胞的生长和分裂、组织的发生与形态建成是不可或缺的。由盐度变化形成的渗透压可能作为信号分子, 通过细胞体积的改变直接或者间接的影响增殖、代谢以及程序性死亡。广盐性鱼类在渗透压调节过程中, 通过信号转导使鱼体在整体上对外界环境的变化做出最适宜的反应。罗非鱼作为广盐性鱼类, 具有极强的盐度适应能力, 在海水与淡水中皆可生存, 因此可作为研究广盐性鱼类盐度适应信号转导的经典模型。
1.1 低盐环境下信号转导机制在淡水环境中受到盐分丢失的低渗胁迫, 莫桑比克罗非鱼(Oreochromis mossambicus) (Lam et al, 2014)鱼鳃中与细胞形态和细胞体积调控相关的信号通路上调减少水的吸收、保持细胞体积稳定(表 1)。通过增加具有隔离和重吸收盐离子的离子细胞进行细胞景观重塑的相关信号通路在低渗胁迫后均上调, 此类通路在低渗胁迫后的细胞连接、细胞运动以及细胞形态保持中发挥重要作用。而且与细胞生长、细胞增殖发育相关的信号通路以及与细胞死亡和存活相关的PETN信号、14-3-3介导信号和SAPK信号等信号通路也在罗非鱼的低渗胁迫的渗透压调节中发挥重要作用。
| 富集范围 | 信号通路名称 |
| A细胞功能和保持, 细胞运动, 细胞形态与细胞组装, 器官, 细胞信号与相互作用 | Rho家族GTPase信号通路 |
| Rho信号通路 | |
| 小窝介导的胞吞信号通路 | |
| 紧密连接 | |
| 缝隙连接 | |
| ILK信号通路 | |
| FAK信号通路 | |
| 肌动蛋白细胞骨架 | |
| 桩蛋白 | |
| 整联素 | |
| Wnt/β-连环蛋白 | |
| G蛋白偶联受体 | |
| 趋化因子 | |
| 钙素信号通路 | |
| 蛋白激酶A | |
| PAK信号通路 | |
| ERK/MAPK信号通路 | |
| 音猬因子信号通路 | |
| 肝配蛋白受体 | |
| B细胞生长、分化和发育 | IGF-1信号通路 |
| 血管生成素 | |
| FGF信号通路 | |
| 生长激素信号通路 | |
| 轴突指导 | |
| 神经酰胺信号通路 | |
| SAPK/JNK信号通路 | |
| C细胞死亡与存活 | 14-3-3介导信号通路 |
| PTEN信号通路 | |
| 醛固酮信号通路 | |
| D渗透调控与其他 | 肾素-血管生成素信号通路 |
| 催乳素信号通路 | |
| 注: A中Wnt/β-连环蛋白、G蛋白偶联受体、趋化因子、钙素信号通路、蛋白激酶A、PAK信号通路、ERK/MAPK信号通路和C的全部信号通路也在B中发挥作用 | |
在海水环境中, 莫桑比克罗非鱼鱼体通过鳃丝增加富含线粒体的离子细胞主动排出过多的盐分保持离子浓度梯度(Lam et al, 2014)。由高渗胁迫和盐排出的能量消耗引起的细胞新陈代谢和线粒体活动增加导致氧化应激, 近而加速细胞损伤和细胞周转。罗非鱼在高渗胁迫下, 与线粒体活动相关的经典信号通路, 如TCA循环和脂质代谢等生理过程出现基因差异表达和基因富集; 而且涉及细胞周期和细胞分化, DNA复制、重组和修复, 生理代谢和产能, 蛋白质合成和降解等范畴的经典信号通路均被用于渗透压调节。鱼体高盐适应的生理活动通过反馈机制影响其信号分子的表达, 因此, DNA复制与修复、蛋白质合成降解以及细胞周期调控的信号分子增加(表 2)。
| 富集范围 | 信号通路名称 |
| 蛋白质合成与处理 | 蛋白泛素化通路 |
| RNA聚合酶Ⅰ复合物组装 | |
| 真核生物中TCA循环Ⅱ | |
| 硬脂酸生物合成(动物) | |
| 能量产生与代谢 | 甲羟戊酸通路Ⅰ |
| NRF2介导的氧化应激反应 | |
| 线粒体的L-carnitine shuttle通路 | |
| 线粒体功能障碍 | |
| 真核细胞的错配修复 | |
| DNA复制、重组与修复 | DNA双链断裂修复 |
| BRCA1在DNA损伤反应中的作用 | |
| 细胞周期蛋白和细胞周期调控 | |
| G1/S检查点调控 | |
| G2/M DNA损伤检查点调控 | |
| 细胞周期与细胞分化 | polo样激酶的有丝分裂作用 |
| RNA信号通路 | |
| CHK蛋白在细胞周期检查点控制中的作用 | |
| TG家族蛋白的细胞周期调控 | |
| 染色体复制的细胞周期调控 | |
| 细胞功能和保持, 细胞运动, 细胞形态与细胞组装, 器官, 细胞信号与相互作用 | Rho家族GTPase信号通路 |
| Rho信号通路 | |
| 小窝介导的胞吞信号通路 | |
| 紧密连接 |
从分子生物学和细胞组学角度深入研究基因功能和表达差异发现, 有丝分裂原激活蛋白酶(MAPK)信号通路(图 2)以及其亚家族信号通路在广盐性鱼类低渗调节过程中发挥重要作用。通过对鳉鱼(Fundulus heteroclitus) (Kültz et al, 2001)鳃细胞进行盐度差异化处理, 结合酶活动力学与表观分子学分析发现, 在低盐胁迫下, 鳉鱼鳃细胞通过提高ERK1酶的活性增强盐度信号在细胞表面受体与细胞核DNA之间的交流, 从而促进细胞对渗透压变化的响应; 同时提高应激激活蛋白激酶2(SAPK2/P38)和应激激活蛋白激酶1(SAPK1/JNK)的活性, 激活下游目标蛋白合成相应的调节因子调节渗透压平衡。在多种类型细胞中, 低渗细胞膨胀可引起MAPK, 尤其是ERK1/2的激活。细胞类型的不同决定ERK1/2磷酸化是否在调控性体积减小过程中发挥作用。大菱鲆(Scophthalmus maxi mum) (Fouchs et al, 2010)肝脏细胞低渗应激后, ATP从细胞内释放到细胞外介质中, 作为自分泌或旁分泌因子与嘌呤P2受体结合激活ERK1/2并级联激活细胞体积调控过程其他细胞事件(图 3)。鱼体通过转运上皮感知盐度变化引起整体渗透压的改变, 导致鳃组织中MAP激酶表达量和磷酸化的改变从而调控跨膜转运过程。在低盐急性胁迫后, 鳉鱼鳃上皮细胞(Marshall et al, 2005)p38磷酸化显著提高并通过MAPK信号通路的酶级联反应过程使离子转运细胞膨胀, 最终抑制氯离子分泌(图 4)。通过对MAPK信号通路对鳉鱼和大菱鲆鳃细胞渗透压调节发现, MAPK信号通路在鱼类的低渗调节中发挥重要作用。但对日本鳗鲡(Anguilla japonica)鳃原代培养细胞渗透压调节机制研究发现, ERK1/2和pp38活性在高渗刺激后出现迅速且瞬时提高, JNK活性也出现相对缓慢增加(Chow et al, 2011)。推测原因是在盐度胁迫的日本鳗鲡体内, ERK1/2、p38通过MAPK信号通路的酶级联反应过程直接进行渗透压调节, 而JNK通过增加相应蛋白的活性促进渗透质转运蛋白相关基因Na+/K+-ATPase (NKA)、TauT的表达, 间接进行渗透压调节。
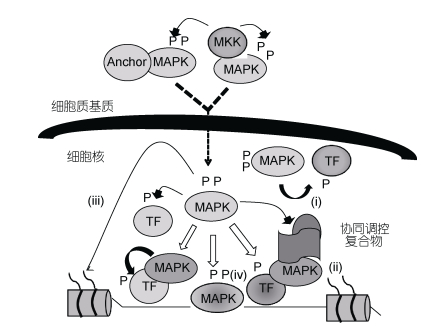 |
| 图 2 MAPK通路作用机制 Fig. 2 Mechanisms of MAPK signaling pathway 注:数据来源于Yang等(2013) |
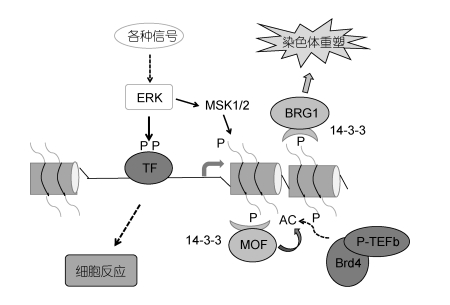 |
| 图 3 ERK信号通路作用机制 Fig. 3 Mechanisms of ERK signaling pathway 注:数据来源于Yang等(2013) |
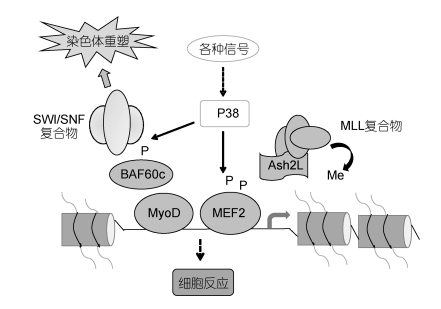 |
| 图 4 P38信号通路作用机制 Fig. 4 Mechanisms of P38 signaling pathway 注:数据来源于Yang等(2013) |
由复杂调控机制介导的渗透感知将信号细胞外基质、细胞骨架和细胞内的离子强度、大分子拥挤和细胞膜拉伸与潜力等信号整合并作用于特殊效应蛋白, 从而维持恒定的细胞体积(Wehner et al, 2003)。虽然相当多研究已剖析这一基本过程, 但感受渗透压变化的蛋白质分子的确切机制尚未阐明。这可能是由于不同渗透压感知蛋白质信号串扰的复杂性使得单独阐述单个渗透感知信号级联放大过程变得非常困难。然而, 渗透感知蛋白引起的信号分子和下游效应蛋白的激活与细胞体积调控的相互作用对破解涉及多细胞功能的基础过程非常重要。
2.1 鳃细胞调控机制鳃细胞信号感知系统激活信号级联反应, 进行鳃上皮功能转换, 从而使鳃细胞重塑促进细胞体积调控和跨膜离子转运(Chow et al, 2011)。淡水驯化的星斑川鲽(Platichthys stellatus)幼鱼(尤宏争等, 2013), 其鳃丝上生成少量泌氯细胞, 使鳃小片远端扁平细胞的气体交换通畅, 促使体内过多的NaCl排出体外从而维持体液渗透压平衡。但对蓝非鲫(Oreochromis aureus) (姜明等, 1998)不同渗透压水环境中细胞结构及机理的变化的形态学研究发现, 在高渗环境生活时, 蓝非鲫通过显著增大泌氯细胞胞体, 增加线粒体数量, 使微细小管系统发达且分布密集, 促进泌氯细胞的泌氯功能和细胞代谢水平迅速提高, 进行离子代谢平衡调节。鲈鱼(Lateolabrax japonicus)稚鱼(王艳等, 2009)通过增大泌氯细胞胞体以及胞质分布密集程度, 提高泌氯功能和代谢水平应对高盐胁迫; 在淡水中, 通过增大扁平细胞胞体和细胞之间紧密连接程度防止金属离子自由渗漏以及增加鳃丝上皮中的黏液细胞数量、增大胞体保护其下的组织免受机械损伤, 促进离子的交换进行渗透调节。采用扫描电镜和免疫组化技术, 研究尼罗罗非鱼(Oreochromis nilotic_us)鳃中氯细胞的分布及其不同盐度胁迫对氯细胞数目和形态变化的影响, 表明, 尼罗罗非鱼可通过改变各种亚型鳃氯细胞数量和形态结构来适应环境中的盐度变化, 推测Ⅰ型氯细胞和Ⅲ型氯细胞分别在低盐适应、高盐适应中起重要作用(庄青青等, 2012)。
2.2 肾细胞调控机制鱼体受到盐度胁迫时, 鱼类重要渗透调节和免疫器官头肾、脾脏的细胞类型、细胞结构及细胞生理生化过程均会发生相应的变化, 以此增强机体免疫力并进行渗透调节。在盐度胁迫后, 许氏平鲉(Sebastes schlegeli)头肾、脾脏组织中的中粒细胞的外部形态和细胞超微结构发生了明显变化, 而且各种粒细胞中的特殊颗粒数量明显增加, 个体增大, 并且不同类型的粒细胞还伴有线粒体、粗面内质网数量的增加(王晓杰等, 2006)。通过不同生境中的鲻鱼(Mugil cephalus)幼鱼肾组织光镜的比较观察, 淡水组和低盐度组的肾小球发达, 肾结构充实, 肾小管粗壮, 大多数均较饱满; 高盐度组则相反, 肾脏退化, 肾小球缩小甚至消失, 肾小管缩短, 肾小管细胞萎缩, 导致管径变大(于娜等, 2012)。通过对海水处理的淞江鲈鱼(Trachidermus fasciafus Heckel)的肾组织切片观察发现, 肾小球毛细血管较淡水鲈鱼欠充实, 整个血管球的体积相对缩小, 且肾小体的肾小囊的壁层与脏层之间的腔隙明显增大(王先敏, 1988)。
2.3 调控性体积减小机制体积恒定性对细胞的生存和正常功能至关重要。低渗细胞膨胀导致调控性体积减小(RVD)机制的激活抵消低渗诱导的细胞体积增加, 其是由细胞内渗透质和相关水分流动调控的复杂的体积调控机制。大菱鲆(Scophthalmus maximum)作为广盐性海水硬骨鱼类, 可通过触发有效的适应机制应对外界环境大幅度盐度变化。细胞外渗透质浓度降低时, 大菱鲆肝细胞通过激活细胞内酪氨酸激酶、p38MAPK信号通路和Cl-和K-通道以及Cl-/HCO3-特异性膜转运蛋白介导的调控性体积减小机制抵消低渗诱导的细胞体积增大应对瞬时渗透膨胀(Ollivier et al, 2006a)。研究发现, 蛋白激酶在低渗刺激的大菱鲆肝脏细胞的信号转导中发挥基本作用, 且蛋白酶抑制剂可显著减弱细胞体积调控。酪氨酸激酶通过触发体积波动感受机制和酶激活级联放大机制在大菱鲆肝脏细胞的调控性体积减小反应的早期阶段发挥重要作用(Hoffmann, 2000), 也可直接磷酸化Cl-通道促进RVD (Tilly et al, 1993)。p38MAPK信号通路可能通过其作用机制直接作用于调控性体积减小过程, 也可能利用p38蛋白促进Cl-的流动以及降低细胞膜对Na+的渗透性促进调控性体积减小过程。Fouchs等(2009)研究大菱鲆(Scophthalmus maximum)肝细胞呼吸链与调控性体积减小过程的关系时发现, 糖酵解参与嘌呤信号转导过程, 并作为有氧能量代谢的第一步, 为线粒体呼吸提供丙酮酸, 然后合成调控性体积减小反应的必须元素ATP, 存于细胞外囊泡中。大菱鲆肝细胞受到低渗刺激时, 引起肝细胞胞吐作用的强烈增加释放ATP作用于调控性体积减小过程。大菱鲆肝细胞ATP的释放包含一个钙依赖性机制, 低渗膨胀后的细胞体积恢复可能需要钙依赖性嘌呤通路和嘌呤依赖性钙信号通路的双重作用, 且钙浓度需要达到阈值来触发ATP释放机制。作为反馈信号, 细胞外的ATP可以结合到嘌呤上, 引起大的钙离子波动。即, ATP释放诱导细胞游离钙含量增加, 当与细胞膜嘌呤受体结合时参与低渗胁迫后体积调控过程(Ollivier et al, 2006b)。
3 渗透调控的内分泌调节机制当外界环境盐度变化时, 广盐性鱼类内分泌激素在保持体液平衡中发挥重要作用。参与鱼类环境盐度适应过程的多种激素根据作用特点可分为快速作用激素和慢性作用激素, 且其功能具有种的特异性或与其他系统相互作用而具有双重功能。快速作用激素是胺类或寡肽激素, 根据环境的变化立即分泌并迅速从循环中排出(Takei, 2008)。快速作用激素也作用于大脑以及外周渗透压调节器官改变转运上皮中多种转运分子的活性, 如转运蛋白、通道、泵和细胞粘附分子。而且, 快速作用激素可通过刺激慢性作用激素的分泌缓慢适应新盐度环境。慢性作用激素通过上皮细胞膜和细胞间连接的转运分子从头合成, 通过干细胞的增殖和分化或细胞类型的形态发生来反转离子和水通量的方向, 从而诱导渗透调节器官的重组。慢性作用激素又称长效激素, 是缓慢分泌的激素并存留在血液循环中以长期适应新的渗透环境。交感神经系统与慢性作用激素和快速作用激素的相互作用对广盐性鱼类的生存至关重要。
3.1 快速作用激素作用机制为应对环境盐度的突然变化, 广盐性鱼类通过神经和内分泌系统立即关闭主动运输机制并激活转运蛋白反转离子和水的运输(Wood, 2011)。在此急性盐度胁迫应激反应中, 血管紧张素、钠尿肽、神经垂体激素、尿紧张素和鸟苷酸蛋白等快速或短效激素发挥重要作用(McCormick, 2001)。上述寡肽激素是由内分泌器官分泌或者是在环境盐度发生变化后通过酶作用(肾素-血管紧张素系统和激肽释放酶-激肽系统)在血浆中产生。血管紧张素由肾素-血管紧张素系统产生, 其在保持水和离子的平衡中发挥重要作用(Kobayashi et al, 1996), 而钠尿肽是肠道NaCl吸收的生理调节因子(Loretz et al, 1997); 神经垂体激素通过影响肾小管水的重吸收进行体液调节(Babey et al, 2011), 而尿紧张素由泌尿系统分泌直接与肾和肠的循环接触, 从而作用于鱼类的渗透压调节(McCrohan et al, 2007), 鸟苷酸蛋白则在肠中合成, 然后分泌到肠腔和内环境中进行渗透调节(Yuge et al, 2003)。
当日本鳗鲡(Anguilla japonica)从淡水转移到海水时, 血浆血管紧张素Ⅱ浓度瞬时增加, 增加的模式与血浆NaCl浓度的模式完全平行(Wong et al, 2012), 而且向血液循环中注入高渗氯化钠溶液极大地增加其血浆血管紧张素Ⅱ的浓度(Takei et al, 1988)。从淡水转移到海水后, 日本鳗鲡血浆心房钠尿肽(ANP)浓度瞬时增加, 然后降低至海水水平(Kaiya et al, 1996), 而且肠鸟苷素mRNA表达量增加至淡水表达水平的5倍(Yuge et al, 2006)。洄游性鱼类由淡水进入海水后, 其下丘脑催产加压素(VT)mRNA表达水平、垂体VT含量和血浆VT水平均明显上升(陈丹丹等, 2009)。生理学研究证明, 莫桑比克罗非鱼(Mainoya et al, 1982)在淡水适应过程中尿紧张素Ⅰ抑制了前肠水分和NaCl的重吸收, 而在牙鲆体内, 尿紧张素Ⅰ直接刺激了皮质醇(COR)的分泌(Kelsall et al, 1998)。
3.2 长效激素作用机制催乳素(prolactin, PRL)、GH/胰岛素样生长因子-1(IGF-Ⅰ)、皮质醇、性激素以及甲状腺激素等慢性作用激素的作用是改变硬骨鱼类整体渗透调节能力。鱼类催乳素在广盐性鱼类的淡水适应中通过使氯细胞变小并抑制Na+/K+-ATPase (NKA)的活性调节渗透压(孟庆辉等, 2010)。当外界盐度变化时, HPI被激活, 引起COR等应激激素的合成与释放, 促进鳃中氯细胞的盐度耐受力和增殖分化、增强鳃中NKA活性以及NKAα亚基的基因表达以适应海水环境(Sakamoto et al, 1997)。由于GH的促生长作用, GH能增强NKA及钠钾氯协同转运蛋白能力及鳃氯细胞体积及数量, 进一步促进了鱼类对海水的适应。胰岛素样生长因子-Ⅰ (IGF-Ⅰ)是鱼类生长激素(GH)适应海水环境作用的内分泌介质, 具有增加鱼类的盐度耐受力和调节渗透压的作用。甲状腺激素T3、T4可能具有促进产生不成熟氯细胞和NKA合成的作用, 参与鱼体海水适应的渗透压调节(冯广朋等, 2007)。研究证明, 性激素对罗非鱼和大马哈鱼的盐度忍受能力有负面影响, 而且雌激素成分可以减少循环的IGF-Ⅰ水平和鳃中NKA的活性(McCormick et al, 2005)。
3.3 激素协同作用机制研究不同盐度海水驯养中史氏鲟(Acipenser schrenckii)内分泌激素的变化规律及其对渗透压的调控作用发现, 随着海水盐度变化, 史氏鲟催乳素(PRL)、皮质醇、胰岛素样生长因子-Ⅰ以及四碘甲状腺原氨酸T4、T3均呈现不同的表达趋势, 5种激素协同作用, 共同增强史氏鲟对海水的适应和渗透压调节能力, 但PRL和COR对渗透压具有决定性的调控作用(庄平等, 2005)。研究急性低盐胁迫对褐牙鲆(Paralichthys olivaceus)的影响发现, 血浆皮质醇(COR)、催乳素(PRL)、生长激素(GH)等3种激素分别表达不同量的mRNA调节渗透压。因此说明, 褐牙鲆成鱼具有成熟完善的渗透压调节机制, 在急性低盐环境胁迫下, COR、PRL、GH等激素的共同作用能在短期内调整机体适应盐度变化, 并建立新的内环境稳态(贾倩倩等, 2016)。
4 无机离子通道和转运蛋白介导的渗透调控活体细胞不停地进行新陈代谢活动, 就必须不断地与周围环境进行物质交换, 而细胞膜上的离子通道就是物质交换的重要途径。离子通道是鱼体渗透压调节的重要通路, 在不同盐度条件下, 通过改变离子细胞中相关离子通道转运基因和蛋白的表达水平, 对渗透压进行调节, 以适应环境的变化。除钠通道、钾通道、钙通道以及N型乙酰胆碱受体通道外, 其他无机离子通道以及囊性纤维化转膜传导调节因子(CFTR)、Na+/K+/2Cl-协同转运蛋白(NKCC)、Na+/K+-ATPase (NKA)等Cl-分泌载体和通道均参与广盐性鱼类的渗透压调节。
4.1 离子通道和转运蛋白作用机制橙色莫桑比克罗非鱼(Oreochromis mossambicus)在盐度胁迫后, AQP1基因在离子主要调节器官鳃和肾中表达量均升高, 且其表达量与盐度密切相关(李茜茜等, 2015)。甘远迪等(2014)对萨罗罗非鱼(Sarotherodon melanothern)AQP3基因进行组织表达分析发现, 在不同的渗透压调节作用中萨罗罗非鱼通过不同组织器官中AQP3来参与水的转运过程。研究证明, 大西洋鲑(Salmo salar)肾和鳃组织中AQP六种同工型相互的转换可能与这些器官在淡水和海水中作用的改变有关; 同时小肠切片和动力学观察表明, AQP-8b异构体是鲑鱼肠道中水吸收的关键通道(Tipsmark et al, 2010)。结合细胞和分子的方法研究欧洲鲈鱼(Dicentrarchus labrax) (Bodinier et al, 2009)幼鱼适应盐度的机理发现, CFTR基因和蛋白在鳃、后肠和肾中进行功能特异性表达并耦联其他离子转运蛋白进行离子调节, 从而使欧洲鲈鱼适应盐度转换。Chen等(2009)对不同盐度处理的香鱼的apoA-Ⅰ基因进行荧光定量检测发现, 从淡水向咸水转移的香鱼中的蛋白质和mRNA显著下调, 表明在该物种中涉及高渗调节。
4.2 离子通道协同作用机制研究表明, 海水和淡水适应的青鳉鱼(Oryzias latipes) (Hsu et al, 2014)胚胎皮肤分别含有2种和3种离子细胞(图 5)。利用原位荧光杂交和免疫细胞化学分析证实, 3种离子细胞分别为:包含顶膜中的NHE3、Rhcg1和基底外侧膜的NKCC、NKA、Rhbg、AE1的NHE细胞, 包含顶膜中的ECaC和基底外侧膜的NKA, 包含顶膜中的NCC和基底外侧膜的HA和NKA; 而且海水适应的青鳉鱼有种特殊的离子细胞, 其包含顶膜中的CFTR、NHE3、NHE2、Rhcg1和基底膜的NKCC、NKA、Rhbg等离体通道, 而且其有少量表达NKA的伴随细胞AC。通过对莫桑比克罗非鱼(Lam et al, 2014)淡水适应和海水适应的鳃组织进行转录组测序, 对比分析发现, 与减少盐分损失的AE、NBC、NABC、NKA、NCX、NCC、HA、NHE3、KCC、CCC9等通道富集于淡水适应的鳃中, 且均具有较高的表达量; 在海水适应的鳃中, 与盐离子分泌相关的AE、CFTR、KCC3、NKA、NKCC等通道富集且均具有较高的表达量。同时, 转录组测序证实了渗透压调控需要多种离子通道协同作用。
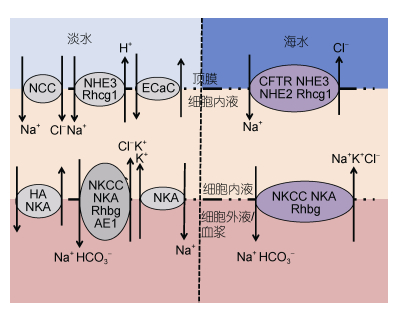 |
| 图 5 青鳉鱼胚胎皮肤离子细胞通道 Fig. 5 The ion channels on embryonic skin of O. latipes |
广盐性鱼类生活在广泛的盐度环境中, 从淡水到海水乃至高盐环境中均有其物种存在。广盐性鱼类, 如鲑鱼、鳗鲡和罗非鱼在全球渔业和水产养殖中均具有重要的经济价值, 而包括青鳉鱼在内的广盐性鱼类则具有重要的研究价值。拥有强大的渗透压调节能力对广盐性鱼类的生存至关重要, 研究广盐性鱼类的渗透压调剂机制, 有助于研究其环境适应机理, 对生产实践具有重要价值。因此, 对广盐性鱼类的渗透压适应性和生理可塑性的研究对促进世界水产养殖业的发展以及水产养殖学的进步均具有重要的意义。目前, 关于鱼类渗透压调节机制已有不少研究, 如对鱼的广盐性以及渗透调节的原理和模式的分析, 从有机体、细胞以及分子水平等对渗透感知的综述, 对广盐性鱼类的激素控制的探讨, 以及对洄游、溯河、潮间带等广盐性鱼类的调节机制进行探究, 但这些研究均存在较大的局限性。随着转录组学、基因组学、蛋白组学以及各种分子技术的发展, 渗透压调节机制涉及的信号分子、蛋白受体、激素、离子运动和细胞调控以及信号与细胞、细胞与细胞之间的信号传递等知识将获得更多的信息。新技术与现有经典技术的结合将为研究广盐性鱼类的渗透压调节机制开辟一个新的研究方向。
| 于娜, 李加儿, 区又君, 等, 2012. 不同盐度下鲻鱼幼鱼鳃和肾组织结构变化. 生态科学, 31(4): 424–428 DOI:10.3969/j.issn.1008-8873.2012.04.014 |
| 马爱军, 许可, 黄智慧, 等, 2011. 大菱鲆与耐高温性状相关的微卫星标记筛选. 海洋科学进展, 29(3): 370–378 DOI:10.3969/j.issn.1671-6647.2011.03.014 |
| 王艳, 胡先成, 2009. 不同盐度下鲈鱼稚鱼鳃的显微结构观察. 海洋科学, 33(12): 138–142 |
| 王先敏, 1988. 外界环境盐度对淞江鲈鱼肾脏组织结构的影响. 海洋学报, 10(3): 334–336 |
| 王晓杰, 张秀梅, 姜明, 2006. 盐度胁迫对许氏平鲉鳃、头肾、脾脏超微结构的影响. 中国海洋大学学报, 36(S1): 85–90 |
| 尤宏争, 郑艳坤, 姜志强, 2013. 盐度对星斑川鲽幼鱼鳃和肾细胞结构的影响. 浙江海洋学院学报(自然科学版), 32(1): 15–19 DOI:10.3969/j.issn.1008-830X.2013.01.004 |
| 甘远迪, 赵金良, ThammaratsuntornJ, 等, 2014. 萨罗罗非鱼AQP3 cDNA序列克隆及盐度胁迫下组织表达特征. 动物学杂志, 49(4): 560–569 |
| 冯广朋, 庄平, 赵峰, 等, 2007. 不同盐度海水驯养中史氏鲟血清激素浓度的变化. 上海水产大学学报, 16(4): 317–322 |
| 庄平, 冯广朋, 赵峰等, 2005.内分泌激素对海水驯养史氏鲟渗透压的调控.见: 国家"863"计划资源环境技术领域第三届海洋生物高技术论坛论文集.厦门: 中国21世纪议程管理中心 http://www.wanfangdata.com.cn/details/detail.do?_type=conference&id=6162751 |
| 庄青青, 赵金良, 赵丽慧, 等, 2012. 盐度胁迫对尼罗罗非鱼鳃氯细胞调节变化的影响. 生态学杂志, 31(10): 2619–2624 |
| 刘贤敏, 李星星, 冷向军, 等, 2008. 盐度对奥尼罗非鱼和乌鳢生长及肌肉成分影响的比较研究. 上海海洋大学学报, 17(2): 242–246 |
| 李茜茜, 朱华平, 卢迈新等, 2015.盐度胁迫对莫桑比克罗非鱼AQP1基因表达的影响.见: 中国水产学会学术年会论文摘要集.杭州: 中国水产学会 |
| 陈丹丹, 刘宗柱, 2009. 鱼类的神经垂体激素. 生物学教学, 34(12): 8–10 DOI:10.3969/j.issn.1004-7549.2009.12.004 |
| 孟庆辉, 李思发, 范武江, 等, 2010. 尼罗罗非鱼、萨罗罗非鱼及其杂交子代的催乳素Ⅰ基因克隆及序列分析. 中国水产科学, 17(3): 414–423 |
| 姜明, 汝少国, 刘晓云, 等, 1998. 不同盐度下蓝非鲫鳃泌氯细胞的结构变化. 青岛海洋大学学报, 28(4): 603–608 |
| 贾倩倩, 吕为群, 2016. 低盐胁迫对褐牙鲆成鱼血浆渗透压、皮质醇、生长激素和催乳素的影响. 上海海洋大学学报, 25(1): 71–77 |
| Babey M, Kopp P, Robertson G L, 2011. Familial forms of diabetes insipidus: clinical and molecular characteristics. Nat Rev Endocrinol, 7: 701–714 DOI:10.1038/nrendo.2011.100 |
| Bodinier C, Lorin-Nebel C, Charmantier G, et al, 2009. Influence of salinity on the localization and expression of the CFTR chloride channel in the ionocytes of juvenile Dicentrarchus labrax exposed to seawater and freshwater. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 153(3): 345–351 |
| Chen J, Shi Y H, Hu H Q, et al, 2009. Apolipoprotein A-Ⅰ, a hyperosmotic adaptation-related protein in ayu (Plecoglossus altivelis). Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 152(2): 196–201 DOI:10.1016/j.cbpb.2008.11.005 |
| Chow S C, Wong C K C, 2011. Regulatory function of hyperosmotic stress-induced signaling cascades in the expression of transcription factors and osmolyte transporters in freshwater Japanese eel primary gill cell culture. Journal of Experimental Biology, 214(Pt 8): 1264–1270 |
| Fouchs A, Ollivier H, Haond C, et al, 2010. Activation of the MAPKs ERK1/2 by cell swelling in turbot hepatocytes. Biology of the Cell, 102(8): 447–456 DOI:10.1042/BC20090154 |
| Fouchs A, Ollivier H, Theron M, et al, 2009. Involvement of respiratory chain in the regulatory volume decrease process in turbot hepatocytes. Biochemistry and Cell Biology, 87(3): 499–504 DOI:10.1139/O09-009 |
| Hoffmann E K, 2000. Intracellular signalling involved in volume regulatory decrease. Cellular Physiology and Biochemistry, 10(5-6): 273–288 DOI:10.1159/000016356 |
| Hsu H H, Lin L Y, Tseng Y C, et al, 2014. A new model for fish ion regulation: identification of ionocytes in freshwater- and seawater-acclimated medaka (Oryzias latipes). Cell and Tissue Research, 357(1): 225–243 DOI:10.1007/s00441-014-1883-z |
| Kaiya H, Takei Y, 1996. Osmotic and volaemic regulation of atrial and ventricular natriuretic peptide secretion in conscious eels. Journal of Endocrinology, 149(3): 441–447 DOI:10.1677/joe.0.1490441 |
| Kelsall C J, Balment R J, 1998. Native urotensins influence cortisol secretion and plasma cortisol concentration in the euryhaline flounder, Platichthys flesus. General and Comparative Endocrinology, 112(2): 210–219 DOI:10.1006/gcen.1998.7166 |
| Kobayashi H, Takei Y, 1996. Zoophysiology, Vol.35. The Renin-Angiotensin System-Comparative Aspects. Berlin: Springer, 1-245 |
| Kültz D, Avila K, 2001. Mitogen-activated protein kinases are in vivo transducers of osmosensory signals in fish gill cells. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 129(4): 821–829 DOI:10.1016/S1096-4959(01)00395-5 |
| Lam S H, Lui E Y, Li Z J, et al, 2014. Differential transcriptomic analyses revealed genes and signaling pathways involved in iono-osmoregulation and cellular remodeling in the gills of euryhaline Mozambique tilapia, Oreochromis mossambicus. BMC Genomics, 15(1): 921 DOI:10.1186/1471-2164-15-921 |
| Loretz C A, Pollina C, Kaiya H, et al, 1997. Local synthesis of natriuretic peptides in the eel intestine. Biochemical & Biophysical Research Communications, 238(3): 817–822 |
| Mainoya J R, Bern H A, 1982. Effects of teleost urotensins on intestinal absorption of water and NaCl in tilapia, Sarotherodon mossambicus, adapted to fresh water or seawater. General and Comparative Endocrinology, 47(1): 54–58 DOI:10.1016/0016-6480(82)90083-1 |
| Marshall W S, Ossum C G, Hoffmann E K, 2005. Hypotonic shock mediation by p38 MAPK, JNK, PKC, FAK, OSR1 and SPAK in osmosensing chloride secreting cells of killifish opercular epithelium. Journal of Experimental Biology, 208(Pt 6): 1063–1077 |
| McCormick S D, 2001. Endocrine control of osmoregulation in teleost fish. American Zoologist, 41(4): 781–794 |
| McCormick S D, O'Dea M F, Moeckel A M, et al, 2005. Endocrine disruption of parr-smolt transformation and seawater tolerance of Atlantic salmon by 4-nonylphenol and 17β-estradiol. General and Comparative Endocrinology, 142(3): 280–288 DOI:10.1016/j.ygcen.2005.01.015 |
| Mccrohan C, Lu W M, Dow L, et al, 2007. Fish caudal neurosecretory system: a model for the study of neuroendocrine secretion. General & Comparative Endocrinology, 153(1-3): 243 |
| Ollivier H, Pichavant K, Puill-Stephan E, et al, 2006a. Volume regulation following hyposmotic shock in isolated turbot (Scophthalmus maximus) hepatocytes. Journal of Comparative Physiology B, 176(5): 393–403 DOI:10.1007/s00360-005-0061-8 |
| Ollivier H, Pichavant-Rafini K, Puill-Stephan E, et al, 2006b. Effects of hypo-osmotic stress on ATP release in isolated turbot (Scophthalmus maximus) hepatocytes. Biology of the Cell, 98(7): 427–437 DOI:10.1042/BC20050077 |
| Sakamoto T, Shepherd B S, Madsen S S, et al, 1997. Osmoregulatory actions of growth hormone and prolactin in an advanced teleost. General and Comparative Endocrinology, 106(1): 95–101 DOI:10.1006/gcen.1996.6854 |
| Takei Y, 2008. Exploring novel hormones essential for seawater adaptation in teleost fish. General and Comparative Endocrinology, 157(1): 3–13 DOI:10.1016/j.ygcen.2008.03.021 |
| Takei Y, Okubo J, Yamaguchi K, 1988. Effects of cellular dehydration on drinking and plasma angiotensin 2 level in the eel, Anguilla japonica. Zoological Science, 5(1): 43–51 |
| Tilly B C, van den Berghe N, Tertoolen L G, et al, 1993. Protein tyrosine phosphorylation is involved in osmoregulation of ionic conductances. Journal of Biological Chemistry, 268(27): 19919–19922 |
| Tipsmark C K, Sørensen K J, Madsen S S, 2010. Aquaporin expression dynamics in osmoregulatory tissues of Atlantic salmon during smoltification and seawater acclimation. Journal of Experimental Biology, 213(3): 368–379 DOI:10.1242/jeb.034785 |
| Wehner F, Olsen H, Tinel H et al, 2003. Cell volume regulation: osmolytes, osmolyte transport, and signal transduction. In: Amara S G, Bamberg E, Blaustein F M P et al eds. Reviews of Physiology, Biochemistry and Pharmacology. Berlin Heidelberg: Springer, 1-80 http://med.wanfangdata.com.cn/Paper/Detail?id=PeriodicalPaper_JJ0213528851 |
| Wong M K S, Takei Y, 2012. Changes in plasma angiotensin subtypes in Japanese eel acclimated to various salinities from deionized water to double-strength seawater. General and Comparative Endocrinology, 178(2): 250–258 DOI:10.1016/j.ygcen.2012.06.007 |
| Wood C M, 2011. Rapid regulation of Na+ and Cl- flux rates in killifish after acute salinity challenge. Journal of Experimental Marine Biology and Ecology, 409(1-2): 62–69 DOI:10.1016/j.jembe.2011.08.009 |
| Yang S H, Sharrocks A D, Whitmarsh A J, 2013. Map kinase signalling cascades and transcriptional regulation. Gene, 513(1): 1–13 DOI:10.1016/j.gene.2012.10.033 |
| Yuge S, Inoue K, Hyodo S, et al, 2003. A Novel Guanylin Family (Guanylin, Uroguanylin, and Renoguanylin) in eels: possible osmoregulatory hormones in intestine and kidney. Journal of Biological Chemistry, 278(25): 22726–22733 DOI:10.1074/jbc.M303111200 |
| Yuge S, Yamagami S, Inoue K, et al, 2006. Identification of two functional guanylin receptors in eel: Multiple hormone-receptor system for osmoregulation in fish intestine and kidney. General and Comparative Endocrinology, 149(1): 10–20 DOI:10.1016/j.ygcen.2006.04.012 |
 2018, Vol. 49
2018, Vol. 49

