
中国海洋湖沼学会主办。
文章信息
- 侯红红, 苗亮, 李明云, 郭晓飞, 杜静雅, 陈炯. 2018.
- HOU Hong-Hong, MIAO Liang, LI Ming-Yun, GUO Xiao-Fei, DU Jing-Ya, CHEN Jiong. 2018.
- 大黄鱼(Larimichthys crocea)白细胞介素10(IL-10)基因克隆及溶藻弧菌(Vibrio alginolyticus)侵染后表达变化分析
- CLONING OF INTERLEUKIN-10 (IL-10) GENE FROM LARGE YELLOW CROAKER LARIMICHTHYS CROCEA AND THE EXPRESSION PATTERN ANALYSIS ON VIBRIO ALGINOLYTICUS INFECTION
- 海洋与湖沼, 49(6): 1334-1340
- Oceanologia et Limnologia Sinica, 49(6): 1334-1340.
- http://dx.doi.org/10.11693/hyhz20180200043
-
文章历史
- 收稿日期:2018-02-24
- 收修改稿日期:2018-04-05
大黄鱼(Larimichthys crocea)是我国海水鱼类中养殖规模最大、产量最高的主要经济种类(农业部渔业渔政管理局, 2016), 但近年来网箱养殖大黄鱼病害发作呈逐年递增趋势, 造成了严重的经济损失, 不仅病原多样化、且出现耐药性, 加大了病害防治难度(曹飞飞等, 2017)。因此研究大黄鱼的免疫机理并探寻免疫增加方法、开发新型药物以及进行抗病育种对于食品安全和健康养殖都具有重要的科学意义和应用价值。
鱼类具有较完善的先天性免疫系统(Magnadóttir, 2006), 在多种细胞因子中, 白细胞介素(interleukin, IL)在激活与调节免疫细胞、信号传递以及炎症反应中起重要作用(丰培金, 2006)。白细胞介素家族中的白细胞介素10(interleukin-10, IL-10)是一种强效的抗炎性细胞因子, 最初发现自小鼠的Th2细胞(Fiorentino et al, 1991), 之后的研究显示几乎所有的白细胞(包括T细胞、B细胞、树突细胞、NK细胞、肥大细胞和角化细胞等)均能产生IL-10(Blanco et al, 2008), IL-10能通过激活巨噬细胞和防止组织损伤而有抑制炎症反应的效果(Moore et al, 2001), 其作用机制包括下调主要组织相容性复合体Ⅱ类(major histocompatibility complex class Ⅱ, MHC Ⅱ)基因的表达、减少NO的产生以及抑制巨噬细胞产生炎症因子(如IL-1β、IL-12、TNF-α)等。目前已在鲤(Cyprinus carpio)、虹鳟(Oncorhynchus mykiss)、斑马鱼(Danio rerio)、卵形鲳鲹(Trachinotus ovatus)等多种鱼类中进行了IL-10基因克隆、分析, 并发现其参与机体抵御病原侵染的免疫反应(高珊等, 2014; Peng et al, 2017)。
对大黄鱼全基因组的分析显示其先天性免疫系统较为完善(Wu et al, 2014), 白细胞介素家族是大黄鱼先天性免疫系统的重要组成部分, 目前已对大黄鱼IL-1β、IL-8、IL-17等白介素家族基因在抵御病原侵染中的作用进行了研究(Li et al, 2013; Mu et al, 2015; Wu et al, 2015; Ding et al, 2016), 但未见有关于IL-10基因的研究报道。本研究克隆了大黄鱼IL-10 cDNA序列, 并通过实时荧光定量PCR(quantitative real time PCR, qRT-PCR)检测溶藻弧菌(Vibrio alginolyticus)侵染后大黄鱼组织中IL-10的表达变化, 以期为了解大黄鱼IL-10基因的结构及其在机体内的免疫机制提供参考。
1 材料与方法 1.1 实验用鱼及溶藻弧菌侵染实验实验用鱼为购自宁波市象山海韵水产专业合作社的网箱养殖“东海1号”大黄鱼(平均体长19.5cm, 平均体重89.3g), 运至实验室暂养1周。随机取3尾健康、无病的鱼, 丁香酚麻醉后解剖取心脏、肝、脾、肠、头肾、肌肉、鳃、脑等组织, 液氮速冻后–80℃保存, 用于IL-10基因克隆及组织表达检测。随机挑选60尾健康、无病的个体进行溶藻弧菌侵染实验:将鱼随机分为2组, 其中实验组腹腔注射浓度为108cfu/mL溶藻弧菌溶液0.2mL, 对照组注射等量无菌的PBS溶液, 实验组和对照组各设置3组重复; 分别在注射(0h)和注射后4h、8h、12h和24h采样, 每次每组随机取6尾鱼、丁香酚麻醉后解剖取肠、脑、脾、肝和头肾, 液氮速冻后–80℃保存, 用于检测IL-10表达变化。
采集的组织样品用RNAiso Plus试剂(TaKaRa)提取总RNA, 用PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒(TaKaRa)反转录合成cDNA。
1.2 大黄鱼IL-10基因克隆根据本实验室大黄鱼巨噬细胞转录组测序获得的IL-10部分序列, 用Primer 5.0软件设计引物lc-IL10-V(表 1)在肝脏cDNA中进行扩增验证, PCR产物先经1.5%琼脂糖凝胶电泳检测, 对目的条带切胶回收后连入pET-28a载体, 转化入大肠杆菌(Escherichia coli)DH5α菌株, 经蓝白斑筛选后对阳性克隆进行测序。
| 引物名称 | 序列(5′—3′) | 退火温度(℃) | 用途 |
| lc-IL10-V | F: ATTTCACCGGCATGACTC R: CTATGCCGTTTAGAAGCC |
56 | 序列扩增 |
| lc-IL10-3'-O | ACTTCCACTGCAAGAACCAG | 56 | 3′-RACE扩增的外侧引物 |
| lc-IL10-3'-I | TACATTGAGACGTATCTGGC | 54 | 3′-RACE扩增的内侧引物 |
| q-lc-IL10 | F: CTGGTTCTCTTGTCTTTTTTC R: CATAGTTTAGTCTGAGCGTCT |
56 | 表达检测 |
| β-actin | F: ACGTTGCCATCCAGGCTGTGCT R: ACGCACGATTTCCCTCTCGGCT |
56 | 表达检测内参 |
用3′-Full RACE Core Set with PrimeScriptTM RTase试剂盒(TaKaRa)进行3′-RACE反应, 步骤为将肝脏总RNA反转录合成cDNA并与3′RACE Adaptor连接, 用引物lc-IL10-3′-O和3′RACE Outer Primer进行第1轮扩增, 用引物lc-IL10-3′-I和3′RACE Inner Primer进行第2轮扩增。其中引物lc-IL10-3′-O和lc-IL10-3′-I(表 1)为根据前一步验证后的大黄鱼IL-10部分序列自行设计, 引物3′RACE Outer Primer和3′RACE Inner Primer为试剂盒提供。按照试剂盒说明书配制PCR体系和设置反应程序, PCR产物经1.5%琼脂糖凝胶电泳检测后回收目的条带、连入pET-28a载体、转化入E. coli DH5α菌株、蓝白斑筛选后对阳性克隆测序, 经序列拼接后获得大黄鱼IL-10基因cDNA序列。本实验所用引物均由生工生物工程(上海)股份有限公司合成, 样品测序均由华大基因完成。
1.3 大黄鱼IL-10基因cDNA序列分析及表达检测对获得的大黄鱼IL-10 cDNA序列, 用在线BLASTX工具(http://www.ncbi.nlm.nih.gov/BLAST/)进行序列同源性比对和相似性分析, 用EditSeq软件分析开放阅读框(open reading frame, ORF)并推测编码氨基酸序列, 用Compute pI/Mw工具(http://web.expasy.org/compute_pi)预测等电点, 用SignalP 4.1工具(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽, 用NetNGlyc工具(http://www.cbs.dtu.dk/services/NetNGlyc/)预测糖基化位点。从GenBank数据库中下载各种白细胞介素蛋白序列, 用ClustalW程序(http://clustalw.ddbj.nig.ac.jp/)进行多重序列比对, 用MEGA 5.0软件构建邻接法(neighbor-joining method, NJ method)系统进化树。
设计引物q-lc-IL10、并以β-actin作为内参基因(表 1)检测健康大黄鱼心脏、肝、脾、脑、肠、肌肉、鳃、头肾等8种组织中以及溶藻弧菌侵染前、后不同时间肠、脑、肝、头肾、脾等5种组织中IL-10的表达情况。在Mastercycler ep realplex实时定量PCR仪(Eppendorf)上进行qRT-PCR反应, 20μL反应体系包括: SYBR® Premix Ex Taq (TaKaRa) 10μL, 10μmol/L的正、反向引物各1μL, cDNA模板1μL, ddH2O 7μL。反应程序为: 94℃ 2min (94℃ 15s, 56℃ 15s, 72℃ 30s)×40次循环。根据目的基因和内参基因的Ct值, 通过2–ΔΔCt法(Livak et al, 2001)计算IL-10基因相对表达量。所得数据用SPSS 19.0软件进行统计分析, 对各个采样点的表达量进行单因素方差分析(One-way ANOVA), 以P < 0.05为具有显著性差异。
2 结果 2.1 大黄鱼IL-10基因cDNA克隆与序列特征经扩增验证和3′-RACE后测序拼接, 获得的大黄鱼IL-10基因cDNA序列899bp (GenBank登录号: MG845871), 其3′端非编码区存在3个mRNA不稳定序列ATTTA(其中前2个形成复合结构“ATTTATTTA”)和1个mRNA的加尾信号AATAAA; 开放阅读框长度为555bp, 推测编码蛋白含184个氨基酸残基, 经SingalP预测N端22个氨基酸(MTPRSLLLCAL VLLSFFITVWT)为信号肽(图 1)。预测大黄鱼IL-10基因编码蛋白分子量为21.24kDa、理论等电点为6.29; NetNGlyc分析显示大黄鱼IL-10基因的编码蛋白不存在O-糖基化位点, 只在Asn146处有一个N-糖基化位点(可能性为0.63)。
 |
| 图 1 大黄鱼IL-10 cDNA序列及其编码的氨基酸序列 Fig. 1 The nucleotide sequence of lc-IL-10 cDNA and the deduced amino acid sequence 注: *示终止密码子; 阴影示信号肽; 单下划线示加尾信号(AATAAA); 双下划线示RNA不稳定序列(ATTTA); 方框示潜在的N糖基化位点 |
经氨基酸序列比对分析(图 2), 大黄鱼IL-10基因的编码蛋白在第156—172个氨基酸处具有IL-10家族特征性序列“GLYKAMGELNLLFNYIE”, 这一序列在鱼类中保守性较高; 各种动物的IL-10基因编码蛋白均含有4个保守的半胱氨酸、可形成2对二硫键。大黄鱼IL-10基因的编码蛋白序列与欧洲鲈(Dicentrarchus labrax)IL-10蛋白的序列相似性最高(78.5%), 与大西洋鳕鱼(Gadus morhua)、虹鳟(O. mykiss)、欧洲鳗鲡(Anguilla anguilla)、斑马鱼(D. rerio)等鱼类IL-10蛋白的相似性均 > 46%, 而与人IL-10蛋白的相似性较低(29.2%)。
 |
| 图 2 大黄鱼与其他动物IL-10氨基酸序列比对 Fig. 2 Multiple alignment of IL-10 amino acid among L. crocea and other vertebrates 注:深色阴影示相同氨基酸; 浅色阴影示相似氨基酸; *示4个保守性半胱氨酸; 方框示IL-10家族特征序列 |
基于氨基酸序列的系统进化树分析显示(图 3), 各种动物的IL-1、IL-8、IL-10、IL-15、IL-22均单独成簇; 在IL-10大簇中, 鲤(C. carpio)、草鱼(Ctenopharyngodon idella)、斑马鱼(D. rerio)等鲤科鱼类单独聚为一个小簇, 本研究获得的大黄鱼IL-10与同属鲈形目的欧洲鲈(Dicentrarchus labrax)优先相聚、表明二者进化关系较近(图 3)。
 |
| 图 3 基于白细胞介素氨基酸序列构建的系统进化树(NJ法, bootstraps=1000) Fig. 3 The phylogenetic tree based on the amino acid sequence of interleukin (neighbor-joining method, bootstraps=1000) |
qRT-PCR检测显示健康大黄鱼心、肠、肌肉、脑、脾、肝、头肾和鳃等组织中均有IL-10基因表达, 鳃和肠中高表达, 脑、脾、心和肌肉呈中等表达, 肝和头肾中低表达(图 4)。
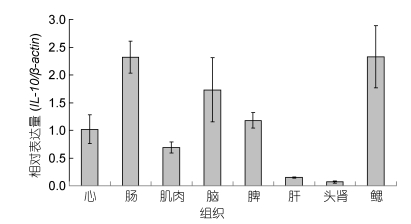 |
| 图 4 qRT-PCR检测大黄鱼IL-10基因的组织表达(n=3) Fig. 4 The expression of IL-10 gene in different tissues of L. crocea detected by qRT-PCR (n=3) |
qRT-PCR检测显示, 溶藻弧菌侵染后大黄鱼各组织中IL-10均出现表达上调。肠中IL-10的表达则是在菌侵染后4h时急剧升高、8—24h期间表达量逐渐降低, 表明肠对腹腔注射侵染的溶藻弧菌最为敏感; 菌侵染后4—24h期间, 脑、脾、肝、头肾中IL-10的表达均呈先升后降的变化, 其中肝和头肾变化幅度最大、并均在8h时出现显著的表达高峰(分别达侵染前的8.79倍和10.06倍), 提示在溶藻弧菌侵染引起的免疫反应中肝和头肾可能是主要的参与器官(图 5)。
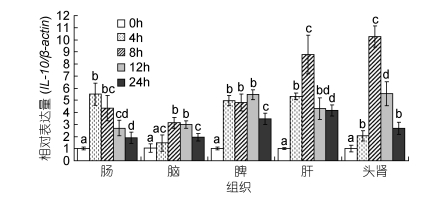 |
| 图 5 qRT-PCR检测溶藻弧菌侵染后大黄鱼IL-10基因的表达变化(n=6) Fig. 5 Changes in expression of L. crocea IL-10 gene after V. alginolyticus infection (n=6) 注:同一组织中不同时间点无相同小写字母表示IL-10基因表达量有显著性差异(P < 0.05) |
随着养殖规模的扩大和养殖环境的变差, 近年来鱼病防治形势日趋严峻。许多研究者试图从鱼体免疫机理着手, 通过增强鱼体抗病、抗逆能力来提高养殖产量和质量, 其中细胞因子是研究热点之一。IL-10是机体的一种重要免疫因子, 对免疫细胞和其他免疫因子具有双向调节作用, 参与机体对病原免疫和炎症应答(井申荣等, 2006)。目前已在斑马鱼、虹鳟、金鱼、卵形鲳鲹等多种鱼类中获得了IL-10基因序列(Inoue et al, 2005; Zhang et al, 2005; Grayfer et al, 2011; Peng et al, 2017)。本研究获得的大黄鱼IL-10基因cDNA序列在3’末端含有3个mRNA不稳定信号ATTTA, 并且有2个形成了复合型的ATTTATTTA结构, 卵形鲳鲹IL-10 mRNA的不稳定信号也是如此(Peng et al, 2017), 而鱼类IL-10 mRNA中不稳定信号的数量明显少于高等脊椎动物(肖凡书等, 2006)。包括大黄鱼在内的各种动物IL-10蛋白均含有信号肽和保守的IL-10家族特征性序列, 并且有4个半胱氨酸在各类动物中高度保守, 对哺乳动物IL-10蛋白的研究显示这4个半胱氨酸所形成的2对二硫键对于IL-10蛋白的空间构型和功能起着决定性的作用(Windsor et al, 1993)。另外, 很多鱼类的IL-10中还包含另外2个半胱氨酸, 大黄鱼中也是如此, 但研究显示这两个半胱氨酸可能并未形成特殊的结合(Peng et al, 2017)。
组织表达检测显示IL-10基因在大黄鱼鳃和肠中表达量较高, 这与虹鳟中的情况一致(Inoue et al, 2005), 但虹鳟头肾中IL-10有中等程度的表达, 而大黄鱼头肾中IL-10的表达量较低。其他鱼类中IL-10基因的组织表达情况也不尽相同:欧洲鲈头肾和肠中高表达、鳃中低表达(Buonocore et al, 2007); 卵形鲳鲹在皮肤、心和鳃中高表达, 肌肉和肠外中低表达, 其他各组织中均呈中等程度表达(Peng et al, 2017); 卡特拉鱼则是肾和心中高表达、皮肤中几乎不表达(Swain et al, 2012)。这种组织表达差异可能是不同物种的免疫机能差异所致, 也可能与各种鱼类生活的水环境不同有关。
哺乳动物中IL-10在机体免疫中的功能及作用机制已得到了较深入的研究(Sabat et al, 2010), 在鱼类中的研究也表明其参与机体抵御细菌、病毒侵染后的免疫反应(Kongchum et al, 2011; Swain et al, 2012)。注射LPS可引起斑马鱼、虹鳟和卡特拉鱼肾、肝、肠、脾、鳃等组织中IL-10表达量显著升高(Inoue et al, 2005; Zhang et al, 2005; Swain et al, 2012); 嗜水气单胞菌(Aeromonas hydrophila)侵染后鲤、卡特拉鱼均出现IL-10表达上调(Swain et al, 2012; Jiang et al, 2016)。本研究中大黄鱼头肾、肝、脑、脾、肠等组织IL-10的表达量在溶藻弧菌侵染后均出现显著上调, 提示IL-10参与了大黄鱼抵抗病原菌的免疫应答反应。Zou等(2003)发现红鳍东方鲀(Fugu rubripes)IL-10基因的启动子上存在NF-κB结合位点, Swain等(2012)在卡特拉鱼中的研究显示NF-κB阻断剂可以解除LPS诱导的细胞IL-10表达上调, 提示免疫应答中IL-10的表达是通过NF-κB信号通路诱导的。但大黄鱼中IL-10基因中是否存在NF-κB结合位点以及其诱导机制如何尚有待于进一步研究。另外, Kongchum等(2011)发现鲤IL-10基因中存在有与鲤孢疹病毒-3(cyprinid herpesvirus-3)抗性相关的SNP位点, 因此今后在深入研究大黄鱼IL-10基因免疫机理的同时开展可用于分子标记辅助育种的抗病性相关SNP位点筛查也具有十分重要的意义。
4 结论本文获得了长度为899bp的大黄鱼IL-10基因cDNA序列, 共编码184个氨基酸, 预测编码蛋白N端有长度为22个氨基酸的信号肽序列, 序列比对和系统进化分析显示大黄鱼IL-10与欧洲鲈进化关系最近。qRT-PCR检测显示溶藻弧菌侵染后大黄鱼肠、脑、肝、脾、头肾等组织中IL-10基因表达量显著升高, 提示该基因参与菌侵染后大黄鱼的免疫反应, 结果可为研究大黄鱼的免疫机制提供参考资料。
| 丰培金, 2006. 鱼类的白细胞介素研究进展. 安徽农业科学, 34(17): 4317–4318, 4320 DOI:10.3969/j.issn.0517-6611.2006.17.066 |
| 井申荣, 邹全明, 2006. 白细胞介素10的研究进展. 免疫学杂志, 22(3): 26–28, 32 |
| 农业部渔业渔政管理局, 2016. 中国渔业统计年鉴. 北京: 中国农业出版社, 28-32 |
| 肖凡书, 昌鸣先, 孙军, 等, 2006. 鲢(Hypophthalmichthys molitrix)IL-10基因的克隆及表达分析. 自然科学进展, 16(2): 183–189 DOI:10.3321/j.issn:1002-008X.2006.02.008 |
| 高珊, 余涛, 周景祥, 等, 2014. 鱼类白介素及其受体的研究. 水产学杂志, 27(03): 62–64 DOI:10.3969/j.issn.1005-3832.2014.03.014 |
| 曹飞飞, 朱凝瑜, 郑晓叶, 2017. 2014-2016年浙江省大黄鱼养殖病害测报及防治建议. 浙江农业科学, 58(6): 1043–1047 |
| Blanco P, Palucka A K, Pascual V, et al, 2008. Dendritic cells and cytokines in human inflammatory and autoimmune diseases. Cytokine & Growth Factor Reviews, 19(1): 41–52 |
| Buonocore F, Randelli E, Bird S, et al, 2007. Interleukin-10 expression by real-time PCR and homology modelling analysis in the European sea bass (Dicentrarchus labrax L.). Aquaculture, 270(1-4): 512–522 DOI:10.1016/j.aquaculture.2007.05.040 |
| Ding Y, Ao J Q, Ai C X, et al, 2016. Molecular and functional identification of three interleukin-17A/F (IL-17A/F) homologues in large yellow croaker (Larimichthys crocea). Developmental & Comparative Immunology, 55: 221–232 |
| Fiorentino D F, Zlotnik A, Mosmann T R, et al, 1991. IL-10 inhibits cytokine production by activated macrophages. Journal of Immunology, 147(11): 3815–3822 |
| Grayfer L, Hodgkinson J W, Hitchen S J, et al, 2011. Characterization and functional analysis of goldfish (Carassius auratus L.) interleukin-10. Molecular Immunology, 48(4): 563–571 DOI:10.1016/j.molimm.2010.10.013 |
| Inoue Y, Kamota S, Ito K, et al, 2005. Molecular cloning and expression analysis of rainbow trout (Oncorhynchus mykiss) interleukin-10 cDNAs. Fish & Shellfish Immunology, 18(4): 335–344 |
| Jiang X Y, Zhang C, Zhao Y J, et al, 2016. Immune effects of the vaccine of live attenuated Aeromonas hydrophila screened by rifampicin on common carp (Cyprinus carpio L). Vaccine, 34(27): 3087–3092 DOI:10.1016/j.vaccine.2016.04.075 |
| Kongchum P, Sandel E, Lutzky S, et al, 2011. Association between IL-10a single nucleotide polymorphisms and resistance to cyprinid herpesvirus-3 infection in common carp (Cyprinus carpio). Aquaculture, 315(3-4): 417–421 DOI:10.1016/j.aquaculture.2011.02.035 |
| Li C, Yao C L, 2013. Molecular and expression characterizations of interleukin-8 gene in large yellow croaker (Larimichthys crocea). Fish & Shellfish Immunology, 34(3): 799–809 |
| Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCT method. Methods, 25(4): 402–408 DOI:10.1006/meth.2001.1262 |
| Magnadóttir B, 2006. Innate immunity of fish (overview). Fish & Shellfish Immunology, 20(2): 137–151 |
| Moore K W, de Waal Malefyt R, Coffman R L, et al, 2001. Interleukin-10 and the Interleukin-10 receptor. Annual Review of Immunology, 19: 683–765 DOI:10.1146/annurev.immunol.19.1.683 |
| Mu Y N, Wang K R, Ao J Q, et al, 2015. Molecular characterization and biological effects of a CXCL8 homologue in large yellow croaker (Larimichthys crocea). Fish & Shellfish Immunology, 44(2): 462–470 |
| Peng Y H, Cai X H, Zhang G Y, et al, 2017. Molecular characterization and expression of interleukin-10 and interleukin-22 in golden pompano (Trachinotus ovatus) in response to Streptococcus agalactiae stimulus. Fish & Shellfish Immunology, 65: 244–255 |
| Sabat R, Grutz G, Warszawska K, et al, 2010. Biology of interleukin-10. Cytokine & Growth Factor Reviews, 21(5): 331–344 |
| Swain B, Samanta M, Basu M, et al, 2012. Molecular characterization, inductive expression and mechanism of interleukin-10 gene induction in the Indian major carp, catla (Catla catla). Aquaculture Research, 43(6): 897–907 DOI:10.1111/are.2012.43.issue-6 |
| Windsor W T, Syto R, Tsarbopoulos A, et al, 1993. Disulfide bond assignments and secondary structure analysis of human and murine interleukin 10. Biochemistry, 32(34): 8807–8815 DOI:10.1021/bi00085a011 |
| Wu C W, Zhang D, Kan M Y, et al, 2014. The draft genome of the large yellow croaker reveals well-developed innate immunity. Nature Communication, 5: 5227 DOI:10.1038/ncomms6227 |
| Wu J, Shi Y H, Zhang X H, et al, 2015. Molecular characterization of an IL-1β gene from the large yellow croaker (Larimichthys crocea) and its effect on fish defense against Vibrio alginolyticus infection. Zoological Research, 36(1): 133–141 |
| Zhang D C, Shao Y Q, Huang Y Q, et al, 2005. Cloning, characterization and expression analysis of interleukin-10 from the zebrafish (Danio rerion). Journal of Biochemistry and Molecular Biology, 38(5): 571–576 |
| Zou J, Clark M S, Secombes C J, 2003. Characterisation, expression and promoter analysis of an interleukin 10 homologue in the puffer fish, Fugu rubripes. Immunogenetics, 55(5): 325–335 DOI:10.1007/s00251-003-0580-y |
 2018, Vol. 49
2018, Vol. 49


