
中国海洋湖沼学会主办。
文章信息
- 陈楠桦, 梁仁杰, 白义, 王海瑞. 2018.
- CHEN Nan-Hua, LIANG Ren-Jie, BAI Yi, WANG Hai-Rui. 2018.
- 基于几何形态测量学的四种滨螺形态差异与系统发生关系研究
- A GEOMETRIC-MORPHOMETRY-BASED STUDY ON PHYLOGENY OF FOUR LITTORINA (GASTROPODA: LITTORINIDAE) SPECIES
- 海洋与湖沼, 49(6): 1365-1374
- Oceanologia et Limnologia Sinica, 49(6): 1365-1374.
- http://dx.doi.org/10.11693/hyhz20171100293
-
文章历史
- 收稿日期:2017-11-17
- 收修改稿日期:2018-03-31
2. 台州学院生态研究所 台州 318000;
3. 台州学院体育科学学院 台州 318000
2. Institute of Ecology, Taizhou University, Taizhou 318000, China;
3. Sports Science Insititute, TaizhouUniversity, Taizhou 318000, China
种间形态分化规律以及与环境因子的相关性, 一直是分类学以及生态学领域研究的热点问题(Minton et al, 2008; 闫宝荣等, 2010)。以海洋贝类为例, 生活在潮间带的海洋贝类可通过改变体型结构, 如增加贝壳的厚度或形成保护性的附属物来抵御潮水以及捕食者侵害, 而一些逃跑能力迅速的种类具有较薄的壳或无保护性壳(Zieritz et al, 2009), 通过逃跑或躲避来适应环境。滨螺是广泛分布于潮间带的腹足类动物, 是潮间带生物群落的主要成员, 是岩相高潮带最具代表性种类, 对环境压力的抵抗力很强(蔡如星等, 1991b)。滨螺科中不同种类体型多样, 有的种类螺层高耸, 螺体较小, 有的种类螺层低平, 螺体较大, 还有些种类螺体表面有瘤状突起。从分布上看, 滨螺的体型总是跟其在潮间带上的分布有关(Chapman, 1994, Carvajal-Rodríguez et al, 2005; Conde-Padín et al, 2007)。因此滨螺是研究种间形态差异及其与潮间带环境关系的好材料。
在种间形态关系的研究中, 形态结构的量化分析是关键。几何形态测量学(Geometric morphometric)方法的出现为生物体结构的量化分析提供了有力的工具。使我们能够从数量上和形态上来总结形态数据, 从多维角度分析生物体间的形态结构关系。以往传统的形态测量法是多变量统计分析在形态变量数值化中的应用, 如长度, 宽度和高度。而几何形态测量学(morphometrics)是对形状及形状变异的定量描述、分析以及解释的科学。它主要研究形态变量及其协同变量与其他变量的关系。通过对不同标志点的信息整合将完整的生物标本的整体轮廓、对称性及不同部位的排列关系等几何形态信息以图形的方式展示(白明等, 2007; 刘武等, 2010)。几何形态测量学作为一个成熟的形态定量比较的科学计算工具, 在解决众多学科问题上具有普适性, 在滨螺的形态分析中也不例外。以往, 关于腹足类的研究大多是其地理分布、种类及区系、多样性与环境等方面(谢进金, 2000; 黎道洪等, 2003; 张铭华等, 2013), 近年来, 几何形态测量学方法已大量运用于软体动物的形态关系研究, 涉及不同地域的种内分化(Leyva-Valencia et al, 2012), 种内形态渐变与亚种的形成(Miller, 2016), 野生种群与养殖种群的形态差异(Valladares et al, 2010)以及近缘种间形态分化规律研究(Minton et al, 2008; Perez, 2011)。基于形态特征的种间差异规律和亲缘关系研究正在成为进化生态学研究的重要内容, 一般认为特定的形态特征是遗传信息和环境适应中多因素交互反馈的结果(Beldade et al, 2002; Collado et al, 2014)。以滨螺为对象的近缘种形态差异规律研究, 有助于我们认识滨螺在适应潮间带环境中的体型多样性以及种间进化规律。国内对于螺类的遗传多样性以及生理学等方面已有一些报道(蒋湘等, 2014; 蔡岩等, 2014; 张鑫等, 2015), 也有一些腹足类形态分类方面的研究(张素萍, 2013; 孙启梦等, 2014; 张树乾等, 2016), 但大多是形态特征的基本描述以及体轴方向、壳口直径的单一测量(庆宁等, 2007)。运用几何形态测量学方法研究腹足类的形态差异以及系统发生关系在国内还不多见。
本研究采集的4种滨螺均属于滨螺科, 其基本特征为贝壳较小, 最大的壳高约30mm, 呈卵圆形或球形, 表面较粗糙, 色泽不鲜艳, 具有螺肋或颗粒状突起。壳口圆形, 完整, 厣角质, 褐色, 很薄。从外形上看4种滨螺在螺体大小和壳口上均有差异, 那么这些差异具有哪些规律, 跟潮间带环境的适应性有何关系, 彼此间亲缘关系如何, 至今不得而知。本研究运用几何形态测量学方法比较4种滨螺的螺体、壳口的形态差异, 并进一步分析其形态特征与潮间带环境适应性的关系。运用螺体特征建立4种滨螺的系统发生树, 分析其亲缘关系, 并运用特征追踪法分析螺层和螺肋的演化规律。
1 材料与方法 1.1 标本整理、图像获取作者于2013年5月至6月, 采集了浙江省大陈岛海域分布的滨螺, 将所有滨螺保存在80%的酒精溶液中。并根据滨螺的螺层、螺肋特征对其进行分类鉴定, 参考《浙江动物志(软体动物)》(蔡如星等, 1991a)和《黄渤海软体动物图志》(张素萍, 2016), 共鉴定出4种滨螺。每种滨螺选择个体完整、大小匀称的个体, 分别是粗糙滨螺(Littorina scabra Linnaeus, 1758)(20只)、短滨螺(L. brevicula Philippi, 1844)(20只)、粒结节滨螺(Nodilittorina exigua Dunker, 1860)(20只)、塔结节滨螺(N. pyramidalis Quoy and Gaimard, 1833)(30只), 共计90只。4种滨螺在潮间带上的分布情况是:粒结节滨螺主要分布在潮上带, 一般在屏蔽性海岸和开敞性海岸都有分布, 短滨螺与粗糙滨螺分布在高潮带上, 主要分布在屏蔽性海岸, 塔结节滨螺主要分布在潮上带, 在开敞性海岸多见。标本的处理过程为:首先把采集来的滨螺浸泡在80%的酒精溶液中处死; 再将处理好的滨螺进行分类、排序、编号; 按照顺序将滨螺固定于橡皮泥之上, 保证每个滨螺的拍摄体位一致(橡皮泥柔软, 有黏性, 可以有效固定滨螺的体位)。运用尼康5100单反相机进行拍照。具体操作步骤为:首先连接设备, 保证各设备正常工作, 打开照明设备, 为拍摄过程提供充足光线。然后把相机调整为微距拍摄, 并固定焦距。所有标本都在同一模式下拍摄。最后将拍摄好的照片保存备用。
1.2 数据的标准化处理用TPSdig2软件(Rohlf, 2006)分别对每种滨螺的壳口及螺体进行数字化标点, 即地标志点(Landmark, LM), 壳口用LMa来表示, 共标记10个点(图 1)。螺体用LMb来表示, 共标记10个点(图 2), 分别来描述壳口和螺体的形状。壳口的10地标志点的设定依据为: LMa1为螺的壳口外缘与体螺层交点, 即壳口的起始点, LMa2为过螺的壳顶方向作垂线, 与壳口下边缘外缘的交点。LMa3为滨螺的螺轴回旋处, LMa4至LMa7是将LMa1和LMa2之间进行等分, 为半标点(Semi-landmark), LMa8和LMa9是将LMa2和LMa3之间进行等分, 为半标点, LMa10是LMa3和LMa1之间的中点, 为半标点。螺体的10个标志点设定依据为: LMb1为螺的壳顶, LMb2和LMb3为体螺体层之上第三层宽度, LMb4和LMb5为体螺体层之上第二层宽度, LMb6和LMb7为体螺体层之上第一层宽度, LMb8和LMb9为体螺层的宽度, LMb10为过螺的壳顶方向做垂线与壳口外缘垂线交点。TPSdig2软件可以对多个样本进行连续标记, 记录结果以坐标数据的形式追加保存到一个文本文件, 即每种滨螺的形态信息数据。用IMP系列软件中的Coordgen软件对每种滨螺的形态信息做叠印分析(Procrustes analysis), 通过设置基线, 壳口取LMa1和LMa2设置基线, 螺体取LMb1和LMb10设置基线, 经叠印分析, 对每个样本的地标点进行平移置中、旋转以及矫正, 从而消除个体大小、尺寸差异、旋转等因素对分析造成的影响(Rohlf, 2006), 获得基于统一坐标系的每种滨螺每个个体的形态信息、中心值以及平均形态信息。中心值(Centroid size, CS)是所有地标志点到重心点距离的平方累加值的平方根。任何标本的大小均可通过中心值的大小进行衡量。
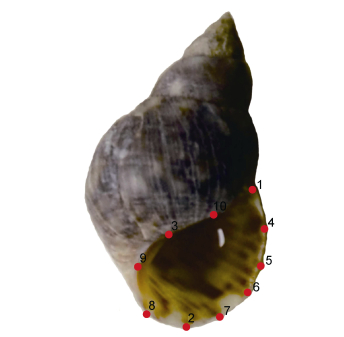 |
| 图 1 滨螺的壳口与地标志点 Fig. 1 The landmarks on the aperture of Littorina |
 |
| 图 2 滨螺的螺体与地标志点 Fig. 2 The landmarks on the body whorl of Littorina |
将以上经叠印分析的4种滨螺的每个个体的形态信息导入MorphoJ软件(Klingenberg, 2011), 对滨螺的壳口和螺体分别作主成分分析(Principal components analysis, PCA), 由所有地标志点构成的全部形态变异转换为较少数量、彼此不相关的主成分变异指标, 将由前几个主成分代表主要的形态变异信息, 分别表示为第一主成分(PC1), 第二主成分(PC2)和第三主成分(PC3)。用TPS软件的curves工具分别绘制螺体形状和壳口形状并保存为文本数据, 经格式转化后导入MorphoJ软件, 然后使用“薄片样条”法解析标志点离差(用轮廓图表示)(Thin-plate spline), 以可视化图例的方式来显示各种群在螺体和壳口形状上的差异。
将以上经叠印分析的获得4种滨螺的每个个体的壳口和螺体的中心值(CS值)导入SPSS19.0, 并进行One-way ANOVA分析, 绘制箱图, 并运用LSD法分别比较4种滨螺壳口和螺体的差异性。
本研究运用Mesquite 3.2软件(Maddison et al, 2017)对4种滨螺的螺体特征作系统发育关系研究。由MorphoJ软件获得的螺体的前3主成分得分数据(Foth et al, 2016), 导入Mesquite 3.2软件中, 运用最大简约分析法(Maximum parsimony)和贝叶斯法(MrBayes)分析, 分别构建系统发育树。运用Squared change parsimony法(Maddison, 1991), 通过祖先重建(Reconstruct ancestral states)(Schäffer et al, 2010)追踪螺层和螺肋的形成规律, 祖先特征通过离散数据表达, 4种滨螺的层数方面, 6层赋值1, 7层赋值2, 8层赋值3;螺肋方面, 具粗细不均匀螺肋赋值1, 螺肋密生赋值2, 螺肋颗粒状突起赋值2, 具体描述见表 1。
| 种类 | 螺层层数 | 螺肋特征 |
| 粗糙滨螺L. scabra | 8层(3) | 螺肋密生(2) |
| 短滨螺L.brevicula | 6层(1) | 具粗细不均匀螺肋(1) |
| 粒结节滨螺N.exigua | 6层(1) | 螺肋密生(2) |
| 塔结节滨螺N.pyramidalis | 7层(2) | 螺肋颗粒状突起(3) |
| 注:上表括号中数值为特征附值 | ||
由4种滨螺壳口的PCA分析(表 2)可知, 壳口PC1的特征值0.0029, 占总变异的31.638%, PC2的特征值为0.0023, 占总变异的25.295%, PC3特征值为0.0017, 占总变异的19.094%, 前3个成分的特征值占总变异量的76.028%, 能够说明4种滨螺壳口的主要变异规律。对第一成分、第二成分和第三成分作图(图 3)。从PCA散点图可以看出, 4种滨螺壳口形状彼此重叠, 区分不明显, 说明4种滨螺的壳口形状较为相似。
| 主成分Principal component | 特征值Eigenvalue | 占总体变异(%) Variance explained (%) | 累计总体变异(%) Cumulative variance explained (%) |
| 第一主成分(PC1) | 0.0029 | 31.638 | 31.638 |
| 第二主成分(PC2) | 0.0023 | 25.295 | 56.934 |
| 第三主成分(PC3) | 0.0017 | 19.094 | 76.028 |
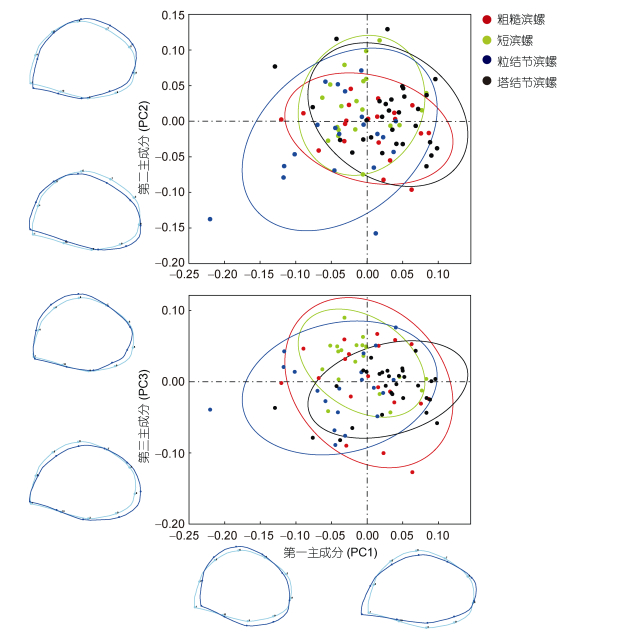 |
| 图 3 四种滨螺壳口的第一主成分、第二主成和第三主成分分析散点图 Fig. 3 The first, second and third principal component analyze scatter plots of the aperture of Littorina in four species 注:坐标轴数值为主成分系数, 薄片样条法显示的6个轮廓图分别表示壳口的每个PC的极端情况下与平均形态的差异 |
由4种滨螺螺体的PCA分析(表 3)可知, 螺体PC1的特征值为0.0014, 占总变异的32.513%, PC2的特征值为0.0008, 占总变异的17.936%, PC3特征值为0.0006, 占总变异的13.042%, 前3个成分的特征值占总变异量的63.491%, 能够说明4种滨螺螺体的主要变异规律。对第一成分、第二成分和第三成分作图(图 4), 在PC1轴上, 粗糙滨螺和塔结节滨螺主要分布在PC1的正方向, 而短滨螺主要分布在PC1负方向, 粒结节滨螺分布在中央。结合螺的轮廓图可知, 在PC1的正方向, 螺的形态为螺体沿体轴方向隆起较高(LMb1与LMb10之间), 螺层间较厚, 体螺层较窄(LMb8与LMb9之间)。在PC1的负方向, 螺的形态为螺体较短(LMb1与LMb10之间), 螺层间扁平, 体螺层较宽(LMb8与LMb9之间)。在PC2分析中, 粗糙滨螺和塔结节滨螺主要分布在PC2的正方向。粒结节滨螺主要分布在PC2负方向。短滨螺位于前两者之间。结合螺的轮廓图可知, 在PC2的正方向, 体螺层之上第一层以及体螺层之间较厚(LMb6至LMb9之间), 螺体较大。在PC2的负方向, 体螺层之上第一层以及体螺层之间较薄(LMb6至LMb9之间), 螺体较小。PC3分析中, 4种滨螺的散点分布互有重叠, 从轮廓图上可知, 差异的部位主要是体螺层的高度变化。
| 主成分Principal component | 特征值Eigenvalue | 占总体变异(%) Variance explained(%) | 累计总体变异(%) Cumulative variance explained(%) |
| 第一主成分(PC1) | 0.0014 | 32.513 | 32.513 |
| 第二主成分(PC2) | 0.0008 | 17.936 | 50.450 |
| 第三主成分(PC3) | 0.0006 | 13.042 | 63.491 |
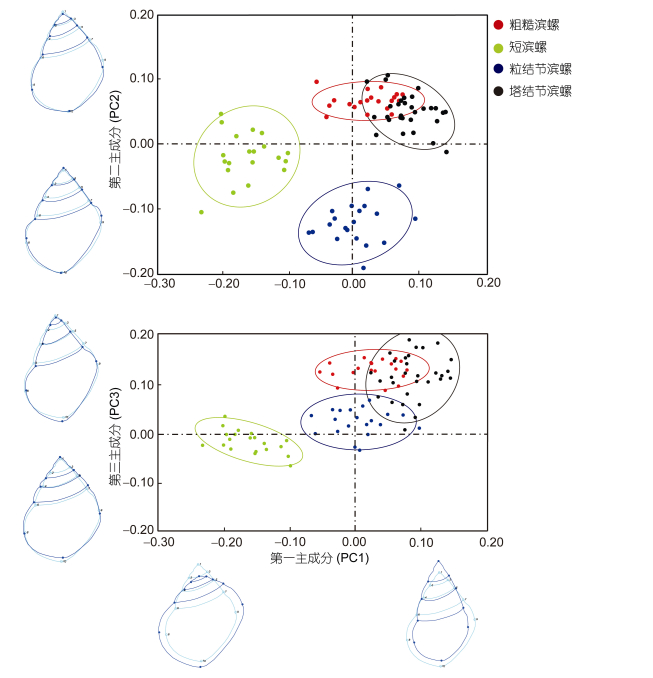 |
| 图 4 四种滨螺螺体的第一主成分、第二主成和第三主成分分析散点图 Fig. 4 The scatter plots of the first, second and third principal components of body whorl of four Littorina species 注:坐标轴数值为主成分系数, 薄片样条法显示的6个轮廓图6个轮廓图分别表示螺体的每个PC的极端情况下与平均形态的差异 |
对4种滨螺的壳口大小做One-way ANOVA分析, 结果表明4种滨螺的壳口大小存在极显著差异F(3, 90)=123.855, P < 0.001。用LSD法进一步分析, 结果表明4种滨螺的壳口大小存在极显著差异(P < 0.001)。其中短滨螺的壳口最大, 塔结节滨螺的壳口最小, 其他两种滨螺次之(见图 5)。对4种滨螺的螺体大小作One-way ANOVA分析, 结果表明4种滨螺的螺体大小存在极显著差异F(3, 90)=24.238, P < 0.001。用LSD法进一步比较分析, 结果表明4种滨螺中, 粗糙滨螺和粒结节滨螺之间大小差异不显著(P > 0.05), 其他几种滨螺彼此间差异极显著(P < 0.001)。其中短滨螺的螺体最大, 塔结节滨螺的螺体最小, 其他两种滨螺次之(见图 5)。
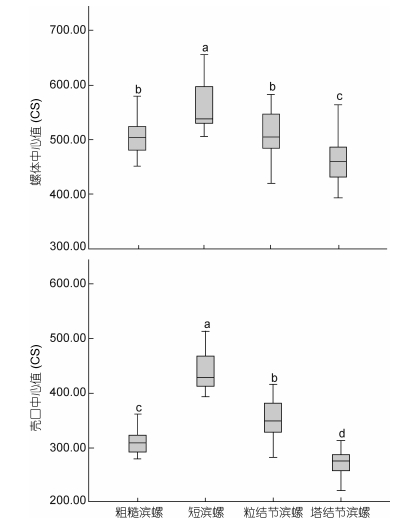 |
| 图 5 4种滨螺的螺体和壳口的中心值(CS)大小分析 Fig. 5 The size analysis of aperture and body whorl of Littorina in the Centroid size(CS) 注:图中不同字母表示差异显著(P < 0.05) |
运用最大简约法和贝叶斯法, 根据螺体特征, 建立4种滨螺的系统发育关系树。由于壳口特征在种间不稳定, 因此仅选螺体特征作系统发育分析。为了有效显示系统发育树的完整分支, 用Mesquite的修剪工具(Prune tools)去除部分重复分支, 见图 6。结果显示, 贝叶斯法和最大简约法获得的系统发育树基本相似, 主要分支一致, 粗糙滨螺和塔结节滨螺在两种算法中分支结果略有差异, 结果符合预期, 建树结果可靠。因此亲缘关系方面, 初步认为粗糙滨螺和塔结节滨螺亲缘关系最近, 皆由同一分支分出, 其次为短滨螺, 而亲缘关系最不相近的为粒结节滨螺。运用祖先特征追踪法对4种滨螺的螺层追踪可知(见图 7), 祖先种的螺层数为6层, 短滨螺和粒结节滨螺均保持其祖先螺层数6层这一特征, 后来分别演化出塔结节滨螺的螺层数7层和粗糙滨螺的螺层数8层。对4种滨螺的螺肋追踪可知, 祖先种为螺肋密生特征, 粒结节滨螺和粗糙滨螺保持祖先种的螺肋密生特征, 后来演化出短滨螺粗细不均匀的螺肋和塔结节滨螺的螺肋具颗粒状突起这些特征。
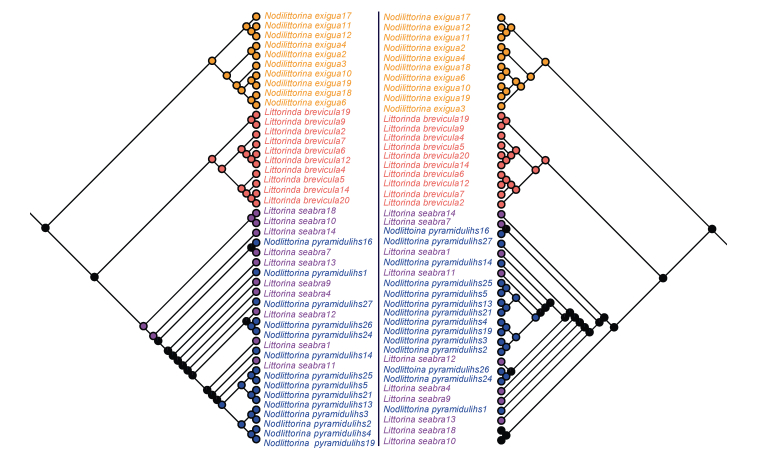 |
| 图 6 运用贝叶斯法(左)和最大简约法(右)基于螺体形态信息建立4种滨螺的系统发育树 Fig. 6 Using MrBayes method (left) and Maximum parsimony method (right) based on body whorl to construct phylogenetic trees of four species of Littorina 注:图中用相同颜色拉丁名和分支颜色代表同一种类 |
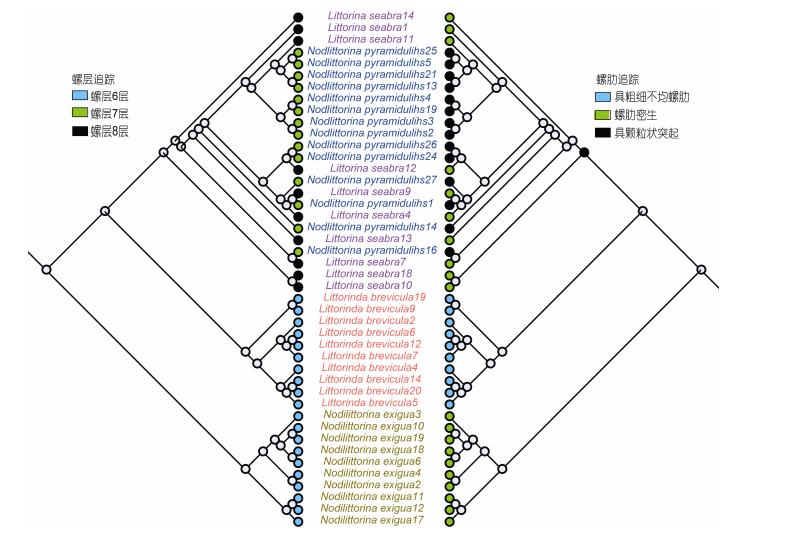 |
| 图 7 运用螺体特征建树(最大简约法)与体螺层、螺肋的特征追踪 Fig. 7 The phylogenetic trees (Maximum parsimony)of body whorl of Littorina and tracking characteristics of body whorl and ribs 注:图中相同颜色拉丁名代表同一种类 |
几何形态测量学方法在腹足类的形态研究中还处于初步阶段。Johnston(1991)认为在螺类的研究中地标点应沿着螺体的体轴方向选取, 且只在某些腹足类中有效。而另外一些研究则认为(Stone, 1998; Guralnick et al, 2001)地标点的选取应从螺层之间选择, 用地标点距离来表示螺层的高度和宽度, 其研究内容主要为螺的个体发育方面。本研究的目的是比较几种近缘种滨螺的形态关系, 因此在选择地标点时既考虑到螺体的体轴方向(LMb1和LMb10之间), 也考虑到螺层之间的关系(LMb2, LMb3, …LMb9之间)。另外考虑到不同滨螺在潮间带上的适应能力, 对其壳口的形态也作了分析。
根据已有的研究成果(易建生等, 1988; 尤仲杰, 1990), 在浙江省大陈岛海域, 4种滨螺在潮间带上分布规律表现为:短滨螺的分布区域最为广泛, 其分布区域可以延伸至中潮带, 粗糙滨螺的分布也能到达中潮带, 粒结节滨螺和塔结节滨螺则只分布在高潮带上。本研究运用PCA法分析4种滨螺的形态发现, 粗糙滨螺和塔结节滨螺形态关系较近, 总体上表现为螺层间较窄, 较厚, 螺体沿体轴方向隆起较高。短滨螺其螺层间较宽, 较薄, 螺体沿体轴方向隆起较低。粒结节滨螺的体型鉴于粗糙滨螺和短滨螺之间, 主要是体螺层上的差异。壳口的形状在几种滨螺间无明显差异。Connell等(1975)指出生物在潮间带的分布区域, 上限取决于该种生物对各种物理环境的耐受能力, 下限取决于种间的空间竞争以及该种生物抵抗敌害生物捕食的能力。潮间带生物分布的高度决定于水的损失速率和有机体再次被潮水淹没而重新获得失去水分所需时间两者之间的关系(Connell, 1972)。滨螺生活于潮间带的高潮带, 耐受高温和干燥的能力, 直接影响它们的生存(薛钦昭, 1992)。逃避和改变自身结构是其基本生存策略。短滨螺的体型较扁, 相较于其他滨螺更能经受潮水的拍击, 而塔结节滨螺螺体高耸, 减少了受热面, 在干燥环境中的耐受力更强。粗糙滨螺和粒结节滨螺则可通过适应潮汐节律, 采用逃避策略来减少不良环境的压力。因此, 滨螺的体型特征与其分布的潮间带区域密切有关, 如螺体面积较大的短滨螺分布区可延伸至中潮带, 螺体面积较小的塔结节滨螺仅分布在高潮带。然而一些种类的体型特征与分布区域并无直接关系, 这些种类可通过逃避等手段来充分适应潮间带环境。
传统的测量方法大多通过测定螺体高度、宽度、螺层厚度等指标来说明不同种类间的差异, 然而这些指标相互间独立, 缺乏整体性(吴帆等, 2013), 不能有效说明螺体形状的差异。本研究中运用的几何形态测量学方法从螺的大小(中心值的大小)和形态(螺体和壳口)方面说明几种滨螺的差异性。几何形态测量法是将研究对象的结构转化为二维或三维坐标系中的点阵, 并将对象的形状作为整体进行比较以获得形态差异的多变量分析方法(Adams et al, 2004; Rochette et al, 2007; 白明等, 2014)。该方法克服了早期形态测量分析仅依靠线性距离、相对面积、角度等指标来描述螺类个体差异的缺点, 通过对不同地标志点的量化信息的整合, 能够更准确地借助数据再现螺类的整体轮廓, 并且显示个体间微小的差异。在螺类的形态研究中, 几何形态测量学获得的形态指标更能有效的说明生物体结构上的多样性变化。本研究中对4种滨螺螺体和壳口的PCA分析可知, 螺体的形状可以有效区分4种滨螺, 而壳口则无法有效区分。说明滨螺在适应潮间带的环境中, 壳口在抗外力和运动中可能具有相似的行为和功能。因此将壳口作为几种滨螺的分类指标是无效的。4种滨螺中壳口和螺体的中心值表现为短滨螺最大, 塔结节滨螺最小, 其他两种滨螺次之, 这一结果与传统方法测得的滨螺大小所得结果较为一致(蔡如星等, 1991b)。而且壳口和螺体的中心值的大小表现出一致规律, 即较大的螺体, 也具有较大的壳口, 体现螺类局部与整体按比例变化, 即局部与整体相统一的特点。
本研究借鉴许多成熟的研究方法(Klingenberg et al, 2010; Smith et al, 2013; Foth et al, 2016), 根据螺体的形态的信息建立4种滨螺的系统发育关系。从系统发育树可知, 粗糙滨螺与塔结节滨螺的亲缘关系最为相近, 其次为短滨螺, 粒结节滨螺与其他几种滨螺的分支较早, 亲缘关系最远。该结果与滨螺螺体的主成分差异分析结果基本相近, 即螺体形态差异越大, 亲缘关系越远。从分子的角度看, Reid(2012)依据分子建树法, 运用核糖体RNA和细胞色素氧化酶研究全世界147种滨螺的系统发育关系发现, 粗糙滨螺与塔结节滨螺亲缘关系最近, 其次为短滨螺, 由于粒结节滨螺主要分布在中国沿海, 在外文文献中未涉及, 这与本研究由形态数据所验证的亲缘关系基本一致, 说明该4种滨螺演化过程中, 外部形态结构与遗传结构是同步发展。本研究运用祖先特征追踪法分别追踪螺层和螺肋特征在螺体上的形成规律, 结果表明螺层特征和螺肋特征与螺体的形成过程同步, 说明滨螺的螺层数与螺肋特征不仅能作为其物种的分类特征, 而且能反映出物种的系统发育关系。本研究未对滨螺的壳口作系统发育分析, 尽管壳口在螺类的生存中占据重要地位, 但是不同种类滨螺间壳口没有规律性差异, 也不具有系统发育的信息。
几何形态测量学方法已经被大量运用于腹足类的形态研究(Leyva-Valencia et al, 2012; Miller, 2016), 并以此为基础进一步开展形态的系统发育关系研究。在形态结构的分析中特别强调结构的同源性, 因此无论是形态差异分析, 还是基于形态特征的系统发育关系分析, 结构的同源性是分析的基础(Bai et al, 2016)。分析中使用的软件容易操作, 与传统的测量相比该方法省时、高效, 特别是能有效分析生物体形状的多样性变化。此外, 几何形态测量学方法作为形态定量比较的科学计算工具, 既能发现不同螺类种群间形态上微小的差异, 同时能够充分认识螺体形状的变化规律。它代表了腹足类分类学研究和系统进化研究一个全新的发展方向。
4 结论运用几何形态测量学方法量化分析4种滨螺在壳口和螺体上的差异性, 并根据螺体特征建立4种滨螺的系统发育关系。从外形上看, 滨螺在壳口上存在一些差异, 然而主成分分析结果表明这种差异不具有规律性。说明滨螺种内个体间壳口的形状不稳定, 可能随环境变化或生存竞争而发生改变。主成分分析结果表明螺体特征在不同滨螺间存在明显差异, 结合TPS分析可知, 4种滨螺间螺体特征的差异主要发生在体螺层上, 体螺层的高度和宽度在不同滨螺间差异明显。运用最大简约法根据螺体的形态的信息建立4种滨螺的系统发育关系。从系统发育树可知, 粗糙滨螺与塔结节滨螺的亲缘关系最近, 其次为短滨螺, 粒结节滨螺与其他几种滨螺的分支较早, 亲缘关系最远, 该结果与已有的分子方面的研究结果较一致, 说明滨螺的演化中, 其外部形态结构与内部分子结构同步发展。运用祖先特征追踪法分别追踪螺层和螺肋特征在螺体上的形成规律, 研究结果表明螺层特征和螺肋特征与螺体的形成过程同步, 将螺层和螺肋特征作为滨螺种间分类依据是可靠的。
| 尤仲杰, 1990. 浙江沿海滨螺科的生态学研究. 动物学杂志, 25(4): 1–6 |
| 白明, 杨星科, 2007. 几何形态测量法在生物形态学研究中的应用. 昆虫知识, 44(1): 143–147 DOI:10.3969/j.issn.0452-8255.2007.01.035 |
| 白明, 杨星科, 李静, 等, 2014. 几何形态学:关于形态定量比较的科学计算工具. 科学通报, 59(10): 887–894 |
| 刘武, ClarkeR, 邢松, 2010. 湖北建始更新世早期人类牙齿几何形态测量分析. 中国科学:地球科学, 40(6): 724–736 |
| 孙启梦, 张树乾, 张素萍, 2014. 中国近海蟹守螺科(Cerithiidae)两新纪录种及常见种名修订. 海洋与湖沼, 45(4): 902–906 |
| 庆宁, 林岳光, 张宝, 2007. 广西防城港玉石滩滨螺的分布和数量初步调查. 热带海洋学报, 26(3): 68–71 DOI:10.3969/j.issn.1009-5470.2007.03.012 |
| 闫宝荣, 花保祯, 2010. 几何形态测量学及其在昆虫分类学和系统发育中的应用. 昆虫分类学报, 32(4): 313–320 |
| 吴帆, 赵鑫, 李海云, 等, 2013. 福寿螺表型性状的相关性及2种壳色福寿螺表型性状的差异性分析. 华南农业大学学报, 34(2): 254–257 |
| 张鑫, 蔡秀红, 黄贻涛, 等, 2015. 杂色鲍(Haliotis diversicolor)硒结合蛋白1基因的克隆及其应激表达. 海洋与湖沼, 46(2): 454–462 |
| 张树乾, 张素萍, 2016. 中国近海蛾螺科(Gastropoda: Buccinidae)种类齿舌的扫描电镜观察. 海洋与湖沼, 47(2): 414–421 |
| 张素萍, 2013. 中国海织纹螺属Nassarius(腹足纲, 织纹螺科)两新记录种. 海洋与湖沼, 44(3): 814–816 |
| 张素萍, 张均平, 陈志云, 等, 2016. 黄渤海软体动物图志. 北京: 科学出版社, 1-421 |
| 张铭华, 徐亮, 谢广龙, 等, 2013. 鄱阳湖流域淡水贝类物种多样性、分布与保护. 海洋科学, 37(8): 114–124 |
| 易建生, 李复雪, 1988. 福建九龙江口滨螺的分布及数量变化. 海洋学报, 10(4): 492–500 |
| 蒋湘, 刘建勇, 赖志服, 2014. 九孔鲍(Haliotis diversicolor supertexta)耐低盐与生长性状的遗传参数评估. 海洋与湖沼, 45(3): 542–547 |
| 谢进金, 2000. 福建崇武潮间带滨螺科的生态研究. 泉州师范学院学报, 18(4): 40–44 DOI:10.3969/j.issn.1009-8224.2000.04.012 |
| 蔡岩, 周永灿, 冯永勤, 等, 2014. 法螺(Chanoria tritonis)染色体核型分析. 海洋与湖沼, 45(6): 1324–1329 |
| 蔡如星, 郑锋, 王彝豪, 等, 1991b. 舟山潮间带生态学研究Ⅱ.数量及其分布. 东海和海洋, 9(3): 58–72 |
| 蔡如星, 黄惟灏, 1991a. 浙江动物志-软体动物. 浙江科学技术出版社, 1-486 |
| 黎道洪, 陈德牛, 罗泰昌, 等, 2003. 贵州洞穴螺类的物种多样性及分布初步研究. 中国岩溶, 22(3): 212–218 DOI:10.3969/j.issn.1001-4810.2003.03.007 |
| 薛钦昭, 1992. 青岛岩相潮间带短滨螺种群动态的研究. 海洋与湖沼, 23(4): 438–444 |
| Adams D C, Rohlf F J, Slice D E, 2004. Geometric morphometrics: ten years of progress following the "revolution". Italian Journal of Zoology, 71(1): 5–16 DOI:10.1080/11250000409356545 |
| Bai Y, Dong J J, Guan D L et al, 2016. Geographic variation in wing size and shape of the grasshopper Trilophidia annulata (Orthoptera: Oedipodidae): morphological trait variations follow an ecogeographical rule. Scientific Reports, 6: 32680. https://doi.org/10.1038/srep32680 |
| Beldade P, Koops K, Brakefield P M, 2002. Developmental constraints versus flexibility in morphological evolution. Nature, 416(6883): 844–847 DOI:10.1038/416844a |
| Carvajal-Rodríguez A, Conde-Padín P, Rolán-Alvarez E, 2005. Decomposing shell form into size and shape by geometric morphometric methods in two sympatric ecotypes of Littorina Saxatilis. Journal of Molluscan Studies, 71(4): 313–318 DOI:10.1093/mollus/eyi037 |
| Chapman M G, 1994. Small-scale patterns of distribution and size-structure of the intertidal littorinid Littorina unifasciata (Gastropoda: Littorinidae) in New South Wales. Australian Journal of Marine and Freshwater Research, 45(4): 635–652 DOI:10.1071/MF9940635 |
| Collado G A, Salinas H F, Méndez M A, 2014. Genetic, morphological, and life history traits variation in freshwater snails from extremely high environments of the Andean Altiplano. Zoological Studies, 53(1): 14 DOI:10.1186/1810-522X-53-14 |
| Conde-Padín P, Grahame J W, Rolán-Alvarez E, 2007. Detecting shape differences in species of the Littorina Saxatilis complex by morphometric analysis. Journal of Molluscan Studies, 73(2): 147–154 DOI:10.1093/mollus/eym009 |
| Connell J H, 1972. Community interactions on marine rocky intertidal shores. Annual Review of Ecology and Systematics, 3(1): 169–192 DOI:10.1146/annurev.es.03.110172.001125 |
| Connell J H, Diamond J M, 1975. Ecology and Evolution of Communties. Cambridge: Harvard University Press, |
| Foth C, Ezcurra M D, Sookias R B, et al, 2016. Unappreciated diversification of stem archosaurs during the Middle Triassic predated the dominance of dinosaurs. BMC Evolutionary Biology, 16(1): 188 DOI:10.1186/s12862-016-0761-6 |
| Guralnick R P, Kurpius J, 2001. Spatial and temporal growth patterns in the phenotypically variable Littorina saxatilis: surprising patterns emerge from chaos. In: Zeldich M ed. Beyond heterochrony. New York: John Wiley and Sons, 195-228 |
| Johnston M R, Tabachnick R E, Bookstein F L, 1991. Landmark-based morphometrics of spiral accretionary growth. Paleobiology, 17(1): 19–36 DOI:10.1017/S0094837300010320 |
| Klingenberg C P, Gidaszewski N A, 2010. Testing and quantifying phylogenetic signals and homoplasy in morphometric data. Systematic Biology, 59(3): 245–261 DOI:10.1093/sysbio/syp106 |
| Klingenberg C P, 2011. Morphoj: an integrated software package for geometric morphometrics. Molecular Ecology Resources, 11(2): 353–357 DOI:10.1111/men.2011.11.issue-2 |
| Leyva-Valencia I, Álvarez-Castañeda S T, Lluch-Cota D B, et al, 2012. Shell shape differences between two Panopea species and phenotypic variation among P. Globosa at different sites using two geometric morphometrics approaches. Malacologia, 55(1): 1–13 DOI:10.4002/040.055.0101 |
| Maddison W P, 1991. Squared-change parsimony reconstructions of ancestral states for continuous-valued characters on a phylogenetic tree. Systematic Zoology, 40(3): 304–314 DOI:10.2307/2992324 |
| Maddison W P, Maddison D R, 2017. Mesquite: a modular system for evolutionary analysis. Version 3.2. Available at: http://mesquiteproject.org/ |
| Miller J P, 2016. Geometric morphometric analysis of the shell of Cerion mumia (Pulmonata: Cerionidae) and related species. Folia Malacologica, 24(4): 239–250 DOI:10.12657/folmal.024.020 |
| Minton R L, Norwood A P, Hayes D M, 2008. Quantifying phenotypic gradients in freshwater snail body: a case study in Lithasia (Gastropoda: Pleuroceridae). Hydrobiologia, 605(1): 173–182 DOI:10.1007/s10750-008-9332-1 |
| Perez K E, 2011. A new species of Praticolella (Gastropoda: Polygyridae) from northeastern Mexico and revision of several species of this genus. Nautilus Greenville then Sanibel, 125(3): 113–126 |
| Reid D G, Dyal P, Williams S T, 2012. A global molecular phylogeny of 147 periwinkle species(Gastropoda, Littorininae). Zoologica Scripta, 41(2): 125–136 DOI:10.1111/j.1463-6409.2011.00505.x |
| Rochette R, Doyle S P, Edgell T C, 2007. Interaction between an invasive decapod and a native gastropod: predator foraging tactics and prey architectural defenses. Marine Ecology Progress Series, 330: 179–188 DOI:10.3354/meps330179 |
| Rohlf F J, 2006. TpsDig2, Digitize Landmarks and Outlines. Version 2.10. Stony Brook, NY: State University of New York |
| Schäffer S, Koblmüller S, Pfingstl T, et al, 2010. Ancestral state reconstruction reveals multiple independent evolution of diagnostic morphological characters in the "Higher Oribatida" (Acari), conflicting with current classification schemes. BMC Evolutionary Biology, 10(1): 246 DOI:10.1186/1471-2148-10-246 |
| Smith U E, Hendricks J R., 2013. Geometric morphometric character suites as phylogenetic data: extracting phylogenetic signal from gastropod shells. Systematic Biology, 62(3): 366–385 DOI:10.1093/sysbio/syt002 |
| Stone J R, 1998. Landmark based thin plate spline relative warp analysis of gastropod shells. Systematic Biology, 47(2): 254–263 DOI:10.1080/106351598260905 |
| Valladares A, Manríquez G, Suárez-Isla B A, 2010. Shell shape variation in populations of Mytilus chilensis (Hupe 1854) from southern Chile: a geometric morphometric approach. Marine Biology, 157(12): 2731–2738 DOI:10.1007/s00227-010-1532-3 |
| Zieritz A, Aldridge D C, 2009. Identification of ecophenotypic trends within three European freshwater mussel species (Bivalvia: Unionoida) using traditional and modern morphometric techniques. Biological Journal of the Linnean Society, 98(4): 814–825 DOI:10.1111/j.1095-8312.2009.01329.x |
 2018, Vol. 49
2018, Vol. 49


