中国海洋湖沼学会主办。
文章信息
- 李兆钦, 李欣, 孙利元, 刘子洲, 顾艳镇, 翟方国, 李培良. 2019.
- LI Zhao-Qin, LI Xin, SUN Li-Yuan, LIU Zi-Zhou, GU Yan-Zhen, ZHAI Fang-Guo, LI Pei-Liang. 2019.
- 刘公岛海洋牧场底层海水溶解氧浓度的变化特征
- ANALYSIS OF THE TEMPORAL VARIATIONS OF DISSOLVED OXYGEN CONCENTRATION IN SEAWATER IN THE BOTTOM OF THE LIUGONG ISLAND MARINE PASTURE
- 海洋与湖沼, 50(1): 86-99
- Oceanologia et Limnologia Sinica, 50(1): 86-99.
- http://dx.doi.org/10.11693/hyhz20180300062
-
文章历史
- 收稿日期:2018-03-23
- 收修改稿日期:2018-04-11
2. 山东省潍坊市海洋环境监测中心站 潍坊 261000;
3. 山东省水生生物资源养护管理中心 烟台 264000
2. Weifang Marine Environment Monitoring center station in Shandong Province, Weifang 261000, China;
3. Shandong Hydrobios Resources Conservation and Management Center, Yantai 264000, China
海水中的溶解氧是反映生物生长状况和环境质量状况的重要指标, 是研究海洋中各种物理、生物和化学过程的重要参数(张莹莹等, 2007)。当海水溶解氧的日平均值小于3mg/L或者是24小时之内的任何观测值小于1mg/L时, 就认为出现低氧现象(Nezlin et al, 2009)。自从20世纪50年代第一次低氧事件报道以来, 低氧区域扩展迅速并成为世界性的生态问题(Diaz, 2001)。当低氧事件发生时, 海洋生物尤其是海洋鱼类的存活率会大幅降低, 海洋生态系统的平衡受到严重威胁(Shimps et al, 2005)。因为鱼类和海洋生物能够探查并主动回避低氧水体, 所以一旦发生低氧事件, 相应海域的渔获量就会受到严重影响(Pihl et al, 1991)。因此在跨学科的研究中, 海水溶解氧含量的时空分布特征及其影响过程受到越来越多的关注(Zhang et al, 2010)。
低氧现象主要可分为自然和人为形成两种情况(顾孝连等, 2009)。自然形成的低氧现象多发于夏季, 主要是由于夏季形成季节性温跃层阻断了溶解氧的垂向输运, 生物呼吸作用和有机物分解耗氧所造成(Yin et al, 2004; Ni et al, 2016)。人为形成的低氧区主要是由于海洋污染物增多引起海水富营养化使浮游植物激增, 浮游植物死亡后在海底分解消耗掉大量氧气从而加剧了低氧的形成, 这是近年来低氧现象频发的主要原因(Wei et al, 2007)。除此之外, 全球变暖与低氧区的形成也有一定的关系, 大气中二氧化碳的增加和气候变化与海洋生态系统中溶解氧含量的同步变化有关, 可能会对低氧效应产生潜在的影响(Doney et al, 2012)。
我国低氧区多集中在珠江口、长江口以及渤海海域。Zhang等(2010)研究了夏季物理和生物过程对珠江口溶解氧收支的影响, Wang(2009)根据长时间序列的季节数据对长江口自20世纪50年代后期以来的低氧现象进行了研究。江涛等(2016)研究表明2014年8月渤海中部海域出现低氧区。山东半岛附近海域也存在显著的低氧现象。2002年莱州湾小清河入海口由于河口富营养化出现低氧区, 2009年夏季乳山湾发现季节性低氧区(孟春霞等, 2005; 冉祥滨等, 2012)。
对于山东近海及周边海域海水溶解氧的时空分布前人也做了许多工作。顾宏堪(1980)研究表明黄海溶解氧浓度在垂向上存在极大值的现象。宋国栋等(2007)研究表明影响黄海外海海域溶解氧分布的主要因素为温度和盐度; 影响近岸溶解氧分布的主要因素是温度, 与盐度无关。辛明等(2013)分析了黄海溶解氧的平面分布特征, 表明各季节水体溶解氧水平和垂向分布不同; 春季溶解氧含量最高, 秋季含量最低。刘春利等(2017)结合1960至1997年的黄海表层溶解氧数据, 研究了不同时期溶解氧的时空变化规律, 结果表明表层溶解氧的月平均值3月份最高, 8月份最低, 各季节含量为春季>冬季>夏季>秋季。
尽管前人对渤海和黄海海域海水溶解氧的时空分布特征已经有了一定了解, 但是目前基于定点连续长时间观测的溶解氧研究很少, 溶解氧连续的时间变化及其影响机制尚不清楚。前人对于海水溶解氧的研究以采样数据为主, 精度较低, 不能进行连续观测, 无法对海水溶解氧的日变化规律以及变化幅度的研究。2015年山东省全面启动海洋牧场观测网项目, 实现海洋牧场生态环境的长期连续监控, 获得了山东沿海十多个海洋牧场的海洋环境要素实时高频数据(孟鑫等, 2017)。本文基于刘公岛海洋牧场有缆实时在线观测系统于2016年7月20日至2017年3月14日期间所获数据, 研究了底层海水溶解氧的多时间尺度变化特征, 结合温度以及风速数据对影响海水溶解氧浓度变化的因素进行了讨论, 为进一步研究山东近海溶解氧变化特征提供参考。
1 数据和方法 1.1 数据2016年7月在刘公岛海洋牧场内布放了一套生态环境实时在线观测系统, 布放位置离岸约2 km, 水深约为19.8 m(图 1)。该观测系统的水下观测平台集成安装了Hydrocat CTD温盐深仪和ROS C600海底高清彩色摄像机; 前者可连续实时观测海水的温度、电导率、压强和海水溶解氧浓度(Dissolved Oxygen Concentration, O2), 后者在水下光源辅助下可实时监控水下生物的活动状况。温度的初始精度为±0.002℃, 分辨率为0.0001℃; 电导率的初始精度为±0.0003S/m, 分辨率为0.00001S/m; 压强精度为全量程的0.1%, 分辨率为0.002%;溶解氧浓度量程为120%饱和度, 测量精度为±2%饱和度, 仪器的各项参数在部署之前都进行了校准。利用观测数据计算观测处海水的盐度和深度。CTD温盐深仪的观测时间间隔为1min。本文选取2016年7月20日至2017年3月14日期间的数据进行分析, 共计238天。
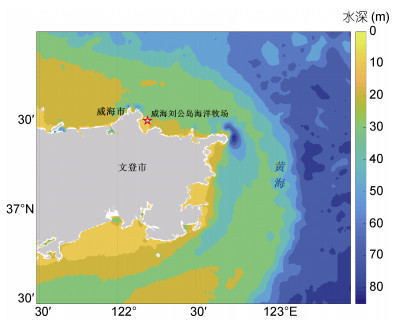 |
| 图 1 刘公岛海洋牧场周围地形图 Fig. 1 Topography around the Liugong Island marine pasture 注:图中红色星号表示观测点 |
为了探讨影响海水溶解氧浓度随时间变化的主要过程和因素, 本文还采用了欧洲中期天气预报中心(European Centre for Medium-Range Weather Forecasts; ECMWF)提供的Interim再分析资料(Dee et al, 2011)。本文主要使用的变量是海面10m高度风和海表面温度, 空间分辨率为0.125°×0.125°, 时间间隔为6小时, 时间范围为2016年7月20日至2017年3月14日, 通过双线性插值得到观测系统布放处的海面风和海表面温度时间序列。
1.2 溶解氧相关参数计算海水饱和溶解氧浓度(O2S, 单位为mg/L)是指当水体与大气中氧交换达到平衡时水中溶解氧的浓度。海水中饱和溶解氧浓度随着水体的温度、压强和盐度变化(Weiss, 1970)。本文采用Garcia等(1992)改进过的饱和溶解氧计算公式:
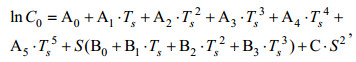 (1)
(1)式中, C0表示氧在海水中的饱和浓度, 单位为mL/L; S表示实测海水盐度; Ts表示温度转换系数:
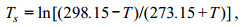 (2)
(2)T表示实测海水温度, 单位℃; A、B、C为经验常数, 其数值分别为:
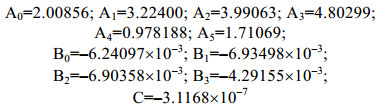
接下来对饱和溶解氧进行单位换算得到Osat(mg/L), 公式如下:
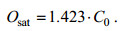 (3)
(3)下面根据USGS (United States Geological Survey) No. 81.11对Osat进行压力订正, 订正公式如下:
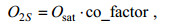 (4)
(4)其中co_factor为订正系数, 需要用到水深H, 公式如下:
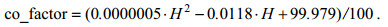 (5)
(5)海水溶解氧饱和度(saturation percentage, p)计算公式如下:
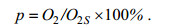 (6)
(6)p不仅可以帮助预测低氧的发生, 而且对于水产养殖有重要的参考价值, p过低时海水易发生低氧现象, 鱼类和海洋生物会主动回避氧饱和度低的水域(Wannamaker et al, 2000)。
表观耗氧量(apparent oxygen utilization, AOU)计算公式如下:
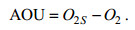 (7)
(7)AOU用来描述生物耗氧过程:当AOU < 0时, 表示海水中的溶解氧处于过饱和状态; AOU > 0表示海水中的溶解氧处于不饱和状态。底层AOU的变化可以反映有机物的分解耗氧情况以及呼吸作用耗氧情况(Zhu et al, 2016; 石强, 2016), AOU越大, 耗氧越多。
2 时间变化 2.1 总体特征图 2展示了观测期间刘公岛海洋牧场溶解氧浓度原始数据的时间序列。在整个观测期间, 海水溶解氧浓度约为4.71—11.07mg/L, 平均值、方差和标准差分别为8.45mg/L、3.54mg/L和1.88mg/L。
 |
| 图 2 观测期间O2(mg/L)时间序列 Fig. 2 Time series of the O2(mg/L) during the observation period |
通过图 2可以看出, 观测期间海水溶解氧浓度变化呈现出多时间尺度特征, 包含高频的日变化以及低频的月变化和季节变化, 其中季节变化规律最为显著。海水溶解氧浓度从7月份到8月呈现出波动下降的趋势, 并于8月14日出现最低值4.71mg/L, 8月份到次年2月中旬则呈现波动上升的趋势, 并于2月11日出现最高值11.07mg/L, 2月中旬之后又逐渐减小。
2.2 逐月变化与季节变化图 3给出了观测期间海水溶解氧浓度的小时平均、日平均、月平均以及季节平均时间序列。其中2016年7月和2017年3月的月平均值分别只利用当月下旬和上半月的数据计算得到。此外整个观测期间春季只有3月上半月的观测数据, 所以图 3c并未给出春季的平均值。
 |
| 图 3 观测期间O2(mg/L)的小时平均、日平均(a), 月平均(b)和季节平均(c)等时间序列图。 Fig. 3 The time series of the hourly and daily means (a), monthly mean (b) and seasonal mean (c) of the O2(mg/L) during the observation period 注:子图(a)中黑色线和红色线分别代表小时平均和日平均时间序列; 子图(b)中蓝色实线代表年平均值, 黑色数字表示月平均值; 子图(c)中黑色数字表示季节平均值 |
通过图 3可以看出海水溶解氧浓度在不同时间尺度的变化。对于月平均变化, 海水溶解氧浓度从2016年7月至8月降低, 8月至2017年2月逐渐升高, 从2017年2月至3月又降低。图 3b中蓝色线代表观测期间的平均值, 为8.45mg/L。观测期间大于平均值的有2016年12月和2017年1月至3月中上旬, 其余月份均小于平均值。其月平均值于8月最低、约为5.91mg/L, 而于2月最高、约为10.83mg/L。刘春利等(2017)基于1960—1997年间的黄海表层溶解氧数据指出, 黄海区域平均的表层海水溶解氧浓度于3月最高、约为9.61 mg/L, 而于8月最低、约为6.73mg/L, 与本文结果基本一致。但是两者最高值发生的月份稍有不同, 这可能与观测时间不同、区域或观测深度不同等因素有关。
对于季节变化, 刘公岛海洋牧场观测的底层海水溶解氧浓度从夏季到冬季逐渐升高。而刘春利等(2017)的研究结果显示, 刘公岛海洋牧场区域的表层海水溶解氧浓度夏季大于秋季, 与本文中底层的观测结果不同。这可能与夏季季节性温跃层较强有关。海洋表层海水可以通过风的搅拌、波浪的破碎等过程与大气相互作用获得氧气, 但是海洋内部的氧气只能通过浮游植物的光合作用、海流的垂向输运和湍流过程引起的垂向混合等补充。在夏季, 由于上层海水升温快, 而且海表面风较弱(陈国光等, 2016), 海水的垂向混合比较弱, 导致海表和海底的温差比较大, 垂向分层明显, 从而将富氧的表层水和贫氧的底层水分开, 限制了氧气的垂向交换, 再加上底层生物呼吸作用和沉积物分解作用等耗氧过程(Zhu et al, 2016), 进一步导致底层海水溶解氧含量降低。
2.3 日变化特征利用小时平均的海水溶解氧数据, 计算得到各月平均的日变化曲线, 如图 4所示。可以看出, 不同月份中海水溶解氧浓度的日变化并不相同, 其极大值对应不同时刻。说明在不同季节中, 海水溶解氧浓度日变化的主导因素并不相同(Li et al, 2018)。
 |
| 图 4 各月平均的海水溶解氧日变化(mg/L) Fig. 4 The monthly mean daily time series of the O2(mg/L) |
根据白天期间O2的变化特征, 本文将不同月份的日变化分为三类:第一类为2016年8—10月和2017年3月, 海水溶解氧浓度以升高为主; 第二类为2016年7月和2017年1—2月, 海水溶解氧浓度以降低为主; 第三类为2016年11月和12月, 海水溶解氧浓度变化幅度较小。第一种类型的海水溶解氧浓度极大值发生在18时左右, 这主要是因为白天时浮游植物生命活动比较活跃, 可通过光合作用产生大量氧气(Koko et al, 2017)。第二种类型的海水溶解氧浓度极大值发生在凌晨。第三种类型的海水溶解氧浓度极大值在白天和晚上都存在。表 1给出了不同月份里, 海水溶解氧浓度日变化的最大值和最小值发生的时刻。
| 月份 | 7 | 8 | 9 | 10 | 11 | 12 | 1 | 2 | 3 |
| 极大时 | 3/17 | 16 | 20 | 18 | 10/18 | 9/13/23 | 9/22 | 9/0 | 18 |
| 极小时 | 14/20 | 10 | 8 | 1 | 1/15 | 3/11/17 | 4/15 | 2/19 | 9 |
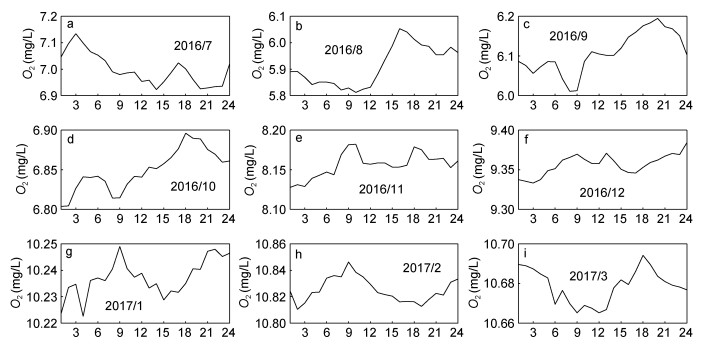
为了查看海水溶解氧浓度的变化幅度随时间的变化情况, 本文利用日平均和小时平均的海水溶解氧浓度分别计算了其月标准差和日标准差时间序列, 如图 5所示。海水溶解氧浓度的月标准差和日标准差可分别反映其每个月份的日变化强度和每日的逐小时变化强度。
 |
| 图 5 海水溶解氧浓度的月标准差(a, mg/L)和日标准差(b, mg/L)时间序列 Fig. 5 Time series of the monthly (a) and daily (b) standard deviations of the O2(mg/L) during the observation period 注:子图(b)中灰色线表示日标准差的月平均值 |
图 5a显示, 观测期间海水溶解氧浓度的月标准差呈现显著的季节变化: 2016年8月最大、约为0.42mg/L, 2017年3月最小、约为0.02mg/L, 于两者之间单调减小。这与其月平均值的时间变化特征(图 3b)相反。月标准差于夏季最大亦说明日平均海水溶解氧浓度的天气时间尺度变化过程于夏季最强。图 5b显示, 观测期间海水溶解氧浓度的日标准差也呈现显著的季节变化。其月平均值呈现与海水溶解氧浓度月标准差(图 5a)一致的季节变化, 于2016年8月最大、约为0.18mg/L, 于2017年3月最小、约为0.03mg/L, 于两者之间单调减小。这说明海水溶解氧浓度的小时变化强度和日变化强度均于2016年8月份最强。此外, 海水溶解氧浓度的日标准差还存在显著的天气时间尺度变化, 且该变化强度亦于2016年8月份时最强。观测期间海水溶解氧浓度日标准差的最高值约为0.47mg/L, 发生在2016年8月25日。
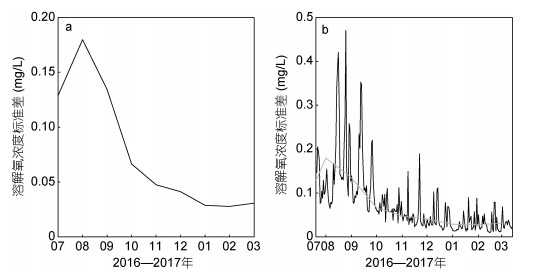
2.5 海水溶解氧饱和度分析图 6a比较了观测的O2和O2S时间序列。从图中可以看出, 在观测的大部分时间里, O2均小于O2S。而仅在2016年11月22日和2017年1月30日, O2近似等于O2S。尽管如此, 两者呈现基本一致的时间变化, 其同期相关系数约为0.99、高于95%置信度水平。与O2一样, O2S以季节变化为主:夏季最低, 约为7.55mg/L, 冬季最高, 约为10.66mg/L, 而于两者之间随时间增大。
 |
| 图 6 观测期间的O2(mg/L)、O2S(mg/L)、p(b)、日平均AOU (c, mg/L)和月平均AOU (d, mg/L)时间序列 Fig. 6 Time series of the O2(mg/L), O2S(mg/L), p(b), daily AOU (c, mg/L) and monthly AOU (d, mg/L) during the observation period 注:子图(a)中蓝色线表示观测的O2, 红色线代表O2S; 子图(c)和(d)中的红色线表示平均值 |
图 6b给出了刘公岛海洋牧场底层海水的溶解氧饱和度时间序列。在海洋表层, 由于与大气直接接触且海水混合强烈, p通常维持在100%左右; 而在海洋底层, 因为垂向层化对海水溶解氧垂向交换的阻隔等过程的影响, p通常较低。观测期间, 刘公岛海洋牧场底层海水的p约为62%—99%, 平均值为90%, 因此基本处于不饱和状态。和观测的O2类似, p也呈现较为明显的季节变化, 7月20日至8月15日波动下降, 于8月15日达到最小值62%, 之后波动增大。
图 6c和图 6d分别展示了日平均和月平均AOU时间序列。在整个观测期间, AOU的平均值为0.76mg/L, 变化范围是0—2.74mg/L。因此大部分观测期间, AOU始终是大于0的, 说明研究区域海水处于溶解氧亏损的状态, 是氧气的汇。AOU同样呈现较为明显的季节变化, 7月20日开始至8月15日波动上升, 并在8月15日达到最大值2.74mg/L, 之后波动下降。
通过图 6d还可以看出观测期间, 月平均AOU于2016年8月最大, 之后不断减小。AOU越大表示溶解氧亏损越多, 也就是说在8月份海底溶解氧的消耗最大。该季节变化与月平均海水溶解氧的季节变化(图 3b)正好相反。因此, 底层海水溶解氧虽然于夏季浓度最低, 但是其消耗却最强。
表 2进一步统计给出了底层海水溶解氧的p、AOU和海水温度在不同季节里的变化范围和平均值。通过表 2可以看出不同季节的p值是夏季 < 秋季 < 冬季 < 初春, AOU值和温度值是初春 < 冬季 < 秋季 < 夏季。因此, AOU和温度的季节变化相同, 而p和温度的季节变化相反。p和AOU的变化幅度呈现一致的季节特征, 夏季最大, 秋季次之, 冬季再次, 初春最小。
| 季节项目 | 饱和百分比(%) | AOU(mg/L) | 海水温度(℃) | |||||
| 变化范围 | 平均 | 变化范围 | 平均 | 变化范围 | 平均 | |||
| 夏季 | 62—93 | 82 | 0.55—2.92 | 1.33 | 15.97—24.94 | 21.08 | ||
| 秋季 | 72—99 | 89 | 0.13—2.01 | 0.81 | 10.27—24.56 | 19.31 | ||
| 冬季 | 93—98 | 95 | 0.23—0.67 | 0.55 | 1.73—10.26 | 4.70 | ||
| 初春 | 95—99 | 97 | 0.14—0.46 | 0.35 | 2.45—4.10 | 3.16 | ||
山东近岸海水中溶解氧浓度受到温度、盐度、季风、沿岸流和离岸流等的影响(石强, 2016)。前人研究表明, 盐度从30增至40, 仅能影响溶解氧浓度的0.7%(Garcia et al, 1992)。观测期间溶解氧浓度的变化幅度为6.36mg/L, 相比于平均溶解氧浓度的变化率达到0.75, 但是观测期间刘公岛海洋牧场盐度的变化幅度仅为1.2, 说明刘公岛海洋牧场底层海水盐度变化对溶解氧浓度变化的影响很小, 可以忽略不计。下文将分别讨论温度、水体层结、风混合以及潮汐作用等对溶解氧浓度随时间变化的影响。
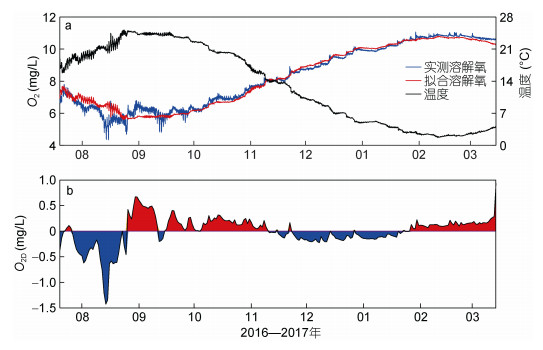
3.1 海水温度海水中氧的溶解度与温度成反比, 温度升高造成水中氧的溶解量降低; 其次, 夏季天气闷热, 气压低, 氧分压也低, 造成海水溶解氧浓度有所降低, 冬季则相反, 所以近海海洋表面的溶解氧的季节性变化与温度的季节性循环有关系(Boyer et al, 1999)。海水温度的时间序列如下图 7a中黑色线所示。
 |
| 图 7 观测期间的O2(mg/L)、O2T(mg/L)、温度(℃)、O2D(mg/L)时间序列 Fig. 7 Time series of O2(mg/L), O2T(mg/L), temperature(℃), and O2D(mg/L) 注:子图(a)中蓝色线代表O2, 红色线代表O2T, 黑色线代表温度; 子图(b)中红色部分代表O2D大于0, 蓝色部分代表O2D小于0 |
从图 7可以看出, 底层海水温度的季节性信号非常明显, 与溶解氧浓度的变化趋势相反, 2016年7月至8月下旬逐渐升高, 并于8月23日达到最大值25.2℃。2016年8月23日至2017年2月中旬逐渐降低, 并于2月11日达到最小值1.66℃。经计算, 月平均温度在9月份达到最大值24.0℃, 在2月份达到最小值2.2℃。对比图 7a中海水实测溶解氧和温度可以发现, 两者呈显著的负相关, 其同期相关系数为–0.99, 高于95%置信水平。基于海水O2与温度T之间的高度线性相关系数, 本文通过最小二乘法得到两者之间的线性关系式:
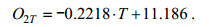 (8)
(8)图 7a中的红色实线为根据海水温度利用关系式(8)计算得到的海水溶解氧O2T。从图可以看出, O2T与观测的O2不论大小还是时间变化均基本一致, 其同期相关系数为0.99、高于95%置信水平, 说明海水温度对海水溶解氧浓度的变化具有主导作用。温度越高, 海水溶解氧浓度越低, 反之, 海水溶解氧浓度越高。本文用实测的溶解氧浓度O2减去拟合的溶解氧浓度O2T得到两者之差O2D, 如图 7b所示, O2D大于0说明实测溶解氧浓度高于该温度下的预期溶解氧浓度, 小于0则相反。从图可以看出, 2016年7至9月, 两者差别较大, 而从2016年10月份至2017年3月份, 两者差别较小。这说明从2016年10月份至2017年3月份海水溶解氧浓度主要受海水温度影响, 而2016年7—9月份期间海水溶解氧浓度除了海水温度之外还受到其他过程的影响, 这些因素就是接下来要讨论的海洋层结和海表面风。
3.2 海洋层结研究区域位于近岸, 平均水深19.83米, 只存在季节性温跃层, 结合前人的研究(湘平, 2006), 可以将观测期间水温垂直结构划分为三种类型:冬季型、夏季型、过渡型。冬季型无温跃层类型, 温度垂直结构呈均匀一致, 对应2016年11月至次年3月; 夏季型为温跃层盛行期类型, 存在时间约为6至8月, 过渡型为温跃层衰消型, 出现在2016年9至10月份。海底锚定的观测系统只能观测海底的温度数据, 而无法获得整个水体剖面的资料。鉴于此, 本文利用ECMWF提供的海洋表层温度数据(TS)、观测的底层海水温度(T)以及平均水深H求得海表面到观测深度范围内的平均温度梯度DT, 计算公式如下:
 (9)
(9)DT可近似指示海水层结强度。DT大于0代表表层温度高于底层温度, 小于0则表示表层温度低于底层温度, DT越大, 代表水体层结现象越明显。
为了研究海水层结与溶解氧浓度的关系, 本文将2016年7月20日至9月30日之间的海表面温度、海底温度、DT和O2D的时间序列对比分析, 各要素变化情况如下图 8所示。
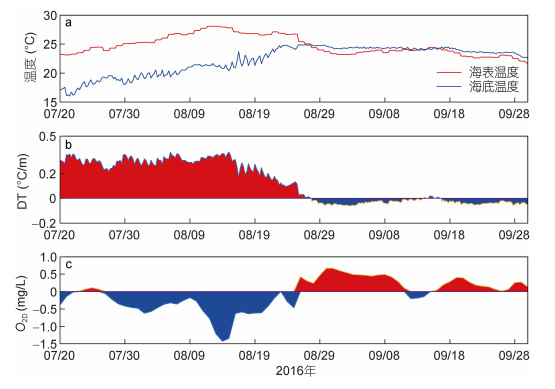 |
| 图 8 观测期间温度(℃)、DT(b, ℃/m)、O2D(c, mg/L)时间序列 Fig. 8 Time series of temperature(℃), DT(b, ℃/m) and O2D(c, mg/L) 注:子图(a)中红色代表海表温度, 蓝色代表海底温度; 子图(b)中红色代表DT大于0, 蓝色代表DT小于0;子图(c)中红色部分代表O2D大于0, 蓝色部分代表O2D小于0 |
图 8a显示在7月20日至8月25日期间, 观测点底层海水温度远低于表层海水温度, DT远大于0, 水体层化显著。受水体垂向层结的阻隔, 底层海水无法得到来自上层水体溶解氧的补充, 因此其溶解氧浓度在生物耗氧和化学耗氧的影响下会显著降低, 从而导致该期间底层海水的O2D小于0。在8月25日至9月30日期间, 观测点底层海水温度逐渐超过海表面温度, DT出现小于0的现象, 说明水体垂向混合均匀, 不存在层化现象。底层海水溶解氧浓度可以通过垂向混合得到补充, 因此会显著升高, 我们看到对应时期底层海水的O2D基本是大于0的。
经过上文分析, 可以看出当DT大于0的时候, O2D小于0, 反之O2D大于0。经计算, 二者相关系数达到了–0.70。这也说明水体存在层结时, 底层海水耗氧严重, 实测溶解氧浓度低于该温度下的预期溶解氧浓度。刘公岛海洋牧场夏季海水层结现象明显, 对应O2D随着时间减小, O2D小于0对应于持续耗氧的过程, 是一个过程累计量, 底部海水的溶解氧在生物呼吸作用和细菌的分解作用等消耗下会快速降低, 氧亏损就会越来越严重, 所以若层结不打破, 存在发生低氧灾害的可能。
3.3 风致混合大风能够驱动海水的混合, 当超过8m/s风速的强风经常发生时, 在海表面能量输入和潮致混合作用下垂向混合会加强(MacCready et al, 2009)。风速对于水体分层的影响主要是通过风应力引起的海水混合与潮汐作用引起的海水混合在研究区域的协调来产生的(Xuan et al, 2012)。本文选取2016年7月20日至9月30日的风场来分析其对分层和海底溶解氧浓度的影响。
图 9展示了风速、DT和实测与拟合溶解氧浓度的时间序列。通过图 9a可以看出风速在时间上有一个3—4天的弱周期变化, 本文用红色的曲线标出了7次大风过程, 最大风速分别在7月20日、7月25日、8月15日、8月25日、8月30日、9月19日、9月27日。DT在8月30日之前出现了三次大幅下降, 分别是7月26日、8月16日以及8月26日, 这与大风过程出现的时间段相吻合。8月15日的风速没有超过8m/s, 但是查阅历史天气发现8月14日出现了降雨过程, 而且8月15日和16日的气温普遍降低, 这在一定程度上也使得DT减弱较为明显。8月24日至9月1日期间出现了持续的大风过程, 最大风速13m/s, 这次大风过程直接导致了DT的快速降低, 将海水层结破坏之后出现了DT < 0的情况, 对应海底温度高于海表温度, 说明此时的海洋混合十分充分。此后海洋层结再未形成, 所以说大风天气对于海水层结具有抑制的作用。
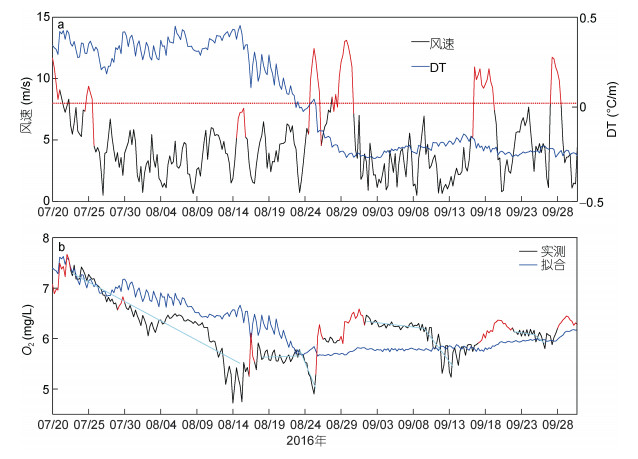 |
| 图 9 2016年7月20日至9月30日风速(m/s)、DT(℃/m)、O2(mg/L)、O2T(mg/L)时间序列 Fig. 9 Time series of wind(m/s), DT(℃/m), O2(mg/L) and O2T (mg/L)from July 20 to September 30, 2016 注:子图(a)中黑色线代表风速, 蓝色线代表DT, 红色直线代表风速等于8m/s; 子图(b)中黑色线代表O2, 蓝色线代表O2T, 青色线代表溶解氧某一段变化趋势 |
对比溶解氧浓度和风速时间序列可以分析二者之间的关系, 在图 9b中本文用红色的曲线标出了出现的7次溶解氧浓度的极大值过程, 极大值分别在7月22日、7月29日、8月16日、8月26日、8月31日、9月20日、9月29日。溶解氧浓度的升高明显要滞后于大风过程, 通过超前滞后分析, 当溶解氧浓度滞后24小时时溶解氧浓度和风速的相关性最好。此外, 本文还发现一个显著的现象, 8月26日至31日受大风过程影响, 溶解氧浓度快速升高, 9月3日至8日溶解氧浓度缓慢下降, 随后9月9日至13日, 这段时间出现了溶解氧的大幅下降。这种现象与前人(朱卓毅等, 2013)研究风混合引起的浮游植物的大量繁殖, 在高溶解氧条件下有机物分解率高, 所以溶解氧浓度降低较快的结果较为一致。对比图 9b中后面三段青色线和风速的关系, 能够发现同样的规律。因此本文猜测, 夏季每一次大风过程会促进溶解氧浓度的上升, 但是在之后的几天会出现一个快速的下降趋势(其中图 9b中第一段青色线对应溶解氧浓度的下降是由于海洋层结引起的)。大风引起海底有机物悬浮, 为浮游植物提供养料, 从而使浮游植物大量繁殖, 浮游植物凋亡所产生的有机物沉入海底, 在高溶解氧浓度的情况下腐烂分解消耗大量氧气, 氧气含量快速降低, 研究表明风力越大、持续时间越久, 则溶解氧浓度下降出现的时间越晚, 下降速率越快。
3.4 生物过程和天气底层AOU的变化可以反映有机物的分解耗氧以及呼吸作用耗氧等生物过程对溶解氧浓度的影响。生物作用对于溶解氧浓度的影响主要体现在溶解氧浓度的日变化以及氧饱和度的方面。图 10展示的是AOU、p以及溶解氧浓度日标准差的时间序列。
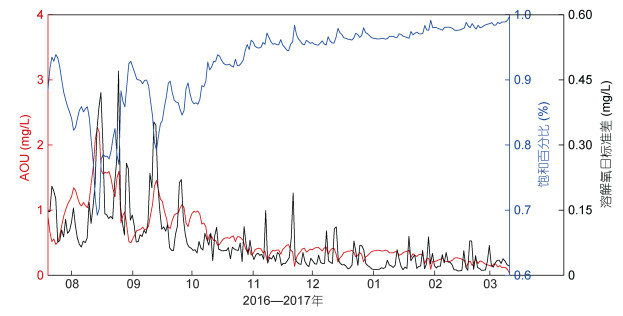 |
| 图 10 观测期间的AOU(mg/L)、p、溶解氧浓度日标准差(mg/L)时间序列 Fig. 10 Time series of AOU(mg/L), p and the daily standard deviation of the O2(mg/L) 注:图中红线表示AOU, 蓝线代表p, 黑线代表溶解氧浓度日标准差 |
无论是AOU、p还是溶解氧浓度标准差都在深秋和冬春季节变化幅度较小, 说明生物对海水溶解氧浓度的影响主要集中在夏季。观测点水深19.8米左右, 通过水下高清视频可以看到, 夏季和初秋季海水中悬浮物较多, 有多种鱼类和虾的存在, 生物量大, 底层海水的耗氧量较高, 氧饱和度低, 对应图 10中夏季和秋初时间段AOU和图 10中p的变化趋势。深秋至冬春季节, 近岸水温低, 大部分洄游鱼类和虾都游至深海区, 近岸生物种类和数量大幅度下降, 所以耗氧量降低, 底层海水溶解氧浓度接近于饱和, 对应图 10中深秋和冬春时间段AOU和图 10中p的变化趋势。
生物作用对于海水溶解氧浓度的影响还体现在日变化幅度和日变化趋势方面。结合天气状况, 7月20日至7月31日威海绝大部分时间处于降雨以及多云的天气之下, 所以浮游植物无法进行有效的光合作用产生氧气, 海底的溶解氧浓度主要受到生物活动耗氧和温度的制约。观测期间7月份的溶解氧逐时日变化在凌晨4时出现最高值, 溶解氧的日变化幅度不大。夏天晴朗无云时, 浮游植物白天可以进行光合作用, 溶解氧浓度会升高, 并于下午4时最高, 晚上在生物的呼吸作用和细菌等的分解作用下溶解氧浓度降低, 海水溶解氧浓度的日变幅较大。
3.5 潮汐海水溶解氧浓度的日变化受海面热通量、海面风、浮游植物光合作用、底层生物耗氧、垂向混合、潮流输运等过程的影响(D’Avanzo et al, 1994)。因为资料的限制, 本文仅讨论海水溶解氧浓度的日变化与潮汐过程的关系。利用观测的压强数据经转换计算得到观测处的海水深度, 进一步减去其平均值得到水深异常, 可等同于水位异常。图 11b为利用各个月份的水位异常时间序列计算得到的功率谱。从图可以看出, 各个月份水位异常的功率谱呈现类似特征, 均在12小时和24小时附近存在两个显著峰值, 说明水位变化存在显著地日周期和半日周期, 且以半日周期为主。利用小时平均的水位异常时间序列进行调和分析, 可得各主要分潮(信噪比 > 100)的调和常数如表 3所示。图 11c比较了观测的水位异常时间序列与利用调和分析结果反演的水位异常时间序列。从图中可以看出, 两者吻合一致, 其同期相关系数约为0.99, 方差解释率为86%。根据调和分析结果, 进一步计算得到潮汐特征值为0.46, 说明刘公岛海洋牧场海域的潮汐类型为正规半日潮, 且以周期为12.42小时的M2分潮为主。图 11a展示了不同月份中利用小时平均的海水溶解氧浓度时间序列计算得到的功率谱。从图中可以看出, 仅有部分月份的海水溶解氧数据呈现出一定的日周期和半日周期变化, 可能与潮汐过程有关。
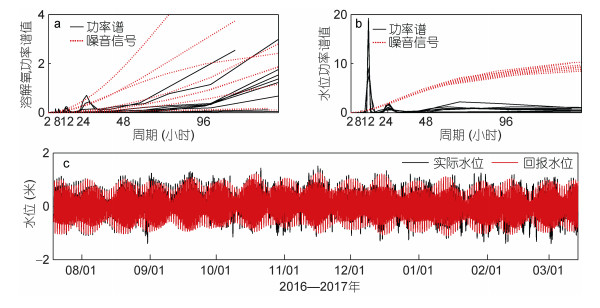 |
| 图 11 各月份O2功率谱(a)、水位功率谱(b)和水位调和分析结果(c, 单位: m) Fig. 11 Power spectrum analysis of the O2(a), water level(b) in each month and the result of harmonic analysis(c, m) |
| 分潮 | 周期(时) | 振幅(m) | 振幅误差(m) | 迟角(°) | 迟角误差(°) | 信噪比 |
| M2 | 12.42 | 0.6728 | 0.004 | 276.49 | 0.28 | 36000 |
| S2 | 12.00 | 0.2107 | 0.004 | 332.27 | 1.03 | 3400 |
| K1 | 23.92 | 0.2011 | 0.005 | 300.94 | 1.41 | 1500 |
| N2 | 12.66 | 0.1206 | 0.004 | 242.27 | 1.65 | 1200 |
| O1 | 25.84 | 0.1195 | 0.005 | 249.69 | 2.47 | 590 |
| M4 | 6.21 | 0.0305 | 0.002 | 178.17 | 3.45 | 300 |
| K2 | 11.96 | 0.0626 | 0.005 | 330.22 | 3.53 | 140 |
| P1 | 24.04 | 0.0535 | 0.005 | 298.9 | 4.80 | 120 |
| L2 | 12.20 | 0.0331 | 0.003 | 311.89 | 5.79 | 120 |
| MS4 | 6.11 | 0.0187 | 0.002 | 245.22 | 5.16 | 100 |
本文利用刘公岛海洋环境有缆实时在线观测系统所获数据, 研究了底层海水溶解氧的时间变化特征和变化幅度特征; 结合温度、盐度、水深以及风速数据对海水溶解氧浓度的影响因素进行了讨论; 结合天气情况对溶解氧的变化进行了分析。结论如下:
(1) 刘公岛海洋牧场底层海水溶解氧浓度呈现多时间尺度变化特征, 观测期间海水溶解氧浓度的平均值为8.45mg/L, 变化范围为4.71—11.07mg/L。从月平均的数据来看, 变化趋势为2016年7月至8月海水溶解氧浓度逐渐降低, 8月达到最低, 为5.91mg/L, 2016年8月至2017年2月海水溶解氧浓度逐渐升高, 2月达到最高, 为10.83mg/L。从季节平均数据来看, 海水溶解氧浓度初春 > 冬季 > 秋季 > 夏季(这里初春指3月上旬)。
(2) 海水溶解氧浓度的日变化在不同季节有不同的变化特征, 夏季受天气的影响较大, 夏天晴朗无云时, 在浮游植物光合作用产生大量氧气的情况下溶解氧浓度18时左右最高, 若阴雨天, 则受温度控制, 凌晨4时左右最高, 下午降低; 秋冬季节溶解氧浓度的日变化主要受温度的日变化控制, 温度越高, 溶解氧浓度越低。从日变化幅度和月变化幅度来看, 刘公岛海洋牧场溶解氧浓度的夏季变化幅度最大, 冬季的变化幅度最小。观测期间海水溶解氧浓度的月标准差和日标准差均呈现显著的季节变化, 月标准差于2016年8月最大、约为0.42mg/L, 于2017年3月最小、约为0.02mg/L, 于两者之间单调减小, 日标准差于2016年8月最大、约为0.18mg/L, 于2017年3月最小、约为0.03mg/L, 于两者之间单调减小。此外, 海水溶解氧浓度的日标准差还存在显著的天气时间尺度变化, 且变化强度亦于2016年8月份时最强。观测期间海水溶解氧浓度日标准差的最高值约为0.47mg/L, 发生在2016年8月25日。
(3) 观测期间刘公岛海洋牧场AOU始终是大于0的, 海水处于氧亏损的状态, 是氧气的汇。整个观测期间AOU的平均值为0.76mg/L, 变化范围是0—2.74mg/L。AOU在时间变化上同样呈现出较为明显的季节变化趋势, 7月20日开始至8月15日AOU波动上升, 并在8月15日达到最大值2.74mg/L; 8月15日之后AOU波动下降。AOU最大的三个月份分别是7、8、9月份, 说明在7、8、9月份海底溶解氧的消耗很大。饱和百分比的季节变化趋势是夏季 < 秋季 < 冬季 < 初春, AOU和温度的季节变化趋势是初春 < 冬季 < 秋季 < 夏季。AOU和温度的变化趋势相同, 饱和百分比和温度的变化趋势相反。
(4) 温度是影响刘公岛海洋牧场底层海水溶解氧浓度的主要因素, 与溶解氧浓度呈负相关关系, 温度越高, 溶解氧浓度越低, 观测期间盐度和潮汐对溶解氧浓度的影响可以忽略不计。温度拟合的溶解氧浓度与实测溶解氧浓度相关系数达到0.99。海洋层结是影响夏季刘公岛海洋牧场底层海水溶解氧浓度的一个重要因素, 夏季出现的季节性温跃层阻断了溶解氧由表层向下运输的通道, 在生物呼吸和细菌分解等耗氧作用下会使海水中溶解氧浓度逐渐降低, 若层结一直存在, 则有发生低氧的可能。
(5) 夏季大风过程可以通过打破夏季的季节性温跃层使水体发生垂向混合, 从而为海底提供氧气, 溶解氧浓度快速升高, 但是大风过程之后的几天海水溶解氧浓度会出现快速下降趋势, 因为大风引起海底有机物悬浮, 为浮游植物提供养料, 从而使浮游植物大量繁殖, 浮游植物凋亡所产生的有机物沉入海底, 在高溶解氧浓度的情况下分解消耗大量氧气, 氧气含量快速降低。研究表明风力越大、持续时间越久, 则溶解氧浓度下降出现的时间越晚, 下降速率越快。
(6) 观测期间刘公岛海洋牧场水质良好, 不存在低氧现象, 但是于8月份出现低氧的条件, 在无风或风力较弱的天气下, 可能由于水体分层造成海底溶解氧消耗严重的情况, 或在夏季降雨、大风天气过后的几天, 溶解氧浓度可能会出现快速的降低。
| 石强, 2016. 黄海溶解氧含量场季节循环时空模态与机制. 应用海洋学学报, 35(1): 1–14 DOI:10.3969/J.ISSN.2095-4972.2016.01.001 |
| 冉祥滨, 臧家业, 韦钦胜, 等, 2012. 乳山湾邻近海域低氧现象及成因浅析. 海洋科学进展, 30(3): 347–356 DOI:10.3969/j.issn.1671-6647.2012.03.005 |
| 朱卓毅, 张经, 吴莹, 等, 2013. 长江口外颗粒有机碳及光合色素在不同溶氧水平下早期降解速率研究. 海洋与湖沼, 44(1): 1–8 |
| 刘春利, 葛长字, 张玉娟, 等, 2017. 黄海表层溶解氧时空分布特征. 海洋环境科学, 36(2): 255–260 |
| 江涛, 徐勇, 刘传霞, 等, 2016. 渤海中部海域低氧区的发生记录. 渔业科学进展, 37(4): 1–6 |
| 辛明, 马德毅, 王保栋, 等, 2013. 黄海溶解氧的平面分布特征及其季节变化. 中国海洋大学学报, 43(7): 56–60 |
| 宋国栋, 石晓勇, 祝陈坚, 2007. 春季黄海溶解氧的平面分布特征及主要影响因素初探. 海洋环境科学, 26(6): 534–536 DOI:10.3969/j.issn.1007-6336.2007.06.009 |
| 张莹莹, 张经, 吴莹, 等, 2007. 长江口溶解氧的分布特征及影响因素研究. 环境科学, 28(8): 1649–1654 DOI:10.3321/j.issn:0250-3301.2007.08.001 |
| 陈国光, 翟方国, 李培良, 等, 2016. 黄海海浪季节变化的数值模拟研究. 海洋科学, 40(11): 155–168 DOI:10.11759/hykx20160704004 |
| 孟鑫, 王冬, 李培良, 等, 2017. 海洋牧场溶解氧生态模型初探. 海洋技术学报, 36(5): 120–126 |
| 孟春霞, 邓春梅, 姚鹏, 等, 2005. 小清河口及邻近海域的溶解氧. 海洋环境科学, 24(3): 25–28 DOI:10.3969/j.issn.1007-6336.2005.03.007 |
| 顾孝连, 徐兆礼, 2009. 河口及近岸海域低氧环境对水生动物的影响. 海洋渔业, 31(4): 426–437 DOI:10.3969/j.issn.1004-2490.2009.04.013 |
| 顾宏堪, 1980. 黄海溶解氧垂直分布的最大值. 海洋学报(中文版), 2(2): 70–80 |
| 孙湘平, 2006. 中国近海区域海洋. |
| Boyer T, Conkright M E, Levitus S, 1999. Seasonal variability of dissolved oxygen, percent oxygen saturation, and apparent oxygen utilization in the Atlantic and Pacific Oceans. Deep Sea Research Part Ⅰ:Oceanographic Research Papers, 46(9): 1593–1613 DOI:10.1016/S0967-0637(99)00021-7 |
| D'Avanzo C, Kremer J N, 1994. Diel oxygen dynamics and anoxic events in an eutrophic estuary of Waquoit Bay, Massachusetts. Estuaries, 17(1): 131–139 DOI:10.2307/1352562 |
| Dee D P, Uppala S M, Simmons A J, et al, 2011. The ERA-Interim reanalysis:configuration and performance of the data assimilation system. Quarterly Journal of the Royal Meteorological Society, 137(656): 553–597 DOI:10.1002/qj.v137.656 |
| Diaz R J, 2001. Overview of hypoxia around the world. Journal of Environmental Quality, 30(2): 275–281 DOI:10.2134/jeq2001.302275x |
| Doney S C, Ruckelshaus M, Duffy J E, et al, 2012. Climate change impacts on marine ecosystems. Annual Review of Marine Science, 4: 11–37 DOI:10.1146/annurev-marine-041911-111611 |
| Garcia H E, Gordon L I, 1992. Oxygen solubility in seawater:Better fitting equations. Limnology and Oceanography, 37(6): 1307–1312 |
| Koko S, Irvine K, Jindal R, et al, 2017. Spatial and temporal variations of dissolved oxygen in Cha-Am municipality wastewater treatment ponds using GIS kriging interpolation. Journal of Water Management Modeling, 25: C427 DOI:10.14796/JWMM.C427 |
| Li G, Liu J X, Diao Z H, et al, 2018. Subsurface low dissolved oxygen occurred at fresh-and saline-water intersection of the Pearl River estuary during the summer period. Marine Pollution Bulletin, 126: 585–591 DOI:10.1016/j.marpolbul.2017.09.061 |
| MacCready P, Banas N S, Hickey B M, et al, 2009. A model study of tide-and wind-induced mixing in the Columbia River Estuary and plume. Continental Shelf Research, 29(1): 278–291 DOI:10.1016/j.csr.2008.03.015 |
| Nezlin N P, Kamer K, Hyde J, et al, 2009. Dissolved oxygen dynamics in a eutrophic estuary, Upper Newport Bay, California. Estuarine Coastal and Shelf Science, 82(1): 139–151 DOI:10.1016/j.ecss.2009.01.004 |
| Ni X B, Huang D J, Zeng D Y, et al, 2016. The impact of wind mixing on the variation of bottom dissolved oxygen off the Changjiang Estuary during summer. Journal of Marine Systems, 154: 122–130 DOI:10.1016/j.jmarsys.2014.11.010 |
| Pihl L, Baden S P, Diaz R J, 1991. Effects of periodic hypoxia on distribution of demersal fish and crustaceans. Marine Biology, 108(3): 349–360 DOI:10.1007/BF01313644 |
| Shimps E L, Rice J A, Osborne J A, 2005. Hypoxia tolerance in two juvenile estuary-dependent fishes. Journal of Experimental Marine Biology and Ecology, 325(2): 146–162 DOI:10.1016/j.jembe.2005.04.026 |
| Wang B, 2009. Hydromorphological mechanisms leading to hypoxia off the Changjiang estuary. Marine Environmental Research, 67(1): 53–58 DOI:10.1016/j.marenvres.2008.11.001 |
| Wannamaker C M, Rice J A, 2000. Effects of hypoxia on movements and behavior of selected estuarine organisms from the southeastern United States. Journal of Experimental Marine Biology and Ecology, 249(2): 145–163 |
| Wei H, He Y C, Li Q J, et al, 2007. Summer hypoxia adjacent to the Changjiang Estuary. Journal of Marine Systems, 67(3-4): 292–303 |
| Weiss R F, 1970. The solubility of nitrogen, oxygen and argon in water and seawater. Deep Sea Research and Oceanographic Abstracts, 17(4): 721–735 DOI:10.1016/0011-7471(70)90037-9 |
| Xuan J L, Huang D J, Zhou F, et al, 2012. The role of wind on the detachment of low salinity water in the Changjiang estuary in summer. Journal of Geophysical Research, 117(C10): C10004 DOI:10.1029/2012JC008121 |
| Yin K D, Lin Z F, Ke Z Y, 2004. Temporal and spatial distribution of dissolved oxygen in the Pearl River Estuary and adjacent coastal waters. Continental Shelf Research, 24(16): 1935–1948 DOI:10.1016/j.csr.2004.06.017 |
| Zhang H, Li S Y, 2010. Effects of physical and biochemical processes on the dissolved oxygen budget for the Pearl River Estuary during summer. Journal of Marine Systems, 79(1-2): 65–88 |
| Zhang J, Gilbert D, Gooday A J, et al, 2010. Natural and human-induced hypoxia and consequences for coastal areas:synthesis and future development. Biogeosciences, 7(5): 1443–1467 DOI:10.5194/bg-7-1443-2010 |
| Zhu J R, Zhu Z Y, Lin J, et al, 2016. Distribution of hypoxia and pycnocline off the Changjiang Estuary, China. Journal of Marine Systems, 154: 28–40 DOI:10.1016/j.jmarsys.2015.05.002 |
 2019, Vol. 50
2019, Vol. 50


