
中国海洋湖沼学会主办。
文章信息
- 袁朝杰, 张莹, 李涛, 李爱芬. 2019.
- YUAN Chao-Jie, ZHANG Ying, LI Tao, LI Ai-Fen. 2019.
- 迦得拟微球藻在不同硝酸钾浓度下的生长和生理生化特征
- THE GROWTH, PHYSIOLOGICAL AND BIOCHEMICAL CHARACTERISTICS OF NANNOCHLOROPSIS GADITANA IN DIFFERENT POTASSIUM NITRATE CONCENTRATION
- 海洋与湖沼, 50(1): 106-115
- Oceanologia et Limnologia Sinica, 50(1): 106-115.
- http://dx.doi.org/10.11693/hyhz20180600142
-
文章历史
- 收稿日期:2018-06-05
- 收修改稿日期:2018-07-26
2. 中国科学院南海海洋研究所 中国科学院热带海洋生物资源与生态重点实验室 广州 510301
2. Key Laboratory of Tropical Marine Bio-resources and Ecology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China
海洋单细胞微藻富含蛋白质、脂肪、多糖和人体所必需的多种营养成分, 是现代海洋生物技术中重要的研究和开发对象。迦得拟微球藻(N.gaditana)是一株单细胞海洋微藻, 属于真眼点藻纲(Eustigmatophyceae)、真眼点藻目(Eustigmatales)、拟单胞藻科(Monodopsidaceae)、微拟球藻属(Nannochloropsis) (高保燕等, 2014)。该藻细胞呈球形或卵形, 只含有叶绿素a (chlorophyll a, chl a) (Whittle et al, 1975)。研究表明, 该属微藻生长快、可以合成长链多不饱和脂肪酸、金藻昆布糖和蛋白质等活性物质, 具有极高的开发利用价值, 因而在生物柴油、微藻饵料和环境保护等方面具有很大的经济价值及应用前景(Rebolloso-Fuentes et al, 2001; Recht et al, 2012; Van Vooren et al, 2012; 魏东等, 2014)。
微藻生长和代谢产物的积累与培养条件密切相关, 包括氮、磷营养、光照和培养温度等, 其中培养液中氮素浓度对微藻的生长和物质积累影响尤为明显。邱昌恩等(2005)研究报道, 绿球藻(Chlorococcum sp.)在6种不同硝酸钠浓度下的生长存在差异; Illman等(2000)在低氮条件下培养5株小球藻, 其中4株小球藻的总脂含量明显升高; Widjaja等(2009)也报道了在缺氮条件下培养普通小球藻(Chlorella vulgaris), 其总脂含量明显提高。氮素营养水平对微藻的生化组成的影响结果不尽相同, 曹春晖等(2006)对(小球藻Chlorella spp. MACC/C95/C97/C102)和裂丝藻属绿藻(Stichococcus bacillaris MACC/C19)在不同氮浓度下的总脂含量和脂肪酸组成进行了分析, 结果有3株小球藻的总脂含量变化显著; Yao等(2012)研究报道, 海洋绿藻亚心形四爿藻(Tetraselmis subcordiformis)淀粉含量在低氮条件下显著高于氮素充足条件; Ho等(2012)的研究证实, 斜生栅藻(Scenedesmus obliquus CNW-N)在氮饥饿条件下同时积累脂质和多糖; Shekh等(2013)研究报道, 蛋白核小球藻(Chlorella pyrenoidosa)在低氮条件下培养, 多不饱和脂肪酸(PUFA)的含量增加了两倍; Wang等(2015)报道了湛江等鞭金藻(Isochrysis zhangjiangensis)在低氮胁迫时类胡萝卜素含量相对升高。上述研究表明, 藻细胞积累活性物质需要适宜的氮素营养条件, 并且不同藻种适宜生长和积累活性物质的氮素营养条件可能存在差异。
迦得拟微球藻具有生长速度快、油脂含量高、可以积累EPA等特性, 但对于不同氮素水平调控迦得拟微球藻细胞物质定向积累的研究相对较少, 以迦得拟微球藻作为研究细胞物质积累的材料, 更具有实际指导意义。本文以迦得拟微球藻为实验材料, 分析了4种不同硝酸钾浓度对藻细胞生长和总脂、多糖、可溶性蛋白、脂肪酸、色素以及表观光合参数的影响, 旨在探究氮素浓度调控其细胞物质定向积累的可行性, 并尝试从光合生理角度解释其可能的内在机制, 为该藻株的综合开发利用提供有益参考。
1 材料与方法 1.1 实验材料迦得拟微球藻由中国科学院南海海洋研究所海藻资源与生物技术学科组提供, 分离自广东省巽寮湾海域, 藻株编号为SCS-01。
1.2 实验方法 1.2.1 培养条件将保藏的藻种活化扩大培养至对数期[扩种采用Φ6.0cm×60cm的柱状光生物反应器进行, 光照强度为100μmol photons/(m2·s)], 接入ASW培养基中(Andersen, 2005), 接种密度为OD750=1.0±0.01, 温度为(25±1)℃, 光照强度为300μmol photons/(m2·s), 采用Φ3.0cm×60cm的柱状光生物反应器培养, 通气(含1% CO2的压缩空气)搅拌, 设置四种硝酸钾浓度, 分别是3.0、5.0、7.5和14.9mmol/L, 其中, 14.9mmol/L为正常ASW的硝酸钾浓度, 为本研究的对照组, 其他处理组分别为对照组硝酸钾浓度的1/5、1/3和1/2, 每组设置3个平行实验, 培养周期为14天, 每2天取样测定生物质浓度, 每天取样测定叶绿素荧光参数, 第0天、第6天、第10天、第14天离心收集藻泥, 测定总脂含量和脂肪酸组成, 并测定第14天的色素组成。
1.2.2 生物量测定每2天从不同氮浓度组取5—10mL藻液, 用干燥至恒重的混合纤维滤膜(0.45μm)和真空泵进行抽滤, 随后将滤膜烘干至恒重, 利用抽滤前后滤膜的干重差计算出单位体积生物量(g/L)。
1.2.3 总脂含量测定及产率的计算根据Khozin-Goldberg等(2005)的方法, 取第0天、第6天、第10天、第14天冻干藻粉100mg置于内含磁力转子的玻璃离心管中, 加入10%二甲亚砜-甲醇溶液2mL, 在恒温磁力水浴锅中先于50℃水浴抽提1.5h, 在转移至冰浴抽提, 磁力搅拌1.5h, 3000r/min离心5min, 收集上清液于洁净玻璃瓶中, 沉淀加入4mL乙醚-正己烷混合液(1︰1, v︰v), 0℃磁力搅拌提取1h, 3000r/min离心5min, 收集上清至同一玻璃小瓶中, 重复加入上述两种混合溶液提取, 直到沉淀变成白色。在上清液中加入蒸馏水, 静置12h, 等待混合液体分相, 将分层后的有机相移至另一玻璃瓶中, 氮气吹干后再用乙醚稀释, 将浓缩液转移至称重过的离心管中, 用氮气吹干后再次称重, 即得总脂含量。
单位体积总脂产率[g/(L·d)]=(第14天生物质浓度×第14天总脂含量-第0天生物质浓度×第0天总脂含量)/14天.
1.2.4 多糖含量的测定及产率的计算依据本实验室改良方法(汪亚俊等, 2014; 吴琼芳等, 2016), 将提取过总脂的藻粉干燥后, 精确称量10mg放入内置磁力转子的玻璃离心管中, 加入0.5mmol/L H2SO4 5mL, 置于恒温磁力搅拌器中, 100℃水浴搅拌4h, 3000r/min离心5min, 将上清溶液转移至50mL容量瓶, 用纯水洗涤沉淀, 再次离心后收集上清溶液, 合并至同一容量瓶中, 重复洗涤2次, 定容后取溶液1mL, 用纯水补至2mL, 迅速依次加入浓H2SO4和6%苯酚, 混合均匀, 冷却至常温后测定波长为490nm下吸光度, 利用葡萄糖为标准品测量出的数据制作标准曲线, 利用标准方程计算多糖含量。
单位体积多糖产率[g/(L·d)]=(第14天生物质浓度×第14天多糖含量-第0天生物质浓度×第0天多糖含量)/14天.
1.2.5 可溶性蛋白含量的测定及产率的计算提取过总脂的藻粉干燥后, 精确称量10mg放入内有磁力转子的玻璃离心管中, 加入5mL浓度为0.5mmol/L的NaOH溶液, 于恒温磁力水浴锅中, 80℃水浴提取30min, 3000r/min离心5min, 将上层溶液转移至50mL容量瓶, 反复抽提直至完全, 定容后取溶液1mL, 采用Lowry法蛋白含量测定试剂盒测定蛋白提取液, 根据测定的标准曲线计算蛋白含量。
单位体积可溶性蛋白含量产率[g/(L·d)]=(第14天生物质浓度×第14天可溶性蛋白含量-第0天生物质浓度×第0天可溶性蛋白含量)/14天.
1.2.6 光合放氧速率及暗呼吸速率的测定每天取样测用Clark氧电极(Hansatech Oxygraph, 英国)测定单位时间内藻细胞溶氧量的变化。置于恒温水浴箱(25℃)中暗处理30min。测定时, 打开磁力转子后首先用LED光源在培养光强下照射藻细胞, 测定10min内氧气平均释放速率, 计算每毫克叶绿素产生的氧气量(μmol), 即为光合放氧速率(μmol/mg chl a/min)。关闭光源, 测定暗处理10min内氧气的平均消耗速率, 同样以每毫克叶绿素产生的氧气量(μmol)进行换算, 即为暗呼吸速率(μmol/mg chl a /min)。
1.2.7 叶绿素荧光参数测定参考Gao等(2015)的方法, 每天取样测定利用脉冲调制式叶绿素荧光仪XE-PAM测定PSⅡ的最大光量子产量(Fv/Fm)、相对电子传递效率(rETR)。将样品调为同一吸光度并暗适应30min, 取3mL加入比色皿置于荧光仪中, 打开测量光照射30s, 测定暗适应后的最小荧光F0。然后打开光化光处理5min [300μmol photons/(m2·s)], 再打开饱和脉冲光, 测定藻细胞不同生长时期PSⅡ的rETR、Fv/Fm等光合参数。
1.2.8 色素组成分析称取第0天和第14天的10mg冻干藻粉放入内置磁力转子的玻璃离心管中, 加入丙酮5mL, 置于磁力搅拌器上避光提取12h, 直至藻渣变为灰白色, 3500r/min离心5min, 收集上清液, 将上清液用微孔滤膜(0.22μm)抽滤, 转移至液相小瓶, 保存于4℃待测。
采用戴安UltiMate 3000高效液相色谱系统(四元泵单元、自动进样器、柱温箱系统、DAD检测器); 色谱条件:反相Kromasil C18色谱柱(5μm, 100Å, 250mm×4.6mm), 配有Acclaim 120 C18保护柱(5μm, 120Å, 15mm×4.6mm)。流动相A:乙腈-水(90︰10, v/v), 流动相B:乙酸乙酯。检测波长: 445nm, 波长扫描范围: 300—800nm, 柱温: 20℃, 流速: 1mL/min, 进样量: 20μL。利用色素标准品和吸收光谱对色素种类进行鉴定。
1.2.9 脂肪酸组成分析精确称取第0天、第6天、第10天、第14天的冻干藻粉25mg, 放入内置磁力转子可密封的玻璃离心管中, 加入2mL含有2% H2SO4的无水甲醇-甲苯(9︰1, v︰v)混合液, 充满氮气后, 于恒温磁力水浴锅中, 80℃搅拌提取1.5h, 然后依次加入1mL纯水和正己烷, 混合均匀后离心, 将上层有机相转移到1.5mL样品瓶中, 在通风厨中用氮气吹干, 再加入100μL正己烷密封, 保存于−20℃待测。利用气相色谱质谱分析柱为对样品进行测定分析, 通过标准品脂肪酸的峰面积计算得到脂肪酸组成及其含量。
1.2.10 数据处理采用Origin8.6和SPSS13.0软件进行数据处理及单因素方差分析, P < 0.05表示差异显著。
2 实验结果 2.1 不同硝酸钾浓度下迦得拟微球藻的生长迦得拟微球藻在3.0、5.0、7.5和14.9mmol/L四种不同硝酸钾浓度培养条件下, 生物量随时间的变化曲线如图 1所示, 不同硝酸钾浓度下, 迦得拟微球藻的生物量均呈现逐渐增加的趋势, 0—8天各浓度组生物量的增加趋势并未出现明显差异, 培养8天后生物量开始出现差异, 生物量的增加速率随氮浓度增加而增加, 14.9mmol/L浓度组藻细胞生长最快, 至培养结束, 生物量可达7.82g/L。此外, 培养结束时藻液的颜色从低浓度到高浓度分别为浅黄色、深黄色、棕色和褐绿色。
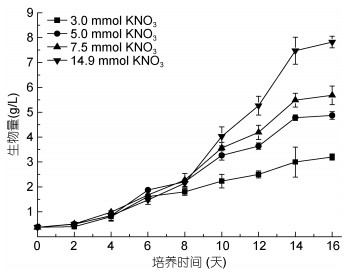 |
| 图 1 不同硝酸钾浓度下迦得拟微球藻生物量的变化 Fig. 1 Changes of biomass Nannochloropsis gaditana at different potassium nitrate concentrations |
不同硝酸钾浓度下, 迦得拟微球藻总脂含量的变化情况如图 2a所示, 培养周期内, 各浓度组迦得拟微球藻的总脂含量持续增加, 且与硝酸钾浓度呈负相关。藻细胞0—6天总脂含量积累缓慢, 6—14天快速积累。至培养结束, 3.0mmol/L浓度组藻细胞总脂含量最高, 为41.6% (干重, dw)。
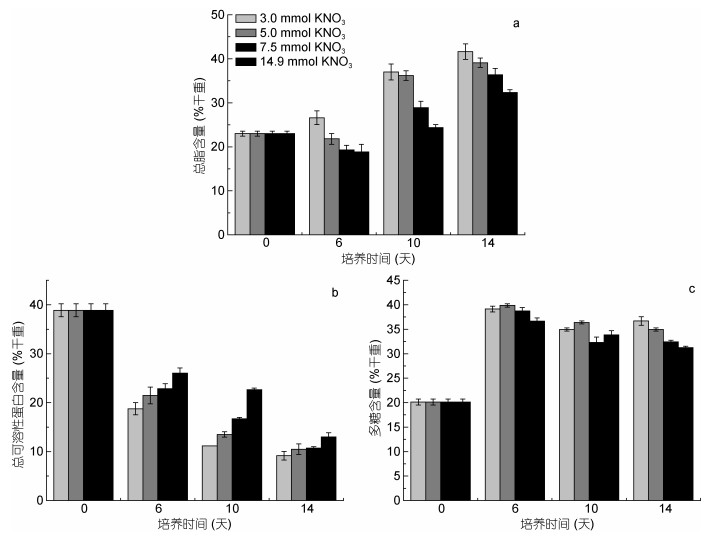 |
| 图 2 不同硝酸钾浓度下迦得拟微球藻生化组分的含量 Fig. 2 Changes in biochemical components of Nannochloropsis gaditana under different potassium nitrate concentrations 注: a:总脂; b:可溶性蛋白; c:多糖 |
迦得拟微球藻可溶性蛋白含量在不同硝酸钾浓度培养下的变化如图 2b所示。各浓度组藻细胞可溶性蛋白含量逐渐下降, 且随硝酸钾浓度的降低可溶性蛋白含量降低速率增加, 各浓度组间差异显著(P < 0.05)。3.0mmol/L浓度组可溶性蛋白含量下降最快, 培养结束时, 其可溶性蛋白含量从培养初期的38.9% (dw)下降到13.0% (dw)。
不同硝酸钾浓度下, 迦得拟微球藻多糖含量的变化如图 2c所示。培养前期各浓度组藻细胞的多糖含量快速积累, 随后呈现降低趋势, 培养结束时, 3.0、5.0、7.5和14.9mmol/L 4个浓度组藻细胞的多糖含量分别为31.3%、32.5%、35.0%、36.7% (dw)。
迦得拟微球藻主要生化组分的单位体积产率如表 1所示, 14.9mmol/L浓度组藻细胞的单位体积总脂产率、可溶性蛋白产率与多糖产率均显著高于其他浓度组(P < 0.05), 分别为0.150、0.053和0.17g/(L·d)。
| 细胞物质 | 不同硝酸钾浓度(mmol/L)下的单位体积产率 | |||
| 3.0 | 5.0 | 7.5 | 14.9 | |
| 总脂 | 0.074±0.013d1 | 0.097±0.021c1 | 0.130±0.0190b1 | 0.150±0.023a1 |
| 可溶性蛋白 | 0.014±0.002c2 | 0.020±0.004b2 | 0.028±0.004b2 | 0.053±0.009a2 |
| 多糖 | 0.049±0.002d3 | 0.073±0.004c3 | 0.120±0.006b3 | 0.170±0.009a3 |
| 注: a1, b1, c1, d1之间存在显著性差异; a2, b2, c2之间存在显著性差异; a3, b3, c3, d3之间存在显著性差异 | ||||
通过气相色谱法分析迦得拟微球藻的脂肪酸组成, 其主要脂肪酸包括二十碳五烯酸(C20:5, EPA)、花生四烯酸(C20:4, AA)、油酸(C18:1)、棕榈油酸(C16:1)和棕榈酸(16:0)。不同硝酸钾浓度下迦得拟微球藻脂肪酸组成的变化情况如图 3所示, 其中C16:0、C16:1和C18:1总和可占总脂肪酸的60%以上, 各脂肪酸相对含量均随培养时间的延长而增加, 且与硝酸钾浓度呈负相关; 花生四烯酸含量为0.6%—5.8% TFA (总脂肪酸, total fatty acids, TFA), 二十碳五烯酸含量为2.9%—10.9% TFA, C18:3、C20:5和C20:4的含量随着硝酸钾浓度的降低和培养时间的延长而减少。
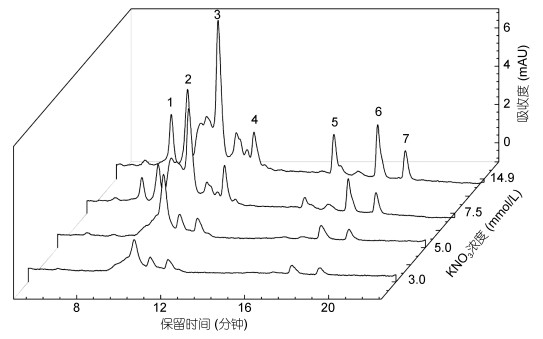 |
| 图 3 不同硝酸钾浓度下迦得拟微球藻色素组成 Fig. 3 Changes in pigment composition of Nannochloropsis gaditana under different potassium nitrate concentrations 注: 1:堇菜黄素; 2:未知色素; 3:无隔藻黄素; 4:未知色素; 5:叶绿素a; 6:虾青素单脂; 7: β-胡萝卜素 |
| 脂肪酸种类 | 不同培养时间不同硝酸钾浓度下的迦得拟微球藻脂肪酸组成 | ||||||||||||||||||
| 3.0mmol/L | 5.0mmol/L | 7.5mmol/L | 14.9mmol/L | ||||||||||||||||
| 0天 | 5天 | 10天 | 15天 | 0天 | 5天 | 10天 | 15天 | 0天 | 5天 | 10天 | 15天 | 0天 | 5天 | 10天 | 15天 | ||||
| C14:0 | 5.30 | 4.46 | 3.48 | 4.33 | 5.30 | 2.49 | 2.86 | 3.01 | 5.30 | 3.63 | 3.31 | 3.31 | 5.30 | 3.92 | 3.65 | 2.63 | |||
| C14:1 | 0.80 | 0.88 | 0.84 | 0.83 | 0.80 | 0.83 | 0.85 | 0.83 | 0.80 | 0.83 | 0.82 | 0.82 | 0.80 | 1.48 | 1.49 | 1.73 | |||
| C16:0 | 23.50 | 29.70 | 42.90 | 43.45 | 23.50 | 27.07 | 40.87 | 41.69 | 23.50 | 26.74 | 38.52 | 40.27 | 23.50 | 26.37 | 33.31 | 38.60 | |||
| C16:1 | 25.19 | 26.85 | 27.66 | 34.61 | 25.19 | 27.82 | 28.80 | 29.57 | 25.19 | 26.07 | 27.15 | 28.51 | 25.19 | 26.48 | 26.40 | 27.01 | |||
| C18:0 | 1.22 | 1.72 | 1.02 | 0.98 | 1.22 | 3.08 | 1.60 | 1.40 | 1.22 | 1.57 | 1.38 | 1.23 | 1.22 | 1.23 | 1.23 | 1.20 | |||
| C18:1 | 8.50 | 8.12 | 8.32 | 9.47 | 8.50 | 7.17 | 7.56 | 11.95 | 8.50 | 9.42 | 10.03 | 12.75 | 8.50 | 8.32 | 7.76 | 9.20 | |||
| C18:3 | 2.76 | 1.35 | 1.76 | 1.42 | 2.76 | 2.67 | 2.55 | 1.33 | 2.76 | 1.78 | 1.67 | 1.20 | 2.76 | 2.67 | 2.51 | 2.34 | |||
| C20:4 | 3.46 | 2.20 | 1.40 | 0.66 | 3.46 | 2.46 | 2.08 | 1.66 | 3.46 | 3.92 | 2.68 | 2.20 | 3.46 | 3.83 | 5.03 | 5.73 | |||
| C20:5 | 10.91 | 9.50 | 2.68 | 1.01 | 10.91 | 8.96 | 2.73 | 1.91 | 10.91 | 8.07 | 2.60 | 2.86 | 10.91 | 7.24 | 4.77 | 3.76 | |||
| 其他 | 18.37 | 15.23 | 9.93 | 3.24 | 18.37 | 17.46 | 10.10 | 6.65 | 18.37 | 17.98 | 11.86 | 6.85 | 18.37 | 18.46 | 13.85 | 7.82 | |||
不同硝酸钾浓度条件下迦得拟微球藻色素组成的变化如图 3所示。根据色素保留时间及其特征吸收光谱, 鉴定藻细胞的主要色素包括堇菜黄素(violaxanthin)、无隔藻黄素(vaucheriaxanthin)、β-胡萝卜素(β-Carotene)、叶绿素a (chl a)以及虾青素单脂(mono- astaxanthin)。培养第14天, 14.9mmol/L浓度组的色素含量最为丰富, 其中无隔藻黄素含量最高, 各色素含量随着硝酸钾浓度的降低而减少, 堇菜黄素和叶绿素a在3.0和5.0mmol/L硝酸钾浓度下, 由于含量低而无法检出(两种处理组培养物颜色变为土黄色), 但属于次生类胡萝卜素类的虾青素单脂(mono-astaxanthin)在整个培养周期中均存在, 且随着硝酸钾的增加而增加。
2.5 不同硝酸钾浓度下迦得拟微球藻的表观光合效率参数叶绿素荧光参数的高低可以反映微藻细胞的光合效率, 图 4a和4b为不同硝酸钾浓度下迦得拟微球藻主要叶绿素荧光参数的时相动态变化。由图 4a可知, 在整个培养周期内迦得拟微球藻的最大光能转化效率Fv/Fm呈先上升后下降趋势。各浓度组藻细胞的Fv/Fm在培养周期的第6—16天差异显著(P < 0.05), 氮素限制降低Fv/Fm。从图 4b看出, 不同硝酸钾浓度下, 迦得拟微球藻的相对电子传递效率rETR在第4天达到最大值, 随后逐渐降低。
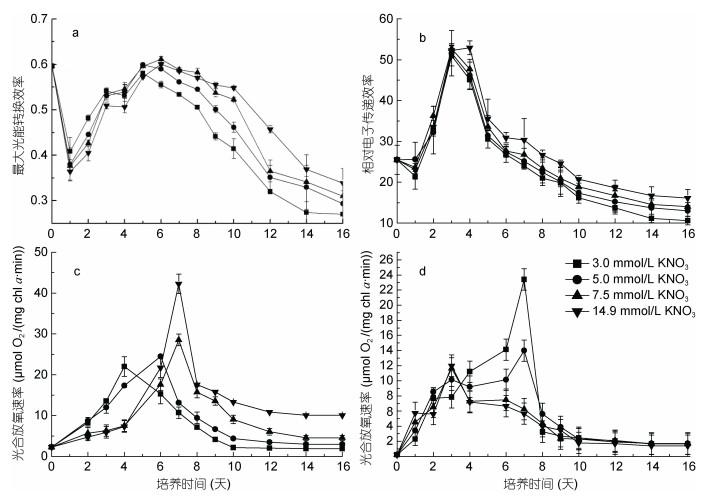 |
| 图 4 不同硝酸钾浓度下迦得拟微球藻表观光合效率参数的时相变化 Fig. 4 Time-course changes in apparent photosynthetic parameter of Nannochloropsis gaditana under different potassium nitrate concentrations 注: a:最大光量子产量Fv/Fm; b:相对电子传递效率rETR; c:光合放氧速率; d:暗呼吸速率 |
不同初始硝酸钾浓度下迦得拟微球藻光合和与暗呼吸速率结果(图 4c, 4d)表明, 随培养时间的推移二者在整个培养周期内均呈先迅速上升后逐渐下降, 最后趋于稳定。其中, 各浓度组的光合速率分别于培养周期的第4—7天达到最大值, 后迅速下降, 10天后趋于稳定。培养7天后, 3.0、5.0和7.5mmol/L浓度组的光合速率显著低于14.9mmol/L氮浓度组(P < 0.05)。随着培养时间的延长, 暗呼吸速率与培养基内氮浓度呈负相关, 3.0和5.0mmol/L浓度组暗呼吸速率高于7.5和14.9mmol/L浓度组(P < 0.05)。其中, 3.0和5.0mmol/L浓度组的暗呼吸速率在培养前7天持续上升, 达到最大值后, 随着培养时间的延长, 暗呼吸速率均逐渐下降, 12天后趋于稳定。
3 讨论氮素是限制微藻细胞生长最重要的营养因子之一, 氮限制条件有利于油脂的积累, 却会阻碍藻类的生长和单位体积油脂产率的增长(Geider et al, 1993)。本论文中迦得拟微球藻在硝酸钾浓度为14.9mmol/L条件下获得最高的生物量和活性物质产率, 而3.0mmol/L浓度组生物量仅为3.14g/L, 说明低氮条件对迦得拟微球藻生长有明显抑制作用, 这可能是由于低氮条件影响到藻细胞的分裂和叶绿素的合成(Converti et al, 2009)。但汪亚俊等(2014)对尖状栅藻(Scenedesmus acuminatus)的研究表明, 低氮条件对尖状栅藻的生长存在促进作用, 由此可以推测, 不同的藻类对培养基中氮素的响应存在种属差异。
微藻光合作用固定的无机碳主要用于多糖、脂类和蛋白质的合成, 氮浓度可以改变藻细胞的碳流分配, 从而影响三大生化组分的相对含量(Siaut et al, 2011)。氮缺乏抑制蛋白质的合成, 促进多糖或脂类的积累(Huppe et al, 1994), 与本实验结果一致。在培养周期内蛋白质含量随着总脂的积累持续下降, 多糖在培养前6天快速积累, 随后开始下降, 结合色素分析结果, 推测出原因可能为:氮素消耗导致含氮化合物的合成受阻(如叶绿素、蛋白质), 因而降低藻细胞的光合效率(Hörtensteiner et al, 2002)。有些藻类在缺氮条件下可以将细胞内富含氮素的蛋白如Rubisco, 作为内在氮源分解合成油脂(Ördög et al, 2012), 这也可以解释本文中可溶性蛋白质含量下降的原因。由于本研究中取样点跨度相对较大, 可能会遗漏一些真实且重要的信息, 我们将在后续研究中增加采样点, 获得更加精确的结果。Zhang等(2013a)对类波氏真眼点藻(Eustigmatos cf. polyphem)研究认为先积累多糖再积累脂类, 并且多糖含量快速降低与脂类含量升高在同一培养阶段出现, 油脂是作为长期储能物质应对营养缺乏与环境胁迫。本研究结果表明:降低氮浓度可以明显促进微拟球藻油脂的积累, 14.9mmol/L浓度组的总脂含量较3.0mmol/L组降低23.3% (P < 0.05), 但总脂产率等于总脂含量与生物质浓度的乘积, 14.9mmol/L浓度组由于培养过程中保持较高的光合效率, 使其生物质浓度显著高于其他3个浓度组, 计算各浓度组的总脂产率, 14.9mmol/L分别比7.5、5.0、3.0mmol/L提高了15.4%、54.6%、102.7%。因此, 在通过低氮限制诱导油脂积累时, 不仅要考虑油脂含量, 同时还要考虑低氮限制对生物质浓度的负面影响, 后续将进一步优化获得一种较优的氮浓度, 既保证藻粉具有高油脂含量, 同时也可以获得高的生物质浓度, 以获得较高的总脂产率。另一个油脂开发的关键问题是油脂品质问题, 包括中性脂比例、叶绿素浓度等, 后续我们将开展氮浓度对微藻油脂品质影响的研究。
微藻中脂肪酸的含量和组成直接影响其营养价值和开发价值(Borowitzka, 2013)。本文中迦得拟微球藻脂肪酸含有丰富的C16:0、C16:1、C18:1、EPA和AA。其中C16:0和C16:1的相对含量可达67%—79% TFA, 相比其他的藻类也有一定的优势(Levy et al, 1992; Khotimchenko, 1993)。除此之外, 该藻中还含有医药和营养价值较高的EPA和AA, 其含量随氮浓度降低而呈降低趋势, 这与Simionato等(2013)对迦得拟微球藻的研究结果一致。本研究显示, 氮浓度降低引起EPA的相对含量减少, C16:0、C16:1和C18:1的相对含量增加。一般来说, 三酰甘油可以由细胞中的两种主要途径产生: (1)经Kennedy途径从头合成脂肪酸, 再合成三酰甘油; (2)从已存在的极性甘油脂转化。由第一路线生成三酰甘油所含的脂肪酸有新合成的分子特征, 即高水平C16:0和C18:1, 而从膜脂回收得到的三酰甘油所含得的脂肪酸具有原脂质分子特征, 即有相当比例的多不饱和脂肪酸的种类如C20:5 (Boudière et al, 2012)。因此可以推测, 低氮浓度条件下迦得拟微球藻脂质积累主要是来源于新合成的脂肪酸, 还有小部分来源于膜甘油酯的回收利用, 因此导致EPA相对含量的降低, 对于新合成与再合成的比例需要更加深入的研究。
叶绿素在光合作用中承担吸收及转化光能的作用, 类胡萝卜素有利于高光条件下过剩光能的耗散及植物体内活性氧的清除(Zhang et al, 2013b)。本研究表明, 各氮浓度下迦得拟微球藻chl a及类胡萝卜素的含量均呈现逐步下降的趋势, 色素含量随氮浓度降低而呈降低趋势, 表明低氮浓度条件下捕光复合物含量减少, PSⅡ光化学活性降低(Wang et al, 2015)。小新月菱形藻(Nitzschiaclosterium f.minut-issima)在氮限制条件下的chl a含量也出现下降(Liu et al, 2012)。本研究中, 各浓度组在培养后期chl a降解, 此时藻细胞中主要色素均为类胡萝卜素, 表明低氮可以促进迦得拟微球藻积累类胡萝卜素。
叶绿素荧光参数Fv/Fm是PSⅡ的最大量子产量, 反映了光合生物潜在最大光合效率, 能够指征PSⅡ的完整性。氮素是组成叶绿体的主要元素, 氮素的缺乏势必对微藻的光合作用造成负面影响, 这主要表现在PSⅡ最大光能转化效率Fv/Fm比值下降。在实验周期内, 迦得拟微球藻的叶绿素荧光参数Fv/Fm和rETR均呈现下降趋势, 并且随氮浓度降低而呈降低趋势。Jiang等(2012)对假微型海链藻(Thalassiosira pseudonana)和杜氏藻(Dunalliela tertiolecta)的研究表明, 在无氮培养后Fv/Fm和Yield的值均下降, 只是两株藻开始下降的时间不同。值得注意的是四种硝酸钾浓度组的Fv/Fm在接种第1天后均出现显著降低的趋势, 推测可能原因为: (1)微拟球藻由扩种培养容器(Φ6.0cm×60cm)重新接种至正式实验的培养容器(Φ3.0cm×60cm)中后, 由于培养容器光径和培养密度的改变, 使单位藻细胞的接受到的光照短时间内增加, 本文作者在对该藻的户外养殖研究中发现, 其对强光适应性较差, 因此, 我们推测Fv/Fm在接种第1天后显著降低原因可能与强光损伤有关, 而随着藻细胞密度逐渐增加和细胞间遮蔽效应增强, 细胞逐渐适应300μmol photons/(m2·s)并进行正常生长; (2)另一种可能的原因推测为:藻细胞重新接种至新鲜培养基中, 由于营养盐浓度(氮、磷等)和培养条件(pH等)的改变, 藻细胞需要一定时间进行适应, 因此会观察到藻细胞生长出现延滞期(图 1), 同时光合效率也相应降低。本文中各浓度组Fv/Fm值由0.60下降到0.35以下, 相对电子传递速率rETR随氮浓度的降低和培养时间的延长而不断降低, 可能是由于在氮素限制的情况下, 藻细胞的类囊体膜受损, 活性降低, PSⅡ反应中心无法恢复, 阻碍了原初电子受体Q的还原, 影响了光合电子的传递, 因而使Yiled和rETR降低(Young et al, 2003; Simionato et al, 2013)。而Fv/Fm和rETR降低则是藻细胞依赖叶黄素循环热耗散的特征(许大全, 2013)。迦得拟微球藻光合放氧速率的变化趋势与叶绿素荧光参数相同, 随氮浓度降低而呈降低趋势。在培养6—16天, 3.0及5.0mmol/L组的光合放氧速率均低于14.9及7.5mmol/L组, 可能由于低氮组藻细胞中氮素无法得到补充, 造成叶绿素合成受阻, 进而影响迦得拟微球藻的光能捕获和传递能力, 使光合速率下降, 这与Pirastru等(2012)研究结果相一致。由此说明, 光合放氧速率下降是由叶绿素含量的减少导致。
当培养基中氮素耗尽后, 为维持藻细胞生存, 一些具有双重功能的蛋白质(如色素蛋白复合物)会被降解, 合成细胞必需的物质。而伴随着色素蛋白复合物的分解, 叶绿体膜系统受到损伤, 同时导致PSⅡ受损, 光合效率下降。培养后期, 可能存在细胞多糖分解代谢提供微藻生长所需的能量和碳源。藻细胞自身会激发一些光保护机制, 如依赖叶黄素循环的能量耗散。迦得拟微球藻在14.9mmol/L硝酸钾浓度下, 可获得较高的总脂、可溶性蛋白、多糖和C20:5产率, 高光合效率是迦得拟微球藻获得较高活性物质产率的主要原因。
4 结论迦得拟微球藻在不同硝酸钾浓度下活性物质积累模式存在差异, 14.9mmol/L硝酸钾浓度条件下可获得较高的总脂、可溶性蛋白、多糖和C20:5产率。迦得拟微球藻PSⅡ活性随氮浓度降低而呈降低趋势, 叶绿素减少, PSⅡ活性受损是不同细胞物质积累模式存在差异的重要原因之一。
| 许大全, 2013. 光合作用学. 北京: 科学出版社, 153 |
| 吴琼芳, 张莹, 罗舒怀, 等, 2016. 氮限制对普通小球藻积累油脂过程中生化组成与光合生理的影响. 植物科学学报, 34(2): 280–288 |
| 邱昌恩, 况琪军, 刘国祥, 等, 2005. 不同氮浓度对绿球藻生长及生理特性的影响. 中国环境科学, 25(4): 408–411 DOI:10.3321/j.issn:1000-6923.2005.04.006 |
| 汪亚俊, 孙明哲, 李爱芬, 等, 2014. 不同氮素水平对产油尖状栅藻生长及光合生理的影响. 中国生物工程杂志, 34(12): 51–58 |
| 高保燕, 张成武, 万凌琳, 等, 2014. 真眼点藻纲的系统分类、生物学特性及应用研究. 水生生物学报, 38(5): 945–956 |
| 曹春晖, 孙世春, 麦康森, 等, 2006. 氮浓度对四株海洋绿藻总脂含量和脂肪酸组成的影响. 海洋湖沼通报,(3): 79–84 DOI:10.3969/j.issn.1003-6482.2006.03.012 |
| 魏东, 俞建中, 2014. 微藻在水产养殖和新型饲料开发中的应用. 海洋与渔业∙水产前沿,(4): 84–89 |
| Andersen R A, 2005. Algal Culturing Techniques. Oxford, Britain: Elsevier Academic Press, |
| Borowitzka M A, 2013. High-value products from microalgae-their development and commercialisation. Journal of Applied Phycology, 25(3): 743–756 DOI:10.1007/s10811-013-9983-9 |
| Boudière L, Botté C Y, Saidani N, et al, 2012. Galvestine-1, a novel chemical probe for the study of the glycerolipid homeostasis system in plant cells. Molecular BioSystems, 8(8): 2023–2035 DOI:10.1039/c2mb25067e |
| Converti A, Casazza A A, Ortiz E Y, et al, 2009. Effect of temperature and nitrogen concentration on the growth and lipid content of Nannochloropsis oculata and Chlorella vulgaris for biodiesel production. Chemical Engineering and Processing:Process Intensification, 48(6): 1146–1151 DOI:10.1016/j.cep.2009.03.006 |
| Gao S, Gu W H, Xiong Q, et al, 2015. Desiccation enhances phosphorylation of PSⅡ and affects the distribution of protein complexes in the thylakoid membrane. Physiologia Plantarum, 153(3): 492–502 |
| Geider R J, La Roche J, Greene R M, et al, 1993. Response of the photosynthetic apparatus of Phaeodactylum tricornutum (Bacillariophyceae) to nitrate, phosphate, or iron starvation. Journal of Phycology, 29(6): 755–766 DOI:10.1111/j.0022-3646.1993.00755.x |
| Ho S H, Chen C Y, Chang J S, 2012. Effect of light intensity and nitrogen starvation on CO2 fixation and lipid/carbohydrate production of an indigenous microalga Scenedesmus obliquus CNW-N. Bioresource Technology, 113: 244–252 DOI:10.1016/j.biortech.2011.11.133 |
| Hörtensteiner S, Feller U, 2002. Nitrogen metabolism and remobilization during senescence. Journal of Experimental Botany, 53(370): 927–937 DOI:10.1093/jexbot/53.370.927 |
| Huppe H C, Turpin D H., 1994. Integration of carbon and nitrogen metabolism in plant and algal cells. Annual review of Plant Physiology and Plant Molecular Biology, 45(1): 577–607 DOI:10.1146/annurev.pp.45.060194.003045 |
| Illman A M, Scragg A H, Shales S W, 2000. Increase in Chlorella strains calorific values when grown in low nitrogen medium. Enzyme and Microbial Technology, 27(8): 631–635 DOI:10.1016/S0141-0229(00)00266-0 |
| Jiang Y L, Yoshida T, Quigg A, 2012. Photosynthetic performance, lipid production and biomass composition in response to nitrogen limitation in marine microalgae. Plant Physiology and Biochemistry, 54: 70–77 DOI:10.1016/j.plaphy.2012.02.012 |
| Khotimchenko S V, 1993. Fatty acids of green macrophytic algae from the Sea of Japan. Phytochemistry, 32(5): 1203–1207 DOI:10.1016/S0031-9422(00)95092-1 |
| Khozin-Goldberg I, Shrestha P, Cohen Z, 2005. Mobilization of arachidonyl moieties from triacylglycerols into chloroplastic lipids following recovery from nitrogen starvation of the microalga Parietochloris incisa. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 1738(1-3): 63–71 |
| Levy I, Maxim C, Friedlander M, 1992. Fatty acid distribution among some red algal macrophytes. Journal of Phycology, 28(3): 299–304 DOI:10.1111/j.0022-3646.1992.00299.x |
| Liu W H, Huang Z W, Li P, et al, 2012. Formation of triacylglycerol in Nitzschia closterium f. minutissima under nitrogen limitation and possible physiological and biochemical mechanisms. Journal of Experimental Marine Biology and Ecology, 418-419: 24–29 DOI:10.1016/j.jembe.2012.03.005 |
| Ördög V, Stirk W A, Bálint P, et al, 2012. Changes in lipid, protein and pigment concentrations in nitrogen-stressed Chlorella minutissima cultures. Journal of Applied Phycology, 24(4): 907–914 DOI:10.1007/s10811-011-9711-2 |
| Pirastru L, Darwish M, Chu F L, et al, 2012. Carotenoid production and change of photosynthetic functions in Scenedesmus sp.exposed to nitrogen limitation and acetate treatment. Journal of Applied Phycology, 24(1): 117–124 DOI:10.1007/s10811-011-9657-4 |
| Rebolloso-Fuentes M M, Navarro-Pérez A, García-Camacho F, et al, 2001. Biomass nutrient profiles of the microalga Nannochloropsis. Journal of Agricultural and Food Chemistry, 49(6): 2966–2972 DOI:10.1021/jf0010376 |
| Recht L, Zarka A, Boussiba S, 2012. Patterns of carbohydrate and fatty acid changes under nitrogen starvation in the microalgae Haematococcus pluvialis and Nannochloropsis sp. Applied Microbiology and Biotechnology, 94(6): 1495–1503 DOI:10.1007/s00253-012-3940-4 |
| Shekh A Y, Shrivastava P, Krishnamurthi K, et al, 2013. Stress-induced lipids are unsuitable as a direct biodiesel feedstock:A case study with Chlorella pyrenoidosa. Bioresource Technology, 138: 382–386 DOI:10.1016/j.biortech.2013.04.010 |
| Siaut M, Cuiné S, Cagnon C, et al, 2011. Oil accumulation in the model green alga Chlamydomonas reinhardtii:character rization, variability between common laboratory strains and relationship with starch reserves. BMC Biotechnology, 11: 7 DOI:10.1186/1472-6750-11-7 |
| Simionato D, Block M A, La Rocca N, et al, 2013. The response of Nannochloropsis gaditana to nitrogen starvation includes De Novo biosynthesis of triacylglycerols, a decrease of chloroplast galactolipids, and reorganization of the photosynthetic apparatus. Eukaryotic Cell, 12(5): 665–676 DOI:10.1128/EC.00363-12 |
| Van Vooren G, Le Grand F, Legrand J, et al, 2012. Investigation of fatty acids accumulation in Nannochloropsis oculata for biodiesel application. Bioresource Technology, 124: 421–432 DOI:10.1016/j.biortech.2012.08.009 |
| Wang H T, Meng Y Y, Cao X P, et al, 2015. Coordinated response of photosynthesis, carbon assimilation, and triacylglycerol accumulation to nitrogen starvation in the marine microalgae Isochrysis zhangjiangensis (Haptophyta). Bioresource Technology, 177: 282–288 DOI:10.1016/j.biortech.2014.11.028 |
| Whittle S J, Casselton P J, 1975. The chloroplast pigments of the algal classes Eustigmatophyceae and Xanthophyceae. I. Eustigmatophyceae. British Phycological Journal, 10(2): 179–191 DOI:10.1080/00071617500650171 |
| Widjaja A, Chien C C, Ju Y H., 2009. Study of increasing lipid production from fresh water microalgae Chlorella vulgaris. Journal of the Taiwan Institute of Chemical Engineers, 40(1): 13–20 DOI:10.1016/j.jtice.2008.07.007 |
| Yao C H, Ai J N, Cao X P, et al, 2012. Enhancing starch production of a marine green microalga Tetraselmis subcordiformis through nutrient limitation. Bioresource Technology, 118: 438–444 DOI:10.1016/j.biortech.2012.05.030 |
| Young E B, Beardall J, 2003. Rapid ammonium-and nitrate-induced perturbations to Chl a fluorescence in nitrogen-stressed Dunaliella tertiolecta (Chlorophyta). Journal of Phycology, 39(2): 332–342 DOI:10.1046/j.1529-8817.2003.02109.x |
| Zhang J J, Wan L L, Xia S, et al, 2013a. Morphological and spectrometric analyses of lipids accumulation in a novel oleaginous microalga, Eustigmatos cf. polyphem (Eustigma-t-ophyceae). Bioprocess and Biosystems Engineering, 36(8): 1125–1130 DOI:10.1007/s00449-012-0866-2 |
| Zhang Y M, Chen H, He C L, et al, 2013b. Nitrogen starvation induced oxidative stress in an oil-producing green alga Chlorella sorokiniana C3. PLoS One, 8(7): e69225 DOI:10.1371/journal.pone.0069225 |
 2019, Vol. 50
2019, Vol. 50


