
中国海洋湖沼学会主办。
文章信息
- 陈田田, 宋书群, 刘云, 李才文. 2019.
- CHEN Tian-Tian, SONG Shu-Qun, LIU Yun, LI Cai-Wen. 2019.
- 2015—2016年长江口及其邻近海域甲藻群落与阿米巴藻感染的周年变化
- THE 2015-2016 ANNUAL VARIATION OF DINOFLAGELLATE COMMUNITY AND AMOEBOPHRYA INFECTIONS IN THE CHANGJIANG (YANGTZE) RIVER ESTUARY AND ADJACENT WATERS
- 海洋与湖沼, 50(1): 139-148
- Oceanologia et Limnologia Sinica, 50(1): 139-148.
- http://dx.doi.org/10.11693/hyhz20180600140
-
文章历史
- 收稿日期:2018-06-04
- 收修改稿日期:2018-07-16
2. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院海洋大科学研究中心 青岛 266071;
4. 中国科学院大学 北京 100049
2. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy of Science, Beijing 100049, China
甲藻是近海海洋浮游植物的主要类群, 其种类和数量仅次于硅藻, 是近海初级生产力的重要贡献者, 也是主要的有害藻华生物, 在近海生态系统中发挥重要的作用。阿米巴藻(Amoebophrya spp.)是一类可感染海洋浮游甲藻类的寄生性甲藻, 能够特异性感染一些有害藻华甲藻, 其大量增殖能够裂解、破碎宿主细胞, 从而对有害藻华产生下行控制作用(Coats et al, 1996; Chambouvet et al, 2008)。自1894年Nicolas Koeppen首次报道阿米巴藻感染以来, 研究人员相继在北大西洋、北太平洋和地中海的30个属70余种浮游甲藻中发现了阿米巴藻感染现象(Chambouvet et al, 2008; Salomon et al, 2009; Alves-de-Souza et al, 2012; 李才文, 2014; Li et al, 2014)。
长江口海域是我国有害藻华高发区之一, 浮游植物相关研究一直是该海域的研究重点(何青等, 2009; Li et al, 2010; 刘录三等, 2011; 张璇等, 2012; 于仁成等, 2017; Chen et al, 2017)。然而关于阿米巴藻的研究较少, Li等(2014)首次报道了长江口水域阿米巴藻感染浮游甲藻的情况, 计算了其感染率, 并分析了其遗传多样性。本研究基于2015年2月—2016年1月在长江口及其邻近海域开展的10次现场调查, 研究了浮游甲藻的种类组成、时空分布特征, 分析了阿米巴藻的宿主种类及感染率的周年变化, 为长江口及其邻近海域的浮游植物生态学研究提供基础资料, 有助于丰富和完善我们对于甲藻生物学和生态学的认知, 为进一步揭示阿米巴藻在甲藻藻华消长过程中的作用机理奠定基础。
1 材料与方法 1.1 调查站位与时间搭载“科学3”号和“北斗”号科学考察船, 于2015年2月—2016年1月对长江口及其邻近海域(28°00′—33°00′N、121°00′—124°00′E)进行多学科综合调查(表 1), 共布设26个调查站位(图 1)。
| 航次 | 采样时间 | 采样站位数 |
| 2015-02 2015-03 2015-04 2015-05 2015-06 2015-07 2015-09 2015-10 2015-11 2016-01 |
20150202—20150206 20150308—20150315 20150412—20150423 20150515—20150522 20150618—20150628 20150719—20150727 20150915—20150920 20151014—20151020 20151120—20151129 20160109—20160121 |
26 26 26 26 26 25 19 26 26 26 |
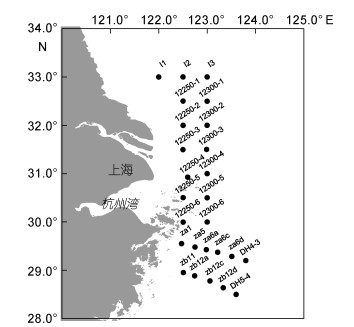 |
| 图 1 研究区域与调查站位 Fig. 1 The study area and sampling stations |
现场样品的采集、保存按照《海洋调查规范》(GB17378.3-2007)进行。各站位采用12L Niskin采水器采集表层海水, 取250mL水样置于聚丙烯(PE)瓶中, 立即加入中性福尔马林溶液固定保存(终浓度为2%)。温度、盐度等指标由CTD仪(SBE917)获得。
浮游甲藻鉴定与细胞计数采用Utermhl方法:取20mL浮游植物亚样品于Hydro-bios计数框内静置沉降24h, 在IX71倒置显微镜(Olympus)×200或×400倍下进行甲藻物种鉴定和计数。甲藻物种鉴定、中文名及拉丁文名参照潘玉龙等(2012), 细胞丰度的统计和误差处理参考孙军等(2002)。另取100mL浮游植物亚样品参考Li等(2017)样品处理和染色方法, 制备样品封片。封片干燥后, 在BX53正置显微镜(Olympus)×200或×400倍下进行阿米巴藻宿主甲藻的物种鉴定与细胞计数。阿米巴藻在感染末期会在宿主细胞内形成“蜂巢状”的多核体结构, 与未感染甲藻细胞形成鲜明对比。计算阿米巴藻的感染率时, 样品中至少保证检测到100个宿主甲藻细胞以使结果具有统计意义。
1.3 数据处理浮游甲藻的优势种根据每个种的优势度值(Y)来确定:
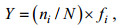 (1)
(1)式中, ni为i种的个体数, N为所有种类总个体数, fi为第i种出现的频率。Y≥0.02的种类为全年调查的优势种。
阿米巴藻感染率计算方法如下:
 (2)
(2)本研究数据分析和图表绘制分别运用Golden Software Surfer 12.0和Origin Version 8.5软件进行; 采用SPSS 16.0软件对甲藻丰度、阿米巴藻感染率及环境参数进行Pearson相关性分析。
2 结果与分析 2.1 环境特征2015年2月—2016年1月长江口及其邻近海域表层海水温度由2月[(11.17±3.22)℃]到7月[(27.09±0.70)℃]逐渐升高, 随后逐渐降低。夏季与秋季海水表层温度较高, 介于17.72—28.15℃之间。全年表层海水温度由北至南, 从近岸到外海呈现出逐渐升高的趋势(图 2)。受到近岸冲淡水以及沿岸流的影响, 2—4月调查区域水温整体较低, 呈现出调查区域的西北部较低, 东南部较高的趋势, 最低值均出现在近岸海域; 5—10月表层海水温度整体较高, 东南部水温高于其他海域; 11—1月, 表层海水温度分布趋势与2—4月类似。
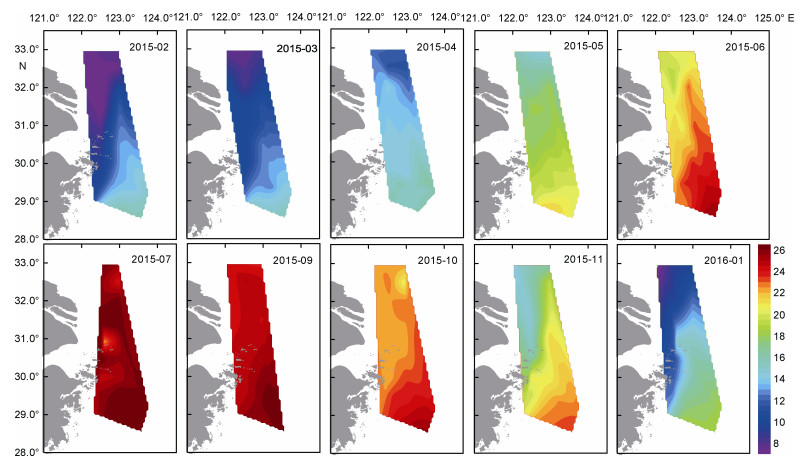 |
| 图 2 长江口及其邻近海域温度平面分布的周年变化(℃) Fig. 2 The annual variation of horizontal distribution of temperature (℃) in the Changjiang (Yangtze) River estuary and adjacent areas |
受长江冲淡水以及黑潮分支的影响, 调查区域呈现出明显的盐度梯度分布趋势(图 3)。夏季与秋季表层盐度均值显著低于其他季节(P < 0.05)。2—4月, 海水盐度值相对较高, 30等盐线位于123°E附近, 盐度高值区均出现在调查区域的东南部; 5—7月, 随着长江径流量的增加, 调查区域盐度整体较低, 介于14.41—32.62, 平均值为28.93±3.97。9—1月, 表层盐度分布趋势一致, 均呈现出近岸到外海逐渐升高的趋势, 30等盐线逐渐向西收缩, 最高值均出现在DH5-4站位。
 |
| 图 3 长江口及其邻近海域盐度平面分布的周年变化 Fig. 3 The annual variation of horizontal distribution of salinity in the Changjiang (Yangtze) River estuary and adjacent areas |
2015年2月—2016年1月在长江口及其邻近海域共检出浮游甲藻38种(含变种), 隶属于15属(表 2)。原多甲藻属(Protoperidinium Bergh)和原甲藻属(Prorocentrum Ehrenberg)出现物种较多, 分别为7种和5种。环沟藻(Gyrodinium sp.)、微小原甲藻(Prorocentrum minimum)、亚历山大藻(Alexandrium sp.)、叉状角藻(Ceratium furca)、梭角藻(Ceratium fusus)、红色赤潮藻(Akashiwo sanguinea)、米氏凯伦藻(Karenia mikimotoi)和裸甲藻(Gymnodinium sp.)在各调查月份均有出现, 而灰白下沟藻(Katodinium glaucum)仅在10月份检测到。调查海域浮游甲藻群落结构相对稳定, 甲藻种类最多为26种, 出现在2015年9月份和10月份; 甲藻种类最少为16种, 出现在2015年2月份。
| 种名 | 拉丁文名 | 2月 | 3月 | 4月 | 5月 | 6月 | 7月 | 9月 | 10月 | 11月 | 1月 |
| 螺旋环沟藻 | Gyrodinium spirale | ++++ | ++ | +++ | +++ | ||||||
| 环沟藻 | Gyrodinium sp. | +++ | +++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | +++ | +++ |
| 微小原甲藻 | Prorocentrum minimum | ++ | ++ | +++++ | +++ | +++++ | +++++ | +++ | +++ | ++ | ++++ |
| 纤细原甲藻 | Prorocentrum gracile | ++ | +++ | +++ | ++ | + | |||||
| 反曲原甲藻 | Prorocentrum sigmoides | + | ++ | ++ | + | ||||||
| 东海原甲藻 | Prorocentrum donghaiense | ++ | +++++ | ++ | ++++ | ++++ | ++ | + | ++ | ||
| 海洋原甲藻 | Prorocentrum micans | +++ | ++ | ||||||||
| 锥状斯氏藻 | Scrippsiella trochoidea | ++ | ++ | ++++ | +++ | ++++ | +++ | ++ | ++ | ++ | |
| 塔玛亚历山大藻 | Alexandrium tarmarense | ++ | ++ | + | |||||||
| 微小亚历山大藻 | Alexandrium minutum | ++ | ++ | + | + | ||||||
| 链状亚历山大藻 | Alexandrium catenella | ++ | ++ | +++ | +++ | ++++ | +++ | +++ | ++++ | ||
| 亚历山大藻 | Alexandrium sp. | ++ | +++ | +++ | ++ | ++ | ++ | +++ | ++ | ++ | ++ |
| 斯氏原多甲藻 | Protoperidinium stenii | ++ | ++ | ++ | + | ||||||
| 卵形原多甲藻 | Protoperidinium ovum | ++ | +++ | + | |||||||
| 光甲原多甲藻 | Protoperidinium pallidum | ++ | +++ | ||||||||
| 厚甲原多甲藻 | Protoperidinium crassipes | ++ | ++ | ++ | |||||||
| 锥形原多甲藻 | Protoperidinium conicum | ++ | +++ | +++ | ++ | ++ | + | ||||
| 灰甲原多甲藻 | Protoperidinium pellucidum | ++ | +++ | + | ++ | ++ | ++ | ++ | |||
| 原多甲藻 | Protoperidinium sp. | ++ | +++ | ++++ | +++ | ++ | ++ | +++ | + | + | |
| 具刺膝沟藻 | Gonyaulax spinifera | + | ++ | +++ | ++ | ++++ | ++++ | ++++ | ++ | ||
| 多纹膝沟藻 | Gonyaulax polygramma | + | +++ | ++ | ++++ | ++++ | +++ | ++ | ++ | + | |
| 三角角藻 | Ceratium tripos | ++ | ++ | +++ | ++++ | ++++ | ++ | +++ | ++ | + | |
| 三角角藻大西洋变种 | Ceratium tripos var. atlanticum | ++ | +++ | +++ | ++ | ||||||
| 叉状角藻 | Ceratium furca | ++ | +++ | ++ | ++ | +++ | +++ | +++ | ++++ | ++ | ++ |
| 梭角藻 | Ceratiumfusus | ++ | + | + | ++ | ++++ | ++++ | +++ | +++ | + | + |
| 红色赤潮藻 | Akashiwo sanguinea | ++ | +++ | ++ | ++ | +++ | +++ | +++ | ++++ | ++ | ++ |
| 米氏凯伦藻 | Karenia mikimotoi | ++ | ++ | +++ | +++ | +++ | +++ | + | ++ | +++ | ++ |
| 简单裸甲藻 | Gymnodinium simplex | + | ++ | + | ++ | + | + | ||||
| 裸甲藻 | Gymnodinium sp. | ++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ |
| 鳍藻 | Dinophysis sp. | + | + | ++ | + | ||||||
| 具尾鳍藻 | Dinophysis caudata | + | ++ | ++ | +++ | +++ | +++ | + | + | ||
| 纺锤前沟藻 | Amphidinium fusiforme | ++ | + | ++ | |||||||
| 前沟藻 | Amphidinium sp. | ++ | ++ | +++ | + | ||||||
| 灰白下沟藻 | Katodinium glaucum | ++ | |||||||||
| 多边舌甲藻 | Lingulodinium polyedrum | + | ++ | ++ | ++ | ||||||
| 刺尖甲藻 | Oxytoxum scolopax | + | + | + | ++ | ||||||
| 节杖尖甲藻 | Oxytoxum sceptrum | + | + | ++ | |||||||
| 蓝色贝其那藻 | Balechina coerulea | + | +++ | ++ | ++ | + | |||||
| 注: +:1—10cells/L; ++:10—100cells/L; +++:100—1000cells/L; ++++:1000—10000cells/L; +++++: > 10000cells/L | |||||||||||
各调查月份的主要优势甲藻及其优势度示于表 3。环沟藻是该海域最主要的优势种群, 年内总共有8个月为优势种; 裸甲藻在调查区内检出率也较高, 特别是在2016年1月, 占有绝对优势; 东海原甲藻、纤细原甲藻分别在4月、11月份检出为优势种。总体上, 调查海域甲藻优势度季节变化明显, 全年优势种既有交叉又有演替。有时优势种类多, 但数量优势不明显, 有时则单一种类数量占绝对优势。6月, 甲藻优势种有8种, 优势度普遍较低, 数量优势不明显; 4月, 东海原甲藻是唯一的优势种, 优势度为0.75, 优势地位明显。
| 优势种 | 拉丁文名 | 优势度 | |||||||||
| 螺旋环沟藻 | Gyrodinium spirale | 0.06 | |||||||||
| 环沟藻 | Gyrodinium sp. | 0.71 | 0.56 | 0.53 | 0.24 | 0.24 | 0.48 | 0.44 | 0.37 | ||
| 微小原甲藻 | Prorocentrum minimum | 0.08 | 0.19 | 0.23 | 0.05 | ||||||
| 纤细原甲藻 | Prorocentrum gracile | 0.02 | |||||||||
| 东海原甲藻 | Prorocentrum donghaiense | 0.75 | |||||||||
| 锥状斯氏藻 | Scrippsiella trochoidea | 0.04 | 0.07 | 0.02 | |||||||
| 链状亚历山大藻 | Alexandrium catenella | 0.02 | 0.07 | ||||||||
| 原多甲藻 | Protoperidinium sp. | 0.06 | |||||||||
| 具刺膝沟藻 | Gonyaulax spinifera | 0.03 | |||||||||
| 多纹膝沟藻 | Gonyaulax polygramma | 0.02 | |||||||||
| 叉状角藻 | Ceratium furca | 0.09 | 0.03 | 0.07 | 0.18 | ||||||
| 梭角藻 | Ceratiumfusus | 0.05 | 0.08 | 0.03 | 0.03 | ||||||
| 三角角藻 | Ceratium tripos | 0.04 | 0.09 | 0.18 | |||||||
| 红色赤潮藻 | Akashiwo sanguinea | 0.08 | 0.07 | 0.03 | 0.05 | ||||||
| 裸甲藻 | Gymnodinium sp. | 0.07 | 0.09 | 0.05 | 0.06 | 0.33 | |||||
| 注:空白区域表示该种类的优势度 < 0.02 | |||||||||||
本次调查中, 长江口及其邻近海域浮游甲藻的丰度变化较大, 介于9.06×103—6.10×106cells/L之间, 平均值为6.62×105cells/L, 丰度最高值出现在2015年4月份的DH5-4站位, 最低值出现在2015年11月份的12250-4站位。甲藻丰度的周年变化曲线呈单峰型, 高峰值出现在4月份(图 4)。除了5月和9月甲藻丰度相对较低外, 4—10月浮游甲藻丰度水平较高。6月为全年次高值, 丰度为1.92×105cells/L。而2015年2—3月、11月, 2016年1月浮游甲藻丰度水平较低, 2月份甲藻丰度最低, 为9.06×103cells/L。方差分析显示, 四个季度之间甲藻丰度差异不显著(P > 0.05), 但月份之间甲藻丰度存在显著差异(P < 0.05)。
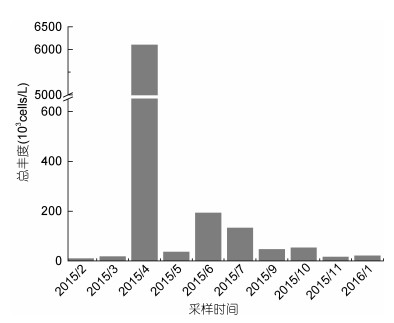 |
| 图 4 长江口及其邻近海域浮游甲藻种类与丰度的周年变化 Fig. 4 The annual variation of species and abundance of dinoflagellate in the Changjiang (Yangtze) River estuary and adjacent areas |
调查海域浮游甲藻丰度(×103cells/L)的平面分布因月份而异(图 5)。2月和3月份整个海区甲藻丰度水平很低, 但是分布布局有很大差异。2月份近岸数量比远岸稍高, 3月则相反。4月和5月这两个月份的丰度相差较大, 但是分布布局相近, 高值区位于调查海域南部, 其他海域的丰度很低。6月份甲藻丰度高值区位于北部近岸海域, 其他区域丰度较低。7月和9月的分布格局相近, 但是丰度有很大差距。高值区均出现在调查区域的北部海域, 9月除了在北部出现高值以外, 南部的数量也较高。10月在北部中央形成一个密集中心。11月和1月这两个月份调查区域甲藻丰度整体较低, 分别在远岸和北部区域出现高值区。
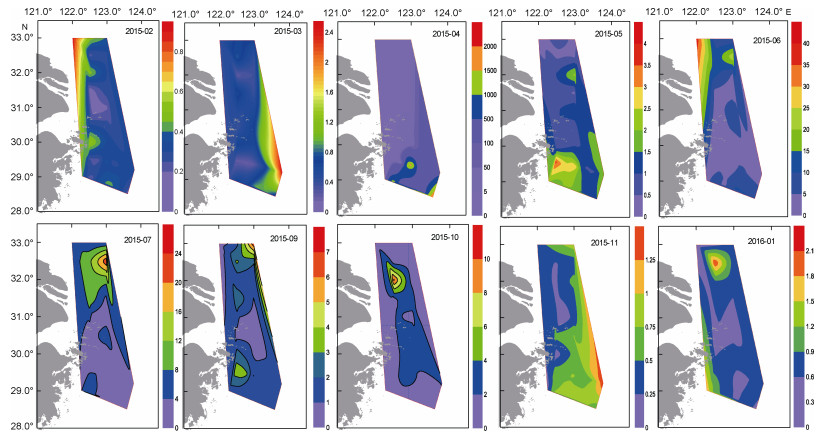 |
| 图 5 长江口及其邻近海域甲藻丰度(×103cells/L)平面分布的周年变化 Fig. 5 The annual variation of horizontal distribution of dinoflagellate cell abundance (×103cells/L) in the Changjiang (Yangtze) River estuary and adjacent areas |
2015年2月—2016年1月, 在调查海域共检测到14种甲藻被阿米巴藻寄生感染, 分别为螺旋环沟藻(Gyrodinium spirale)、微小原甲藻(Prorocentrum minimum)、东海原甲藻(Prorocentrum donghaiense)、海洋原甲藻(Prorocentrum micans)、锥状斯氏藻(Scrippsiella trochoidea)、亚历山大藻(Alexandrium sp.)、原多甲藻(Protoperidinium sp.)、多纹膝沟藻(Gonyaulax polygramma)、三角角藻(Ceratium tripos)、叉状角藻(Ceratium furca)、梭角藻(Ceratium fusus)、红色赤潮藻(Akashiwo sanguinea)、米氏凯伦藻(Karenia mikimotoi)和裸甲藻(Gymnodinium sp.) (图 6)。调查结果显示, 阿米巴藻宿主种类及感染率呈现出明显的季节差异, 夏、秋两季阿米巴藻宿主种类和感染率明显高于冬、春两季。
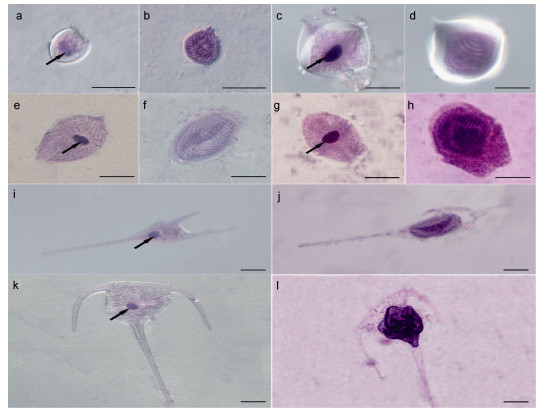 |
| 图 6 苏木精-伊红染色(H & E)后, 海洋浮游甲藻的光学显微镜照片 Fig. 6 The photomicrographs of marine dinoflagellates processed with the modified hematoxylin and eosin (H & E) protocol 注:经H & E染色后, 细胞核呈不同程度的蓝紫色, 细胞质呈红色或粉色。在感染细胞(b, d, f, h, j, l)内, 可观察到特征性的“蜂巢”状多核体结构, 与健康甲藻(a, c, e, g, i, k)紧致密实的细胞核结构(箭头)形成鲜明对比。a, b:微小原甲藻; c, d:原多甲藻; e, f:螺旋环沟藻; g, h:红色赤潮藻; i, j:叉状角藻; k, l:三角角藻 |
2月, 浮游甲藻丰度较低, 未发现阿米巴藻的寄生感染。3月, 仅检测到螺旋环沟藻被感染, 感染率为0.45%。4月, 共检出8种浮游甲藻被阿米巴藻寄生感染, 微小原甲藻感染率最高, 为3.23%;锥状斯氏藻感染率次之, 为2.73%。调查期间, 该海域暴发了东海原甲藻藻华, 藻密度高达1.94×106cells/L, 然而阿米巴藻感染率仅为0.01%;米氏凯伦藻因藻密度低于统计水平, 未能计算出感染率。5月, 共检出8种甲藻被感染, 东海原甲藻感染率最高, 为3.81%。6月, 共检出11种甲藻被感染, 是全年中感染甲藻最多的月份; 其中, 东海原甲藻感染率最高, 为3.26%, 其次为亚历山大藻, 为1.76%。7月, 共检出7种甲藻被感染, 梭角藻感染率最高, 为4.79%。9—10月, 分别有6种、5种甲藻被感染; 10月, 叉状甲藻感染率是全年最高值, 为5.13%。11月, 4种甲藻被感染, 螺旋环沟藻感染率为0.83%, 东海原甲藻、锥状斯氏藻与原多甲藻检测出被阿米巴藻寄生感染, 但均未达到统计水平。2016年1月, 仅检出螺旋环沟藻和裸甲藻被阿米巴藻感染, 感染率分别为0.14%、0.16% (图 7)。
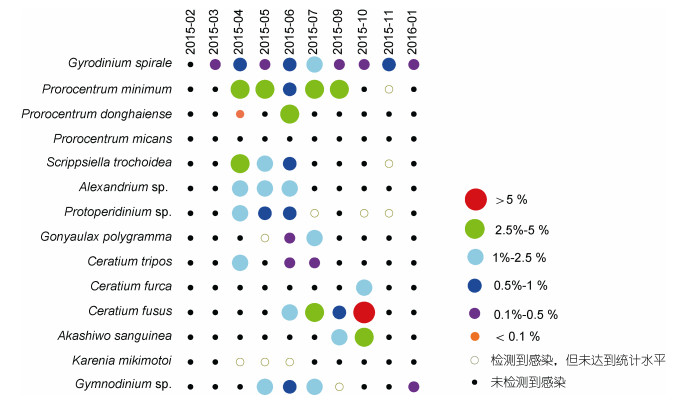 |
| 图 7 长江口及其邻近海域阿米巴藻宿主种类及感染率的周年变化 Fig. 7 Host cell abundance and the prevalence of Amoebophrya infection in planktonic samples collected from Changjiang (Yangtze) River estuary and adjacent areas from February 2015 to January 2016 |
阿米巴藻与温度、盐度相关性分析结果见表 4:除10、11月外, 阿米巴藻与温度均呈正相关关系; 4—5月, 该寄生性甲藻与温度呈现出极显著的正相关关系。6—11月, 阿米巴藻与盐度均呈负相关关系; 6—7月, 呈现出显著的负相关关系。
| 不同时间下阿米巴藻感染率 | ||||||||||
| 2015-02 | 2015-03 | 2015-04 | 2015-05 | 2015-06 | 2015-07 | 2015-09 | 2015-10 | 2015-11 | 2016-01 | |
| 温度 | - | 0.148* | 0.353** | 0.241** | 0.088 | 0.105 | 0.208 | –0.068 | –0.320* | 0.137 |
| 盐度 | - | 0.143 | 0.150 | 0.035 | –0.242* | –0.168* | –0.027 | –0.071 | –0.070 | 0.093 |
长江口地处黄海和东海的分界处, 是多种水系混合组成的水体, 既有近岸广温低盐种类、半咸水种类, 又有钱塘江入海、长江冲淡水带来的淡水种类, 还有随台湾暖流所携带的暖水性种类, 因此该海域浮游植物群落组成比较复杂(刘子琳等, 1994; 苏纪兰, 2001; 何青等, 2009)。研究人员分析了过去50年中长江口及其邻近海域浮游植物的演替规律, 发现硅藻和甲藻种类数均呈上升趋势, 其中甲藻的上升趋势更为明显, 从而导致其占有比例逐渐上升(Jiang et al, 2014)。1984—2000年, 长江口海域硅藻所占比例从85%降到60%, 而且该海域有害藻华开始由硅藻类藻华向甲藻类藻华转变(Zhou et al, 2008)。研究者普遍认为该海域水体环境的长期变化, 特别是营养盐浓度和结构的变动, 是导致甲藻类所占比例升高以及有害藻华优势类群演变的主要原因(Zhou et al, 2008; 于仁成等, 2017)。本研究航次调查期间, 共检出38种浮游甲藻, 甲藻群落结构相对稳定, 2月种类数较少, 为16种; 9月和10月为全年种类最多, 共26种。其中, 膝沟藻目占有绝对优势, 这与李照等(2017)对调查海域2013年浮游植物的研究结果相似。按照甲藻的生存策略, 可将甲藻分为三大基本类群:耐受物理扰动的类群、耐受营养胁迫的类群和集群种类—耐受化学扰动的类群(Smayda et al, 2003)。长江口存在较大的物理扰动, 伴随着人类活动加剧引起营养盐比例失衡及营养盐含量的增加, 使得该海域同时具有上述三大生境特征, 而膝沟藻目的生态习性介于上述三者之间, 可能是膝沟藻目在该海域长期占据优势的主要原因。
研究表明, 长江口海域浮游植物丰度随季节变化、呈单周期型, 在夏季形成一年中浮游植物的最高峰(林峰竹等, 2008), 本文针对浮游甲藻的研究也得到了相似的结果。冬季1月和2月份, 甲藻丰度处于全年的最低时期, 这是由于较低的温度限制了甲藻的生长, 研究结果与以往长江口浮游植物的变化规律相似(刘笑等, 2014)。3月, 随着温度的升高, 甲藻的丰度和多样性逐渐升高(图 5)。4月, 东海原甲藻占据绝对优势, 藻密度变化范围为0.03×103—1.94× 106cells/L, 最大值出现在DH5-4站位, 水体成褐红色, 呈条状, 与正常海域有明显的界限区分。从2000年开始, 每年4月底或5月初, 长江口海域几乎都发生东海原甲藻赤潮(王金辉等, 2003)。众多研究表明, 东海原甲藻属于广温广盐藻种(适温、适盐范围分别为15—25℃和14—32), 生长速率较高, 运动能力强且具有昼夜垂直移动特性, 能够利用有机态营养物质, 在海流交汇的紊乱水体中具有强适应能力进而形成藻华(王金辉等, 2003)。随着藻华的消退, 东海原甲藻优势地位渐失, 环沟藻成为该海域的主要优势种且甲藻整体丰度降低(5—10月), 但甲藻种类数变化不大。
海洋生态系统中, 阿米巴藻寄生感染是一种常见的种间作用, 也是一种存在于浮游甲藻中的普遍现象; 该类寄生性甲藻感染宿主甲藻后, 在宿主甲藻细胞内大量增殖, 最终导致宿主甲藻破裂死亡(Alves-de-Souza et al, 2012)。阿米巴藻世代时间短(2—3d)、繁殖能力强, 可以在短时间内扩散、增殖。尽管, 在非甲藻藻华期间, 宿主甲藻感染率一般维持在较低水平(约2%); 然而, 在甲藻藻华期间, 该类寄生性甲藻能够形成较高的感染率(高达80%), 导致宿主细胞大量死亡(Salomon et al, 2009)。Nishitani等(1985)研究发现, 在美国西海岸地区, 阿米巴藻在链状亚历山大藻(Alexandrium catenella)中的感染率为30%—40%; Coats等(1996)对美国切萨皮克湾支流的Gyrodinium uncatenum藻华消长过程进行了研究, 发现阿米巴藻的感染率最高可达80%, 即每天约有54%的宿主细胞由于该寄生性甲藻的感染而死亡。研究表明, 阿米巴藻能够有效阻滞宿主甲藻藻华的形成, 并导致藻华的消退(Chambouvet et al, 2008; Salomon et al, 2009; Chen et al, 2017)。
本研究中, 我们首次利用苏木精-伊红染色技术分析了2015—2016年长江口及其邻近海域阿米巴藻宿主种类及其感染率的周年变化, 发现有14种浮游甲藻被阿米巴藻寄生感染, 且该类寄生性甲藻的宿主种类和感染率呈现明显的季节差异; 该海域阿米巴藻感染率范围为0.006%—5.13%, 与Li等(2014)的相关研究结果一致。2—3月, 调查海域未发现阿米巴藻对东海原甲藻的寄生感染; 4月, 该海域爆发了东海原甲藻藻华, 而阿米巴藻感染率仅为0.01%; 5月, 东海原甲藻藻华消退, 未检测到阿米巴藻对东海原甲藻的寄生感染; 6月, 阿米巴藻在东海原甲藻中的感染率为3.26 %。同样地, Li等(2014) 2012年对该海域研究发现, 在藻华甲藻米氏凯伦藻及其他优势甲藻中未发现阿米巴藻的寄生感染, 而阿米巴藻宿主甲藻细胞相对丰度较低且主要分布在20等盐线以外。本研究中, 近岸海域阿米巴藻的宿主种类和感染率明显高于外海, 但感染率普遍较低。现场研究表明, 在封闭且较浅的海域, 阿米巴藻容易形成高感染率(Coats et al, 1996); 在开放且较深的海域, 阿米巴藻感染率一般维持在较低水平(Salomon et al, 2006)。长江口海域处于长江冲淡水、黄海冷水团和台湾暖流交汇区域, 地势开阔, 理化环境复杂多变, 这可能是阿米巴藻感染率较低的原因之一。阿米巴藻的低感染率与宿主甲藻丰度有关, 在非甲藻藻华环境下, 由于宿主甲藻丰度的限制, 该寄生性甲藻的感染率一般维持在较低水平。同时, 正是由于这种寄生性病原的存在使得宿主甲藻在短时间内不能快速增殖进而延缓或控制了宿主甲藻藻华的发生(Siano et al, 2011)。然而, 由于采样周期的局限性, 阿米巴藻对宿主甲藻种群的影响可能会被低估。该寄生性甲藻的高感染率通常发生在宿主甲藻藻华期间, 持续时间很短, 藻华过后由于宿主密度急剧下降, 感染率随之下降(Nishitani et al, 1985; Maranda, 2001)。阿米巴藻孢子在离开宿主甲藻后, 只能存活3—11天, 如果没有及时感染新的宿主细胞, 会死亡或者被浮游动物直接摄食, 浮游动物对阿米巴藻孢子的滤食也是影响阿米巴藻感染率的重要因素(Johansson et al, 2002)。本研究中, 显微镜镜检样品时常会发现大量微型浮游动物的存在, 浮游动物对阿米巴藻孢子的滤食可能是造成该海区浮游甲藻感染率低的原因之一。
4 结论2015年2月—2016年1月于长江口及其邻近海域进行的10次调查期间, 共检出浮游甲藻类38种, 甲藻群落结构相对稳定, 甲藻种类全年不存在明显差异, 优势种呈交叉、演替现象; 浮游甲藻全年变动范围为9.06×103—6.10×106cells/L, 平均值为6.62×105cells/L; 调查海域共有14种甲藻被阿米巴藻寄生感染, 其宿主种类及感染率表现出明显的季节差异; 夏、秋两季阿米巴藻的宿主种类和感染率明显高于春、冬两季, 6月为全年最高峰, 11种甲藻被寄生感染。
长江口海域藻华优势类群近年来已由硅藻转变为甲藻, 且甲藻藻华原因种表现出有毒有害藻种增多的态势, 亟待深入解析其演变机理与驱动因素。因此, 要进一步了解该海域浮游植物群落变化特征需要长周期、连续海洋调查资料的积累; 同时对于浮游植物与各种生物因素之间的关系, 也需要进一步的现场调查和实验去验证。
| 于仁成, 张清春, 孔凡洲, 等, 2017. 长江口及其邻近海域有害藻华的发生情况、危害效应与演变趋势. 海洋与湖沼, 48(6): 1178–1186 |
| 王金辉, 黄秀清, 2003. 具齿原甲藻的生态特征及赤潮成因浅析. 应用生态学报, 14(7): 1065–1069 DOI:10.3321/j.issn:1001-9332.2003.07.007 |
| 刘笑, 薛俊增, 吴惠仙, 2014. 长江口北支浮游植物群落结构周年变化特征. 生物学杂志, 31(3): 20–24, 28 DOI:10.3969/j.issn.2095-1736.2014.03.020 |
| 刘子琳, 宁修仁, 1994. 杭州湾锋区浮游植物现存量和初级生产力. 东海海洋, 12(4): 58–66 |
| 刘录三, 李子成, 周娟, 等, 2011. 长江口及其邻近海域赤潮时空分布研究. 环境科学, 32(9): 2497–2504 |
| 孙军, 刘东艳, 钱树本, 2002. 一种海洋浮游植物定量研究分析方法——Uterm hl方法的介绍及其改进. 黄渤海海洋, 20(2): 105–112 DOI:10.3969/j.issn.1671-6647.2002.02.016 |
| 苏纪兰, 2001. 中国近海的环流动力机制研究. 海洋学报, 23(4): 1–16 |
| 李照, 宋书群, 李才文, 等, 2017. 丰、枯水期长江口邻近海域浮游植物群落结构特征及其环境影响初探. 海洋学报, 39(10): 124–144 DOI:10.3969/j.issn.0253-4193.2017.10.011 |
| 李才文, 2014. 海洋寄生性甲藻--阿米巴藻Amoebophrya spp.的研究进展. 海洋学报, 36(6): 1–9 |
| 何青, 孙军, 2009. 长江口及其邻近水域网采浮游植物群落. 生态学报, 29(7): 3928–3938 DOI:10.3321/j.issn:1000-0933.2009.07.056 |
| 张璇, 石晓勇, 张传松, 等, 2012. 长江口及邻近海域赤潮藻种演替过程中营养盐特征. 海洋环境科学, 31(6): 817–820 |
| 林峰竹, 吴玉霖, 于海成, 等, 2008. 2004年长江口浮游植物群落结构特征分析. 海洋与湖沼, 39(4): 401–410 DOI:10.3321/j.issn:0029-814X.2008.04.016 |
| 潘玉龙, 李瑞香, 李艳, 等, 2012. 中国近海裸甲藻中文名的研究. 海洋通报, 31(2): 207–213 DOI:10.3969/j.issn.1001-6392.2012.02.012 |
| Alves-de-Souza C, Varela D, Iriarte J L, et al, 2012. Infection dynamics of Amoebophryidae parasitoids on harmful dinoflagellates in a southern Chilean fjord dominated by diatoms. Aquatic Microbial Ecology, 66(2): 183–197 DOI:10.3354/ame01567 |
| Chambouvet A, Morin P, Marie D, et al, 2008. Control of toxic marine dinoflagellate blooms by serial parasitic killers. Science, 322(5905): 1254–1257 DOI:10.1126/science.1164387 |
| Chen J Y, Pan D L, Liu M L, et al, 2017. Relationships between long-term trend of satellite-derived chlorophyll-a and hypoxia off the Changjiang estuary. Estuaries and Coasts, 40(4): 1055–1065 DOI:10.1007/s12237-016-0203-0 |
| Chen T T, Liu Y, Song S Q, et al, 2018. Characterization of the parasitic dinoflagellate Amoebophrya sp.infecting Akashiwo sanguinea in coastal waters of China. The Journal of Eukaryotic Microbiology, 65(4): 448–457 |
| Coats D W, Adam E J, Gallegos C L, et al, 1996. Parasitism of photosynthetic dinoflagellates in a shallow subestuary of Chesapeake Bay, USA. Aquatic Microbial Ecology, 11(1): 1–9 |
| Jiang Z B, Liu J J, Chen J F, et al, 2014. Responses of summer phytoplankton community to drastic environmental changes in the Changjiang (Yangtze River) estuary during the past 50 years. Water Research, 54: 1–11 DOI:10.1016/j.watres.2014.01.032 |
| Johansson M, Coats D W, 2002. Ciliate grazing on the parasite Amoebophrya sp.decreases infection of the red-tide dinoflagellate Akashiwo sanguinea. Aquatic Microbial Ecology, 28(1): 69–78 |
| Li C W, Chen T T, 2017. A novel hematoxylin and eosin stain assay for detection of the parasitic dinoflagellate Amoebophrya. Harmful Algae, 62: 30–36 DOI:10.1016/j.hal.2016.12.003 |
| Li C W, Song S Q, Liu Y, et al, 2014. Occurrence of Amoebophrya spp.infection in planktonic dinoflagellates in Changjiang (Yangtze River) Estuary, China. Harmful Algae, 37: 117–124 |
| Li Y, Li D J, Tang J L, et al, 2010. Long-term changes in the Changjiang estuary plankton community related to anthropogenic eutrophication. Aquatic Ecosystem Health & Management, 13(1): 66–72 |
| Maranda L, 2001. Infection of Prorocentrum minimum (Dinophyceae) by the parasite Amoebophrya sp.(Dinoflagellea). Journal of Phycology, 37(2): 245–248 DOI:10.1046/j.1529-8817.2001.037002245.x |
| Nishitani L, Erickson G, Chew K K, 1985. Role of the parasitic dinoflagellate Amoebophrya ceratii in control of Gonyaulax catenella populations. In: Anderson D M, White A W, Baden D G eds. Toxic Dinoflagellates. New York, USA: Elsevier Science Publishers, 225-230 |
| Salomon P S, Granéli E, Neves M H C B, et al, 2009. Infection by Amoebophrya spp.parasitoids of dinoflagellates in a tropical marine coastal area. Aquatic Microbial Ecology, 55(2): 143–153 |
| Salomon P S, Rodriguez E G, Granéli E, 2006. First report of Amoebophrya sp. parasites infecting dinoflagellates from Brazilian coastal waters. Journal of Coastal Research,(SI39): 1090–1093 |
| Siano R, Alves-de-Souza C, Foulon E, et al, 2011. Distribution and host diversity of Amoebophryidae parasites across oligotrophic waters of the Mediterranean Sea. Biogeosciences, 8(2): 267–278 DOI:10.5194/bg-8-267-2011 |
| Smayda T J, Reynolds C S, 2003. Strategies of marine dinoflagellate survival and some rules of assembly. Journal of Sea Research, 49(2): 95–106 DOI:10.1016/S1385-1101(02)00219-8 |
| Zhou M J, Shen Z L, Yu R C, 2008. Responses of a coastal phytoplankton community to increased nutrient input from the Changjiang (Yangtze) River. Continental Shelf Research, 28(12): 1483–1489 DOI:10.1016/j.csr.2007.02.009 |
 2019, Vol. 50
2019, Vol. 50


