中国海洋湖沼学会主办。
文章信息
- 杨秀文, 丁洪昌, 严兴洪, 刘长军. 2019.
- YANG Xiu-Wen, DING Hong-Chang, YAN Xing-Hong, LIU Chang-Jun. 2019.
- 圆紫菜(Pyropia suborbiculata)减数分裂时期的遗传分析与叶状体形态建成
- GENETIC ANALYSIS ON THE PERIOD OF MEIOSIS AND MORPHOGENESIS IN GAMETOPHYTIC BLADES OF PYROPIA SUBORBICULATA (BANGIALES, RHODOPHYTA)
- 海洋与湖沼, 50(1): 173-180
- Oceanologia et Limnologia Sinica, 50(1): 173-180.
- http://dx.doi.org/10.11693/hyhz20180300072
-
文章历史
- 收稿日期:2018-03-30
- 收修改稿日期:2018-07-01
2. 水产科学国家级实验教学示范中心(上海海洋大学) 上海 201306;
3. 上海水产养殖工程技术研究中心(上海海洋大学) 上海 201306;
4. 象山县水产技术推广站 象山 315700
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, China;
4. Xiangshan Fisheries Technical Extension Center, Xiangshan 315700, China
紫菜(Pyropia)(Sutherland et al, 2011)富含蛋白质、维生素、海藻多糖和生物活性物质(张全斌等, 2005), 在我国已有很悠久的食用历史(曾呈奎等, 1962)。目前, 国内栽培的紫菜主要为条斑紫菜(P. yezoensis)和坛紫菜(P. haitanensis), 前者属冷温性红藻, 主要被栽培在江苏和山东沿海, 后者为我国特有种, 属暖温性红藻, 主要被栽培在浙江、福建和广东沿海(朱建一等, 2016)。近些年, 由温室效应引起的海水温度回升现象在坛紫菜栽培期间时常发生, 给该产业带来了严重的损失(李西林, 1992)。国内学者针对这一问题, 培育出了多个坛紫菜耐高温新品种(系)(严兴洪等, 2007; 陈昌生等, 2008; 吕峰等, 2010; 宋武林, 2010; Yan et al, 2010; 王长青等, 2011; 宋武林, 2016), 后者的推广与应用为坛紫菜栽培业减轻了一定的损失。2004年, Monotilla等(2004)研究表明热带产的圆紫菜(P. suborbiculata)具有耐高温的潜力。为进一步挖掘和开发紫菜种质资源, 本实验室以采自广东省阳江海区的野生型圆紫菜作为基础材料培育紫菜新品系。
圆紫菜属暖温带性海藻, 叶状体呈圆形或肾脏形, 雌雄同体, 可通过放散单孢子进行无性繁殖, 主要分布在青岛以南的黄海、东海和南海海域(曾呈奎等, 1962)。目前, 国内外对圆紫菜的研究较少, 仅对其原生质体发育(唐延林, 1982)和系统分类(杨锐, 2001)进行过研究。紫菜减数分裂发生时期的确定, 对完善它的生活史和开展遗传育种工作具有重要意义(马家海等, 2005)。Ohme等(1986)以条斑紫菜的色素突变体与野生型进行杂交实验, 证实了条斑紫菜减数分裂发生在壳孢子萌发初期, 同时他们利用条斑紫菜发生减数分裂后, 性状发生遗传重组的特性, 选育出了世界上首个紫菜杂交良种(Miura et al, 1989)。
紫菜叶状体的早期发育对其藻体形态建成有很大的影响。条斑紫菜(Ohme et al, 1988)和坛紫菜(Zhang et al, 2013)的壳孢子在经过减数分裂后形成线形四分体, 后者发育成的叶状体分别呈长卵形和披针形, 这种藻体有利于在生产栽培过程中对其进行收割。紫红紫菜(Porphyra purpurea)(Mitman et al, 1994)和半叶紫菜华北变种(P. katadai var. hemiphylla) (Wang et al, 2010)的壳孢子在进行第二次减数分裂时, 上部细胞纵向分裂, 下部细胞横向分裂, 形成的四分体呈非直线型, 最终发育成的藻体较宽较短, 生产适用性较差。至今, 圆紫菜的叶状体早期发育和形态建成未见报道, 这直接影响到对它进行遗传改良的可行性。
本文以圆紫菜的绿色突变体(LT)和红色突变体(HT)进行杂交实验, 通过观察F1叶状体是否出现颜色分离和产生颜色嵌合体等来明确圆紫菜的减数分裂发生时期; 并观察圆紫菜的早期发育和形态建成过程, 为培育圆紫菜栽培品系奠定基础。
1 材料与方法 1.1 实验材料杂交实验的父本和母本分别为圆紫菜红色突变体(HT)和绿色突变体(LT), 均由本实验室于2015年采自广东省阳江海区的圆紫菜野生型品系(WT)经紫外线诱变分离而来(相关研究未发表)。3个品系均以自由丝状体的形式被保存于实验室内, 保存方法同Kato等(1984)。实验所使用的培养液为添加MES培养基的灭菌海水(王素娟等, 1986)。
1.2 杂交实验与杂合丝状体的获得贝壳丝状体的接种、促熟、采壳孢子和叶状体培养的方法同严兴洪等(2005)。杂交实验和杂合丝状体验证的方法同Yan等(2000)。具体方法:从即将成熟的父母本叶状体上分别切下面积1cm左右的藻块, 共同培养在250mL充气瓶中; 数天后, 待母本藻块上有大量果孢子囊形成时, 移走父本藻块, 并将母本藻块继续培养。待果孢子囊充分成熟后, 将藻块阴干后置于含有50mL培养液的培养皿中; 数日后, 放散的果孢子发育成丝状体, 随后用毛细管挑取单个丝状体于试管中, 分别单独培养。2—3个月后, 丝状体即可萌发成一定大小的丝状体藻落。取部分藻落移植贝壳长成贝壳丝状体, 后者经促熟后释放壳孢子。显微镜下, 通过观察壳孢子萌发体是否为颜色嵌合体, 以及嵌合体占总叶状体数的比例判断分离到的丝状体是否为杂合丝状体。
1.3 F1壳孢子萌发体的培养与观察促熟上述杂合丝状体, 使其放散壳孢子, 随后将收集的壳孢子于培养皿中静置培养2—3周, 用毛细管挑出壳孢子萌发体于载玻片上, 显微镜(Eclipse 90i, Nikon Japan)下观察并拍照记录嵌合叶状体的类型。
1.4 F1壳孢子萌发体的色彩分离比统计同上述步骤, 在显微镜下统计壳孢子萌发体的色彩分离比, 并进行遗传学分析。
1.5 F1嵌合叶状体各颜色色块单孢子苗生长特性、活体吸收光谱和主要色素蛋白含量的测定培养至45d时, 将F1颜色嵌合叶状体上的4种颜色的藻块切下, 分别置于充气瓶(250mL)中培养, 每个瓶中放入3根5cm长的棉绳, 收集各颜色藻块放散的单孢子。单孢子苗培养至35d时, 开始用叶面积测定仪(YMJ-D, 杭州大吉光电仪器有限公司)每5d测量一次藻体面积; 培养至55d时, 测量其活体吸收光谱和主要色素蛋白含量。活体吸收光谱和叶绿素a (Chl. a)的测量方法同Yan(1997); 藻红蛋白(PE)和藻蓝蛋白(PC)含量的测定方法同高洪峰(1993)。
1.6 圆紫菜壳孢子萌发体的定点跟踪拍照促熟WT品系的丝状体, 使其放散壳孢子, 将获得的壳孢子水搅拌均匀后倒入事先准备好的铺有盖玻片的培养皿内, 静置数小时, 待壳孢子附着后, 每24h一次定点跟踪拍照。培养条件:温度(18±1)℃, 光照密度40—50μmol photons/(m2·s), 光照周期10L:14D, 每5d更换1/2培养液。
1.7 圆紫菜壳孢子萌发体第一次纵分裂发生时期收集WT品系的壳孢子, 于培养皿中静置培养。5d后, 开始观察壳孢子萌发体的发育情况, 统计壳孢子萌发体发生第一次纵向分裂时其所含的细胞个数。
2 结果 2.1 杂交结果和遗传学分析杂交亲本共培养2周后, 从母本藻体上观察到2种颜色的果孢子囊, 分别为暗红色和黄褐色(图 1-1), 而母本叶状体在单独培养时, 其藻体上只能观察到黄褐色果孢子囊。因此, 可初步判定暗红色果孢子囊为杂合果孢子囊。随后收集该果孢子囊释放的果孢子, 后者长成的丝状体经促熟后释放壳孢子, 通过观察壳孢子萌发形成的颜色嵌合叶状体及其占总叶状体的比例, 也证明了该丝状体为杂合丝状体。
 |
| 图 1 圆紫菜杂交产生的果孢子囊、F1叶状体和4种颜色色块的藻体形态及其单孢子苗 Fig. 1 Carposporangium, F1 blades and four types of color blades and monospores germlings in the cross of P. suborbiculata 注: 1.杂合果孢子囊(红色箭头), 图中标尺为50μm; 2—5.分别是杂交获得的绿色(G)、红色(R)、野生色(W)和黄褐色(Y)的叶状体的形态(45d), 图中标尺为1cm; 6—9.分别为杂交获得的绿色(G)、红色(R)、野生色(W)和黄褐色(Y)叶状体的细胞形态(45d), 图中标尺为50μm; 10—13. F1叶状体(14d), 分别是单色叶状体G, 两嵌合叶状体W+Y, 三嵌合叶状体W+R+G, 四嵌合叶状体G+R+W+Y, 图中标尺为50μm; 14. F1叶状体(65d), 标尺为5cm |
表 1为圆紫菜色素突变体杂交产生的F1叶状体中出现的颜色类型和分离情况。共统计了1382株F1叶状体, 出现了2种亲本色和2种重组颜色, 分别为绿色(G, 母本色)、红色(R, 父本色)、野生色(W)和黄褐色(Y)(图 1-2—9)。4种颜色在F1叶状体中形成了大量由2—4个色块组成的颜色嵌合体, 单个嵌合体上的色块数量最多为4个, 呈线形排列, 分界线较明显(图 1-10—13)。杂交F1叶状体中, 出现4种单色叶状体和84种嵌合叶状体, 嵌合体所占比例为82.9%, 其中两嵌合最多(43.4%), 三嵌合次之(32.7%), 四嵌合最少(6.8%)。4种颜色在嵌合体中不成等分比例, 其分离比为1 G: 0.97 R: 0.88 W: 0.69 Y。
| 40 | R | 68 | G | 80 | W | 48 | Y |
| 76 | R+G | 69 | G+R | 60 | W+R | 27 | Y+R |
| 52 | R+W | 34 | G+W | 50 | W+G | 33 | Y+G |
| 44 | R+Y | 39 | G+Y | 73 | W+Y | 43 | Y+W |
| 32 | R+G+R | 18 | G+R+G | 33 | W+R+G | 18 | Y+R+G |
| 20 | R+G+W | 28 | G+R+W | 13 | W+R+W | 6 | Y+R+W |
| 14 | R+G+Y | 2 | G+R+Y | 5 | W+R+Y | 4 | Y+R+Y |
| 1 | R+W+R | 17 | G+W+R | 21 | W+G+R | 18 | Y+G+R |
| 6 | R+W+G | 6 | G+W+G | 21 | W+G+W | 6 | Y+G+W |
| 9 | R+W+Y | 9 | G+W+Y | 16 | W+G+Y | 10 | Y+G+Y |
| 3 | R+Y+R | 4 | G+Y+R | 8 | W+Y+R | 10 | Y+W+R |
| 11 | R+Y+G | 10 | G+Y+G | 20 | W+Y+G | 5 | Y+W+G |
| 8 | R+Y+W | 2 | G+Y+W | 19 | W+Y+W | 10 | Y+W+Y |
| 11 | R+G+R+G | 1 | G+R+G+R | 1 | W+R+G+R | 1 | Y+R+W+R |
| 40 | R | 68 | G | 80 | W | 48 | Y |
| 3 | R+G+R+Y | 2 | G+R+G+W | 1 | W+R+W+R | 1 | Y+R+W+Y |
| 2 | R+G+W+G | 2 | G+R+W+Y | 2 | W+R+W+Y | 2 | Y+R+Y+W |
| 1 | R+G+W+R | 1 | G+R+Y+W | 4 | W+G+R+G | 1 | Y+G+R+W |
| 4 | R+G+W+Y | 1 | G+W+G+R | 10 | W+G+R+Y | 1 | Y+G+Y+G |
| 2 | R+G+Y+R | 2 | W+G+W+R | 1 | Y+W+G+R | ||
| 8 | R+G+Y+W | 4 | W+G+W+G | ||||
| 4 | R+Y+R+G | 2 | W+G+W+Y | ||||
| 1 | R+Y+G+R | 2 | W+G+Y+R | ||||
| 1 | R+Y+W+G | 1 | W+G+Y+W | ||||
| 1 | R+Y+W+Y | 3 | W+Y+R+G | ||||
| 5 | W+Y+G+R | ||||||
| 3 | W+Y+W+Y | ||||||
| 364 | (25) | 313 | (18) | 459 | (26) | 247 | (20) |
| 注:颜色嵌合体的颜色排列是从藻体基部到梢部。藻体色块排列类型前的数字为观察到的个体数。括号里的数目为该栏所观察到的藻体类型数。R.红色; G.绿色; W.野生色; Y.黄褐色 | |||||||
4种颜色藻块放散形成的单孢子苗其生长差异较大, G、R和Y的生长速率均显著低于W, 其中, Y生长速率最慢(图 2)。这解释了F1叶状体中出现了由形状和大小不一的色块组成的嵌合叶状体(图 1-14)。
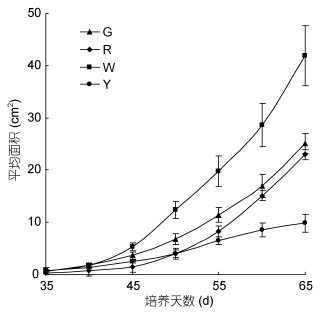 |
| 图 2 圆紫菜F1嵌合叶状体上4种色块放散形成的单孢子苗的面积变化曲线 Fig. 2 The curve in area change of monospore germlings from four color sectors of F1 blades in P. suborbiculata |
如图 3所示, 圆紫菜的活体吸收光谱与坛紫菜和条斑紫菜一样, 在波长350—750nm范围内存在5个吸收峰(P1、P2、P3、P4和P5)。4种色块的活体吸收光谱特性不同, G的P1、P4和P5峰均高于其他色块, 但其P3峰却均低于其他色块; R的P3峰高于其他色块, 而其他峰值均较低; Y的P1和P2峰较高, 其他峰值偏低; 相比其他色块, W的5个峰值均表现适中。
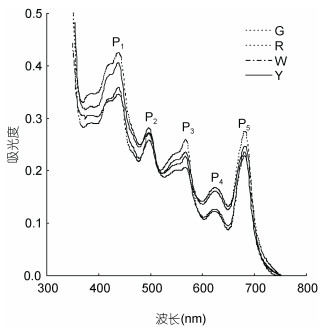 |
| 图 3 圆紫菜F1嵌合叶状体上4种色块放散形成的单孢子苗(55d)的活体吸收光谱 Fig. 3 In vivo absorption spectra of monospore germlings from four color sectors of F1 blades in P. suborbiculata after 55 days in culture |
4种色块的Chl. a含量相差不大; PE的含量, R最高, G最低, W和Y相近; PC的含量趋势, 表现为W > G > R > Y(图 4)。
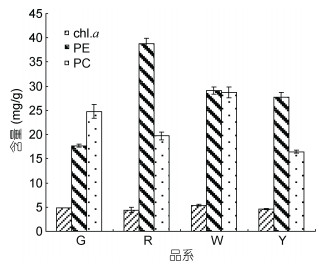 |
| 图 4 圆紫菜F1嵌合叶状体上4种色块放散形成的单孢子苗(55d)的三种主要光合色素蛋白含量 Fig. 4 Contents of chlorophyll a (Chl. a), phycoerythrin (PE), and phycocyanin (PC) of monospore germlings from four color sectors of F1 blades in P. suborbiculata after 55 days in culture |
圆紫菜壳孢子的前两次分裂均为横向分裂(图 6-1, a, b, c), 随后形成一个由4个细胞呈直线排列的四分子结构。后者再经过几次横向分裂形成一个由5—10细胞呈线形排列的萌发体(图 6-1, d, e)。随后, 萌发体中部的一个细胞开始发生纵向分裂, 藻体横向变宽(图 6-1, f)。83%的圆紫菜壳孢子萌发体的第一次纵分裂发生在7—9细胞时期(图 5)。
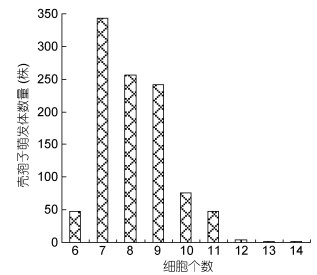 |
| 图 5 圆紫菜壳孢子萌发体发生第一次纵向分裂时其所含的细胞个数 Fig. 5 The number of cells in the first vertical cell division of conchospore germlings of P. suborbiculata |
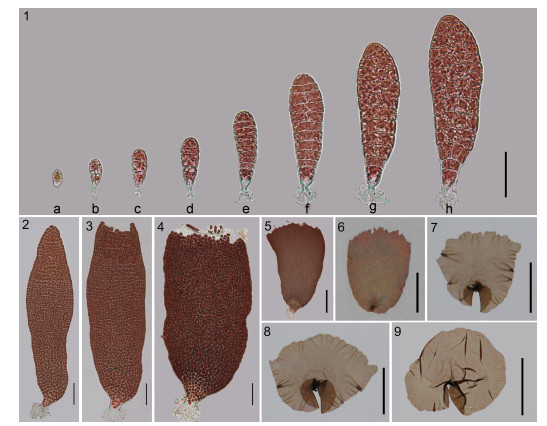 |
| 图 6 圆紫菜的早期发育和形态建成过程 Fig. 6 The early development and morphogenesis of P. suborbiculata 注: 1.圆紫菜的早期发育, a—h分别为1—8d的壳孢子萌发体, 图中标出为50μm; 2—9.圆紫菜的形态建成过程, 分别为15、20、25、30、35、45、55和65d时叶状体的形态, 2—4中的标尺为100μm, 5—9中的标尺分别为500μm, 5mm, 2cm, 2cm和5cm |
培养至15d时, 壳孢子已发育成横向由8—16排细胞组成的萌发体, 后者的梢部细胞开始发生变化, 色素体变弥散, 细胞间间隙增大(图版6-2)。20d时, 藻体梢部的细胞变圆, 开始放散单孢子(图 6-3)。25—65d时, 梢部持续放散单孢子, 藻体的横轴和纵轴比例逐渐增大, 最终形成的藻体形态呈圆形或肾脏形(图 6-4—9)。
3 讨论条斑紫菜杂交实验中的一个难点是其叶状体上雌雄生殖细胞镶嵌分布, 杂交亲本杂交时, 也会各自发生自交, 导致难以区分所得丝状体来自于杂交还是自交(Shin et al, 1990)。圆紫菜的雌雄生殖细胞也是镶嵌分布, 品系间的杂交也存在上述问题。因此, 本实验以圆紫菜的绿色和红色色素突变体作为杂交亲本, 以便于判定杂交是否发生。
实验中, 杂交产生的F1叶状体中出现含有2—4块颜色构成的嵌合叶状体, 观察F1壳孢子的早期发育, 发现这些嵌合叶状体是由最初的4个子细胞发育而来的。这些不同颜色的色块在叶状体上呈线形排列, 色块间有明显的界线, 单个叶状体上最多有4个颜色块, 这一结果与条斑紫菜(Ohme et al, 1986)、坛紫菜(严兴洪等, 2006)的色素突变体和野生型杂交的结果均相似, 表明圆紫菜的减数分裂也发生在壳孢子萌发时最初的两次细胞分裂。另外, 2种新颜色的出现, 是减数分裂过程中染色体的重组与交换所产生的(Ohme et al, 1986)。
圆紫菜壳孢子的前两次分裂均为横向分裂, 随后形成一个由4个细胞呈线形排列的四分子。这一早期发育模式, 与藻体为长卵形的条斑紫菜(Ohme et al, 1988)、披针形的坛紫菜(Zhang et al, 2013)一样, 而与藻体为卵圆形的半叶紫菜华北变种不同(Wang et al, 2010), 后者的壳孢子在第二次分裂时上部细胞就发生了纵向分裂。
Fan等(2008)发现条斑紫菜的壳孢子附着后经历大约10次横向分裂后, 才开始纵向分裂。田翠翠(2015)对外形与圆紫菜相近的皱紫菜的研究表明, 当发育至7—10细胞后, 藻体开始出现纵向分裂。Wang等(1987)在研究坛紫菜体细胞发育时指出, 坛紫菜体细胞纵向分裂越晚, 叶状体越细长。本实验中, 大部分圆紫菜壳孢子萌发体的第一次纵向分裂发生在7—9细胞时期, 随后藻体的细胞发生横向和纵向分裂, 形态逐渐变宽。因此, 我们认为壳孢子萌发时第一次纵向分裂发生时间较早是导致圆紫菜藻体为圆形或肾脏形的原因之一。
目前研究表明, 有少数种类的紫菜, 如甘紫菜(P. tenera)和条斑紫菜等的叶状体可以释放单孢子(曾呈奎等, 1954; Xu et al, 2003), 后者直接长成叶状体。在生产上, 紫菜的单孢子对辅助采苗、延长收获期和提高产量等具有重要意义(王素娟, 1985)。圆紫菜叶状体也具有放散单孢子的能力, 它的壳孢子萌发体被培养至2—3周时, 即开始放散单孢子, 且一直到成体的过程中, 其藻体会持续、大量地放散单孢子, 最终形成的叶状体呈圆形或肾脏形。
Yan等(2004)发现只能放散少量单孢子的条斑紫菜野生型品系, 经人工诱变后分离得到的红色和绿色突变体可大量地放散单孢子, 致使叶状体无法长大。印度产紫菜P. chauhanii野生型品系(PC-WT)能放散单孢子, 但其诱变品系(PC-Y1)失去了放散单孢子的能力(张聪等, 2014)。这证明与紫菜单孢子放散相关的基因是可以通过人工诱变而改变的。利用这一特性, 后续可对圆紫菜进行诱变处理, 筛选叶状体单孢子放散量少、藻体形态适宜生产的新品系。
4 结论通过色素突变体间的杂交实验证实圆紫菜的减数分裂发生在壳孢子萌发时最初的两次细胞分裂; 减数分裂产生的四分子呈线形排列; 由于其壳孢子萌发时第一次纵向分裂发生较早, 萌发体逐渐长成长卵形, 但随着叶状体的继续发育, 梢部藻体开始大量、持续地放散单孢子, 最终导致其藻体形态为圆形或肾脏形。
| 马家海, 许璞, 朱建一, 2005.海洋红藻遗传学——紫菜.见: 张学成, 秦松, 马家海主编.海藻遗传学.北京: 中国农业出版社, 202-203 |
| 王长青, 严兴洪, 黄林彬, 等, 2011. 坛紫菜优良品系"申福2号"的特性分析与海区中试. 水产学报, 35(11): 1658–1667 |
| 王素娟, 1985.紫菜栽培.见: 曾呈奎主编.海藻栽培学.上海: 上海科学技术出版社, 144-146 |
| 王素娟, 张小平, 徐志东, 等, 1986. 坛紫菜营养细胞和原生质体培养的研究Ⅰ. 海洋与湖沼, 17(3): 217–272 |
| 田翠翠, 2015. 3个暗紫红毛菜基础生物学特征及皱紫菜叶状体形态建成观察研究.苏州: 苏州大学硕士学位论文, 33-39 |
| 吕峰, 严兴洪, 刘长军, 等, 2010. 坛紫菜耐高温品系的选育与海区中试. 上海海洋大学学报, 19(4): 457–462 |
| 朱建一, 严兴洪, 丁兰平, 等, 2016. 中国紫菜原色图谱. 北京: 中国农业出版社 |
| 严兴洪, 马少玉, 2007. 坛紫菜抗高温品系的筛选. 水产学报, 31(1): 112–119 |
| 严兴洪, 李琳, 有贺祐胜, 2006. 坛紫菜减数分裂位置的杂交试验分析. 水产学报, 30(1): 1–8 |
| 严兴洪, 梁志强, 宋武林, 等, 2005. 坛紫菜人工色素突变体的诱变与分离. 水产学报, 29(2): 166–172 |
| 李西林, 1992. 论坛紫菜壳孢子采苗时间. 福建水产, 14(2): 40–42 |
| 杨锐, 2001.中国沿海几种常见紫菜的遗传变异与种质鉴定.青岛: 青岛海洋大学博士学位论文, 62-85 |
| 宋武林, 2010. 坛紫菜新品系"申福1、2号"规模化养殖技术研究. 福建水产, 32(4): 29–34 DOI:10.3969/j.issn.1006-5601.2010.04.007 |
| 宋武林, 2016. 坛紫菜新品种"申福1号"和"申福2号"耐高温性中试研究. 上海海洋大学学报, 25(4): 522–527 |
| 张聪, 严兴洪, 2014. Pyropia churharii新品系的分离与特性分析. 水产学报, 38(9): 1457–1465 |
| 张全斌, 赵婷婷, 綦慧敏, 等, 2005. 紫菜的营养价值研究概况. 海洋科学, 29(2): 69–72 DOI:10.3969/j.issn.1000-3096.2005.02.014 |
| 陈昌生, 纪德华, 谢潮添, 等, 2008. 坛紫菜耐高温品系选育及经济性状的初步研究. 海洋学报, 30(5): 100–106 DOI:10.3321/j.issn:0253-4193.2008.05.014 |
| 高洪峰, 1993. 不同生长期坛紫菜中藻胆蛋白的含量变化. 海洋与湖沼, 24(6): 645–648 DOI:10.3321/j.issn:0029-814X.1993.06.010 |
| 唐延林, 1982. 紫菜营养细胞和原生质体的分离和培养. 山东海洋学院学报, 12(4): 37–50 |
| 曾呈奎, 张德瑞, 1954. 紫菜的研究Ⅰ.甘紫菜的生活史. 植物学报, 3(3): 287–302 |
| 曾呈奎, 张德瑞, 张峻甫, 等, 1962. 中国经济海藻志. 北京: 科学出版社, 1-22, 103 |
| Fan X L, Wang G C, Li D M, et al, 2008. Study on early-stage development of conchospore in Porphyra yezoensis Ueda. Aquaculture, 278(1-4): 143–149 DOI:10.1016/j.aquaculture.2008.02.037 |
| Kato M, Aruga Y, 1984. Comparative studies on the growth and photosynthesis of the pigmentation mutants of Porphyra yezoensis in laboratory culture. The Japanese Journal of Phycology, 32(4): 333–347 |
| Mitman G G, Meer J P, 1994. Meiosis, blade development, and sex determination in Porphyra purpurea (Rhodophyta). Journal of Phycology, 30(1): 147–159 DOI:10.1111/j.0022-3646.1994.00147.x |
| Miura A, Shin J A, 1989. Crossbreeding in cultivars of Porphyra yezoensis (Bangiales, Rhodophyta)-preliminary report. The Korean Journal of Phycology, 4(2): 207–211 |
| Monotilla W D, Notoya M, 2004. Morphological and physiological responses of Porphyra suborbiculata Kjellman (Bangiales, Rhodophyta) blades from five localities. Botanica Marina, 47(4): 323–334 |
| Ohme M, Kunifuji Y, Miura A, 1986. Cross experiments of the color mutants in Porphyra yezoensis Ueda. The Japanese Journal of Phycology, 34(2): 101–106 |
| Ohme M, Miura A, 1988. Tetrad analysis in conchospore germlings of Porphyra yezoensis (Rhodophyta, Bangiales). Plant Science, 57(2): 135–140 |
| Shin J A, Miura A, 1990. Estimation of the degree of self-fertilization in Porphyra yezoensis (Bangiales, Rhodophyta). Hydrobiologia, 204(1): 397–400 |
| Sutherland J E, Lindstrom S C, Nelson W A, et al, 2011. A new look at an ancient order:generic revision of the Bangiales (Rhodophyta). Journal of Phycology, 47(5): 1131–1151 DOI:10.1111/j.1529-8817.2011.01052.x |
| Wang J F, Zhu J Y, Wei Z, et al, 2010. Early development patterns and morphogenesis of blades in four species of Porphyra (Bangiales, Rhodophyta). Journal of Applied Phycology, 22(3): 297–303 DOI:10.1007/s10811-009-9459-0 |
| Wang S J, Sun Y L, Lu A M, et al, 1987. Early stage differentiation of thallus cells of Porphyra haitanensis (Rhodophyta). Chinese Journal of Oceanology and Limnology, 5(3): 217–221 DOI:10.1007/BF02843985 |
| Xu L, Zhou Y H, Wang S J, et al, 2003. Ultrastructural and molecular evidence for monospore formation in the thallus of Porphyra yezoensis. Journal of Fisheries of China, 27(6): 519–527 |
| Yan X H, 1997. Induction of pigmentation mutants by treatment of monospore germlings with NNG in Porphyra yezoensis Ueda (Bangiales, Rhodophyta). Algae, 12(1): 39–52 |
| Yan X H, Aruga Y, 2000. Genetic analysis of artificial pigmentation mutants in Porphyra yezoensis Ueda (Bangiales, Rhodophyta). Phycological Research, 48(3): 177–187 DOI:10.1111/pre.2000.48.issue-3 |
| Yan X H, Fujita Y, Aruga Y, 2004. High monospore-producing mutants obtained by treatment with MNNG in Porphyra yezoensis Ueda (Bangiales, Rhodophyta). Hydrobiologia, 512(1-3): 133–140 DOI:10.1023/B:HYDR.0000020318.00749.2d |
| Yan X H, Lv F, Liu C J, et al, 2010. Selection and characterization of a high-temperature tolerant strain of Porphyra haitanensis Chang et Zheng (Bangiales, Rhodophyta). Journal of Applied Phycology, 22(4): 511–516 DOI:10.1007/s10811-009-9486-x |
| Zhang Y, Yan X H, Aruga Y, 2013. The sex and sex determination in Pyropia haitanensis (Bangiales, Rhodophyta). PLoS One, 8(8): e73414 DOI:10.1371/journal.pone.0073414 |
 2019, Vol. 50
2019, Vol. 50


