中国海洋湖沼学会主办。
文章信息
- 潘洁红, 刘光兴. 2019.
- PAN Jie-Hong, LIU Guang-Xing. 2019.
- 甲维盐对安氏伪镖水蚤(Pseudodiaptomus annandalei)摄食、呼吸、发育和生殖的影响
- THE IMPACT OF EMAMECTIN BENZOATE ON THE FEEDING, RESPIRATION, SURVIVAL, DEVELOPMENT, AND REPRODUCTION OF PSEUDODIAPTOMUS ANNANDALEI
- 海洋与湖沼, 50(1): 181-187
- Oceanologia et Limnologia Sinica, 50(1): 181-187.
- http://dx.doi.org/10.11693/hyhz20180400098
-
文章历史
- 收稿日期:2018-04-17
- 收修改稿日期:2018-07-02
2. 中国海洋大学海洋环境与生态教育部重点实验室 青岛 266100
2. Key Laboratory of Marine Environment & amp; Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China
甲氨基阿维菌素苯甲酸盐(Emamectin benzoate, EMB)(简称甲维盐)是1984年美国Merck公司对阿维菌素进行衍生合成而得到的产物, 现作为一种高效杀虫剂用于去除水产养殖生物中的寄生性桡足类以及多种农作物的害虫(Johnson et al, 2004; 朱九生等, 2009)。除了在水产养殖业中的应用, 农业上使用的甲维盐也可通过地表径流等方式进入海洋, 从而对海洋生态系统造成潜在危害。已有报道表明, 甲维盐能对虾类(Veldhoen et al, 2012)、桡足类(Willis et al, 2003; Igboeli et al, 2014)、鱼类等(Stone et al, 2002)等多种海洋生物造成影响。国外有关甲维盐对桡足类的毒理学研究多集中在鱼虱上, 如鱼虱对甲维盐敏感性和抗性存在性别差异(Westcott et al, 2008; Igboeli et al, 2014)、物种差异(Sutherland et al, 2015)等。国内学者对甲维盐的毒理学研究多以陆生生物和淡水生物(如鹌鹑、蜜蜂、家蚕、鱼、蝌蚪等)为研究对象(魏方林等, 2008; 张宝兰等, 2017), 主要在生理水平上研究甲维盐对其急性毒性和生理活动如摄食、趋光性、行为等的影响。甲维盐也会随着径流进入海洋, 对海洋生态系统存在潜在的风险, 而在我国有关甲维盐对海洋生物的影响尚未见相关报道。
桡足类是海洋浮游生态系统最重要的次级生产者, 是海洋食物网中的关键一环。安氏伪镖水蚤(Pseudodiaptomus annandalei)是亚洲海岸、河口等半咸水生态系统常见的桡足类(Walter et al, 2006), 也被广泛用作石斑鱼等鱼类的活体饵料(Celino et al, 2012)。由于安氏伪镖水蚤摄食范围广(Dhanker et al, 2012)、易于在实验室培养和世代周期短(Golez et al, 2004)等优点, 成为生态学和水产养殖研究的理想物种。本研究通过开展甲维盐对安氏伪镖水蚤急慢性毒理实验, 分析了甲维盐对海洋桡足类种群可能造成的潜在危害, 从而为进一步判定甲维盐的生态风险以及为我国海洋渔业环境保护提供科学依据。
1 材料与方法 1.1 实验材料 1.1.1 饵料藻及培养所用饵料为湛江叉鞭金藻(Dicrateria zhanjiangensis), 藻种取自厦门大学近海海洋环境科学重点实验室的海洋微型生物保种中心。实验用海水取自青岛沙子口近岸, 经0.45μm微孔滤膜过滤, 最后调盐度至28±1。
1.1.2 实验溶液的配制将甲维盐(PESTANAL® Sigma-Aldrich, CAS-No: 155569-91-8)溶于二甲基亚砜, 配置成浓度为2×106μg/L的甲维盐储备液, 避光4℃保存。实验时, 用膜滤人工海水逐级稀释。
1.1.3 安氏伪镖水蚤的培养实验所用安氏伪镖水蚤引种自厦门大学滨海湿地生态系统教育部重点实验室。培养条件为:温度23℃, 盐度28, 光照周期L:D = 14h:10h, 光照强度8000 lx。
1.2 实验方法 1.2.1 急性毒性实验用100mL烧杯作为实验容器, 内装80mL实验溶液, 设置7组, 甲维盐浓度分别为0(空白对照组)、1.00、1.58、2.51、3.98、6.30、10.00μg/L, 每组设置三个平行。每个烧杯放置10只健康活跃的雌性安氏伪镖水蚤个体, 以金藻作为饵料, 饵料浓度为1×105 cells/mL。每天在解剖镜下观察安氏伪镖水蚤生理状态并记录死亡率(在解剖针或者水流轻轻刺激下没有反应则认为死亡), 及时吸出死亡个体, 每48h更新实验溶液。用SPSS的Probit模型计算甲维盐对安氏伪镖水蚤的48hLC50和96hLC50(贾春生, 2006)。
1.2.2 摄食实验取对数生长期的金藻藻液, 稀释至实验所需浓度2×106 cells/mL, 分装于15mL小烧杯中, 每个烧杯中溶液的体积为10mL。甲维盐浓度梯度为0(空白对照组)、0.50、1.00、2.00μg/L, 同时设置溶剂对照组, 每个组设置3个实验瓶、2个对照瓶。实验用桡足类先行饥饿驯化24h, 之后挑选5只健康活跃的雌性安氏伪镖水蚤于每组的实验瓶中, 对照瓶不放桡足类。用铝箔包裹好瓶身, 置于黑暗环境下摄食, 24h后将烧杯中藻液摇匀, 并用吸管取出2mL左右藻液用鲁哥氏液固定, 在显微镜下用浮游植物计数框计数。
安氏伪镖水蚤的滤水率和摄食率(即滤食率)的计算按Frost(1972)公式:
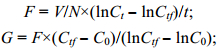
式中, F为滤水率(mL/(ind·h)), 指每只桡足类每小时过滤的含有一定数量浮游植物的水样量; G为摄食率(cells/(ind·h)), 即每只桡足类每小时过滤的饵料细胞数; V为实验容器体积(mL); N为每个实验瓶中桡足类个体数(ind); C0为起始饵料浓度(×104 cells/mL); Ct为对照瓶中的最终饵料浓度(×104 cells/mL); Ctf为实验瓶中最终饵料浓度(×104 cells/mL); t为摄食时间(h)。
1.2.3 呼吸率实验实验用250mL磨口瓶, 装满实验溶液, 不留任何气泡, 甲维盐浓度梯度为0(空白对照组)、0.25、0.50、1.00、2.00μg/L, 同时设置溶剂对照组, 每个浓度组设置3个实验瓶、2个对照瓶, 实验用桡足类先行饥饿驯化24h, 挑选10只健康活泼雌性安氏伪镖水蚤于实验瓶中, 对照瓶中不放桡足类, 用铝箔纸包好瓶身, 置于黑暗环境下培养24h, 实验结束后, 用溶氧仪(哈希HQ40D)测实验瓶和对照瓶中的溶解氧, 计算安氏伪镖水蚤的呼吸率(Omori et al, 1984)。
1.2.4 慢性毒性实验挑选150只抱卵的雌性安氏伪镖水蚤放到烧杯中培养1d, 待卵孵化出无节幼虫, 用200μm筛绢分离成体和新孵出的无节幼虫。实验用六孔培养板, 每孔装有8mL实验溶液, 甲维盐浓度梯度为0(空白对照组)、0.0066、0.0200、0.0660、0.2000μg/L, 同时设置溶剂对照组, 每组设置三个平行, 每个平行加入10只分离出的幼虫, 投喂金藻作为饵料, 浓度为1×105 cells/mL, 每天记录幼虫的发育状态, 并更换溶液。当无节幼虫发育为桡足幼虫时, 更换到50mL烧杯中培养, 其中装有40mL溶液, 饵料浓度不变, 每天记录发育状态, 并更换溶液。当各组中幼体发育为成体时, 将抱卵雌体放入新的六孔板中, 每组挑选六只, 单独培养, 每孔加入8mL对应浓度溶液及饵料, 此过程持续10d, 每天更换溶液, 记录产卵批次、每批孵化的无节幼数量。将第一世代(F1)雌性成体新孵出的无节幼虫取出, 暴露于对应浓度的甲维盐溶液中, 实验方法同第一世代, 培养并观察其发育及生殖, 继续研究甲维盐对第二世代(F2)安氏伪镖水蚤发育、生殖的影响。
计算安氏伪镖水蚤存活率、无节幼虫发育时间、世代发育时间、10d生殖力、每批次产幼数量(Li et al, 2015)。
1.3 数据处理实验数据用SPSS19.0进行统计分析, 采用单因素方差分析处理数据。用Origin Pro 8.5软件作图。
2 结果 2.1 甲维盐对安氏伪镖水蚤的急性毒性实验记录了安氏伪镖水蚤暴露于不同浓度甲维盐溶液中的死亡率(见图 1)和运动状态。暴露于甲维盐溶液中24h后, 浓度为0—1.58μg/L各组的桡足类个体仍然运动能力强, 状态良好; 浓度为2.51—3.98μg/L的实验组, 安氏伪镖水蚤运动力减弱, 并且部分个体失去平衡; 浓度高于6.30μg/L时, 全部桡足类趴底, 死亡率近40%。在48h时, 甲维盐浓度为0—1.00μg/L时, 桡足类仍然运动能力强, 状态良好; 浓度为1.58—2.51μg/L的实验组, 安氏伪镖水蚤运动力减弱, 并且部分个体失去平衡, 个别个体出现死亡; 当甲维盐浓度高于3.98μg/L时, 各组死亡率比第一天升高, 均达到60%及以上, 而存活的个体运动能力也减弱甚至趴底不动。暴露达到72h时, 浓度低于1.00μg/L的各浓度组, 安氏伪镖水蚤活力仍然较好; 浓度为1.58—2.51μg/L的实验组, 死亡的桡足类数量略有增加; 甲维盐浓度高于3.98μg/L的组中, 安氏伪镖水蚤死亡率上升到80%—90%, 存活的个体全部趴底。当暴露时间达到96h时, 甲维盐浓度低于1μg/L的各组中, 安氏伪镖水蚤运动力强, 没有沉入底部, 身体状态与对照组相比未见显著变化; 而浓度为1.58μg/L的实验组内, 安氏伪镖水蚤运动力开始减弱; 甲维盐浓度为2.51μg/L时, 死亡率达到60%—70%以上, 活着的个体运动能力降低, 趴底; 甲维盐浓度为3.98—6.30μg/L时, 死亡率达到了80%;最高浓度组死亡率达到100%。
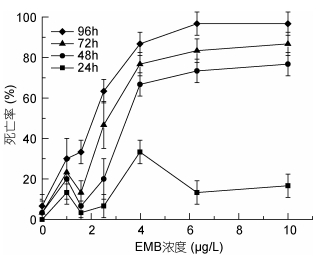 |
| 图 1 安氏伪镖水蚤暴露在不同浓度甲维盐溶液中的死亡率 Fig. 1 The mortality of P. annandalei exposed to a different concentration of EMB |
急性实验数据用SPSS的Probit模型分析得到48h LC50是4.13μg/L, 95%置信区间是(1.907, 11.203)。用SPSS的Probit分析得到96h LC50是1.98μg/L, 95%置信区间是(1.573, 2.384)。
2.2 甲维盐对安氏伪镖水蚤摄食的影响与对照组相比, 暴露于甲维盐中的安氏伪镖水蚤摄食率降低, 并且随着甲维盐浓度升高, 其摄食率逐渐降低(见图 2), 甲维盐浓度为2.00μg/L时, 摄食率最低为0.25×104 cells/(ind·h)。
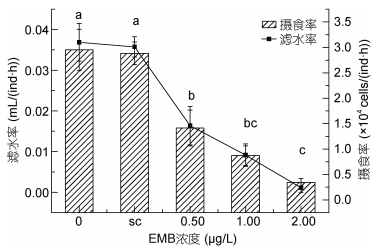 |
| 图 2 The mortality of P. annandalei exposed to a different concentration of EMB Fig. 2 The effect of EMB on the filtration rate (F) and grazing rate (G) of P. annandalei 注: a、b、c: P < 0.05, 误差棒:标准偏差, sc:溶剂对照组 |
随着甲维盐浓度升高, 安氏伪镖水蚤的呼吸率呈现先升高后降低的趋势(见图 3)。对照组呼吸率与溶剂对照组无显著差异, 甲维盐浓度为0.25μg/L时, 安氏伪镖水蚤的呼吸率最高, 达到0.265μL/(ind·h), 显著高于对照组, 而甲维盐浓度高于0.50μg/L时, 安氏伪镖水蚤的呼吸率随着甲维盐浓度的升高而降低, 甲维盐浓度为2.00μg/L, 安氏伪镖水蚤呼吸率降低到0.070μL/(ind·h)。
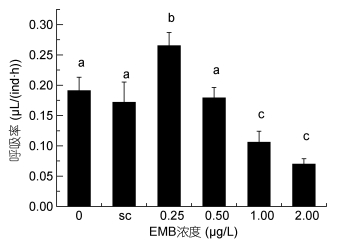 |
| 图 3 甲维盐对安氏伪镖水蚤呼吸率的影响 Fig. 3 The effect of EMB on respiration rate (R) of P. annandalei exposed 注: a、b、c: P < 0.05, 误差棒:标准偏差, sc:溶剂对照组 |
当甲维盐浓度为0.2000μg/L时, 世代发育时间与空白对照组和溶剂对照组相比延长(见图 4, 图 5), 在第二世代更为显著。安氏伪镖水蚤的成活率也受到了显著的影响(见图 6), 甲维盐浓度为0.2000μg/L时, 两个世代的成活率均降低, 分别降低到0.93和0.80, 可见高浓度的甲维盐抑制了安氏伪镖水蚤的发育, 并对安氏伪镖水蚤的成活产生了不利影响。
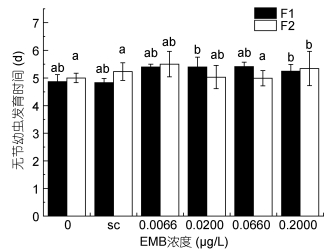 |
| 图 4 甲维盐对安氏伪镖水蚤无节幼虫发育时间的影响 Fig. 4 The effect of EMB on the development time of nauplius phases of P. annandalei 注: a、b、c: P < 0.05, 误差棒:标准偏差, sc:溶剂对照组 |
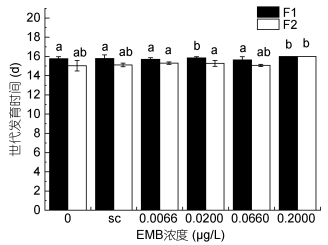 |
| 图 5 甲维盐对安氏伪镖水蚤世代发育时间的影响 Fig. 5 The effect of EMB on the development time of P. annandalei exposed to a different concentration of EMB 注: a、b、c: P < 0.05, 误差棒:标准偏差, sc:溶剂对照组 |
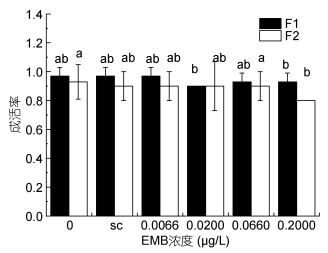 |
| 图 6 甲维盐对安氏伪镖水蚤成活率的影响 Fig. 6 The effect of EMB on the survival rate of P. annandalei 注: a、b、c: P < 0.05, 误差棒:标准偏差, sc:溶剂对照组 |
暴露于甲维盐后, 安氏伪镖水蚤的生殖力受到了显著的影响。暴露于甲维盐后, 雌性安氏伪镖水蚤单批次产幼量与空白对照组相比降低(见图 7), 在甲维盐浓度大于0.0200μg/L的各组, 随甲维盐浓度升高而降低。安氏伪镖水蚤的10d生殖力也出现同样的趋势, 实验组低于对照组, 且在甲维盐浓度大于0.0200μg/L的各组, 10d生殖力随甲维盐浓度升高而逐渐降低(见图 8)。
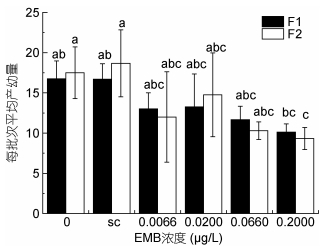 |
| 图 7 甲维盐对安氏伪镖水蚤每批次平均产幼量的影响 Fig. 7 The effect of EMB on the number of nauplii per batch of females 注: a、b、c: P < 0.05, 误差棒:标准偏差, sc:溶剂对照组 |
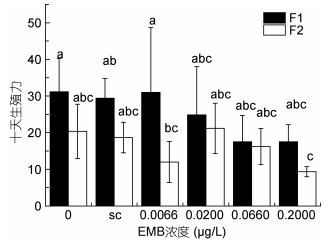 |
| 图 8 甲维盐对安氏伪镖水蚤10d生殖力的影响 Fig. 8 The effect of EMB on the fecundity of females 注: a、b、c: P < 0.05, 误差棒:标准偏差, sc:溶剂对照组 |
本研究表明, 甲维盐对安氏伪镖水蚤的摄食、呼吸、发育和生殖均会产生了不利影响。安氏伪镖水蚤死亡率随时间的变化并不是线性的, 而是在第一天死亡率较低, 桡足类出现运动能力下降、趴底等现象, 在第二、三天死亡率急剧增加, 大部分死亡出现在暴露于甲维盐两天后, 这可能与甲维盐的作用机制有关。甲维盐是一类神经毒性制剂, 药效会有2—4d的延迟效应, 例如作用于昆虫后, 昆虫运动量减少, 先是表现为厌食、卧倒、颤抖等症状, 并且逐渐死亡(魏方林等, 2008)。这可能是安氏伪镖水蚤第一天死亡较少而第二天开始大量死亡的主要原因。
有关研究表明, 桡足类对于甲维盐较为敏感, 在较低剂量下, 就会出现死亡, 甲维盐对克氏纺锤水蚤(Acartia clausi)、长伪哲水蚤(Pseudocalanus elongatus)、长角宽水蚤(Temora longicornis)、拟长腹剑水蚤(Oithona similis)的48h LC50分别为0.29、0.45、2.81、232μg/L (Willis et al, 2003), 本研究得到甲维盐对安氏伪镖水蚤的48h LC50为4.13μg/L, 可见安氏伪镖水蚤对甲维盐也较为敏感。
桡足类的摄食是其获取能量的重要途径, 摄食率高低在一定程度上反映了其生理状态, 也反映了食物链能量流动的效率和物质循环的途径; 而呼吸率是新陈代谢活动(包括运动、摄食和基本生理需求)的综合指标。研究结果显示, 随着甲维盐浓度升高, 安氏伪镖水蚤摄食率明显降低, 呼吸率随着浓度升高先上升后降低。林汝榕等(1991)的研究也表明, 在较低污染物刺激下, 桡足类出现了摄食增加、代谢加快的现象。在低浓度污染物刺激下, 个体通过提高自身新陈代谢, 主动外排体内累积的外源污染物质(Luckenbach et al, 2008), 这可能是低浓度组安氏伪镖水蚤呼吸率升高的原因。桡足类摄食和呼吸的变化可能会进一步影响生长发育和生殖(Xu et al, 2014)。
有毒物质既能够对桡足类的胚胎发育产生不良影响, 也能影响到无节幼虫到成体的整个发育阶段(Frangulos et al, 2000; Ianora et al, 2004)。有研究表明, 安氏伪镖水蚤在发育阶段能受到有害物质的影响, 例如Dhanker等(2015)在研究硅藻多不饱和醛类对安氏伪镖水蚤的效应时, 安氏伪镖水蚤的发育也受到了明显抑制, 表现在安氏伪镖水蚤幼虫的存活率降低, 发育时间延长。本研究观察到暴露于甲维盐后, 安氏伪镖水蚤无节幼成功发育到成体的比例降低, 世代发育时间与对照组相比也显著延长。可见, 甲维盐可以对安氏伪镖水蚤的发育产生不利的影响。
自然环境中桡足类的分布和丰度的时间空间变化取决于种类和特定的生活阶段等因子, 如胚胎发育和胚后发育、生殖力、发育时间、生长、存活和死亡等(Miller et al, 1994; Chen et al, 2006), 其中, 生殖力直接决定桡足类种群的补充和种群动力学。相关研究表明, 桡足类在长期暴露于有害物质中时, 其生殖力会有所降低, 例如, 日本虎斑猛水蚤(Tigriopus japonicus)暴露于汞中, 每批次产幼数量降低、10d生殖力下降, 且该效应会随着世代累积(Li et al, 2015)。同样, 甲维盐也能够影响桡足类的生殖力, 例如, Willis等(2003)研究了克氏纺锤水蚤的7天产卵量, 高浓度条件下(甲维盐浓度大于0.158μg/L), 克氏纺锤水蚤的产卵量受到了显著抑制。本研究发现暴露于甲维盐后, 安氏伪镖水蚤的生殖力下降, 且在一定浓度区间内呈剂量依赖关系, 甲维盐浓度越高, 生殖力越低, 具体表现为每批次产幼数量和10d生殖力的降低。而有害物质对桡足类发育和生殖力的不利影响会影响种群补充, 可能会进一步影响种群的生存(Chen et al, 2006; Cole et al, 2015)。
根据Willis等人的研究, 在鲑鱼养殖水域附近, 甲维盐的浓度只有8.28×10-6μg/L (Willis et al, 2003), 而自然海域中的浓度应该比这个浓度还要低, 所以, 自然环境中的甲维盐目前对安氏伪镖水蚤造成的危害可能较小; 在中国近海的环境中甲维盐浓度尚未见报道。安氏伪镖水蚤在亚洲经常用作石斑鱼幼鱼的饵料(Celino et al, 2012), 在自然海区中, 桡足类也是鱼类等经济动物的重要饵料, 鉴于甲维盐使用的广泛性、桡足类对甲维盐的敏感性及其在海洋生态系统中的重要生态作用, 要控制通过水产养殖、地表径流等途径进入到海洋中的甲维盐的量, 以防甲维盐对海洋生物造成不利影响。本研究对水产养殖管理和自然海域生态环境保护均有一定的指导意义。
4 结论安氏伪镖水蚤暴露于甲维盐后, 运动能力会下降, 摄食、呼吸、发育和繁殖产生异常, 这将会进一步影响其种群的补充。虽然目前在自然海域环境中, 甲维盐对安氏伪镖水蚤的生态风险较低, 但是鉴于桡足类对甲维盐的敏感性及其在海洋生态系统中的重要性, 仍需要加强对甲维盐的环境监管。
| 朱九生, 连梅力, 王静, 等, 2009. 阿维菌素对广赤眼蜂(Trichogramma evanescens)不同发育阶段的毒性和实验种群动态的影响. 生态学报, 29(9): 4738–4744 DOI:10.3321/j.issn:1000-0933.2009.09.018 |
| 张宝兰, 陈翠群, 张宏涛, 等, 2017. 阿维菌素对意大利蜜蜂(Apis mellifera L.)的毒性影响. 生态毒理学报, 12(4): 174–182 |
| 林汝榕, 李少菁, 1991. 铜、镉对中华哲水蚤氨基酸含量影响的实验研究. 海洋与湖沼, 22(3): 242–248 |
| 贾春生, 2006. 利用SPSS软件计算杀虫剂的LC50. 应用昆虫学报, 43(3): 414–417 DOI:10.3969/j.issn.0452-8255.2006.03.035 |
| 魏方林, 朱金文, 李少南, 等, 2008. 甲氨基阿维菌素苯甲酸盐乳油对环境生物的急性毒性研究. 农药科学与管理, 29(3): 19–24 DOI:10.3969/j.issn.1002-5480.2008.03.009 |
| Celino F T, Hilomen-Garcia G V, Del Norte-Campos A G C, 2012. Feeding selectivity of the seahorse, Hippocampus kuda (Bleeker), juveniles under laboratory conditions. Aquaculture Research, 43(12): 1804–1815 DOI:10.1111/are.2012.43.issue-12 |
| Chen Q X, Sheng J Q, Lin Q, et al, 2006. Effect of salinity on reproduction and survival of the copepod Pseudodiaptomus annandalei Sewell..1919. Aquaculture, 258(1-4): 575–582 DOI:10.1016/j.aquaculture.2006.04.032 |
| Cole M, Lindeque P, Fileman E, et al, 2015. The impact of polystyrene microplastics on feeding, function and fecundity in the marine copepod Calanus helgolandicus. Environmental Science & Technology, 49(2): 1130–1137 |
| Dhanker R, Kumar R, Hwang J S, 2012. Predation by Pseudodiaptomus annandalei (Copepoda:Calanoida) on rotifer prey:size selection, egg predation and effect of algal diet. Journal of Experimental Marine Biology and Ecology, 414-415: 44–53 DOI:10.1016/j.jembe.2012.01.011 |
| Dhanker R, Molinero J C, Kumar R, et al, 2015. Responses of the estuarine copepod Pseudodiaptomus annandalei to diatom polyunsaturated aldehydes:Reproduction, survival and postembryonic development. Harmful Algae, 43: 74–81 DOI:10.1016/j.hal.2015.02.002 |
| Frangóulos M, Guisande C, Maneiro I, et al, 2000. Short-term and long-term effects of the toxic dinoflagellate Alexandrium minutum on the copepod Acartia clausi. Marine Ecology Progress Series, 203: 161–169 DOI:10.3354/meps203161 |
| Frost B W, 1972. Effects of size and concentration of food particles on the feeding behavior of the marine planktonic copepod Calanus pacificus. Limnology & Oceanography, 17(6): 805–815 |
| Golez M S N, Takahashi T, Ishimarul T, et al, 2004. Post-embryonic development and reproduction of Pseudodiaptomus annandalei (Copepoda:Calanoida). Plankton Biology and Ecology, 51(1): 15–25 |
| Ianora A, Miralto A, Poulet S A, et al, 2004. Aldehyde suppression of copepod recruitment in blooms of a ubiquitous planktonic diatom. Nature, 429(6990): 403–407 DOI:10.1038/nature02526 |
| Igboeli O O, Burka J F, Fast M D, 2014. Sea lice population and sex differences in P-glycoprotein expression and emamectin benzoate resistance on salmon farms in the Bay of Fundy, New Brunswick, Canada. Pest Management Science, 70(6): 905–914 DOI:10.1002/ps.2014.70.issue-6 |
| Johnson S C, Treasurer J M, Bravo S, et al, 2004. A review of the impact of parasitic copepods on marine aquaculture. Zoological Studies, 43(2): 229–243 |
| Li H Y, Shi L, Wang D Z, et al, 2015. Impacts of mercury exposure on life history traits of Tigriopus japonicus:Multigeneration effects and recovery from pollution. Aquatic Toxicology, 166: 42–49 DOI:10.1016/j.aquatox.2015.06.015 |
| Luckenbach T, Epel D, 2008. ABCB-and ABCC-type transporters confer multixenobiotic resistance and form an environment-tissue barrier in bivalve gills. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 294(6): R1919–R1929 DOI:10.1152/ajpregu.00563.2007 |
| Miller D D, Marcus N H, 1994. The effects of salinity and temperature on the density and sinking velocity of eggs of the calanoid copepod Acartia tonsa Dana. Journal of Experimental Marine Biology and Ecology, 179(2): 235–252 DOI:10.1016/0022-0981(94)90117-1 |
| Omori M, Ikeda T, 1984. Methods in Marine Zooplankton Ecology.. New York: Willy-Interscience Press, |
| Stone J, Roy W J, Sutherland I H, et al, 2002. Safety and efficacy of emamectin benzoate administered in-feed to Atlantic salmon, Salmo salar L., smolts in freshwater, as a preventative treatment against infestations of sea lice, Lepeophtheirus salmonis (Kr yer). Aquaculture, 210(1-4): 21–34 DOI:10.1016/S0044-8486(01)00822-5 |
| Sutherland B J G, Poley J D, Igboeli O O, et al, 2015. Transcriptomic responses to emamectin benzoate in Pacific and Atlantic Canada salmon lice Lepeophtheirus salmonis with differing levels of drug resistance. Evolutionary Applications, 8(2): 133–148 DOI:10.1111/eva.2015.8.issue-2 |
| Veldhoen N, Ikonomou M G, Buday C, et al, 2012. Biological effects of the anti-parasitic chemotherapeutant emamectin benzoate on a non-target crustacean, the spot prawn (Pandalus platyceros Brandt..1851) under laboratory conditions. Aquatic Toxicology, 108: 94–105 DOI:10.1016/j.aquatox.2011.10.015 |
| Walter T C, Ohtsuka S, Castillo L V, 2006. A new species of Pseudodiaptomus (Crustacea:Copepoda:Calanoida) from the Philippines, with a key to pseudodiaptomids from the Philippines and comments on the status of the genus Schmackeria. Proceedings of the Biological Society of Washington, 119(2): 202–221 DOI:10.2988/0006-324X(2006)119[202:ANSOPC]2.0.CO;2 |
| Westcott J D, Stryhn H, Burka J F, et al, 2008. Optimization and field use of a bioassay to monitor sea lice Lepeophtheirus salmonis sensitivity to emamectin benzoate. Diseases of Aquatic Organisms, 79: 119–131 DOI:10.3354/dao01887 |
| Willis K J, Ling N, 2003. The toxicity of emamectin benzoate, an aquaculture pesticide, to planktonic marine copepods. Aquaculture, 221(1-4): 289–297 DOI:10.1016/S0044-8486(03)00066-8 |
| Xu D H, Liu G X, 2014. The effects of DDT on the feeding, respiration, survival, and reproduction of Sinocalanus tenellus (Copepoda:Calanoida). Acta Oceanologica Sinica, 33(9): 133–138 DOI:10.1007/s13131-014-0524-4 |
 2019, Vol. 50
2019, Vol. 50


