中国海洋湖沼学会主办。
文章信息
- 汤玉洁, 棘怀飞, 王欢, 李晔. 2019.
- TANG Yu-Jie, JI Huai-Fei, WANG Huan, LI Ye. 2019.
- 三疣梭子蟹(Portunus trituberculatus)雌雄性腺的差异转录组分析
- COMPARATIVE TRANSCRIPTOME ANALYSIS OF FEMALE AND MALE GONADS OF PORTUNUS TRITUBERCULATUS
- 海洋与湖沼, 50(1): 197-203
- Oceanologia et Limnologia Sinica, 50(1): 197-203.
- http://dx.doi.org/10.11693/hyhz20180500118
-
文章历史
- 收稿日期:2018-05-16
- 收修改稿日期:2018-08-28
三疣梭子蟹(Portunus trituberculatus)属于甲壳纲(Crustacea)、十足目(Decapoda)、梭子蟹科(Portunidae)、梭子蟹属(Portunus), 其营养价值丰富, 生长迅速, 是我国东海海域一种重要的经济类海产动物(孙颖民等, 1984)。在人工养殖过程中常存在亲本性腺发育不良等症状, 需使用野生抱卵梭子蟹作为繁殖亲本(高保全等, 2008)。然而, 近年来由于过度捕捞, 自然环境恶化等问题导致野生亲本量难以满足大规模养殖需求, 制约了梭子蟹养殖业的发展。传统方法通过切除眼柄来诱导雌性虾蟹卵巢快速发育成熟, 提高抱卵率, 但实践发现此方法易造成死亡率上升、蜕皮周期缩短、卵子质量下降及孵化率低等问题(水燕等, 2013)。因此, 三疣梭子蟹性别决定因子、性腺分化以及配子形成等过程分子机理的研究将对其人工培育繁殖亲本提供重要的理论基础。
目前对三疣梭子蟹性腺的研究多是通过生化组成、营养代谢和组织学结构学来进行(陈石林, 2007; 管卫兵等, 2009; 吴旭干等, 2014), 或者通过对单个基因进行克隆, 分析该基因对性腺发育成熟的调控(谢熙等, 2013; 朱韬等, 2016; 贾复龙等, 2016)。转录组学是在整体水平上研究所有基因的转录及调控规律的方法, 其不仅仅局限于对单个基因的研究, 因此在研究那些缺乏参考基因组信息的非模式生物中具有广泛的应用前景(Ozsolak et al, 2011)。目前通过转录组学对三疣梭子蟹展开的研究主要针对卵巢和肝胰腺, Wang等(2014)通过对不同阶段肝胰腺转录组测序, 研究肝胰腺与营养代谢和卵巢发育的关系; Lv等(2014)通过三疣梭子蟹眼柄、肝胰腺、腮和肌肉组织Illumina测序结果, 鉴定出了MIH、Profilin等10个与生长相关基因, 并根据深度测序结果通过飞行质谱法鉴定出了大量单核苷酸多态性位点和微卫星DNA分子标记。
本研究采用Illumina/Solexa技术对三疣梭子蟹雌雄性腺基因表达情况进行分析, 通过GO和KEGG功能富集, 分析差异表达基因和性腺分化发育相关基因, 为后续三疣梭子蟹遗传机制研究提供线索。
1 材料与方法 1.1 材料实验用三疣梭子蟹取自宁波市咸祥梭子蟹养殖场, 体重为200g±6g。成熟螃蟹冰浴30min麻醉, 经活体解剖后取完整性腺, 液氮速冻后置于–80℃冰箱中保存备用。
1.2 方法 1.2.1 样品总RNA提取、上机测序采用总RNA提取试剂盒提取成熟雌雄性腺总RNA, 样品提取总RNA后, 用带有Oligo(dT)的磁珠富集、纯化mRNA, 之后采用片段化试剂将mRNA随机片段化。针对片段化mRNA进行去磷酸以及加磷酸处理(Phosphatase and PNK Treatment), 使得片段化的mRNA 5′端带有磷酸基团, 3′端带有羟基基团。之后首先利用T4 RNA连接酶2(Truncated)将一个腺苷化单链DNA 3′接头和5′接头相继连接到small RNA上, 带有5′与3′链接接头的mRNA序列, 通过与3′端互补的RT引物进行反转录反应, 最后进行PCR扩增15个循环获得cDNA序列。200—300碱基长度的PCR产物经过6% polyacrylamide Tris-borate-EDTA胶回收, 从而完成整个文库制备工作, 构建好的文库用Illumina GAIIX进行测序, 测序读长为2×100bp。
1.2.2 序列拼接对大量的样本数据进行质量预处理, 滑动窗口法去除低质量片段, 同时切除reads中含N部分序列。将2个样本的有效reads合并进行de novo拼接, 使用软件Trinity, 版本trinityrnaseq_ r2012-10-05, 使用paired-end的拼接方法。对拼接序列去重复之后, 取最长转录本作为Unigene。
1.2.3 测序数据分析通过BLAST算法, 将样本基因序列分别与Swissprot、Tremble、CDD、Pfam、NR和KOG库进行比对, 取相似度 > 30%, 且e < 1e-5的注释, 合并基因得到的所有注释详细信息。基于比对Swissprot、Tremble的结果, 对得到的基因进行GO功能分类, 统计基因在Biological Process, Cellular Component, Molecular Function三个类别的GO term; 对unigene进行KEGG注释, 得到的基因进行KEGG Pathway分析, 利用KAAS预测得到对应的KO号, 然后利用KO号对应到KEGG pathway上。根据fold change方法得到差异转录本, 将差异转录本作为前景, 全部转录本作为背景, 进行GO和KEGG的富集分析, 使用超几何分布算法(phyper)计算前景转录本同GO/Pathway分类中某个特定分支的P值。
1.2.4 实时荧光定量PCR根据部分雌雄性腺差异表达基因, 利用primer premier5设计引物(表 1), 实时荧光定量PCR检测基因表达情况。PCR反应以雌雄性腺的cDNA为模板, β-actin作为内参基因, 扩增条件为95℃预变性5min; 95℃ 10s, 60℃ 15s, 72℃ 20s。SPSS 18.0统计软件进行显著性分析。每个组织做三个平行样品, 每个平行样品重复四次。
| 引物名称 | 引物序列(5′—3′) |
| CDK7-F | CTTCACAGCACTTGGCACAC |
| CDK7-R | GCTGCAGGAAACAGGTCTCT |
| EcR-F | ACGACTCGGATGCCAAGTTT |
| EcR-R | TGACGAGCAAGCCTTTAGCA |
| VTG-F | CAGATTTTCTTGCCAGAGGACG |
| VTG-R | AGCTGCTTGCTGGAGACTG |
| nm23-F | CATGATGGGAGAGACCAGGC |
| nm23-R | CCACCTCCTTGTTGGCAGAT |
| RXR-F | ATGTCCGGCTCCCTGGAT |
| RXR-R | GTGGTGTTGCTTGAGAAGCTG |
| FPS-F | TTGGTGCATTGAGCTGTTGC |
| FPS-R | GGGCAAAGTGCTTGTGAAGG |
| β-actin-F β-actin-R |
ACCTGATGAAAATCCTGACC GGAAGGAAGGCTGGAAGAGA |
三疣梭子蟹雌雄性腺cDNA文库经过Solexa双端测序后共获得169660066条原始序列, 去除引物、接头序列和低质量reads后得到有效RNA-seq 134763426条, 其中雌性和雄性性腺分别获得75277290条和59486136条(表 2)。大部分的功能基因长度分布在250—350bp(图 1)。该研究所得转录组数据已提交至NCBI(www.ncbi.nlm.nih.gov/)SRA数据库, 登陆号为SRP145568。将两样本有效的reads合并在一起进行de novo组装, 获得192848个转录本对应130054个独立基因(unigene)。
| 类别 | 雌性性腺 | 雄性性腺 | 合计 |
| 原始序列 | 94436166 | 75223900 | 169660066 |
| 过滤后高质量序列 | 75277290 | 59486136 | 134763426 |
| 过滤后平均读长 | 86.38 | 85.92 | 86.18 |
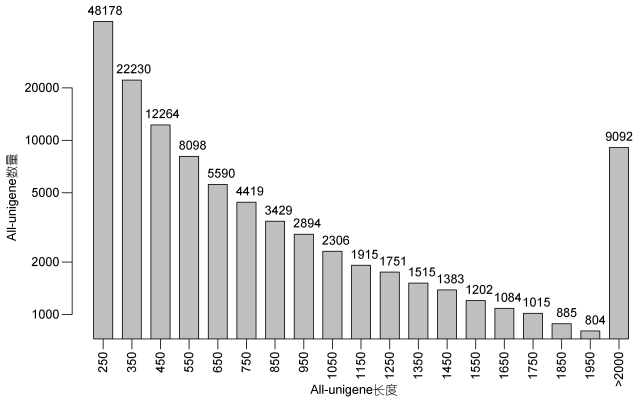 |
| 图 1 All-unigene长度分布图 Fig. 1 Length distribution of all-unigene |
在NR、CDD、Swissprot、Tremble、Pfam五个公共数据库中进行功能注释, 其余未在NR数据库中找到的unigene可能是新的蛋白。五个数据库NR、CDD、Swissprot、Tremble、Pfam分别注释到23456、14905、17881、25780、23247个unigene, 在NR数据库中比对注释的信息最多, 注释了23456个unigene。在NR、CDD、Swissprot、Tremble、Pfam五个数据库中都注释到的unigene有5622个(图 2)。
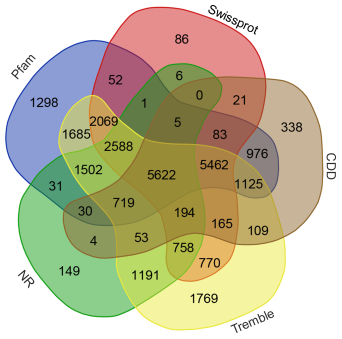 |
| 图 2 Unigene的功能注释结果 Fig. 2 Summary of functional annotation of the unigenes |
对雌雄样本差异基因进行KEGG pathway富集分析, 以P < 0.05作为差异表达基因在该通路显著富集, 共鉴定出86条pathway显著富集, 以P < 0.01作为差异表达基因在该通路显著富集, 共鉴定出63条pathway显著富集, 下表 3中列出差异表达基因显著富集的前10个通路, 其中包括神经活性配体-受体相互作用、细胞外基质受体作用、基础转录因子、脂肪酸代谢、淀粉与蔗糖的代谢、柠檬酸循环(TCA循环)、不饱和脂肪酸生物合成、氧化磷酸化(作用)、真核生物中核糖体的生物合成、突触囊泡循环。
| KO ID | 通路中所有转录本(63166) | 通路中差异基因(28073) | P值 | Q值 | 通路 |
| ko04080 | 157 | 141 | 1.29E-09 | 2.58E-08 | 神经活性配体受体相互作用 |
| ko04512 | 161 | 141 | 7.66E-08 | 1.42E-06 | 细胞外基质受体作用 |
| ko03022 | 78 | 72 | 4.81E-07 | 8.38E-06 | 基础转录因子 |
| ko00071 | 86 | 78 | 1.38E-06 | 2.27E-05 | 脂肪酸代谢 |
| ko00500 | 115 | 101 | 2.98E-06 | 4.61E-05 | 淀粉与蔗糖的代谢 |
| ko00020 | 56 | 52 | 7.68E-06 | 0.000113 | 柠檬酸循环(TCA循环) |
| ko01040 | 49 | 46 | 8.68E-06 | 0.000121 | 不饱和脂肪酸生物合成 |
| ko00190 | 224 | 184 | 2.22E-05 | 0.000295 | 氧化磷酸化(作用) |
| ko03008 | 141 | 119 | 4.25E-05 | 0.000539 | 真核生物中核糖体的生物合成 |
| ko04721 | 82 | 72 | 5.95E-05 | 0.000721 | 突触囊泡循环 |
| GO ID | GO注释中所有转录本(159823) | GO注释中差异基因(71811) | P值 | Q值 | GO_term |
| GO:0005739 | 848 | 692 | 8.47E-14 | 3.50E-13 | 线粒体 |
| GO:0016491 | 1203 | 951 | 1.31E-11 | 5.41E-11 | 氧化还原酶活性 |
| GO:0055114 | 1307 | 1024 | 1.10E-10 | 4.53E-10 | 氧化还原过程 |
| GO:0005576 | 1124 | 887 | 1.30E-10 | 5.34E-10 | 胞外区 |
| GO:0006508 | 875 | 697 | 5.99E-10 | 2.46E-09 | 蛋白质水解 |
| GO:0004930 | 239 | 206 | 6.04E-09 | 2.48E-08 | G-蛋白偶联受体活性 |
| GO:0010466 | 177 | 156 | 1.02E-08 | 4.17E-08 | 肽酶活性的负调控 |
| GO:0030414 | 177 | 156 | 1.02E-08 | 4.17E-08 | 肽酶抑制剂的活性 |
| GO:0007186 | 305 | 256 | 3.07E-08 | 1.25E-07 | G蛋白偶联受体信号通路 |
| GO:0008061 | 191 | 165 | 1.14E-07 | 4.62E-07 | 几丁质结合 |
根据NR数据库注释得到的信息, 对差异转录本进行富集分析, 其中显著富集的10个GO term中属于生物过程和分子过程的分别有4个, 线粒体和胞外区属于细胞组成。
2.5 性腺分化发育相关基因表达情况本研究通过第二代高通量转录组测序技术揭示了雌雄性腺中表达的大量的差异基因, 为了证实转录组测序结果, 挑取了6个差异表达基因通过实时荧光定量PCR技术分析其在雌雄不同性别梭子蟹个体中表达情况(表 5)。转录组结果中6个基因雌雄比均上调, qPCR验证结果与转录组结果趋势一致。
| 转录组ID | 基因名称 | RPKM | 雌/雄 | |
| 雄 | 雌 | |||
| comp64065_c0_seq44 | EcR | 0.01 | 0.18 | up |
| comp49380_c0_seq1 | CDK7 | 0.97 | 9.11 | up |
| comp66894_c0_seq3 | nm23 | 0.7 | 3.15 | up |
| comp25822_c0_seq1 | RXR | 0.05 | 0.8 | up |
| comp66986_c0_seq1 | FPS | 0.5 | 2.75 | up |
| comp998847_c0_seq1 | VTG | 0.19 | 0.74 | up |
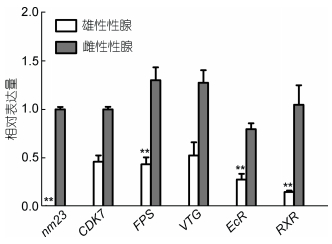 |
| 图 3 性别相关基因荧光定量验证表达量结果 Fig. 3 Quantitative real-time PCR validation of the expression levels of gender-related genes 注: **表示雌雄之间极显著差异(P < 0.01) |
与鱼类、贝类等其他水产动物相比, 甲壳类动物有其独特的生长发育史, 受多因素共同调控, 因此其性腺发育调控机制也会相对复杂。与中华绒螯蟹、锯缘青蟹相比, 三疣梭子蟹分子理论基础薄弱, 遗传背景相对不足(Fanjul-Moles, 2006)。近年来, 转录组学和高通量测序技术的发展日新月异, 本研究基于Illumina高通量测序技术对三疣梭子蟹性腺分化发育相关基因进行发掘。
本次三疣梭子蟹雌雄性腺转录组测序结果经Trinity组装后长度大于500bp的unigene共47465条, 占unigene总数的36.49%;长度大于1000bp的unigene共22971条, 占unigene总数的17.66%, 表明本数据库具有较高的质量。差异基因GO功能富集结果中, 显著富集的主要有氧化还原过程、氧化还原酶活性、线粒体、蛋白质降解以及G蛋白相关, 说明成熟三疣梭子蟹性腺发育需要大量能量。KEGG富集结果中, 显著富集的通路主要有氧化磷酸化、淀粉与蔗糖的代谢、TCA循环等与供能相关的通路, 以及脂肪酸代谢、不饱和脂肪酸合成等影响激素合成的通路。
nm23(non-metastatic 23)编码核苷二磷酸激酶(NDPK), NDPK不仅可以维持生物体内核苷酸平衡, 还参与调节细胞增殖、细胞分化、细胞凋亡和细胞信息传递等多种生物学功能。转录组测序结果发现, 雌性性腺中nm23表达量比在雄性高3倍, 与荧光定量PCR验证结果趋势相同。关于甲壳动物nm23基因的报道相对较少, Jin等(2011)对中华绒螯蟹(Eriocheir sinensis)nm23基因进行了克隆表达, 并与具有细胞凋亡功能的caspase基因的序列和功能进行对比分析, 发现nm23与caspase均参与抗菌反应, 在中华绒螯蟹的内在免疫系统中发挥重要作用。Jiang等(2018)对处于卵巢发育阶段的日本沼虾(Macrobrachium nipponense) nm23基因进行克隆和表征, 结果表明nm23参与日本沼虾卵巢发育调控, 并且可能对卵母细胞和卵巢的成熟具有抑制作用。
维甲酸X受体(retinoid-X receptor, RXR)是甲壳动物中广泛分布的核受体蛋白。RXR可与同属于核受体超家族的蜕皮激素受体EcR(ecdysone receptor)形成异质二聚体, 结合20-羟基蜕皮激素(20-hydroxyecdysone, 20E), 对节肢动物的生殖、蜕皮和附肢再生进行调节(Sarika et al, 2014)。EcR和RXR在转录组测序结果中, 雌性表达量与雄性表达量相比均呈上调趋势, qPCR验证结果与转录组测序结果一致。有报道称, RXR对卵黄蛋白原和卵巢发育, 以及胚胎发育都有调节作用(Cui et al, 2013; Girish et al, 2015; Gong et al, 2016)。目前, 在拟穴青蟹(Scylla paramamosain) (Gong et al, 2016)、三疣梭子蟹、招潮蟹(Uca pugilator) (Durica et al, 2002; Hopkins et al, 2008)等甲壳动物中都克隆出了RXR基因。Durica等(2002)的研究发现, RXR基因在大西洋砂招潮蟹成熟的卵巢中表达量最高。Tang等(2014)在对三疣梭子蟹RXR基因的表达特征研究中发现, 卵巢中的表达量显著高于精巢, 这一结果与本研究相符, 表明该基因可能参与性腺分化(Gong et al, 2016), 但仍需后续研究证明。
细胞周期蛋白依赖性激酶7(cyclin-dependent kinase 7, CDK7)在qPCR验证结果中, 雌性性腺中表达量高于雄性, 此结果与转录组测序中结果基本相符(表 5)。贾复龙等(2016)对三疣梭子蟹的CDK7进行克隆, 发现CDK7参与三疣梭子蟹卵巢发育调控。也有研究表明(韩坤煌等, 2010; 贾复龙等, 2016), CDK7和Cylin H形成的复合体周期蛋白依赖性激酶活化激酶(cyclin-activating kinase, CAK)可以促进细胞发生分裂和繁殖, 在精子发生过程中的减数分裂期具有重要作用。
法尼基焦磷酸合成酶(Farnesyl diphosphate synthase, FPS)是类异戊二烯合成途径中的重要催化酶, 参与MF的合成。MF被认为是一种性腺刺激激素, 具有启动和加速卵黄发生, 促进卵黄蛋白原(Vitellogenin, VTG)合成的功能, 对甲壳动物的蜕皮和繁殖起着重要作用(贾复龙等, 2016)。目前, 三疣梭子蟹中FPS已被克隆, 研究表明FPS对三疣梭子蟹三疣梭子蟹蜕皮及卵巢发育可能有调控作用(谢熙等, 2013; 朱韬等, 2016)。本研究中, qPCR检测结果和转录组测序结果相符, FPS基因在雌性性腺中相对于雄性高表达, 可能在梭子蟹雌雄分化产生一定作用。VTG是非哺乳动物雌体特有的生殖相关蛋白, 是卵黄蛋白的前体物质, 通常是在甲壳动物的肝胰腺中合成(Li et al, 2006), 然后分泌到血淋巴, 由滤泡细胞转运, 最后在卵巢中积累。传统认为, VTG为早期胚胎发育和幼体发育提供营养和能量(Meusy et al, 1988)也有研究表明VTG参与免疫防御, 中华绒螯蟹中克隆出的Es-Vtg1通过结合细菌, 抑制细菌繁殖, 调节抗菌肽表达实现抗菌功能(Li et al, 2017)。转录组测序结果中, VTG基因在雌雄性腺中表达量均较低; qPCR检测结果中, 在雌性性腺中表达量较高于雄性性腺。在拟穴青蟹中, VTG基因表达情况与梭子蟹相符, 雌性性腺中表达而雄性性腺中未检出(Jia et al, 2013)。有文献表明, 雄性无脊椎动物中, VTG基因尽管存在, 但是沉默不表达(Ding et al, 2017)。
4 结论本研究通过高通量测序技术对三疣梭子蟹雌雄性腺进行生物信息学分析, 揭示了三疣梭子蟹雌雄性腺转录本的总体概况和基因特征, GO和KEGG富集分析显著差异基因多集中在供能和激素合成通路上。另外, 本研究挖掘与性腺发育和性别分化相关的基因, 筛选出6个可能参与性腺分化发育调控的差异表达基因, 经荧光定量PCR验证, 6个基因在雌性性腺中表达量较雄性性腺均呈上调趋势, 这些基因的差异表达可能调控了三疣梭子蟹性腺的分化发育过程, 为进一步深入研究三疣梭子蟹性腺分化发育机理积累了科学数据。
| 水燕, 史永红, 徐增洪, 等, 2013. 眼柄切除快速诱导甲壳动物生长发育研究进展. 广东农业科学, 40(21): 124–126, 135 DOI:10.3969/j.issn.1004-874X.2013.21.033 |
| 孙颖民, 宋志乐, 严瑞深, 等, 1984. 三疣梭子蟹生长的初步研究. 生态学报, 4(1): 59–64 |
| 朱韬, 朱冬发, 邱锡尔, 等, 2016. 三疣梭子蟹fps克隆及其在卵巢发育中的表达分析. 生物学杂志, 33(3): 10–14, 19 DOI:10.3969/j.issn.2095-1736.2016.03.010 |
| 吴旭干, 汪倩, 楼宝, 等, 2014. 育肥时间对三疣梭子蟹卵巢发育和营养品质的影响. 水产学报, 38(2): 170–182 |
| 陈石林, 吴旭干, 成永旭, 等, 2007. 三疣梭子蟹胚胎发育过程中主要生化组成的变化及其能量来源. 中国水产科学, 14(2): 229–235 DOI:10.3321/j.issn:1005-8737.2007.02.008 |
| 贾复龙, 孟宪亮, 刘萍, 等, 2016. 三疣梭子蟹细胞Cdk7基因克隆及其在卵巢发育中的表达. 中国水产科学, 23(5): 1032–1040 |
| 高保全, 刘萍, 李健, 等, 2008. 三疣梭子蟹(portunus trituberculatus)不同地理种群内自繁和种群间杂交子一代生长性状的比较. 海洋与湖沼, 39(3): 291–296 DOI:10.3321/j.issn:0029-814X.2008.03.016 |
| 谢熙, 朱冬发, 崔晓雨, 等, 2013. 三疣梭子蟹FAMeT基因克隆及其在蜕皮周期中的表达水平. 水产学报, 37(7): 994–1001 |
| 韩坤煌, 张子平, 王艺磊, 等, 2010. Cyclin-CDK-CKI及UPP参与生殖调控及在甲壳动物性腺发育中的研究进展. 生物技术通报,(7): 48–54 |
| 管卫兵, 宣富君, 戴小杰, 等, 2009. 东海三疣梭子蟹精子发生及精荚形成. 中国水产科学, 16(2): 173–182 DOI:10.3321/j.issn:1005-8737.2009.02.004 |
| Cui J, Wu L T, Chan S M, et al, 2013. cDNA cloning and mRNA expression of retinoid-X-receptor in the ovary of the shrimp Metapenaeus ensis. Molecular Biology Reports, 40(11): 6233–6244 |
| Ding L Y, Jin M, Sun P, et al, 2017. Cloning, tissue expression of the fatty acid-binding protein (Pt-FABP1) gene, and effects of dietary phospholipid levels on fabp and vitellogenin gene expression in the female swimming crab Portunus trituberculatus. Aquaculture, 474: 57–65 DOI:10.1016/j.aquaculture.2017.03.029 |
| Durica D S, Wu X H, Anilkumar G, et al, 2002. Characterization of crab EcR and RXR homologs and expression during limb regeneration and oocyte maturation. Molecular and Cellular Endocrinology, 189(1-2): 59–76 DOI:10.1016/S0303-7207(01)00740-7 |
| Fanjul-Moles M L, 2006. Biochemical and functional aspects of crustacean hyperglycemic hormone in decapod crustaceans:Review and update. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 142(3-4): 390–400 |
| Girish B P, Swetha C, Reddy P S, 2015. Expression of RXR, EcR, E75 and VtG mRNA levels in the hepatopancreas and ovary of the freshwater edible crab, Oziothelphusa senex senex (Fabricius..1798) during different vitellogenic stages. The Science of Nature, 102(3-4): 20 DOI:10.1007/s00114-015-1272-9 |
| Gong J, Huang C C, Shu L, et al, 2016. The retinoid X receptor from mud crab:new insights into its roles in ovarian development and related signaling pathway. Scientific Reports, 6: 23654 DOI:10.1038/srep23654 |
| Hopkins P M, Durica D, Washington T, 2008. RXR isoforms and endogenous retinoids in the fiddler crab, Uca pugilator. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 151(4): 602–614 |
| Jia X W, Chen Y D, Zou Z H, et al, 2013. Characterization and expression profile of Vitellogenin gene from Scylla paramamosain. Gene, 520(2): 119–130 |
| Jiang H X, Li X L, Sun Y H, et al, 2018. Molecular and functional characterization of nucleoside diphosphate kinase (nm23) gene in oriental river prawn Macrobrachium nipponense during ovarian development. Aquaculture Research, 49(3): 1219–1231 DOI:10.1111/are.2018.49.issue-3 |
| Jin X K, Li W W, He L, et al, 2011. Molecular cloning, characterization and expression analysis of two apoptosis genes, caspase and nm23, involved in the antibacterial response in Chinese mitten crab, Eriocheir sinensis. Fish & Shellfish Immunology, 30(1): 263–272 |
| Li K, Chen L Q, Zhou Z L, et al, 2006. The site of vitellogenin synthesis in Chinese mitten-handed crab Eriocheir sinensis. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 143(4): 453–458 DOI:10.1016/j.cbpb.2005.12.019 |
| Li L, Li X J, Wu Y M, et al, 2017. Vitellogenin regulates antimicrobial responses in Chinese mitten crab, Eriocheir sinensis. Fish & Shellfish Immunology, 69: 6–14 |
| Lv J J, Liu P, Gao B Q, et al, 2014. Transcriptome analysis of the Portunus trituberculatus:de novo assembly, growth-related gene identification and marker discovery. PLoS One, 9(4): e94055 DOI:10.1371/journal.pone.0094055 |
| Meusy J J, Payen G G, 1988. Female reproduction in Malacostracan Crustacea. Zoological Science, 5(2): 217–265 |
| Ozsolak F, Milos P M, 2011. RNA sequencing:advances, challenges and opportunities. Nature Reviews Genetics, 12(2): 87–98 DOI:10.1038/nrg2934 |
| Sarika S N, Gopinathan A, 2014. DNA binding domain of retinoid receptor gene (RXR) from a field crab inhabiting the Indian peninsula. Indian Journal of Biotechnology, 13(1): 52–56 |
| Tang J, Zhu D F, Cui X Y, et al, 2014. Molecular cloning, characterization and expression analysis of the retinoid X receptor in the swimming crab, Portunus trituberculatus (Miers..1876) (Decapoda, Portunidae). Crustaceana, 87(3): 312–327 DOI:10.1163/15685403-00003286 |
| Wang W, Wu X G, Liu Z J, et al, 2014. Insights into hepatopancreatic functions for nutrition metabolism and ovarian development in the crab Portunus trituberculatus:gene discovery in the comparative transcriptome of different hepatopancreas stages. PLoS One, 9(1): e84921 DOI:10.1371/journal.pone.0084921 |
 2019, Vol. 50
2019, Vol. 50


