
中国海洋湖沼学会主办。
文章信息
- 沈敏, 赵玉超, 凌涛, 王仁杰, 董甜甜, 崔彦婷, 李玉全, 王淑生, 付瑞江. 2019.
- SHEN Min, ZHAO Yu-Chao, LING Tao, WANG Ren-Jie, DONG Tian-Tian, CUI Yan-Ting, LI Yu-Quan, WANG Shu-Sheng, FU Rui-Jiang. 2019.
- 高盐突变对凡纳滨对虾(Litopenaeus vannamei)生长性能及相关酶活力的影响
- EFFECTS OF HIGH-SALT ABRUPT ON GROWTH AND RELATED ENZYME ACTIVITIES IN LITOPENAEUS VANNAMEI
- 海洋与湖沼, 50(1): 204-209
- Oceanologia et Limnologia Sinica, 50(1): 204-209.
- http://dx.doi.org/10.11693/hyhz20180500138
-
文章历史
- 收稿日期:2018-05-31
- 收修改稿日期:2018-07-08
2. 潍坊市渔业技术推广站 潍坊 261061;
3. 滨州市渔业技术推广站 滨州 256600;
4. 滨州市北海新区海缘养殖科技有限公司 滨州 251907
2. Weifang Fisheries Technology Extension Station, Weifang 261061, China;
3. Binzhou Fisheries Technology Extension Station, Binzhou 256600, China;
4. Binzhou North-sea District Haiyuan Aquaculture Technology Co., Ltd., Binzhou 251907, China
凡纳滨对虾(Litopenaeus vannamei)是世界范围内最具价值的经济虾类之一, 占我国对虾养殖总产量的比重较大(栾生等, 2013), 其养殖属性优良, 具有生长速度快、抗病耐病等优点(张丹等, 2016), 且耐盐能力强, 可在从几乎纯淡水至盐度70左右的水体中生存, 已在淡水、半咸水、海水等水域广泛养殖(Menz et al, 1980; Stern et al, 1990; 李娜等, 2018)。盐度变化是影响对虾生长、存活和生理代谢的主要因素之一(刘慧杰等, 2008), 国内外学者在盐度变化对对虾生长、渗透、免疫的影响方面做了一些研究。马英杰等(1999)研究发现低盐度突变对中国仔虾存活率影响显著, 存活率的高低由盐度降幅和速率决定; 张丹等(2016)研究表明凡纳滨对虾耐受盐度波动能力突出, 即使盐度波动达到10, 依然能维持机体的渗透平衡; Cheng等(2000)和Perazzolo等(2002)研究证明盐度发生变化后, 甲壳动物产生应激反应, 易感染病原菌, 免疫力下降; 刘慧杰等(2008)研究建议在对虾养殖过程中, 盐度变化超过5时, 应在3d内及时关注对虾的机体健康情况, 尽量保持水环境的平衡稳定。但这些研究多围绕低盐或者正常海水盐度范围, 对于高盐突变对凡纳滨对虾的影响研究鲜见报道。
在我国沿海和西北地区存在大面积高盐水域, 仅环渤海沿岸盐度40以上的水域面积就约有13×104 hm2。这些水域处于闲置、晒盐, 或进行丰年虫捕捞生产等状态, 产值低, 经济和社会效益较差。近年来部分高盐水体开展了凡纳滨对虾养殖尝试(李娜等, 2018), 并有少量凡纳滨对虾高盐适应性方面的相关报道。李娜等(2017, 2018)报道了长期高盐胁迫对凡纳滨对虾生长、摄食量、消化和免疫力相关酶活力的影响, 但在高盐突变方面未见相关报道。凡纳滨对虾养殖过程中, 夏季遇到干旱天气, 养殖水体盐度突变频发, 直接影响对虾的蜕皮、生长、代谢等。因此, 本试验以凡纳滨对虾为试验材料, 模拟夏季高盐突变, 分析高盐突变对对虾存活率、相对增重率及相关酶活力的影响, 以期为高盐对虾养殖和抗逆研究提供借鉴, 同时为凡纳滨对虾养殖生产措施的采用提供理论指导。
1 材料与方法 1.1 试验材料试验所用凡纳滨对虾(Litopenaeus vannamei)购自烟台海阳某对虾养殖场, 为正大品牌。对虾初始体长为(53.62±2.67)mm, 初始体重为(0.96±0.14)g, 于青岛农业大学海洋科学与工程学院开放试验室水族箱中暂养7d。暂养期间所用海水为天然海水, 盐度30±2, pH值8.0±0.5。利用加热棒将温度控制在(28±0.5)℃, 24h连续充气, 每日换水1次, 虹吸底部排水, 换水量50%。高盐度海水由天然海水与粗盐调配而成。养殖试验于2017年3月4—31日在开放实验内进行, 历时28d。
1.2 试验设计试验于30cm×20cm×20cm长方形PVC箱中进行, 暂养结束后, 筛选规格相近, 健康活泼的凡纳滨对虾放入PVC箱, 由30盐度在12h内梯度突变至35、40、45、50、55及60盐度, 以盐度30为对照组, 其他为试验组, 各设3个平行组, 每组放入15尾凡纳滨对虾。试验前停食24h, 以排空肠胃中的粪便。连续充气, 每天投喂配合饲料(粗蛋白质43%, 粗纤维5%, 总磷0.9%, 粗脂肪5%, 赖氨酸2.2%, 粗灰分15%, 水分12%) 3次(8:00, 14:00, 20:00), 日投喂量为对虾湿重的5%, 每天10:00换水50%, 每隔7d测定1次体长和体重, 计算特定存活率和相对增重率。
试验结束前24h停止投喂饵料, 各处理凡纳滨对虾的体长和体质量于次日测量, 用游标卡尺进行体长测量, 采用电子天平进行体质量称量, 于每个试验箱中随机取2—5尾对虾, 用1.0mL一次性注射器抽取对虾血窦内的血淋巴, 1︰1加入抗凝剂混合于1.5mL的Eppendorf管中, 4℃过夜后4000r/min离心15min, 收集血清, 测定Na+/K+-ATPase和T-ATPase、AKP、ACP及SOD活力。酶活力测定采用南京建成科技有限公司生产的相应酶试剂盒, 按说明书描述的步骤进行。
1.3 数据处理与分析 1.3.1 数据处理本试验在定期检测对虾体长、体重, 统计死亡数的基础上, 计算高盐突变后凡纳滨对虾的存活率(SR, %)、相对增重率(WG)和体长增长率(LGR, %)等指标, 具体计算公式如下:
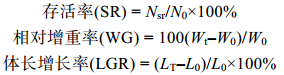
式中, W0和Wt分别为试验起始和结束时对虾湿重(g)。Nsr为存活的个体数目, N0为起始放入的总个体数。L0和LT分别表示试验起始和结束时对虾体长(mm)。
1.3.2 统计分析所有数据均用3个平行组数据的平均值±标准差表示, 所得数据利用SPSS19.0统计软件进行单因素方差分析(One-ANOVA)和Duncan多重比较检验数据差异的显著性, 以P < 0.05作为差异显著, 借助WPS软件作图。
2 结果与分析 2.1 对生长指标的影响 2.1.1 存活率从表 1可以看出, 高盐条件下凡纳滨对虾的存活率表现出逐渐降低的趋势, 盐度35和40时存活率最高, 为97.78%, 盐度60时存活率最低, 为6.67%, 但盐度30—45间存活率差异不显著, 50和55处理间差异不显著(P > 0.05), 其余各处理组间差异显著(P < 0.05), 说明盐度超过50会显著影响凡纳滨对虾的成活率。
| 盐度 | 平均投放数量(尾) | 平均剩余数量(尾) | 存活率(%) |
| 30 | 15 | 14.33±1.15a | 95.56±0.08a |
| 35 | 15 | 14.67±0.58a | 97.78±0.04a |
| 40 | 15 | 14.67±0.58a | 97.78±0.04a |
| 45 | 15 | 14.33±0.58a | 95.56±0.04a |
| 50 | 15 | 11.67±0.58b | 77.78±0.04b |
| 55 | 15 | 10.67±0.58b | 71.11±0.04b |
| 60 | 15 | 1.00±0c | 6.67±0.00c |
| 注:不同字母表示处理间差异显著(P < 0.05), 下同 | |||
从表 2可以看出, 随着突变盐度的升高, 凡纳滨对虾的相对增重率呈现逐渐降低趋势。盐度30和35时相对增重率最高, 盐度40和45相对增重率次之, 盐度60时相对增重率最低, 为83.9%。说明盐度超过40会显著影响对虾的相对增重率。
| 盐度 | 初始湿重(g) | 结束时湿重(g) | 相对增重率 |
| 30 | 0.93±0.06a | 6.01±0.771a | 543.57±111.69a |
| 35 | 0.95±0.05a | 6.03±0.5a | 532.17±45.38a |
| 40 | 0.97±0.07a | 5.14±0.84ab | 431.72±49.78b |
| 45 | 1.06±0b | 4.91±0.76b | 363.52±71.43b |
| 50 | 0.95±0.04a | 3.37±0.39c | 253.85±26.52c |
| 55 | 0.96±0.02a | 2.66±0.14cd | 177.08±14.99cd |
| 60 | 0.97±0.0a | 1.79±0.01d | 83.9±6.22d |
从表 3可以看出, 随着突变盐度的升高, 凡纳滨对虾的体长增长率逐渐降低。盐度30和45时相体长增长率最高, 突变盐度超过50后, 体长增长率降低, 除盐度60处理与其他处理间差异显著外(P < 0.05), 其他各处理间无显著差异(P > 0.05)。
| 盐度 | 初始体长(mm) | 最终体长(mm) | 体长增长率(%) |
| 30 | 73.81±0.96ab | 99.87±3.58a | 35.30±3.12a |
| 35 | 75.67±4.25a | 99.27±2.5a | 31.19±7.99a |
| 40 | 73.08±2.73ab | 94.94±6.66a | 29.91±10.08a |
| 45 | 69.32±2.45b | 93.27±6.11a | 34.54±5.09a |
| 50 | 62.39±1.47c | 83.31±2.91a | 33.53±7.51a |
| 55 | 62.03±5.81c | 77.58±1.12b | 25.07±13.98ab |
| 60 | 59.21±0.76c | 67.45±1.84c | 13.76±1.46b |
由图 1可知, 高盐突变对T-ATPase酶活力影响不显著(P > 0.05), 随着突变盐度的升高, T-ATPase酶活力呈先升高后降低的趋势, 盐度45时出现峰值, 45盐度组与其他组之间差异极显著(P < 0.01), 其他处理组间差异不显(P > 0.05)。
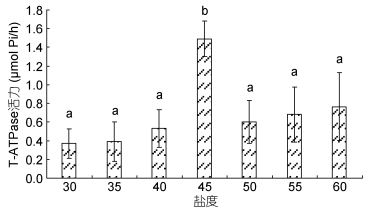 |
| 图 1 高盐突变对T-ATPase活力的影响 Fig. 1 Effect of high salinity abrupt change on T-ATPase activity of L. vannamei |
由图 2可以看出, 随着突变盐度的升高, 凡纳滨对虾Na+/K+-ATP酶活力呈现逐渐上升的变化趋势, 盐度60处理酶活力最高(P < 0.05), 盐度30时最低(P < 0.05), 30盐度和35盐度处理组、35和40、45处理组之间差异不显著(P > 0.05)。结果说明, 盐度增加对虾机体的渗透调节能力增强。
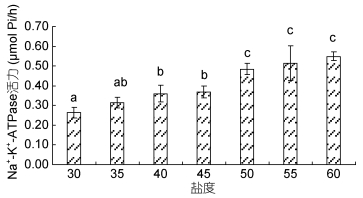 |
| 图 2 高盐突变对Na+/K+-ATPase活力的影响 Fig. 2 Effect of high salinity abrupt change on Na+/K+-ATPase activity of L. vannamei |
由图 3可以看出, SOD酶活力随着突变盐度的升高整体上呈现出逐渐降低的趋势。盐度30和35处理组, 35、40和45处理组, 50、55和60处理组间差异不显著(P > 0.05), 其他盐度处理组之间差异显著(P < 0.05)。
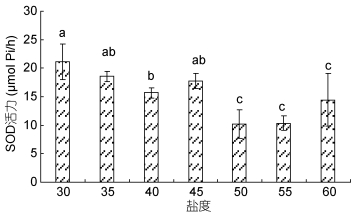 |
| 图 3 高盐突变对凡纳滨对虾对SOD酶活力的影响 Fig. 3 Effect of high salinity abrupt change on SOD activity of L. vannamei |
由图 4可以看出, ACP酶活力变化趋势与T-ATPase变化趋势一致, 随着突变盐度的升高, 呈现先上升再下降的单峰变化趋势, 盐度45处理组出现最高值, 45和35、40、50、55、60盐度处理组之间差异显著(P < 0.05), 30、35、40、50、55、60盐度处理组之间差异不显著(P > 0.05)。
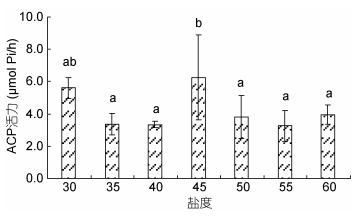 |
| 图 4 低盐突变对凡纳滨对虾ACP酶活力的影响 Fig. 4 Effect of low salinity abrupt change on ACP activity of L. vannamei |
由图 5可以看出, AKP酶活力没有明显的变化趋势, 盐度35处理组出现最低值, 盐度45和60处理组出现最大值, 35和45、60盐度处理组差异显著(P < 0.05), 其他处理组间差异不显著(P > 0.05)。
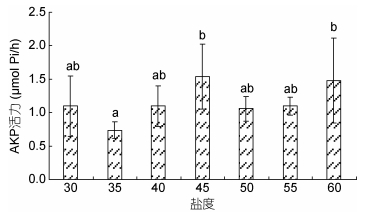 |
| 图 5 高盐突变对凡纳滨对虾对AKP酶活力的影响 Fig. 5 Effect of high salinity abrupt change on AKP activity of L. vannamei |
盐度是影响甲壳类动物生长和存活的重要环境因子, 外界环境盐度高于或低于自身渗透压时, 甲壳类动物会额外消耗能量调节渗透压平衡, 从而使用于生长发育的能量减少, 生长受到抑制(李二超等, 2009)。相关研究表明, 凡纳滨对虾的盐度适应范围广, 可在从几乎纯淡水至盐度70左右的水体中生存(Ponce-Palafox et al, 1997), 机体通过消耗自身能量来调节盐度平衡(孔杰等, 2017)。关于凡纳滨对虾最适生长盐度的报道各不相同, 王兴强等(2004)研究认为凡纳滨对虾可适应的盐度为0.5—50, 最适盐度为15—35, Ponce-Palafox等(1997)研究认为33—40盐度, Bray等(1994)报道为5—15盐度, 另有相关研究认为凡纳滨对虾在15—25盐度中生长速率较快。Dalla Via(1986)报道盐度变化造成代谢耗能增加可使日本囊对虾损失体质量33%以上。戴习林等(2012)研究发现盐度对凡纳滨对虾成活率具有显著影响。本研究发现, 30—45盐度突变组凡纳滨对虾存活率较高, 50以上突变组存活率显著降低, 说明盐度突变超过50时, 凡纳滨对虾机体难以适应大幅度的盐度变化, 凡纳滨对虾的存活受到显著影响。相对增重率随盐度升高逐渐下降, 说明盐度30已经高于凡纳滨对虾的渗透压, 虾类要消耗能量进行渗透压调节, 盐度越高用于渗透调节的能量越多, 生长越慢。这与申玉春等(2012)、李娜等(2017)等人的结论一致。
3.2 高盐突变对相关酶活力的影响ATP酶是一类膜结合蛋白酶, 在养殖水体盐度发生变化时, ATP酶作为离子载体和通道的初动力进行调节(Mancera et al, 2000; Yang et al, 2009), Na+/K+-ATP酶参与细胞膜内外Na+、K+离子的主动运输, 调节离子平衡(Towle, 1981), 能够很好地反映对虾对环境变动的适应性(刘存岐等, 2001)。李玉全等(2015)研究表明, 当盐度发生变化时, Na+、K+离子渗透压发生变化, 为维持Na+、K+离子的平衡, 机体需要Na+/K+-ATP来协助调节, 并且, 在高盐和低盐环境下, 维持Na+、K+离子平衡所付出的Na+/K+-ATP会增加, Na+/K+-ATPase活力提高。本试验中, 随着突变盐度的升高, 凡纳滨对虾的Na+/K+-ATP酶活力呈升高趋势, 30、40、50盐度突变组之间差异显著, 证明盐度突变幅度增加到一定程度, Na+/K+-ATP酶活力提高以适应盐度变化, 50和60突变组之间差异不显著, 可能是对虾机体难以适应大幅度的盐度变化, 具体原因还需进一步研究证实。
SOD是抗氧化酶, 与动物体免疫性能和环境胁迫密切相关(赵磊等, 2016), 被认为是机体防御过氧化损害系统的关键酶之一(许燕等, 2010)。Li等(2002)研究表明, 血液中SOD活性能更迅速的反应出环境中有害物质对机体的毒性作用。李娜等(2017)研究发现盐度胁迫对凡纳滨对虾抗氧化酶产生激活作用, 盐度30到40时SOD活力最大, 盐度继续升高, 对虾机体抗氧化能力显著下降。本试验发现, 随着突变盐度的升高, SOD活力显著下降, 30、40、50盐度突变组之间差异显著, 表明随着盐度突变幅度的增加, 凡纳滨对虾抗氧化能力受到抑制, 免疫抵抗能力下降, 这与前人研究结果一致(李玉全等, 2015; 李娜等, 2018)。
ACP和AKP与物质代谢关系密切(Yokota et al, 1982; Yun et al, 2004)。本试验中, 高盐突变对ACP活力产生了显著影响, 但对AKP影响不显著。ACP和AKP活力在35—45盐度突变组间均呈上升趋势, ACP活力在45盐度突变组呈现峰值后再下降, AKP活力在45—60盐度突变组之间虽然有下降趋势, 但是差异不显著。原因可能在于随着盐度突变幅度的增加, 凡纳滨对虾机体为调节渗透压平衡需要消耗更多的ATP, 而ATP合成需要的无机磷酸由ACP和AKP催化磷酸酯类水解无机磷酸生成, 但当突变盐度增加到一定程度, 两种酶的活力受到了抑制, 因此活力下降。
4 结论综上所述, 高盐突变幅度越大, 凡纳滨对虾存活率越低, 盐度突变超过50时, 存活率显著降低。随着突变盐度的升高, 凡纳滨对虾的Na+/K+-ATP酶活力呈升高趋势, 30、40、50盐度突变组之间差异显著, 说明盐度突变幅度增加, Na+/K+-ATP酶活力提高以适应盐度变化。SOD活力随着突变盐度的升高而显著下降, 凡纳滨对虾抗氧化能力受到抑制。同时, 高盐突变对ACP活力产生了显著影响, 但对AKP影响不显著。
| 马英杰, 张志峰, 马爱军, 等, 1999. 低盐度突变对中国对虾仔虾存活率的影响. 海洋与湖沼, 30(2): 134–138 DOI:10.3321/j.issn:0029-814X.1999.02.003 |
| 王兴强, 马甡, 董双林, 2004. 凡纳滨对虾生物学及养殖生态学研究进展. 海洋湖沼通报,(4): 94–100 DOI:10.3969/j.issn.1003-6482.2004.04.016 |
| 孔杰, 栾生, 罗坤, 等, 2017. 不同盐度下凡纳滨对虾生长和存活性状遗传评估. 水产学报, 41(4): 573–579 |
| 申玉春, 陈作洲, 刘丽, 等, 2012. 盐度和营养对凡纳滨对虾蜕壳和生长的影响. 水产学报, 36(2): 290–299 |
| 刘存岐, 王安利, 王维娜, 等, 2001. 海水中几种金属离子对中国对虾幼体体内碱性磷酸酶和ATPase的影响. 水产学报, 25(4): 298–303 |
| 刘慧杰, 潘鲁青, 胡发文, 2008. 凡纳滨对虾在盐度变化下免疫机能评价的研究. 海洋湖沼通报,(2): 159–166 DOI:10.3969/j.issn.1003-6482.2008.02.022 |
| 许燕, 杨洁, 孙静秋, 等, 2010. 凡纳滨对虾不同组织内SOD、POD酶的细胞化学定位. 水生生物学报, 34(2): 402–409 |
| 李娜, 王仁杰, 赵玉超, 等, 2017. 高盐胁迫对凡纳滨对虾生长指标、血浆渗透压及Na+-K+-ATP酶活力的影响. 浙江海洋学院学报(自然科学版), 36(3): 196–201 DOI:10.3969/j.issn.1008-830X.2017.03.002 |
| 李娜, 赵玉超, 王仁杰, 等, 2018. 高盐胁迫对凡纳滨对虾消化及免疫相关酶活力的影响. 生态学报, 38(4): 1411–1417 |
| 李二超, 陈立侨, 曾嶒, 等, 2009. 盐度对凡纳滨对虾体组织蛋白质积累、氨基酸组成和转氨酶活性的影响. 水生生物学报, 33(3): 532–538 |
| 李玉全, 李永生, 赵法箴, 2015. 盐度渐变与骤变对脊尾白虾渗透、代谢及免疫相关酶活力的影响. 生态学报, 35(21): 7229–7235 |
| 张丹, 王芳, 董双林, 2016. 周期性盐度波动对凡纳滨对虾游离氨基酸含量及渗透调节相关基因表达的影响. 中国水产科学, 23(5): 1130–1136 |
| 赵磊, 龙晓文, 吴旭干, 等, 2016. 水体盐度对中华绒螯蟹成体雄蟹渗透压调节和生理代谢的影响. 水生生物学报, 40(1): 27–34 |
| 栾生, 罗坤, 阮晓红, 等, 2013. 凡纳滨对虾(Litopenaeus vannamei)体重、存活性状的遗传参数和基因型与环境互作效应. 海洋与湖沼, 44(2): 445–452 |
| 戴习林, 张立田, 臧维玲, 等, 2012. Ca2+、Mg2+、盐度对凡纳滨对虾存活、生长及风味的影响. 水产学报, 36(6): 914–921 |
| Bray W A, Lawrence A L, Leung-Trujillo J R, 1994. The effect of salinity on growth and survival of Penaeus vannamei, with observations on the interaction of IHHN virus and salinity. Aquaculture, 122(2-3): 133–146 DOI:10.1016/0044-8486(94)90505-3 |
| Cheng W, Chu C J, 2000. Effects of pH, temperature and salinity on immune parameters of the freshwater prawn Macrobrachium rosenbergii. Fish & Shellfish Immunology, 10(4): 387–391 |
| Dalla Via G J, 1986. Salinity responses of the juvenile penaeid shrimp Penaeus japonicus:Ⅰ. Oxygen consumption and estimations of productivity. Aquaculture, 55(4): 297–306 DOI:10.1016/0044-8486(86)90170-5 |
| Li W, Yin D, Zhang A, et al, 2002. Toxicity of chloroanilines and effects on superoxide dismutase activities in serum of crucian carp (Carassius auratus). Bulletin of Environmental Contamination and Toxicology, 68(5): 630–636 DOI:10.1007/s001280301 |
| Mancera J M, McCormick S D, 2000. Rapid activation of gill Na+, K+-ATPase in the euryhaline teleost Fundulus heteroclitus. Journal of Experimental Zoology, 287(4): 263–274 DOI:10.1002/(ISSN)1097-010X |
| Menz A, Blake B F, 1980. Experiments on the growth of Penaeus vannamei Boone. Journal of Experimental Marine Biology and Ecology, 48(2): 99–111 DOI:10.1016/0022-0981(80)90010-6 |
| Perazzolo L M, Gargioni R, Ogliari P, et al, 2002. Evaluation of some hemato-immunological parameters in the shrimp Farfantepenaeus paulensis submitted to environmental and physiological stress. Aquaculture, 214(1-4): 19–33 DOI:10.1016/S0044-8486(02)00137-0 |
| Ponce-Palafox J, Martinez-Palacios C A, Ross L G, 1997. The effects of salinity and temperature on the growth and survival rates of juvenile white shrimp, Penaeus vannamei, Boone..1931. Aquaculture, 157(1-2): 107–115 DOI:10.1016/S0044-8486(97)00148-8 |
| Stern S, Daniels H, Leteller E, 1990. Tolerance of post larvae and juvenile Penaeus vannamei to low salinity. In:Abstracts, World Aquaculture 90. Halifax, Nova Scotia, Canada, T30. 12.. Ottawa, Ont., Canada: National Research Council Canada, |
| Towle D W, 1981. Role of Na++K+-ATPase in ionic regulation by marine and estuarine animals. Marine Biology Letters, 2: 107–121 |
| Yang W K, Hseu J R, Tang C H, et al, 2009. Na+/K+-ATPase expression in gills of the euryhaline sailfin molly, Poecilia latipinna, is altered in response to salinity challenge. Journal of Experimental Marine Biology and Ecology, 375(1-2): 41–50 DOI:10.1016/j.jembe.2009.05.004 |
| Yokota Y, Nakano E, 1982. Comparative studies on particulate acid phosphatases in sea urchin eggs. Comparative Biochemistry and Physiology Part B:Comparative Biochemistry, 71(4): 563–567 DOI:10.1016/0305-0491(82)90463-1 |
| Yun Y S, Lee Y N, 2004. Purification and some properties of superoxide dismutase from Deinococcus radiophilus, the UV-resistant bacterium. Extremophiles, 8(3): 237–242 DOI:10.1007/s00792-004-0383-6 |
 2019, Vol. 50
2019, Vol. 50


