中国海洋湖沼学会主办。
文章信息
- 林丽春, 吕燕, 孙鹏, 孙雪, 徐年军. 2019.
- LIN Li-Chun, LÜ Yan, SUN Peng, SUN Xue, XU Nian-Jun. 2019.
- 龙须菜(Gracilariopsis lemaneiformis)中两种分支酸代谢酶对温度和水杨酸的响应及其原核表达研究
- RESPONSES OF TWO CHOTISMATE METABOLIC ENZYMES TO TEMPERATURE AND SALICYLIC ACID IN GRACILARIOPSIS LEMANEIFORMIS AND THEIR PROKARYOTIC EXPRESSION ANALYSIS
- 海洋与湖沼, 50(1): 220-227
- Oceanologia et Limnologia Sinica, 50(1): 220-227.
- http://dx.doi.org/10.11693/hyhz20180800200
-
文章历史
- 收稿日期:2018-08-17
- 收修改稿日期:2018-10-28
龙须菜(Gracilariopsis lemaneiformis)为红藻门(Rhodophyta)、真红藻纲(Florideophyceae)、江蓠目(Gracilariales)的一种大型海藻。龙须菜含有丰富的蛋白质、碳水化合物、微量元素和维生素等, 还富含具有生物活性的酸性多糖和藻胆蛋白, 主要用作鲍饵料和琼胶原料。此外, 大规模栽培龙须菜可以吸收海水中氮磷等元素, 有效改善海洋生态环境(Fei, 2004)。龙须菜生长的适宜温度在12—23℃, 夏季高温会导致藻体腐烂, 限制了其在南方海域的大面积栽培。因此提高龙须菜的抗高温能力、延长其养殖期对于龙须菜产业至关重要。
分支酸是连接莽草酸和芳香型化合物代谢的一个重要节点, 是芳香型氨基酸及许多天然产物如色素、生物碱、植物激素等合成的前体(Maeda et al, 2012)。分支酸代谢途径有多种酶参与, 其中异分支酸合成酶(isochorismate synthase, ICS)、分支酸变位酶(chorismate mutase, CM)、邻氨基苯甲酸合酶(anthranilate synthase, AS)和氨基脱氧分支酸合酶(aminodeoxychorismate synthase, ADCS)等为常见的分支酸利用酶。
ICS(EC 5.4.4.2)是水杨酸合成途径之一的异分支酸合成途径的关键酶。分支酸在ICS和异分支酸丙酮酸裂解酶(isochorismate pyruvatelyase, IPL)的催化作用下合成SA(Chen et al, 2009)。目前已在长春花(Catharanthus roseus)、檄树(Morinda citrifolia)、杨树(Populus tremula)等多种植物中克隆到ics基因(Muljono et al, 2002; Hong et al, 2008; Yuan et al, 2009)。在拟南芥(Arabidopsis thaliana)中ics1基因产物被证实具有ICS酶活性, 并定位在质体中(Strawn et al, 2007)。ICS参与了植物激素调控及生物、非生物胁迫过程。如甘蓝型油菜(Brassica napus)的ics1基因表达受植物激素网络的调控, 并在核盘菌(Sclerotinia sclerotiorum)侵染初期参与了SA信号途径的激活(彭琦等, 2016)。类似地, 烟草(Nicotiana tabacum)在受到病原菌侵染、臭氧胁迫时, ics1的转录被促进, 同时伴随着内源SA水平升高(Ogawa et al, 2005)。除了合成SA之外, ICS还是铁载体、甲基萘醌合成途径的关键酶, 这些途径主要存在于细菌中。
CM(EC 5.4.99.5)负责催化分支酸生成预苯酸的化学反应, 是苯丙氨酸和酪氨酸合成途径的第一个关键酶, 多步反应后可以生成多种次级代谢物如木质素、异喹啉、生物碱类、酪醇等。植物激素和一些生物或非生物胁迫同样调控了CM的表达。例如, 用0.5mmol/L水杨酸处理桦褐孔菌(Inonotus obliquus)IO-U1株感染的日本桦树(Betula maximowi czii), 其CM蛋白表达量显著增加(Suzuki et al, 2014)。类似地, 核盘菌感染后的甘蓝型油菜CM的编码基因SS1G-14320表达量升高, 同时SA、茉莉酸、脱落酸和乙烯水平也发生了显著变化(Nováková et al, 2014)。以上研究表明分支酸变位酶与SA等植物激素之间存在着一定的联系。
两种分支酸利用酶ICS和CM参与了SA等下游代谢产物合成的调控过程, 但目前ICS和CM在藻类中相关的研究非常少。我们前期研究发现高温和外源SA均能诱导龙须菜内源SA水平的升高(Hou et al, 2018), 但具体的分子机制尚不明确。因此本文首次从转录水平上探讨了这两种分支酸利用酶对温度和外源SA的响应, 以阐明以上两种因素对藻类分支酸代谢的影响, 然后利用原核表达和亲和柱纯化, 获得了初步纯化的ICS和CM重组蛋白, 为后续制备抗体进行蛋白水平的研究做好准备。
1 材料与方法 1.1 实验材料处理本实验所用材料为龙须菜981抗高温品系, 购自福建霞浦养殖场。实验室培养条件:用Provasoli海水培养基, 光照强度40μmol/(m2·s), 光周期L:D =12h:12h。常温组在23℃光照培养箱中进行, 高温组在23℃预培养30h后依次在28℃和33℃再分别预培养6h和12h。
实验分为4组: 23℃常温组(记为23)、常温加100μmol/L SA组(记为23+SA)、33℃高温组(记为33)、高温加100μmol/L SA组(记为33+SA), 每组三个平行。分别在处理3、6、12、24h后, 取吸干水分的120—150mg藻体, 液氮速冻后立即放入–80℃, 用于后续RNA提取。
1.2 RNA提取及cDNA合成采用RNeasy plant mini kit (Qiagen, Germany)进行龙须菜RNA的提取, 然后用NanoDrop 1000 Spectrophotometer测定RNA浓度和纯度, 用1%琼脂糖凝胶电泳检测RNA完整性。检测合格的RNA样品用TransScript all-in-one first-strand cDNA synthesis supermix for qPCR试剂盒(全式金, 北京)合成cDNA第一链, 冻存备用。
1.3 ics和cm基因的荧光定量PCR分析根据龙须菜基因组测序获得的ics和cm cDNA序列, 用primer premier5.0软件设计荧光定量PCR引物, 以18S rRNA基因为内参(表 1)。利用TransStart tip green qPCR supermix SYBR (全式金, 北京)进行荧光定量PCR。在20μL反应体系中: 10μL SYBR mix, 2μL cDNA, 正反向引物各0.4μL, 7.2μL H2O。PCR反应程序: 95℃, 3min; 40个循环(95℃, 10s; 55℃, 20s; 72℃, 20s)。采用2–ΔΔCt法分析基因的相对表达量。
| 引物名称 | 引物序列(5′—3′) | 扩增长度(bp) |
| Q-ics1432 | TATGGCAATAAAGTGGTGG | |
| Q-ics1561 | CCATTTCAGAACGGATAGA | 130 |
| Q-cm109 | CCGCCGACTTTCATAGCACCAT | |
| Q-cm316 | CGCTAAGGAGCAAGGGCACACC | 208 |
| 18sF | CCTGAGACGGCTACCACATCCA | |
| 18sR | AGACTTGCCCTCTGCTGGCTCCTC | 166 |
| ics1 | CGCGGATCCATGACTGAGCAACTTTCTATATCGT | |
| ics1761 | CGCGTCGACTCAAGAGTTTTGGCAGACTTTTCGTGT | 1761 |
| cm1 | CGCGGATCCATGGGCGCTAACGAAGTTCC | |
| cm1095 | CGCAAGCTTTTACGCATTGGCATCACTTTT | 1095 |
| 注:下划线序列为限制性内切酶识别序列, 其中GGATCC、GTCGAC、AAGCTT分别为BamHⅠ、SalⅠ和Hind Ⅲ的识别序列 | ||
根据ics和cm cDNA序列信息, 设计包含整个开放阅读框全序列的扩增引物(表 1), 并在ics引物两端分别加上BamHⅠ和SalⅠ的酶切位点和保护碱基, cm引物两端分别加上BamHⅠ和Hind Ⅲ的酶切位点和保护碱基。PCR程序为:预变性94℃, 5min; 35个循环(94℃, 30s; 58℃, 30s; 72℃, 1.5min); 72℃, 10min。PCR产物经过电泳检测、回收、连接到pMD18-T载体并转化到大肠杆菌DH5α中, 然后将PCR检测大小正确的单菌落扩大培养后送往上海桑尼公司测序, 最后将测序检测插入序列正确的重组子分别命名为T-ics和T-cm。
1.5 表达载体pET28a-ics和pET28a-cm的构建分别对pET28a和T-ics用BamHⅠ和SalⅠ进行双酶切, 对pET28a和T-cm用BamHⅠ和Hind Ⅲ进行双酶切。在37℃酶切12h后, 割胶回收、连接酶切后的目的片段和pET28a载体片段。连接产物转化到大肠杆菌BL21(DE3)或BL21-codonplus-RIL中。将经过PCR和双酶切检测插入片段大小正确的重组菌落送去测序。
1.6 重组蛋白诱导表达条件的优化将测序验证序列正确的重组菌接种到LB培养基(含50μg/mL卡那霉素)中, 在37℃, 200r/min培养至OD600在0.6—0.8之间, 然后进行诱导条件的优化:诱导时间梯度分别为0、4、8、12h;诱导剂IPTG浓度梯度分别为0、0.1、0.5、1mmol/L; 诱导温度/时间分别为16℃ (24h)、20℃ (15h)、25℃ (10h)、30℃ (8h)。
1.7 重组蛋白的检测及纯化诱导结束后12000r/min离心2min收集菌体, 加入5mL 0.1mol/L PBS缓冲液悬浮, 然后用超声波破碎仪进行细胞破碎(功率为360W, 超声2s间隔3s持续30min)。12000r/min (4℃)离心20min收集上清(可溶性蛋白)并转移到干净的离心管中, 沉淀(包涵体蛋白)用6mol/L尿素冰浴1h变性。取上清与沉淀分别与等体积的2×蛋白上样缓冲液混合后进行SDS-PAGE电泳, 用考马斯亮蓝染色, 蒸馏水加热脱色直至背景清晰, 拍照。利用His标签蛋白纯化试剂盒(康为, 北京), 对重组ICS和CM蛋白分别进行纯化。操作步骤参考说明书, 分别用10、50、100、250、500mmol/L咪唑进行梯度洗脱。
1.8 数据统计利用Excel 2010进行数据统计和作图, 结果以平均值±标准方差(mean±SD)表示。使用SPSS19.0软件的Turkey多重比较检验法进行不同时间点或不同处理间的单因素方差分析, 以P < 0.05作为差异显著的标准。
2 结果与分析 2.1 两种温度下SA对ics基因表达的影响高温和外源激素添加显著影响了龙须菜ics转录水平的表达(图 1a, 1b)。在23℃条件下, 龙须菜ics转录水平相对稳定; 100μmol/L SA添加后龙须菜ics基因的转录表达量升高, 在3、6、12h时其表达量分别为各时间点对照组的3.33倍、4.76倍和2.84倍(P < 0.05)。在33℃条件下, ics表达量急速上升(在3h时最高), 但随着处理时间延长其表达量逐渐下降; 添加SA后, ics表达量在3、6、12h时分别为各时间点高温组的1.25倍、1.62倍和1.44倍(P < 0.05)。上述结果表明高温和外源SA都可以促进龙须菜ics基因的转录, 且常温下SA的促进效果更显著。
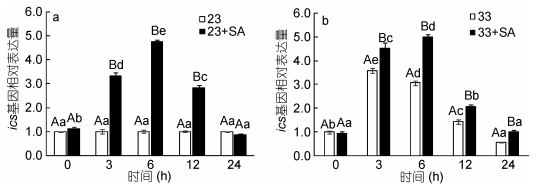 |
| 图 1 两种温度下水杨酸对ics基因表达的影响(a: 23℃, b: 33℃) Fig. 1 Effect of salicylic acid on the expression of ics gene under two temperatures (a: 23℃; b: 33℃) 注:大写字母表示同时间点不同组间的差异, 小写字母表示同组不同时间点间的差异 |
与ics类似, 常温条件下cm转录水平较稳定, 添加SA后cm基因表达量多显著高于对照组, 其中3h和24h时其相对表达量分别为对各自照组的2.16倍和2.73倍(图 2a)。高温条件下龙须菜cm基因表达出现波动, 其中3h和12h时高温组cm表达量分别达到常温组的1.79倍和2.04倍; 在高温条件下添加SA后在6h和24 h时cm表达量分别上升为高温对照组的1.65倍和1.82倍(P < 0.05), 其余时间点cm表达量与高温组无显著差异(图 2b)。
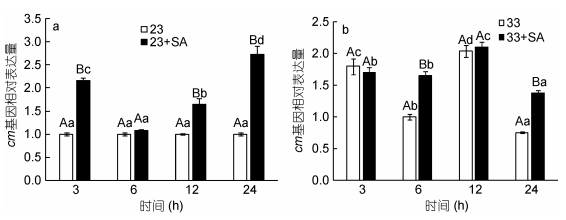 |
| 图 2 两种温度下水杨酸对龙须菜cm基因表达的影响(a: 23℃, b: 33℃) Fig. 2 Effect of salicylic acid on the expression of cm gene under two temperatures (a: 23℃; b: 33℃) 注:大写字母表示同时间点不同组间的差异, 小写字母表示同组不同时间点间的差异 |
ics和cm全cDNA (包含各自完整的开放阅读框)的扩增长度分别为1761bp和1095bp, PCR扩增条带大小与预期结果一致。将两个基因分别克隆到pMD18-T载体中, 经测序验证序列正确。pET28a载体、T-ics和T-cm载体双酶切的电泳结果分别如图 3a—图 3c所示, 酶切完全且片段大小正确。pET28a-ics和pET28a-cm重组载体的菌落PCR检测结果表明目的片段已克隆到pET28a中(图 3d, 图 3e)。为了进一步确认重组载体构建的正确性, 将PCR验证正确的重组菌落送去测序, 测序结果表明两条基因序列和插入方向均正确。
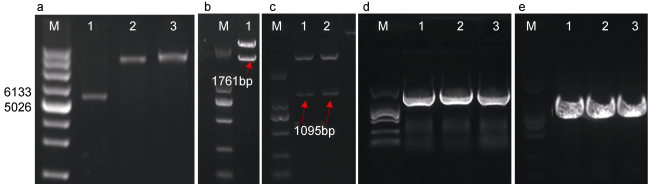 |
| 图 3 酶切和重组pET28a载体菌落PCR检测 Fig. 3 Double-enzyme cutting and PCR detection of recombinant pET28a vector 注: a: pET28a载体的双酶切结果, M为超螺旋marker, 1为pET28a, 2为BamHⅠ和HindⅢ酶切后的pET28a, 3为BamHⅠ和SalⅠ酶切后的pET28a; b: T-ics经BamHⅠ和SalⅠ双酶切的结果(1泳道); c: T-cm经BamHⅠ和HindⅢ双酶切的结果(1, 2泳道); d: pET28a-ics菌落PCR验证(1-3泳道); e: pET28a-cm菌落PCR验证(1-3泳道); 图b—e中的M均为DL2000 marker |
在常用的几种诱导温度和IPTG诱导浓度下, 重组ICS蛋白和CM蛋白均在包涵体中较多, 上清中较少(图 4)。ICS蛋白大小约为70kDa(图 4a), 比理论分子量大小65kDa稍大, 可能是因为ics片段上没有终止密码子, 融合了载体下游的标签。CM蛋白大小在40kDa左右(图 4b), 与预测的分子量41kDa大小一致。我们还比较了BL21(DE3)和RIL表达菌对融合蛋白产量的影响, 结果表明RIL在蛋白表达量和蛋白可溶性方面, 均优于BL21(DE3)(图未给出)。
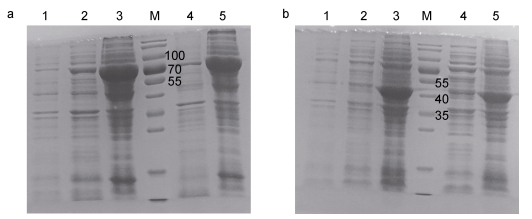 |
| 图 4 pET28a-ics (a)和pET28a-cm (b)的诱导表达 Fig. 4 Induced expression of pET28a-ics (a) and pET28a-cm (b) 注: a: 1:对照组; 2—3: 20℃ (15h)的上清和包涵体; 4—5: 25℃ (10h)的上清和包涵体; b: 1:对照组; 2—3: 0.1mmol/L IPTG诱导(16℃, 24h)的上清和包涵体; 4—5: 0.5mmol/L IPTG诱导(16℃, 24h)的上清和包涵体 |
ICS蛋白的诱导表达结果见图 5a, 在37℃用1mmol/L IPTG诱导时, 随着诱导时间延长蛋白表达增加, 但8h后基本稳定。IPTG浓度为0.1或0.5mmol/L时诱导效果似乎比1mmol/L要稍好一些。对于诱导温度/时间, 16℃长时间诱导与37℃短时间诱导效果类似, 但低温有利于蛋白的正确折叠, 使目的蛋白保持活性。
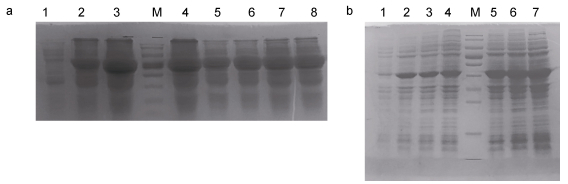 |
| 图 5 不同条件下pET28a-ics (a)和pET28a-cm (b)诱导表达的结果 Fig. 5 Induced expression of pET28-aics (a) and pET28a-cm (b) under different conditions 注: a: 1—4: 1mmol/L IPTG分别诱导0、4、8、12h (37℃); 5—6: 0.1和0.5mmol/L IPTG分别诱导4h (37℃); 7—8:分别用0.1和0.5mmol/L IPTG诱导24h (16℃); b: 1—4: 1mmol/L IPTG分别诱导0、4、8、12h (37℃); 5: 1mmol/L IPTG诱导8h (30℃); 6: 1mmol/L IPTG诱导10h (25℃); 7: 1mmol/L IPTG诱导15h (20℃) |
在不同诱导条件下, CM蛋白的表达结果表明诱导温度对于蛋白表达的影响较大, 低温长时间诱导效果更好(图 5b)。其中20℃诱导15h时CM蛋白的表达最多, 37℃诱导4—12h表达量较少, 30℃诱导8h和25℃诱导10h的蛋白表达量类似。因此, 对于ICS和CM重组蛋白的最佳诱导条件, 我们均选用0.1mmol/L IPTG, 在16℃诱导24h。
2.6 包涵体中重组蛋白的纯化ICS蛋白纯化结果表明50mmol/L咪唑洗脱时得到的目的蛋白条带最亮, 杂蛋白较少, 说明大部分的ICS蛋白被洗脱下来; 随着咪唑浓度的提高, 洗脱下来的目的蛋白量迅速降低(图 6a)。在CM蛋白纯化结果中, 50mmol/L咪唑可以将目的蛋白洗脱下来, 与ICS蛋白不同的是咪唑浓度继续增大到100或250mmol/L时, CM蛋白量与50mmol/L咪唑洗脱的结果类似, 杂蛋白更少, 直至500mmol/L咪唑洗脱下来的重组蛋白量明显降低(图 6b)。
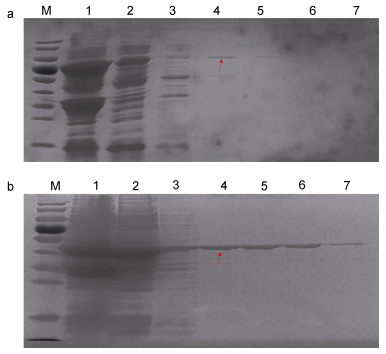 |
| 图 6 包涵体中ICS(a)和CM(b)重组蛋白的纯化 Fig. 6 Purification of ICS (a) and CM (b) recombinant proteins in the inclusion body 注: a, b图: 1:未纯化的包涵体; 2:流穿液; 3—7: 10、50、100、250、500mmol/L咪唑洗脱结果。箭头分别指示ICS和CM重组蛋白 |
SA是植物体内一种普遍存在的小分子酚类物质, 它不仅能够调控植物体生长、发育、成熟、衰老等生理过程, 还可以激活植物的系统获得性抗性, 提高植物对高低温、盐渍、干旱等非生物逆境的耐受性, 以及对病虫害的抗性(Hayat et al, 2010)。在不利环境或生物胁迫条件下植物体会迅速积累SA, 从而刺激机体产生一系列的防御反应, 如抗氧化系统相关酶的激活、热激蛋白和渗透调节物质的合成和钙离子稳态的改变等(Pan et al, 2006; Wang et al, 2006; 曹福亮等, 2008)。
异分支酸途径在植物抗病防御中是合成SA信号的主力军。在转入异分支酸合成途径关键酶——大肠杆菌ICS编码基因和假单胞菌IPL编码基因的转基因烟草中, SA和水杨酸葡糖苷的含量显著高于野生型烟草(Nugroho et al, 2002)。非生物胁迫因素如紫外线、臭氧等能诱导ics基因的表达(Ogawa et al, 2007; Catinot et al, 2008)。同样地, 在低温胁迫处理的“嘎啦”苹果中ics基因表达被诱导(马长青等, 2016)。本研究也得到类似结果, 即在高温胁迫下, 龙须菜中ics基因表达量迅速升高, 但随着胁迫时间的延长, ics表达量逐渐降低。这些结果表明在逆境条件下, ICS酶可能参与了SA信号分子合成从而激活系统获得抗性等以应对不利环境。
外源SA可调节ics基因表达来影响异分支酸合成。如0.1mmol/L SA可以诱导青蒿AaICS1的表达, 在处理8—12h时ics基因表达水平最高(Wang et al, 2017); 1mmol/L SA能显著诱导红花ics基因表达水平(Sadeghi et al, 2013)。以上结果与本研究中外源SA可以促进龙须菜ics基因表达的结果类似。
3.2 水杨酸与分支酸变位酶分支酸变位酶控制着碳同化物由莽草酸途径进入类苯基丙烷代谢途径, 影响着下游芳香型氨基酸、酚类、醌类、色素、维生素、生物碱、SA等的合成。异分支酸途径关键酶的表达抑制了分支酸流向类苯基丙烷途径中, 从而导致其下游产物合成量降低。如在SA组成型表达的转异分支酸合成途径关键酶的转基因烟草中, CM、苯丙氨酸解氨酶和查尔酮合成酶的活性均低于野生型, 对应的下游代谢产物黄酮和绿原酸的含量也相对降低(Nugroho et al, 2002)。
关于CM的研究多集中在线虫和植物病原菌中, 这些寄生生物可以向植物宿主释放自身的CM蛋白, 促进植物的分支酸代谢流偏向于形成预苯酸, 从而减少ICS催化形成SA等抗逆信号分子, 利于病原菌和线虫的定殖和扩散(Long et al, 2006; Djamei et al, 2011)。以上研究说明CM的大量表达可以减少内源SA的形成, 但外源SA对CM影响的文献未见报道。本文结果表明, 在常温或高温胁迫下外源SA多诱导了cm基因的表达。而CM负责提供的芳香氨基酸可用于蛋白质的合成, 可能与常温培养时SA促进龙须菜的生长或高温条件下促进藻体抵抗高温胁迫等有关。但外源SA对cm基因表达的影响无论是时间点的多少还是表达量增加的倍数都不如对ics影响显著, 尤其是高温条件下更加明显。
3.3 影响藻类基因原核表达的因素影响原核表达的因素很多, 如目的蛋白的性质、载体种类、表达菌种类、稀有密码子、蛋白毒性、培养基类型和诱导条件等都会影响蛋白表达(Allert et al, 2010; Khow et al, 2012)。Shafiee等用响应面法对DT386-BR2融合蛋白的诱导条件进行了优化, 在37℃用1mmol/L IPTG诱导2h得到了224.86μg/mL的融合蛋白(Shafiee et al, 2017)。本研究中两个重组蛋白多在包涵体中, 对诱导条件及表达菌进行优化和比较, 结果表明低温长时间诱导以及诱导剂浓度的降低虽然能影响重组蛋白的表达量, 但对改变蛋白可溶性的作用并不显著, 其原因可能与目的蛋白自身性质有关。表达蛋白不可溶, 这种情况在其它藻类中也出现过, 如转入盐藻淀粉磷酸化酶基因(DsSP)的重组pGS21a-DsSP载体, 在28℃用0.3mmol/L IPTG诱导4h后, 重组蛋白大部分在包涵体中(Liu et al, 2014); 转入海带磷酸甘露糖异构酶PMI4基因的重组表达载体pET32a-PMI4在表达菌株BL21中也以包涵体形式为主(张亚兰, 2013)。表达蛋白不可溶可能与原核表达系统无法对蛋白进行翻译后修饰, 且添加诱导剂后目的蛋白表达速度过快, 无法进行正确折叠, 从而形成成熟且有活性的重组蛋白有关。
4 结论本研究表明高温或水杨酸处理可促进龙须菜ics的转录表达, 对cm基因表达也多为促进作用; 而且, 在原核表达载体pET28a中成功表达了ICS和CM这两种分支酸利用酶, 其表达产物多为包涵体蛋白。本研究是首次研究大型藻类中外源植物激素和分支酸利用酶之间的关系, 为探究植物激素和藻类次级代谢的关联、及从蛋白水平来研究水杨酸代谢途径相关酶的功能提供了资料。
| 马长青, 柏素花, 董超华, 等, 2016. 苹果异分支酸合酶基因MdICS1的克隆与表达分析. 植物生理学报, 52(9): 1361–1370 |
| 张亚兰, 2013.海带磷酸甘露糖异构酶基因(PMI)的克隆、分析及表达.青岛: 中国海洋大学硕士学位论文 |
| 曹福亮, 欧祖兰, 2008. 水杨酸对银杏幼苗抗高温胁迫能力的影响. 浙江林学院学报, 25(6): 756–759 DOI:10.3969/j.issn.2095-0756.2008.06.015 |
| 彭琦, 高建芹, 周晓婴, 等, 2016. 甘蓝型油菜异分支酸合酶基因的克隆及信号通路相关基因的诱导表达. 中国油料作物学报, 38(1): 7–12 DOI:10.7505/j.issn.1007-9084.2016.01.002 |
| Allert M, Cox J C, Hellinga H W, 2010. Multifactorial determinants of protein expression in prokaryotic open reading frames. Journal of Molecular Biology, 402(5): 905–918 DOI:10.1016/j.jmb.2010.08.010 |
| Catinot J, Buchala A, Abou-Mansour E, et al, 2008. Salicylic acid production in response to biotic and abiotic stress depends on isochorismate in Nicotiana benthamiana. FEBS Letters, 582(4): 473–478 DOI:10.1016/j.febslet.2007.12.039 |
| Chen Z X, Zheng Z Y, Huang J L, et al, 2009. Biosynthesis of salicylic acid in plants. Plant Signaling and Behavior, 4(6): 493–496 DOI:10.4161/psb.4.6.8392 |
| Djamei A, Schipper K, Rabe F, et al, 2011. Metabolic priming by a secreted fungal effector. Nature, 478(7369): 395–398 DOI:10.1038/nature10454 |
| Fei X G, 2004. Solving the coastal eutrophication problem by large scale seaweed cultivation. Hydrobiologia, 512(1-3): 145–151 DOI:10.1023/B:HYDR.0000020320.68331.ce |
| Hayat Q, Hayat S, Irfan M, et al, 2010. Effect of exogenous salicylic acid under changing environment:a review. Environmental and Experimental Botany, 68(1): 14–25 DOI:10.1016/j.envexpbot.2009.08.005 |
| Hong T S, Roslan H A, 2008. Cloning of a near complete Isochorismate synthase (ICS) cDNA from Morinda citrifolia L. Pertanika Journal of Tropical Agricultural Science, 31(1): 101–105 |
| Hou S N, Lin L C, Lv Y, et al, 2018. Responses of lipoxygenase, jasmonic acid, and salicylic acid to temperature and exogenous phytohormone treatments in Gracilariopsis lemaneiformis (Rhodophyta). Journal of Applied Phycology, 30: 1–8 DOI:10.1007/s10811-018-1514-2 |
| Khow O, Suntrarachun S, 2012. Strategies for production of active eukaryotic proteins in bacterial expression system. Asian Pacific Journal of Tropical Biomedicine, 2(2): 159–162 DOI:10.1016/S2221-1691(11)60213-X |
| Liu S C, Chai X J, Guo W H, et al, 2014. Cloning, analysis and prokaryotic expression of DsSP gene from Dunaliella salina. Agricultural Science and Technology, 15(6): 907–915 |
| Long H, Wang X, Xu J, 2006. Molecular cloning and life-stage expression pattern of a new chorismate mutase gene from the root-knot nematode Meloidogyne arenaria. Plant Pathology, 55(4): 559–563 |
| Maeda H, Dudareva N, 2012. The shikimate pathway and aromatic amino acid biosynthesis in plants. Annual Review of Plant Biology, 63: 73–105 DOI:10.1146/annurev-arplant-042811-105439 |
| Muljono R A B, Talou J R, Scheffer J J C, 2002. Biosynthesis of 2, 3-dihydroxybenzoic acid in transgenic Catharanthus roseus cell cultures overexpressing isochorismate synthase. Heterocycles, 56(1-2): 341–352 DOI:10.3987/COM-01-9268 |
| Nováková M, Šašek V, Dobrev P I, et al, 2014. Plant hormones in defense response of Brassica napus to Sclerotinia sclerotiorum-reassessing the role of salicylic acid in the interaction with a necrotroph. Plant Physiology and Biochemistry, 80: 308–317 DOI:10.1016/j.plaphy.2014.04.019 |
| Nugroho L H, Verberne M C, Verpoorte R, 2002. Activities of enzymes involved in the phenylpropanoid pathway in constitutively salicylic acid-producing tobacco plants. Plant Physiology and Biochemistry, 40: 755–760 DOI:10.1016/S0981-9428(02)01437-7 |
| Ogawa D, Nakajima N, Sano T, et al, 2005. Salicylic acid accumulation under O3 exposure is regulated by ethylene in tobacco plants. Plant and Cell Physiology, 46(7): 1062–1072 DOI:10.1093/pcp/pci118 |
| Ogawa D, Nakajima N, Tamaoki M, et al, 2007. The isochorismate pathway is negatively regulated by salicylic acid signaling in O3-exposed Arabidopsis. Planta, 226(5): 1277–1285 DOI:10.1007/s00425-007-0556-5 |
| Pan Q H, Zhan J C, Liu H T, et al, 2006. Salicylic acid synthesized by benzoic acid 2-hydroxylase participates in the development of thermotolerance in pea plants. Plant Science, 171(2): 226–233 DOI:10.1016/j.plantsci.2006.03.012 |
| Sadeghi M, Dehghan S, Fischer R, et al, 2013. Isolation and characterization of isochorismate synthase and cinnamate 4-hydroxylase during salinity stress, wounding, and salicylic acid treatment in Carthamus tinctorius. Plant Signaling & Behavior, 8(11): e27335 |
| Shafiee F, Rabbani M, Jahanian-Najafabadi A, 2017. Optimization of the expression of DT386-BR2 fusion protein in Escherichia coli using response surface methodology. Advanced Biomedical Research, 6(1): 22 DOI:10.4103/2277-9175.201334 |
| Strawn M A, Marr S K, Inoue K, et al, 2007. Arabidopsis isochorismate synthase functional in pathogen-induced salicylate biosynthesis exhibits properties consistent with a role in diverse stress responses. Journal of Biological Chemistry, 282(8): 5919–5933 DOI:10.1074/jbc.M605193200 |
| Suzuki H, Takashima Y, Ishiguri F, et al, 2014. Proteomic analysis of responsive proteins induced in Japanese birch plantlet treated with salicylic acid. Proteomes, 2(3): 323–340 DOI:10.3390/proteomes2030323 |
| Wang L J, Chen S J, Kong W F, et al, 2006. Salicylic acid pretreatment alleviates chilling injury and affects the antioxidant system and heat shock proteins of peaches during cold storage. Postharvest Biology and Technology, 41(3): 244–251 DOI:10.1016/j.postharvbio.2006.04.010 |
| Wang L Y, Zhang Y, Fu X Q, et al, 2017. Molecular cloning, characterization, and promoter analysis of the isochorismate synthase (AaICS1) gene from Artemisia annua. Journal of Zhejiang University-Science B, 18(8): 662–673 DOI:10.1631/jzus.B1600223 |
| Yuan Y N, Chung J D, Fu X Y, et al, 2009. Alternative splicing and gene duplication differentially shaped the regulation of isochorismate synthase in Populus and Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America, 106(51): 22020–22025 DOI:10.1073/pnas.0906869106 |
 2019, Vol. 50
2019, Vol. 50


