
中国海洋湖沼学会主办。
文章信息
- 刘云, 陈田田, 宋书群, 李才文. 2019.
- LIU Yun, CHEN Tian-Tian, SONG Shu-Qun, LI Cai-Wen. 2019.
- 不同氮浓度条件下红色赤潮藻脂肪酸含量及组成特征
- CONTENT AND COMPOSITION OF FATTY ACID IN PLANKTONIC DINOFLAGELLATE AKASHIWO SANGUINEA CULTURED IN DIFFERENT NITRATE CONCENTRATIONS
- 海洋与湖沼, 50(2): 301-307
- Oceanologia et Limnologia Sinica, 50(2): 301-307.
- http://dx.doi.org/10.11693/hyhz20181200284
-
文章历史
- 收稿日期:2018-12-04
- 收修改稿日期:2018-12-10
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院海洋大科学研究中心 青岛 266071;
4. 中国科学院大学 北京 100049
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy of Science, Beijing 100049, China
微藻是海洋初级生产力的主要贡献者, 是海洋中有机物的主要提供者, 可以作为浮游动物、甲壳类和鱼类幼体的饵料, 因此在海水养殖业中占有重要地位。海洋微藻具有合成脂肪酸的能力, 其脂肪酸尤其是多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)的组成和含量通常被用作衡量其营养价值的重要指标, 如C20:5ω3 (EPA)和C22:6ω3 (DHA)被认为是许多水产养殖生物幼体存活和发育的必需脂肪酸(Levine et al, 1984; Enright et al, 1986), 而一些饱和脂肪酸(saturated fatty acid, SFA)和单不饱和脂肪酸(monounsaturated fatty acid, MUFA)则与生物体内的能量代谢、维持细胞结构、激素调节等生理过程相关(Spector, 1999)。
海洋微藻的脂肪酸组成因藻种不同而异, 同一分类单元的微藻脂肪酸往往具有不同于其他分类单元的组成特征, 因此, 特征性脂肪酸的变化可指示水体中浮游植物的群落结构变化(Reuss et al, 2002)。此外, 微藻生长的环境条件(包括温度、营养盐、光照、pH等)及生长阶段也会对其脂肪酸组成产生影响(Tzovenis et al, 1997; Zhu et al, 1997; Dempster et al, 1998; Mansour et al, 2003)。氮元素是浮游植物生长发育所必需的营养元素, 参与了蛋白质、核酸等许多生物大分子的合成。已有研究表明, 培养液中氮浓度能明显影响微藻中PUFAs的含量(曹春晖等, 2006)。
红色赤潮藻(Akashiwo sanguinea)是一种常见的裸甲藻类, 在全球沿岸水体中广泛分布, 并在我国烟台、温州、厦门等多地引发赤潮(吴玉霖等, 2001;王金辉等, 2005;喻龙等, 2009;陈国斌, 2012)。前期研究结果表明红色赤潮藻在不同的氮源类型及氮浓度条件下呈现不同的生长特征(Liu et al, 2015);并且在氮限制条件下及生长后期, 藻细胞的总脂含量明显增加(课题组未发表数据), 脂质的积累可能为其休眠阶段提供能量(Binder et al, 1990), 但其脂肪酸组成特征尚有待深入研究。因此, 本文初步研究了不同初始氮浓度条件下、不同生长阶段红色赤潮藻脂肪酸含量及组成变化, 以进一步解析红色赤潮藻等赤潮甲藻响应环境演变的生理机制。
1 材料与方法 1.1 藻种来源本实验所用红色赤潮藻于2016年11月采集于青岛胶州湾海域(36°5′N, 120°19′E), 经毛细管分离、纯化后于实验室中保种并长期培养, 培养温度为(20±1)℃, 光暗比为12h︰12h, 光照强度为5000lx。
1.2 微藻培养培养所用海水取自青岛太平湾海域(盐度30±0.1), 经砂滤处理后, 再用Φ 0.45μm孔径混合纤维膜过滤, 121℃高温灭菌30min后, 冷却备用。实验组培养液体积为600mL, 置于1L锥形瓶中, 接种生长良好的指数期藻种, 初始藻密度约为800cells/mL。实验共设6个氮浓度(NaNO3)组, 初始氮浓度分别为0、25、50、100、200、883μmol/L, 其余营养盐浓度按照f/2 (不含Si)配方添加。每个实验组设3个重复, 置于培养箱中进行一次性培养, 温度、光照条件同1.1。培养过程中, 隔天取1mL样品, 经Lugol’s碘液固定后, 在显微镜下计数(Olympus, IX71);同时, 每个培养组随机选取20个细胞, 测量细胞的长度和宽度(CellSens Standard 1.7)。
1.3 脂肪酸样品提取与分析在微藻生长的第2、4、8、12天, 分别量取50 mL藻液, 3000g离心10分钟收集藻细胞, 样品冷冻干燥48小时后称重。向样品中加入C19:0脂肪酸甲酯作为内标, 0.01% BHT甲醇溶液作为抗氧化剂。样品处理过程参照Folch等(1957)和Parrish (1999)的方法。脂肪酸的组成和含量用Agilent 7890A型气相色谱仪分析。
1.4 数据统计脂肪酸含量的计算先采用内标标准曲线法计算绝对含量, 然后再换算成百分含量。不同氮浓度处理组及不同生长阶段间差异采用单因素方差分析(one-way ANOVA)进行统计, 统计软件为SPSS 20.0。
2 结果与分析 2.1 红色赤潮藻生长特征不同氮浓度下红色赤潮藻的生长曲线如图 1所示。在培养的前8天, 所有氮处理组的细胞密度逐渐增加, 不同处理组之间的细胞密度无显著差异(P > 0.05), 第8天时细胞密度约为(4237.5±365)— (5030±315.3)cells/mL; 随后, 两个低氮处理组(0和25μmol/L)细胞密度不再增加, 藻生长进入稳定期。从第10天开始, 不同培养组之间出现差异, 细胞密度随着初始氮浓度的增加而增大(883μmol/L组除外); 50和100μmol/L两个处理组在第12天进入稳定期。此外, 藻细胞体积在不同处理组间出现差异, 主要表现为随着培养液中氮的消耗而变小。红色赤潮藻正常细胞大约长(72±6)μm, 宽(55±2)μm; 而变小的藻细胞长度仅为(37±1)μm, 宽(29±1)μm。第8天时, 两个低氮处理组(0和25μmol/L)处于藻生长的指数生长期晚期到稳定期, 培养液中的藻细胞主要以小细胞为主。除883μmol/L处理组外, 其余几个氮处理组(50—200μmol/L)也出现了藻细胞变小的现象。
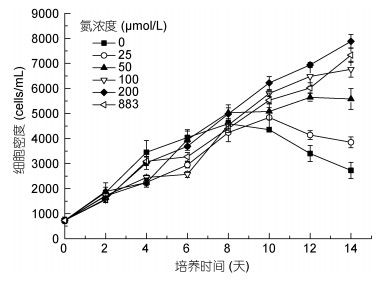 |
| 图 1 红色赤潮藻在不同氮浓度条件下的生长状况 Fig. 1 Growth of A. sanguinea in different nitrogen concentrations |
红色赤潮藻脂肪酸含量随着培养液中初始氮含量及培养时间的改变而发生显著变化(图 2)。0μmol/L处理组脂肪酸含量最高, 均值约为(166.83±46.46)mg/g dw; 883μmol/L处理组最低, 均值约为(86.70± 5.66)mg/g dw。2个低氮处理组(0和25μmol/L)的脂肪酸含量显著高于其他处理组(P < 0.01), 其余氮处理组(50—883μmol/L)之间差异不显著(P > 0.05)。随着培养时间的延长, 红色赤潮藻脂肪酸含量逐渐增高。以0μmol/L处理组为例, 第2天时藻体脂肪酸含量约为(122.79±17.59)mg/g dw, 到第12天时显著增高至(237.05±9.91)mg/g dw。
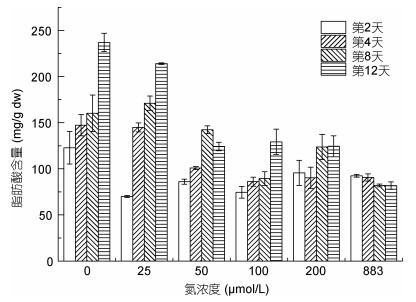 |
| 图 2 不同氮浓度条件下红色赤潮藻生长过程中脂肪酸含量变化 Fig. 2 Variations of total fatty acids contents in A. sanguinea cultured in different nitrogen concentrations |
在红色赤潮藻中共检测到28种脂肪酸, 包括12种SFA、7种MUFA和9种PUFA (表 1)。SFA含量约占总脂肪酸含量的50%—60%, 以C14:0、C16:0和C18:0为主。不同氮处理组之间SFA相对含量有显著差异(P < 0.05), 低氮处理组(0和25μmol/L)SFA相对含量显著高于高氮处理组(100—883μmol/L), 但不同生长阶段间SFA相对含量差异不显著(P > 0.05)。MUFA含量约占总脂肪酸含量的11.57%—25.51%, 主要以C18:1为主。MUFA相对含量在不同氮处理组及不同生长阶段间均呈显著性差异(P < 0.05):随着初始氮浓度的增加, 红色赤潮藻MUFA相对含量显著降低, 883μmol/L处理组具有最低的MUFA相对含量(约为11.57%—12.57%); 同时, 随着培养时间的延长, MUFA相对含量显著增高。以50μmol/L处理组为例, 第2天时藻体内MUFA含量约占总脂肪酸含量的14%, 第12天时, 相对含量增至20.48%。PUFA含量约占总脂肪酸含量的14.41%—42.59%, 以C20:5ω3和C22:6ω3为主。不同氮处理组及不同生长阶段的PUFA相对含量亦呈显著性差异(P < 0.05):低氮处理组(0—25μmol/L) PUFA相对含量显著低于其他氮处理组, 883μmol/L组PUFA含量最高, 最高可达42.59% (8天); 除883μmol/L组外, 其余组的PUFA相对含量随着培养时间的延长显著下降, 以50μmol/L处理组为例, 第2天时, 红色赤潮藻PUFA含量约占总脂肪酸含量的31.7%, 到第12天时降至23.11%。
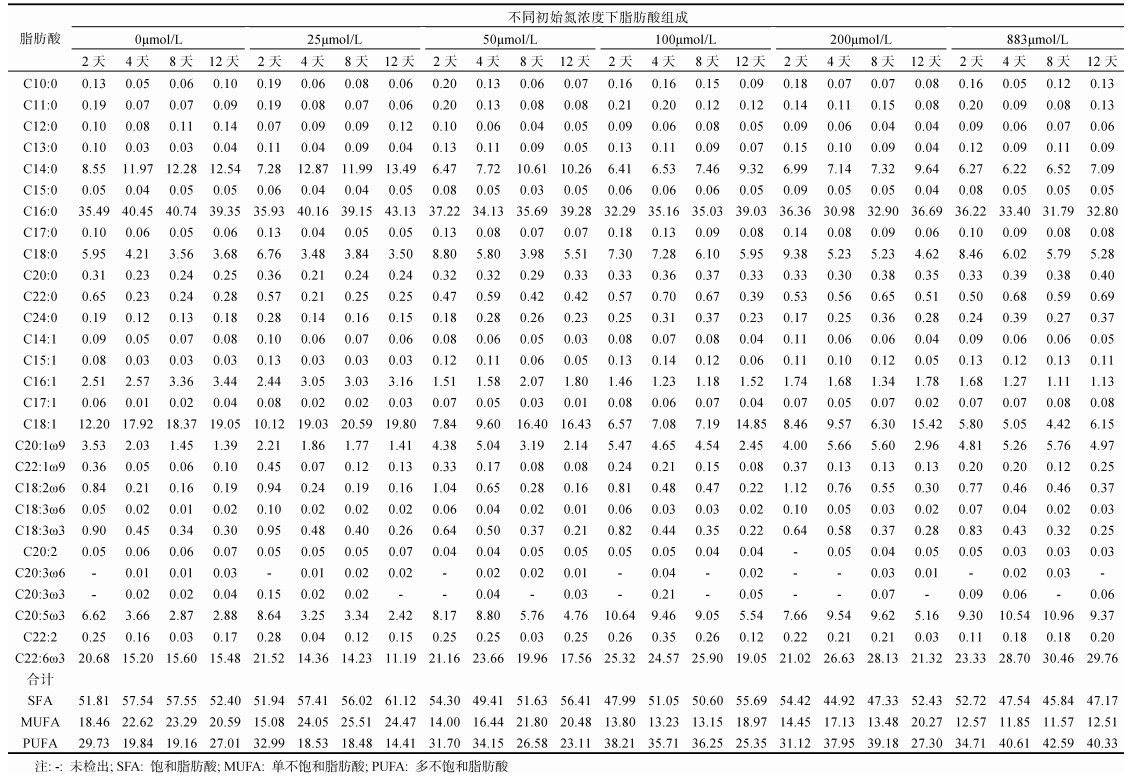
|
通过比较第4天时不同氮处理组红色赤潮藻的主要脂肪酸相对含量(图 3), 结果表明: 6种主要的脂肪酸(C14:0、C16:0、C18:0、C18:1、C20:5ω3和C22:6ω3)约占总脂肪酸含量的90%以上; 其中, C16:0相对含量最高, 约为30.89%—40.38%;其次为C22:6ω3, 相对含量约为14.38%—28.72%。并且, 脂肪酸含量随着培养液中初始氮浓度的变化而变化。C14:0、C16:0、C18:1三种脂肪酸含量随着初始氮浓度的升高而降低, 如C18:1在0μmol/L处理组的含量约为17.9%, 在883μmol/L处理组仅为5.04%, 约为0μmol/L处理组的1/3。C20:5ω3和C22:6ω3两种多不饱和脂肪酸随着初始氮浓度的升高而增高, C20:5ω3升高了约3倍(0μmol/L: 3.67%, 883μmol/L: 10.51%), C22:6ω3升高了约2倍(0μmol/L: 15.27%; 883μmol/L: 28.72%)。
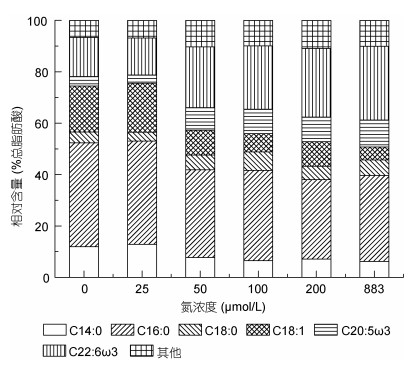 |
| 图 3 不同氮浓度下红色赤潮藻脂肪酸组成变化(第4天) Fig. 3 Variations of fatty acids compositions in A. sanguinea cultured in different nitrogen concentrations (4d) |
以100μmol/L处理组为例, 研究了不同生长阶段红色赤潮藻的脂肪酸组成变化(图 4)。结果表明, 随着培养时间的延长, C14:0, C16:0和C18:1三种脂肪酸的相对含量逐渐升高, 其中C18:1的变化最为显著, 第2天时, 其相对含量约占总脂肪酸含量的6.63%, 到第12天时升高至14.82%。C20:5ω3和C22:6ω3两种多不饱和脂肪酸随着培养时间的延长而降低, C20:5ω3相对含量降低了约50% (第2天: 10.62%;第12天: 5.56%), C22:6ω3则下降了约20% (第2天: 25.34%;第12天: 19.13%)。C18:0相对含量在不同生长阶段变化不显著(P > 0.05)。
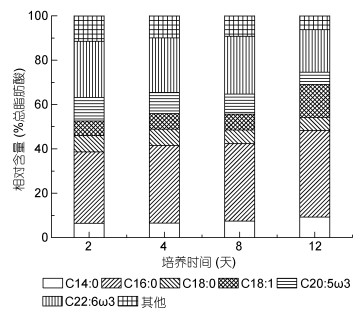 |
| 图 4 不同培养期红色赤潮藻脂肪酸组成变化(100μmol/L) Fig. 4 Variations of fatty acids compositions in A. sanguinea in different growth stage (100μmol/L) |
脂肪酸是浮游植物细胞内脂类的主要组成部分, 能为浮游植物在逆境时提供能量来源, 具有重要的生理功能。然而, 不同的浮游植物类群脂肪酸组成具有较大的差异, 本研究中红色赤潮藻脂肪酸以C16:0、C18:1、C20:5ω3 (EPA)和C22:6ω3 (DHA)等为主, 且DHA相对含量较高, 最高可达30.46% (883μmol/L, 8天, 表 1), 符合甲藻的脂肪酸组成特征(张玉君等, 2011)。此外, 本研究还发现, 培养液中初始氮含量及生长期对红色赤潮藻脂肪酸含量及组成均有显著性影响。
氮元素是浮游植物生长发育所必需的营养元素, 参与了细胞内蛋白质、核酸等生物大分子的合成, 缺氮条件下细胞内的碳通常储存在低氮或无氮的分子中, 如淀粉、脂质等。本研究中氮限制组(0和25μmol/L)脂肪酸含量显著高于其他组, 约为氮充足组(883μmol/L)的2倍, 表明氮限制有利于脂肪酸的累积, 这可能与氮限制条件下脂肪酸合成关键酶表达水平上调有关(赵佩佩等, 2015)。氮含量不仅对微藻脂肪酸含量产生影响, 也会显著影响其脂肪酸组成。本研究发现氮限制导致红色赤潮藻SFA和MUFA在总脂肪酸中所占比例上升, 而PUFA所占比例下降, 相似的研究结果在硅藻(廖启斌等, 2000)、定鞭藻(Li et al, 2005)中均有报道。在真核生物中, 多数PUFA是以SFA为底物, 通过脂肪酸延长酶和去饱和酶作用合成的, 氮限制可能降低了这些酶的活性, 从而导致SFA的积累及PUFA含量下降(廖灵旋等, 2014)。
浮游植物脂肪酸含量在不同生长阶段有显著变化。本研究中, 除883μmol/L处理组外, 其余处理组红色赤潮藻脂肪酸含量均随着培养时间的延长呈增加的趋势, 表明微藻体内脂肪酸逐渐积累, 这与Mansour等(2003)的研究结论一致。在不同的生长阶段, 微藻体内脂肪酸组成也发生显著变化。魏东等(2000)研究发现, 海洋微藻后棘藻(Ellipsoidion sp. 7-14)和眼点拟微球藻(Nannochloropsis oculata)在指数生长早期PUFA含量最高, 而C16:0、C16:1ω9和C18:1ω9等在稳定期较高; 李文权等(2002)也发现三种海洋微藻PUFA含量在指数生长期含量高于稳定期; Mansour等(2003)研究了裸甲藻(Gymnodinium sp.)在不同生长阶段脂肪酸组成变化, 发现随着培养时间的延长, C16:0和DHA相对含量逐渐增高, 而EPA含量逐渐降低。总体上讲, 从对数期到稳定期有利于SFA及MUFA的积累, 不利于PUFA的积累(张玉君等, 2011), 可能是由于稳定期的细胞处于生长限制条件下, 光合作用同化的碳主要积累在中性脂中, 从而导致饱和脂肪酸的比例较高(Zhu et al, 1997)。本研究也发现, 红色赤潮藻藻体中C14:0和C16:0和C18:1三种脂肪酸的相对含量随着培养时间的延长逐渐升高, 而EPA和DHA则随着培养时间的延长而降低。
红色赤潮藻属于广温广盐性种类, 在世界范围内的沿岸水体中广泛分布, 并在多地引发赤潮, 该藻赤潮严重影响鱼、虾、贝类的生长, 给当地海产养殖业带来巨大负面影响(陈全震等, 2000), 休眠孢囊可能在红色赤潮藻地理扩散和赤潮频发中发挥重要作用(Tang et al, 2015)。细胞内能量物质的贮存对休眠孢囊的维持、萌发至关重要, 已有研究表明, 甲藻休眠孢囊的贮存物质主要包括淀粉、脂类等(Ellegaard et al, 2018)。本研究发现红色赤潮藻在稳定期脂肪酸的增加, 可为休眠期脂类物质的积累奠定基础, 有利于该藻度过不良的环境条件。此外, 以往甲藻赤潮生态效应研究大多关注赤潮后期造成的低氧、藻毒素等方面(Botes et al, 2003);本研究显示, 随着红色赤潮藻的生长, 其脂肪酸组成也发生显著变化, 主要体现在PUFA含量下降。PUFA作为海洋动物的必需脂肪酸, 对各类海洋动物的生长、生殖和行为具有重要意义(Evjemo et al, 2008)。因此, 红色赤潮藻赤潮后期藻细胞脂肪酸组成的变化可能会对其他摄食该藻类的海洋生物生殖产生影响, 研究结果将为全面评价红色赤潮藻赤潮的生态效应提供新的研究思路。
4 结论红色赤潮藻由28种脂肪酸组成, 以C16:0、C18:1、EPA和DHA为主, 且DHA相对含量较高。培养液中氮浓度及生长阶段均对红色赤潮藻脂肪酸含量及组成产生影响。氮限制及稳定期有利于脂肪酸的积累, 且SFA和MUFA含量较高; 而高浓度氮处理组和指数生长期脂肪酸含量降低, 但PUFA含量较高。
王金辉, 秦玉涛, 李志恩, 等. 2005. 南麂列岛自然保护区海域红色裸甲藻赤潮及其成因分析. 海洋科学, 29(2): 32-36 DOI:10.3969/j.issn.1000-3096.2005.02.007 |
李文权, 廖启斌, 李芊, 等. 2002. 三种海洋微藻生长期脂肪酸组成研究. 海洋环境科学, 21(2): 10-13 DOI:10.3969/j.issn.1007-6336.2002.02.003 |
吴玉霖, 周成旭, 张永山, 等. 2001. 烟台四十里湾海域红色裸甲藻赤潮发展过程及其成因. 海洋与湖沼, 32(2): 159-167 DOI:10.3321/j.issn:0029-814X.2001.02.007 |
张玉君, 潘进芬, 蒲新明. 2011. 海洋浮游植物的脂肪酸:组成、功能及其生态学意义. 海洋通报, 30(1): 113-120 DOI:10.3969/j.issn.1001-6392.2011.01.019 |
陈全震, 何德华. 2000. 甲藻赤潮对养鲍业的危害及其防治探讨. 水产学报, 24(2): 151-155 |
陈国斌. 2012. 厦门海域一次冬季血红哈卡藻赤潮的初步分析. 福建水产, 34(5): 392-397 DOI:10.3969/j.issn.1006-5601.2012.05.008 |
赵佩佩, 顾文辉, 伍松翠, 等. 2015. 氮限制有利于三角褐指藻脂质积累. 科学通报, 60(23): 2196-2208 |
曹春晖, 孙世春, 麦康森, 等. 2006. 氮浓度对四株海洋绿藻总脂含量和脂肪酸组成的影响. 海洋湖沼通报, (3): 79-84 DOI:10.3969/j.issn.1003-6482.2006.03.012 |
喻龙, 郝彦菊. 2009. 烟台四十里湾一次血红哈卡藻赤潮过程的分析. 海洋科学进展, 27(4): 516-522 DOI:10.3969/j.issn.1671-6647.2009.04.015 |
廖启斌, 李文权, 陈清花, 等. 2000. 营养盐对三角褐指藻脂肪酸含量与百分组成的影响. 海洋环境科学, 19(2): 6-9 DOI:10.3969/j.issn.1007-6336.2000.02.002 |
廖灵旋, 于昊, 黄建忠. 2014. 多不饱和脂肪酸合成途径研究进展. 微生物学杂志, 34(3): 80-85 DOI:10.3969/j.issn.1005-7021.2014.03.016 |
魏东, 张学成, 邹立红, 等. 2000. 细胞生长时期对两种海洋微藻总脂含量和脂肪酸组成的影响. 青岛海洋大学学报, 30(3): 503-509 DOI:10.3969/j.issn.1672-5174.2000.03.019 |
Binder B J, Anderson D M, 1990. Biochemical composition and metabolic activity of Scrippsiella trochoidea (Dinophyceae) resting cysts. Journal of Phycology, 26(2): 289-298 DOI:10.1111/j.0022-3646.1990.00289.x |
Botes L, Smit A J, Cook P A, 2003. The potential threat of algal blooms to the abalone (Haliotis midae) mariculture industry situated around the South African coast. Harmful Algae, 2(4): 247-259 DOI:10.1016/S1568-9883(03)00044-1 |
Dempster T A, Sommerfeld M R, 1998. Effects of environmental conditions on growth and lipid accumulation in Nitzschia communis (Bacillariophyceae). Journal of Phycology, 34(4): 712-721 DOI:10.1046/j.1529-8817.1998.340712.x |
Ellegaard M, Ribeiro S, 2018. The long-term persistence of phytoplankton resting stages in aquatic 'seed banks'. Biological Reviews, 93(1): 166-183 DOI:10.1111/brv.2018.93.issue-1 |
Enright C T, Newkirk G F, Craigie J S et al, 1986. Evaluation of phytoplankton as diets for juvenile Ostrea edulis L. Journal of Experimental Marine Biology and Ecology, 96(1): 1-13 DOI:10.1016/0022-0981(86)90009-2 |
Evjemo J O, Tokle N, Vadstein O et al, 2008. Effect of essential dietary fatty acids on egg production and hatching success of the marine copepod Temora longicornis. Journal of Experimental Marine Biology and Ecology, 365(1): 31-37 DOI:10.1016/j.jembe.2008.07.032 |
Folch J, Lees M, Sloane Stanley G H, 1957. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry, 226(1): 497-509 |
Levine D M, Sulkin S D, 1984. Nutritional significance of long-chain polyunsaturated fatty acids to the zoeal development of the brachyuran crab, Eurypanopeus depressus (Smith). Journal of Experimental Marine Biology and Ecology, 81(3): 211-223 DOI:10.1016/0022-0981(84)90141-2 |
Li M, Gong R M, Rao X J et al, 2005. Effects of nitrate concentration on growth and fatty acid composition of the marine microalga Pavlova viridis (Prymnesiophyceae). Annals of Microbiology, 55(1): 51-55 |
Liu Y, Chen T T, Song S Q et al, 2015. Effects of nitrogenous nutrition on growth and nitrogen assimilation enzymes of dinoflagellate Akashiwo sanguinea. Harmful Algae, 50: 99-106 DOI:10.1016/j.hal.2015.10.005 |
Mansour M P, Volkman J K, Blackburn S I, 2003. The effect of growth phase on the lipid class, fatty acid and sterol composition in the marine dinoflagellate, Gymnodinium sp. in batch culture. Phytochemistry, 63(2): 145-153 DOI:10.1016/S0031-9422(03)00052-9 |
Parrish C C, 1999. Determination of total lipid, lipid classes, and fatty acids in aquatic samples. In: Arts M T, Wainman B Ceds. Lipids in Freshwater Ecosystems. New York:Springer, 4-20
|
Reuss N, Poulsen L, 2002. Evaluation of fatty acids as biomarkers for a natural plankton community. A field study of a spring bloom and a post-bloom period off West Greenland. Marine Biology, 141(3): 423-434 |
Spector A A, 1999. Essentiality of fatty acids. Lipids, 34(S1): S1-S3 DOI:10.1007/BF02562220 |
Tang Y Z, Gobler C J, 2015. Sexual resting cyst production by the dinoflagellate Akashiwo sanguinea:a potential mechanism contributing to the ubiquitous distribution of a harmful alga. Journal of Phycology, 51(2): 298-309 DOI:10.1111/jpy.12274 |
Tzovenis I, De Pauw N, Sorgeloos P, 1997. Effect of different light regimes on the docosahexaenoic acid (DHA) content of Isochrysis aff. galbana (clone T-ISO). Aquaculture International, 5(6): 489-507 |
Zhu C J, Lee Y K, Chao T M, 1997. Effects of temperature and growth phase on lipid and biochemical composition of Isochrysis galbana TK1. Journal of Applied Phycology, 9(5): 451-457 DOI:10.1023/A:1007973319348 |
 2019, Vol. 50
2019, Vol. 50


