
中国海洋湖沼学会主办。
文章信息
- 赵玉超, 王仁杰, 沈敏, 董甜甜, 崔彦婷, 王淑生, 凌涛, 李玉全, 付瑞江. 2019.
- ZHAO Yu-Chao, WANG Ren-Jie, SHEN Min, DONG Tian-Tian, CUI Yan-Ting, WANG Shu-Sheng, LING Tao, LI Yu-Quan, FU Rui-Jiang. 2019.
- 高盐和温度对凡纳滨对虾(Litopenaeus vannamei)受精卵孵化及幼体发育的影响
- EFFECTS OF TEMPERATURE AND HIGH SALINITY ON EGGS HATCHING, METAMORPHOSIS RATE AND SALINITY TOLERANCE OF LARVA IN LITOPENAEUS VANNAMEI
- 海洋与湖沼, 50(2): 347-354
- Oceanologia et Limnologia Sinica, 50(2): 347-354.
- http://dx.doi.org/10.11693/hyhz20180900222
-
文章历史
- 收稿日期:2018-09-20
- 收修改稿日期:2018-10-30
2. 滨州市渔业技术推广站 滨州 256616;
3. 潍坊市渔业技术推广站 潍坊 261061;
4. 滨州市北海新区海缘养殖科技有限公司 滨州 256616
2. Binzhou Fisheries Technology Extension Station, Binzhou 256616, China;
3. Weifang Fisheries Technology Extension Station, Weifang 261061, China;
4. Hai Yuan Breeding Technology Co., Ltd, . Binzhou 256616, China
凡纳滨对虾(Litopenaeus vannamei)属于广盐、广温性虾类, 是一种重要的海水养殖品种。其人工繁育研究早有报道, 国内相关研究可追溯到20世纪90年代, 以亲本和幼体培育环境关键因子的探索为主(张伟权, 1990)。近年来, 随着高品质对虾需求量的增加, 高盐虾的养殖和供给已远不足以满足市场需求, 受限于高盐苗种培育滞后, 耐高盐对虾苗种供应不足以及缺乏配套的高盐养殖模式和技术等问题, 对虾苗种在投放高盐池塘后, 存活率普遍较低、养成个体规格参差不齐且产量低, 影响了养殖产量的提高和经济效益的增加。
温度和盐度是影响水生甲壳动物自然分布极为重要两个环境因子, 与甲壳动物生长发育和繁殖等生命活动密切相关, 国内外学者对此已有大量研究报道(Burel et al, 1996; Ituarte等, 2010; 王涛等, 2017), 主要集中于甲壳动物的繁殖生物学(Romano et al, 2006; 李旭光等, 2014), 以及对虾对盐度、温度变化的生理、生化和遗传响应机制等方面(Li et al, 2014; 付萍等, 2017; 黄东科等, 2017)。盐度和温度也是决定对虾育苗成败的关键环境因子。有研究表明, 受精卵孵化需要适宜的盐度和温度, 超出胚胎发育的适宜盐度和温度范围, 胚胎发育异常, 畸形率升高, 幼体生存活力下降甚至死亡(张彬等, 2014)。尽管关于凡纳滨对虾受精卵孵化的研究多有报道, 但以等渗和低渗环境为主。高盐胁迫条件下凡纳滨对虾繁殖生物学研究报道较少, 高渗条件下的凡纳滨对虾受精卵孵化规律目前未见报道。
盐胁迫是自然界中主要的非生物胁迫之一, 普遍存在于动植物的生境中, 可对生物的生长发育和内在的生理、生化指标造成重要影响(洪磊等, 2004; 何凌仙子等, 2018)。不同生物对盐胁迫的响应方式不同, 同种生物不同发育阶段对盐度的敏感性也不同。凡纳滨对虾的生活史主要包括受精卵、无节幼体、溞状幼体、糠虾幼体、仔虾、幼虾和成虾七个发育阶段, 各阶段个体对盐度的耐受性研究报道较少, 高盐胁迫条件下幼体的变态发育目前未见相关报道。因此, 开展高盐条件下凡纳滨对虾繁殖生物学研究, 探讨高盐和温度对受精卵孵化和幼体发育的影响以及各期幼体对高盐的耐受性分析, 将对凡纳滨对虾高盐苗种繁育和养殖具有重要意义。本文拟以凡纳滨对虾受精卵和各期幼体为实验材料, 分析高盐和温度对凡纳滨对虾受精卵孵化的影响, 并分析比较各期幼体对高盐胁迫的耐受能力, 旨在为凡纳滨对虾在高盐水域的养殖推广和耐高盐亲本的选育、繁育提供理论参考, 并丰富甲壳类动物抗逆生物学基础知识。
1 材料与方法 1.1 实验材料获取实验于2017年4—5月在滨州市北海新区海缘养殖科技有限公司进行。取同一批次受精卵于1L烧杯中, 置于恒温培养箱中29℃恒温培养, 微充气, 保证烧杯内水环境与原产卵池基本相同, 用于受精卵孵化实验; 耐盐性和发育实验所需幼体材料均来自同批次、同家系育苗池, 取发育期和规格一致、健康活泼的个体。高盐海水取自盐田, 使用前经过滤、消毒等处理。基础盐度27, 不同盐度海水用高盐海水与淡水调配, 使用前曝气24h, pH 7.8—8.5。温度和盐度等水质指标采用YSI 556MPS型多参数水质测量仪测定。
1.2 实验设计 1.2.1 受精卵孵化实验设置5个高盐梯度(30、33、36、39和42), 以盐度27为对照和6个温度梯度(28℃、29℃、30℃、31℃、32℃和33℃), 正交设计, 同时设3个平行, 共108个处理。实验于控温系统中进行, 温度偏差小于0.5℃。每处理均放置100粒受精卵于500mL烧杯中。实验开始后每隔1h用玻璃棒轻搅水体, 避免受精卵沉底和结块。6h时开始观察受精卵孵化情况, 每0.5h计数1次, 44h时结束。记录各处理的无节幼体的初孵时间、集中孵化时间以及总孵化量等指标。
1.2.2 幼体耐盐性实验设置11个盐度梯度(30、33、36、39、42、45、48、51、54、57和60), 每梯度设3个平行, 共33个处理。实验材料分别取自同家系溞状幼体至仔虾Ⅲ期各个阶段的幼体, 其中溞状幼体三期(Z1—Z3)、糠虾幼体三期(M1—M3)、仔虾三期(P1—P3)。所有幼体均取自盐度27的苗种培育池, 分别放置于1L烧杯中, 初始盐度27, 水温32±0.5℃, 全程水浴恒温。通过向烧杯中缓慢添加高盐海水直至达到预设盐度, 随后各组分别取30尾幼体放置于盛有同盐度水体的烧杯中恒温培育, 并于0h、2h、6h、10h、14h观察并记录各期幼体的存活量和幼体活力。实验期间不断向烧杯内补水, 维持水位和盐度稳定。
1.2.3 幼体变态发育速度实验设8个盐度梯度(27、30、33、36、39、42、45和48), 每梯度设3个平行, 取刚孵化的同批次、同家系100尾幼体置于1L烧杯中, 30℃水浴恒温培育。盐度调节方法同1.2.2, 单次盐度升幅为3/h, 维持设计盐度直至实验结束, 期间不定期向烧杯内补充海水, 维持水位和盐度稳定。每隔0.5h观察记录幼体的发育及活力情况, 幼体活力判定参考张伟权(1990)的方法进行。
1.3 数据处理与统计分析 1.3.1 数据处理初孵时间(h):受精卵从胚胎发育开始到无节幼体破膜而出所需的最短时间。
幼体孵化率:孵化出的无节幼体数量与总受精卵数量的比值再乘以100, 具体公式为:
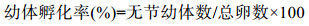
幼体集中孵化时间(h):完成总孵化率30%—90%的平均用时。
幼体发育指数(Larval stage index, LSI)根据文献(梁俊平等, 2013)原有幼体发育指数公式变换而来, 计算公式如下:
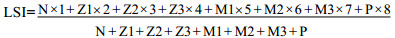
式中, N、Z1、Z2…M3分别表示凡纳滨对虾幼体各期存活的数量, P表示变态为仔虾的数量; 因凡纳滨对虾无节幼体(N)在适宜的孵化温度条件下发育速度较快, 且按发育阶段为无节幼体到仔虾各期分别为其赋予一个值, 即1—8, 表示幼体的发育阶段。以此来计算凡纳滨对虾幼体发育指数, 以表示幼体变态发育的快慢, 幼体发育指数越大, 则表示幼体变态越快。此外, 无节幼体各期间身体结构和行为变化差异较小, 所以无法准确界定无节幼体个体数量和变化, 遂将无节幼体整体记为N, 无各分期之间的数量比较。
1.3.2 统计分析借助SPSS19.0软件进行数据处理, 利用单因子方差分析(one-way ANOVA)比较不同处理间的差异, 利用LSD法进行多重比较, P < 0.05为差异显著。
2 结果 2.1 温度和盐度对受精卵孵化的影响 2.1.1 温度图 1为凡纳滨对虾受精卵孵化温度与平均孵化率之间的关系。分析表明, 温度显著影响受精卵的平均孵化率(P < 0.05), 平均孵化率随温度升高表现出阶梯式上升趋势。温度28—29℃孵化率最低, 30—31℃其次, 32—33℃孵化率最高, 32℃时平均孵化率达到最大值, 随后小幅下降。因此仅从孵化率来看, 32℃为最适孵化温度。
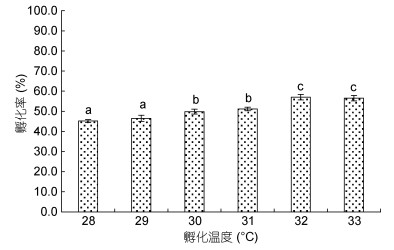 |
| 图 1 温度对凡纳滨对虾受精卵孵化率的影响 Fig. 1 Effects of temperature on hatchability of fertilized eggs of L. vannamei |
图 2为盐度对凡纳滨对虾受精卵孵化率的影响。盐度同样显著影响受精卵的平均孵化率(P < 0.05), 表现为随盐度升高平均孵化率先升高后降低, 盐度30时达到最大值(89.7%), 盐度33和36时平均孵化率较盐度30分别下降了15.0%和32.0%, 盐度36时受精卵孵化率降为50.8%, 盐度39时孵化率仅为3.4%, 盐度42无幼体孵化。由此可见, 凡纳滨对虾受精卵的极限孵化盐度约为40。
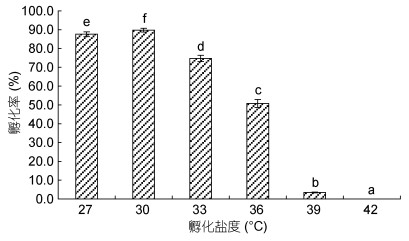 |
| 图 2 不同孵化盐度对凡纳滨对虾受精卵发育的影响 Fig. 2 Effects of different hatching salinity on hatchability of fertilized eggs in L. vannamei |
表 1为盐度和温度交互作用下受精卵的孵化情况。由表 1可见, 孵化率与水体温度和盐度密切相关, 盐度27—33和温度30—33℃分别为最适孵化盐度和温度范围, 在温度33℃和盐度30时, 孵化率达到最大值93.8%, 受精卵在胚胎开始发育后的7.5h完成破膜孵化, 11.5h时均可达到总孵化率的90%以上。而在最适范围以外, 受精卵破膜孵化时间推迟, 盐度越高或温度越低, 均会导致破膜孵化时间增加。
| 温度(℃) | 盐度 | 初孵时间(h) | 集中孵化时间段(h) | 总孵化率(%) |
| 28 | 27 | 9.5 | 9.5—11.5 | 78.3 |
| 30 | 9.5 | 9.5—11.5 | 84.3 | |
| 33 | 9.5 | 9.5—12.0 | 70.5 | |
| 36 | 10.5 | 11.0—13.0 | 35.8 | |
| 39 | 18.0 | — | 2.3 | |
| 42 | — | — | 0 | |
| 29 | 27 | 8.0 | 9.0—10.0 | 84.0 |
| 30 | 8.0 | 8.5—10.0 | 85.0 | |
| 33 | 8.5 | 9.5—12.5 | 69.8 | |
| 36 | 10.0 | 10.5—12.5 | 39.5 | |
| 39 | 18.0 | — | 0.8 | |
| 42 | 0 | — | 0 | |
| 30 | 27 | 7.5 | 7.5—10.5 | 90.0 |
| 30 | 7.5 | 7.5—11.0 | 91.8 | |
| 33 | 7.5 | 7.5—11.0 | 70.8 | |
| 36 | 9.5 | 9.5—12.0 | 44.5 | |
| 39 | 10.5 | 12.5—13.0 | 2.0 | |
| 42 | — | — | 0 | |
| 31 | 27 | 7.5 | 8.0—11.0 | 88.2 |
| 30 | 7.5 | 7.5—11.0 | 91.0 | |
| 33 | 7.5 | 8.0—11.5 | 72.8 | |
| 36 | 9.5 | 9.5—12.5 | 52.8 | |
| 39 | 12.0 | 12.0—12.5 | 2.0 | |
| 42 | — | — | 0 | |
| 32 | 27 | 7.5 | 7.5—10.5 | 92.3 |
| 30 | 7.5 | 7.5—10.5 | 92.3 | |
| 33 | 8.0 | 8.0—11.0 | 81.8 | |
| 36 | 8.0 | 8.0—11.0 | 66.8 | |
| 39 | 8.5 | 10.5—11.5 | 6.5 | |
| 42 | — | — | 0 | |
| 33 | 27 | 7.5 | 7.5—10.0 | 92.8 |
| 30 | 7.5 | 7.5—10.0 | 93.8 | |
| 33 | 7.5 | 7.5—10.5 | 80.3 | |
| 36 | 8.5 | 8.5—11.0 | 65.5 | |
| 39 | 9.0 | 9.5—12.0 | 7.0 | |
| 42 | — | — | 0 |
图 3、图 4、图 5分别为溞状幼体(Z1—Z3)、糠虾(M1—M3)和仔虾(P1—P3)对不同高盐环境的短期耐受性结果。从图中可知, 同一盐度条件下, 不同发育阶段幼体对高盐具有不同的耐受性; 同发育阶段幼体对高盐的耐受性亦不同。凡纳滨对虾各期幼体在盐度30—36范围内表现出较强的适应性, 存活率74%以上; 随着盐度升高, 幼体对高盐的耐受性减弱, 存活率逐步下降, 且各期幼体存活率下降幅度略有不同, 溞状幼体Z3下降幅度最小, Z1下降幅度最大; M3存活率高于M1和M2; P3存活率高于P1和P2。同盐度下, 存活率表现为Z3 > Z2 > Z1, 而糠虾和仔虾各期幼体间存活率无显著差异(P > 0.05)。
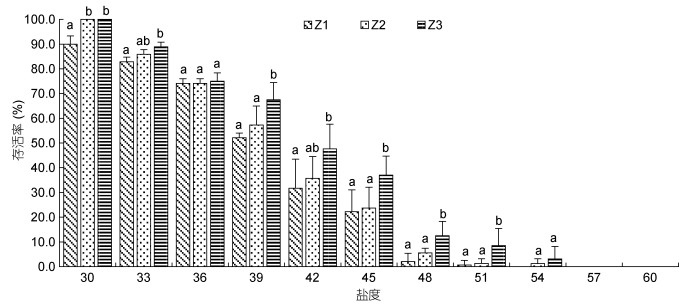 |
| 图 3 高盐对凡纳滨对虾溞状幼体存活率的影响 Fig. 3 Effects of high salinity on the survival rate of zoea stages in L. vannamei |
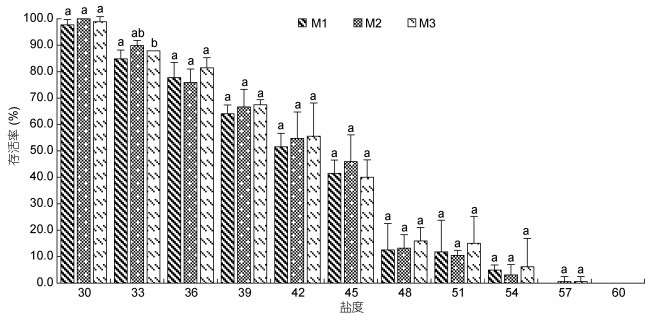 |
| 图 4 高盐对凡纳滨对虾糠虾存活率的影响 Fig. 4 Effects of high salinity on the survival rate of mysis stage larva in L. vannamei |
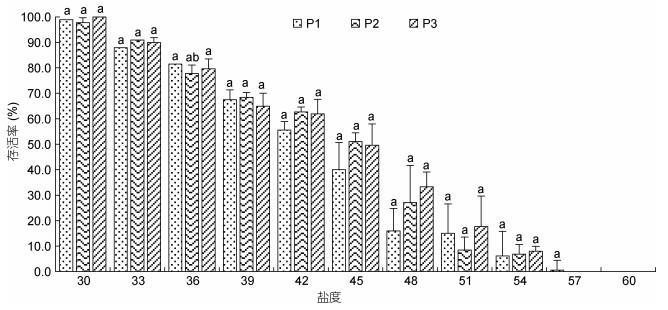 |
| 图 5 高盐对凡纳滨对虾P1—P3仔虾存活率的影响 Fig. 5 Effects of high salinity on the survival rate of P1—P3 in L. Vannamei |
从图 6可以看出, 各期幼体对高盐的耐受性不同。幼体存活率随发育进程缓慢升高, 说明幼体的耐盐性逐步增强。盐度30—60, 溞状幼体、糠虾和P1—P3仔虾的平均存活率分别为35.78%、41.71%和44.40%。Z3的平均存活率显著高于Z1和Z2;糠虾各期幼体间平均存活率差异不显著(P > 0.05);仔虾P1—P3平均存活率随发育小幅升高, 但差异不显著(P > 0.05)。
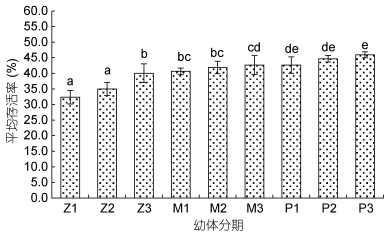 |
| 图 6 凡纳滨对虾各期幼体的耐盐性比较 Fig. 6 Comparison of salinity tolerance of larva stage in L. vannamei |
幼体变态发育的快慢可通过幼体发育指数进行衡量。幼体发育指数越大, 表示幼体变态越快, 反之亦然。从图 7可以发现, 幼体发育指数与盐度负相关, 即随盐度升高, 幼体发育指数呈梯度式下降。盐度27—33, 各处理间幼体发育指数差异不显著(P > 0.05), 幼体发育速度大体相同; 当盐度达到或超过36时, 幼体发育指数显著下降(P < 0.05)。
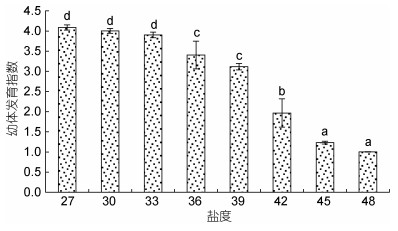 |
| 图 7 高盐对凡纳滨对虾幼体发育指数的影响 Fig. 7 Effects of high salinity on LSI of Larva in L. vannamei |
盐度和温度是影响凡纳滨对虾繁殖的两个重要环境因子。凡纳滨对虾受精卵孵化过程对水环境的盐度和温度具有较高要求, 对盐度和温度变化极为敏感。目前, 关于凡纳滨对虾受精卵孵化的最适温度和盐度的研究报道较多。但研究结果却不尽相同。如梁毅峰等(2007)实验发现凡纳滨对虾在盐度25—35, 温度30℃下具有较好的孵化效果; 而王兴强等(2004)则认为盐度29和水温28—31℃是凡纳滨对虾幼体孵化的最佳盐度和温度范围。
本试验探讨了高盐条件下盐度和温度不同组合对受精卵孵化的影响。结果发现, 凡纳滨对虾最佳孵化盐度为27—30, 高盐条件下, 孵化率急剧降低; 盐度越高, 无节幼体破膜孵化耗时越长, 原因可能在于, 高渗环境下, 胚胎内渗透压难以维持平衡, 生理机能调节紊乱, 胚胎发育放缓或停止, 致使孵化率降低或无法孵化。也有研究认为, 在一定盐度范围内, 胚胎内渗透压可通过卵内原生质层调节保持相对稳定, 以保证胚胎有相对较高的孵化率(陈林等, 2012)。对此Helvik等(1992)曾指出, 当盐度过高或过低时, 卵膜将难以调节细胞与周围介质之间的物质平衡, 卵细胞会发生损伤、破裂; 孙丽华等(2006)在研究军曹鱼孵化方面也有类似结果。沈和定等(2005)认为, 受精卵在孵化盐度超过其耐受范围时, 卵黄囊会失水收缩变小, 受精卵停止发育。分析比较孵化率发现, 盐度与孵化率之间存在正相关关系。Young等(1993)在研究了鱼类受精卵孵化后指出也得到同样结论。此外, 在高盐条件下随盐度升高平均孵化率呈现出先升后降趋势, 于盐度30时达到峰值, 盐度36—39时平均孵化率剧烈下降, 盐度42时无幼体破膜孵化而出。由此可见, 凡纳滨对虾受精卵孵化盐度的上限应介于39—42。本实验结果中最适孵化盐度与他人研究结果略有不同, 可能与凡纳滨对虾材料不同有关。
适宜的温度条件是受精卵完成孵化的关键。从胚胎发育开始到幼体破膜孵化无一不依赖于适宜的温度条件, 适宜温度条件是胚胎发育相关酶高效运转并发挥效应的保障。适宜盐度和温度会提高孵化酶活力, 非适宜的盐度和温度环境中, 孵化酶活力降低, 孵化率显著下降(冯广朋等, 2009)。在一定温度范围内, 受精卵孵化率与水温呈正相关(薛素燕等, 2012)。本实验发现, 温度与受精卵孵化密切相关, 凡纳滨对虾最适孵化温度为30—33℃; 温度32时孵化率达到最大。此外, 实验发现温度对幼体孵化时间有显著影响, 适宜温度条件下胚胎完成发育所用时间短于高温或低温, 这可能与适宜温度下相关酶活较强, 新陈代谢加快有关。此外, 张彬等(2014)也发现水温对凡纳滨对虾受精卵极体的排出和孵化时间有显著影响, 水温每降低1℃, 孵化时间需要增加0.6h; Luczynski等(1984)和杨世平等(2014)也有相似结论, 认为适当提高孵化温度, 会有效地缩短孵化期。
综合分析盐度和温度交互效果可知, 盐度33—36和温度30—33℃可作为凡纳滨对虾高盐孵化的最佳温盐组合, 过高的盐度或温度将限制幼体的孵化和后期的生长发育。
3.2 高盐对凡纳滨对虾幼体耐盐性的影响盐度是决定水生生物分布并影响其生长发育和生理代谢的重要环境因子, 不同水生生物对盐胁迫的响应方式不同(Fielder et al, 2005; 付萍等, 2017), 同种水生生物不同发育阶段和规格对盐度的敏感性也不同(Bouaricha et al, 1991; 林先智等, 2015)。本研究发现, 不同发育期的幼体对高盐具有不同的耐受性, 其中溞状幼体Ⅲ期高于溞状幼体Ⅱ期和Ⅰ期, 而糠虾各期幼体间、P1—P3期仔虾间耐盐性无显著差异(P > 0.05), 随发育进程, 幼体的存活率逐步升高, 说明幼体应对急性高盐胁迫的能力升高, 耐盐性增强。此结果与Bouaricha等(1991)在日本沼虾上的研究结果相近。日本沼虾糠虾之前幼体的渗透调节主要依靠鳃盖、侧板以及副肢来完成, 糠虾开始, 随鳃的发育, 渗透压调节能力显著提高(Bouaricha et al, 1991)。此结论或许也可解释本试验中糠虾和仔虾的耐盐性显著高于溞状幼体的原因。
3.3 高盐对凡纳滨对虾幼体变态发育的影响目前, 关于盐度对水生生物幼体变态发育影响的相关研究报道较少。Baylon等(2007)探讨了盐度与锈斑蟳幼体发育的关系。王桂忠等(1998)和Ruscoe等(2004)探讨了盐度对锯缘青蟹幼体蟹幼体变态发育的影响; 研究发现, 盐度23更有利于青蟹幼体的变态发育和生长, 而从Z4期开始, 盐度高于35会显著抑制幼体的变态发育且致死效应明显。本实验结果发现, 随盐度升高, 幼体发育指数呈梯度式下降, 幼体变态发育速度放缓。盐度27—33时, 盐度对幼体变态发育无显著影响; 盐度33—36时, 幼体变态发育速度显著减慢, 盐度39—42时, 幼体变态发育速度进一步显著降低。邢克智等(1997)的研究发现青虾幼体发育速度与盐度呈负相关关系, 与本研究结果一致。高盐条件下幼体变态发育速度随盐度升高而减慢的原因可能在于:对虾在高渗条件下机体为维持体内渗透压平衡会消耗大量能量, 用于生长发育能量减少, 待能量得不到满足时, 幼体发育相关的生理活动将会受限, 变态发育活动也将变得迟缓, 具体原因需要后续试验加以验证。
王涛, 李琪. 2017. 不同盐度和温度对熊本牡蛎(Crassostrea sikamea)稚贝生长与存活的影响. 海洋与湖沼, 48(2): 297-302 |
王兴强, 马甡, 董双林. 2004. 凡纳滨对虾生物学及养殖生态学研究进展. 海洋湖沼通报, (4): 94-100 DOI:10.3969/j.issn.1003-6482.2004.04.016 |
王桂忠, 林淑君, 林琼武, 等. 1998. 盐度对锯缘青蟹幼体存活与生长发育的影响. 水产学报, 22(1): 89-92 |
付萍, 吕建建, 刘萍, 等. 2017. 盐度胁迫对三疣梭子蟹肌肉和血淋巴中游离氨基酸含量的影响. 水产学报, 41(3): 374-381 |
冯广朋, 庄平, 章龙珍, 等. 2009. 长江口纹缟虾虎鱼胚胎发育及早期仔鱼生长与盐度的关系. 水生生物学报, 33(2): 170-176 |
孙丽华, 陈浩如, 王肇鼎. 2006. 盐度对军曹鱼胚胎和仔鱼发育的影响. 生态科学, 25(1): 48-51, 55 DOI:10.3969/j.issn.1008-8873.2006.01.013 |
邢克智, 刘茂春, 王金华. 1997. 温度、盐度对青虾幼体生长发育的影响. 南开大学学报(自然科学版), 30(3): 88-93, 105 |
何凌仙子, 贾志清, 刘涛, 等. 2018. 植物适应逆境胁迫研究进展. 世界林业研究, 31(2): 13-18 |
张彬, 韦嫔媛, 熊建华, 等. 2014. 凡纳滨对虾胚胎发育进程及诱导染色体加倍时间确定. 南方农业学报, 45(4): 664-670 DOI:10.3969/j:issn.2095-1191.2014.4.664 |
张伟权. 1990. 世界重要养殖品种——南美白对虾生物学简介. 海洋科学, 14(3): 69-73 |
李旭光, 周刚, 谷孝鸿. 2014. 水生甲壳类蜕皮发生过程及其影响因素的研究与进展. 动物学杂志, 49(2): 294-302 |
杨世平, 王成桂, 黄海立, 等. 2014. 环境温度和盐度对墨吉明对虾(Fenneropenaeus merguiensis)胚胎发育的影. 海洋与湖沼, 45(4): 817-822 |
沈和定, 陈贤龙, 陈汉春, 等. 2005. 水温对石磺胚胎发育的影响. 水产学报, 29(6): 776-782 |
陈林, 周文玉, 潘桂平. 2012. 盐度对棘头梅童鱼胚胎发育和仔鱼存活的影响. 海洋渔业, 34(4): 388-392 DOI:10.3969/j.issn.1004-2490.2012.04.004 |
林先智, 区又君, 李加儿, 等. 2015. 盐度胁迫对遮目鱼幼鱼存活、生长及性状相关性的影响. 中国水产科学, 22(4): 675-686 |
洪磊, 张秀梅. 2004. 环境胁迫对鱼类生理机能的影响. 海洋科学进展, 22(1): 114-121 DOI:10.3969/j.issn.1671-6647.2004.01.017 |
梁俊平, 李健, 李吉涛, 等. 2013. 不同温度对脊尾白虾胚胎发育与幼体变态存活的影响. 生态学报, 33(4): 1142-1152 |
梁毅峰, 刘亚军, 栾春钢, 等. 2007. 我国北方地区繁育凡纳滨对虾试验. 水产科学, 26(7): 414-415 DOI:10.3969/j.issn.1003-1111.2007.07.012 |
黄东科, 梁华芳, 张志, 等. 2017. 温度对波纹龙虾存活、摄食、蜕壳和生长的影响. 生态学报, 37(18): 5973-5980 |
薛素燕, 赵法箴, 方建光, 等. 2012. 温度和盐度对中华原钩虾幼体孵化、存活及生长的影响. 水生生物学报, 36(7): 1094-1101 |
Baylon J, Suzuki H, 2007. Effects of changes in salinity and temperature on survival and development of larvae and juveniles of the crucifix crab Charybdis feriatus (Crustacea:Decapoda:Portunidae). Aquaculture, 269(1-4): 390-401 DOI:10.1016/j.aquaculture.2007.03.024 |
Bouaricha N, Thuet P, Charmantier G et al, 1991. Na+-K+ ATPase and carbonic anhydrase activities in larvae, postlarvae and adults of the shrimp Penaeus japonicus (Decapoda, Penaeidea). Comparative Biochemistry and Physiology Part A:Physiology, 100(2): 433-437 DOI:10.1016/0300-9629(91)90495-X |
Burel C, Ruyet J P L, Gaumet F et al, 1996. Effects of temperature on growth and metabolism in juvenile turbot. Journal of Fish Biology, 49(4): 678-692 DOI:10.1111/jfb.1996.49.issue-4 |
Fielder D S, Bardsley W J, Allan G L et al, 2005. The effects of salinity and temperature on growth and survival of Australian snapper, Pagrus auratus larvae. Aquaculture, 250(1-2): 201-214 DOI:10.1016/j.aquaculture.2005.04.045 |
Helvik J V, Walther B T, 1992. Photo-regulation of the hatching process of halibut (Hippoglossus hippoglossus) eggs. Journal of Experimental Zoology, 263(2): 204-209 DOI:10.1002/(ISSN)1097-010X |
Ituarte R B, Spivak E D, Camiolo M et al, 2010. Effects of salinity on the reproductive cycle of female freshwater shrimp, Palaemonetes argentinus. Journal of Crustacean Biology, 30(2): 186-193 DOI:10.1651/09-3174.1 |
Li E C, Wang S L, Li C et al, 2014. Transcriptome sequencing revealed the genes and pathways involved in salinity stress of Chinese mitten crab, Eriocheir sinensis. Physiological Genomics, 46(5): 177-190 DOI:10.1152/physiolgenomics.00191.2013 |
Luczynski M, Kirklewska A, 1984. Dependence of Coregonus albula embryogenesis rate on the incubation temperature. Aquaculture, 42(1): 43-55 DOI:10.1016/0044-8486(84)90312-0 |
Romano N, Zeng C S, 2006. The effects of salinity on the survival, growth and haemolymph osmolality of early juvenile blue swimmer crabs, Portunus pelagicus. Aquaculture, 260(1-4): 151-162 DOI:10.1016/j.aquaculture.2006.06.019 |
Ruscoe I M, Shelley C C, Williams G R, 2004. The combined effects of temperature and salinity on growth and survival of juvenile mud crabs (Scylla serrata Forsk l). Aquaculture, 238(1-4): 239-247 DOI:10.1016/j.aquaculture.2004.05.030 |
Young P S, Cech J J Jr, 1993. Improved Growth, Swimming Performance, and Muscular Development in Exercise- Conditioned Young-of-the-Year Striped Bass (Morone saxatilis). Canadian Journal of Fisheries and Aquatic Sciences, 50(4): 703-707 DOI:10.1139/f93-080 |
 2019, Vol. 50
2019, Vol. 50


