
中国海洋湖沼学会主办。
文章信息
- 王润萍, 戴铃灵, 陈雅飞, 徐永健. 2019.
- WANG Run-Ping, DAI Ling-Ling, CHEN Ya-Fei, XU Yong-Jian. 2019.
- 短期温度、盐度胁迫对海洋青鳉鱼(Oryzias melastigma)摄食行为及抗氧化的影响
- EFFECTS OF SHORT-TERM TEMPERATURE OR SALINITY STRESS ON FEEDING BEHAVIOR AND ANTIOXIDANT OF MARINE MEDAKA (ORYZIAS MELASTIGMA)
- 海洋与湖沼, 50(2): 378-387
- Oceanologia et Limnologia Sinica, 50(2): 378-387.
- http://dx.doi.org/10.11693/hyhz20181000234
-
文章历史
- 收稿日期:2018-10-08
- 收修改稿日期:2018-12-05
环境因素对鱼类的生长、行为和摄食起着重要的作用。其中, 温度和盐度作为两种非常重要的生态因子, 对鱼类的生长、发育、代谢等生命活动具有显著的影响。水温直接或间接影响鱼类生长代谢、消化酶活性、蛋白质合成以及基因表达等(Russell et al, 1996; 周银环等, 2017)。已有大量关于温度对鱼类生长影响的报道: Jain等(2003)研究表明, 虹鳟(Oncorhynchus mykiss)游泳速度和摄食效率受到水温变化的显著影响; 徐革锋等(2015)研究发现, 细鳞鲑(Brachymystax lenok)幼鱼在温度适应范围外时, 游泳能力降低, 爆发游泳速度较适宜温度下显著降低。而Rome等(1990)和Keen等(1994)等研究表明, 鱼类的临界游泳速度变化随着温度升高成比例上升的“线性”关系; 或者呈现随着温度的增加先增加后平稳, 超过最适温度范围随温度增加而降低的“钟形”关系。Handeland等(2008)报道, 大西洋鲑的摄食率、饵料转换率和生长受到水体温度的显著性影响, 14℃时鱼体表现出较高的摄食率和生长率。过高或过低的温度都会影响鱼体内消化酶的活性, 进而影响其摄食行为和生长速率(Handeland et al, 2000)。
盐度同样是影响水生生物生长和存活的又一重要非生物因子, 直接影响鱼类生长与发育(叶富良等, 2002)。盐度变化不仅影响水生动物的代谢活动及渗透压调节, 而且也影响水生动物的营养需求、组织结构、生理生化指标(柳旭东等, 2008; 王涛等, 2013; Huang et al, 2015)。盐度通过等渗压影响鱼类的生长, 在适宜的渗透环境中, 鱼类的生长速度较快, 成活率也较高, 而一旦处在高盐或低盐环境中, 则会影响其生长发育(Abou Anni et al, 2016)。而盐度对鱼类摄食影响已有大量文献报道: 梁国栋等(2014)研究发现, 罗非鱼(Tilapia)仔鱼在盐度为2—10时, 开口率随盐度的增加逐渐上升, 而盐度过高则会对仔鱼摄食产生抑制; 张春禄等(2017)则发现, 盐度对条纹锯鮨(Centropristis striata)仔鱼的活力、摄食及存活有明显影响, 最适盐度在12—37之间。当盐度低于12或高于37时, 仔鱼存活率、开口率和摄食强度均受到抑制。
海洋青鳉鱼(Oryzias melastigma)隶属于脊索动物门(Chordata)、脊椎动物亚门(Vertebrate)、辐鳍亚纲(Actinopterygii)、鳉形目(Cypernodontiformes)、青鳉属(Oryzias), 又名黑点青鳉、印度马达卡(Chen et al, 2009; Kinoshita et al, 2009)。全年产卵, 4—9月份是产卵高峰时间, 该鱼适应温度、盐度范围较广, 体型较小、性别差异明显、世代周期短、产卵率高, 鱼卵和幼体对环境变化的干预敏感, 被推荐为是“一种理想的海洋模式鱼种”(Chen et al, 2009; 陈瑶等, 2010; 伍辛泷等, 2012)。据报道可知, 不同生活方式和生理特性会直接影响到鱼类的摄食行为(黄玉瑶, 1988), 而且已有学者采用近红外成像方法观察鱼类的摄食行为来量化养殖鱼的行为变化(Zhou et al, 2017)。目前对于海洋青鳉鱼的研究多集中在环境毒理、发育等方面(王晓杰等, 2015, 2018; 陈漪等, 2016), 而对于环境变化, 如温度、盐度等造成的摄食行为和生理变化的研究几乎没有。通过对鱼类行为学变化的研究, 可以直观的判断其养殖条件适宜性、水质变化异常性等(Mourente et al, 2002; Zhou et al, 2017)。因此, 本文以海洋青鳉鱼为研究对象, 对雌雄个体间、个体与群体间在不同温度、盐度胁迫下摄食行为和抗氧化能力的变化进行研究分析, 从而提高海洋青鳉鱼的养殖成活率, 也为其他水生生物摄食行为观察的相关研究提供参考。
1 材料与方法 1.1 实验鱼养殖实验用海洋青鳉鱼为宁波大学校内实验基地培育。选择同时生育的一批大小均等、体质良好、活力强的6月龄成鱼(体长: 3.47±0.22cm, 体重: 0.84±0.13g)移养到室内50m×40m×45m的水族玻璃缸中, 暂养一周。养殖条件:盐度25±1、温度25±1℃、光强2000 lx、光暗周期14L:10D。一周后, 分别进行温度和盐度驯化, 其他养殖条件不变。实验温度分别为15℃、25℃(对照组)、31℃三个梯度(盐度为25);实验盐度分别为5、15、25(对照组)、35四个梯度(温度为25℃)。不同盐度在砂滤海水盐度的基础上, 加海水晶(海马海水晶, 青岛海之盐科技有限公司)或蒸馏水进行调配。日常管理中, 青鳉鱼饲喂颗粒饵料(天邦水产饵料, 广东天邦饵料科技有限公司), 饵料平均单粒重为0.55mg。每天下午4点吸污并补充水体后投喂饵料, 定点(投喂位置固定), 定量(投喂量为鱼体重10%左右)。青鳉鱼在各温盐梯度下驯化1—2周, 进行摄食行为实验观察。进行温盐胁迫同时, 定时随机选取各组青鳉鱼进行有关酶活性的检测。
1.2 实验方法 1.2.1 摄食行为先进摄食行为观察预实验, 观察和确定青鳉鱼稳定高效摄食期间所需的摄食时间, 摄食量。将不同温度、盐度下青鳉鱼进行24h的饥饿处理, 随机捞取处理过的青鳉鱼转移到拍摄缸内(透明玻璃缸, 24cm×15cm×10cm), 采用2台摄像机(Sony-220RE)分别放置于拍摄缸水平正面和垂直上面进行拍摄。通过对拍摄视频的观察分析, 测得一尾青鳉鱼平均一次饱食量为10—12粒(约6mg)饵料。适宜的拍摄时长为50min:投饵前5min, 摄食时间35min, 停止摄食后10min。当青鳉鱼有5min以上没有摄食动作时视为饱食状态, 并停止观察。
正式实验前, 将经过不同温度、盐度驯化过的青鳉鱼, 每组取6只, 移养到拍摄室内的暂养缸中, 简单标记并测量体长体重后, 进行饥饿24h处理; 转移到透明玻璃缸适应1h后开始拍摄。分别观察雌、雄单只以及单只(雌雄随机)、群体的摄食行为。同预实验, 拍摄时采用2台Sony-220RE摄像机分别置于水平正面和垂直上面进行拍摄。对拍摄视频进行分析, 从而比较雌雄性别之间、单只与群体状体下青鳉鱼摄食行为的差异。
1.2.2 酶活性检测分别在各温度、盐度处理组驯养的第0(CK)、1、4、7天的上午9:00分别随机取青鳉鱼各6只。用超纯水将鱼体表面冲洗2—3遍后, 将待测样品移至冰盘中, 快速解剖, 取出各组织, 迅速用预冷无菌生理盐水(0.9%)冲洗干净, 置于2mL离心管内(刘峰等, 2016)。按照酶活测定试剂盒(南京建成生物工程研究所)说明, 分别测定超氧化物歧化酶(SOD)、过氧化氢酶(CAT)的活性及丙二醛(MDA)含量。
1.3 参数定义及公式 1.3.1 摄食行为参数摄食响应时间(min):从饵料定点投入起到鱼开始摄食到(包括尝试摄食)第一颗饵料止的时间。
摄食量(g/ind):每条青鳉鱼平均在一次拍摄时间内(即一次饱食)摄入的饵料总量。
摄食速率(particle/min):青鳉鱼摄入第4粒至第8粒(包括第8粒)饵料时的平均速率, 即进食稳定后平均每分钟摄入的饵料数量。
摄食成功率(%)=成功摄食次数/总摄食次数。其中, 总摄食次数为青鳉鱼有摄食动作且口吻部触碰到饵料的次数。成功摄食次数表示鱼成功捕获饵料的次数(包括吞入后再吐出)。
摄食效率(g/min):在一次饱食过程中, 青鳉鱼在单位时间内摄入的饵料量。
1.3.2 酶活定义SOD活性单位(U/mg):每毫克组织蛋白在1mL反应液中SOD抑制率达50%时所对应的SOD量为1个活力单位。
CAT活性单位(U/mg):每毫克组织蛋白每秒钟分解1μmol H2O2的量为一个活力单位。
1.4 数据处理所有结果采用(平均值±标准差)表示, 采用Graphpad prism 6.0 (La Jolla, USA)软件, 利用单因素方差分析(one-way ANOVA)方法检验温度、盐度分别对摄食行为及鱼体内酶活性的影响, 并采用Duncan’s多重检验组间差异显著性。P < 0.05作为差异显著标准。
2 结果 2.1 温度和盐度对青鳉鱼摄食行为的影响 2.1.1 摄食响应时间如图 1可见, 青鳉鱼在不同温度、盐度下的摄食响应时间具有明显差异。其中, 不同温度下(图 1a, b), 青鳉鱼对饵料的响应时间在25℃时最短, 显著性小于15℃和31℃(P < 0.05)。同一温度下, 雄鱼的摄食响应时间显著性小于雌鱼(P < 0.01), 群体状态下的摄食响应时间显著性小于单只状态下(P < 0.01)。盐度对青鳉鱼摄食响应时间的影响类似于温度, 呈现出随盐度升高先降低后升高的趋势(图 1c, d)。盐度为15和25时, 青鳉鱼摄食响应时间均显著性小于盐度为5和35 (P < 0.05)。其中, 盐度为25时, 雌鱼、雄鱼、单只和群体的摄食响应均最短(图 1c, d)。群体的摄食响应时间显著性小于单只状态(P < 0.01)。
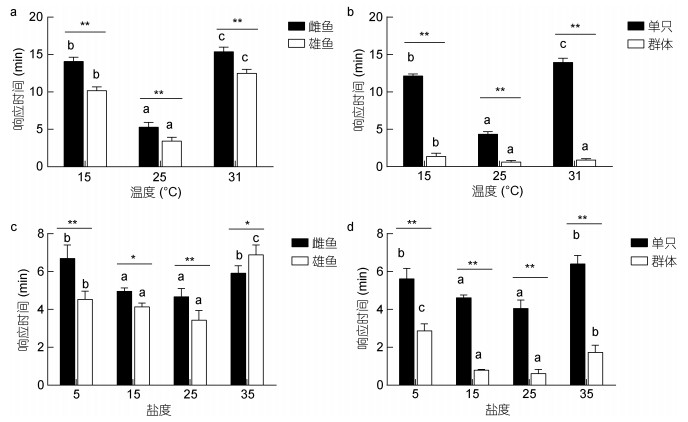 |
| 图 1 温度、盐度胁迫对青鳉鱼摄食响应时间的影响 Fig. 1 Effects of short-term temperature or salinity stress on the feeding response time of O. melastigma 注:不同字母表示相同性别或只数青鳉鱼在不同温度下差异显著(P < 0.05); *表示不同性别或只数组间在相同温度下差异显著: * P < 0.05, ** P < 0.01 |
由图 2a, b可知, 青鳉鱼在25℃的摄食量最大, 显著性高于15℃和31℃ (P < 0.05)。其次, 同一温度下, 单只与群体状态下其摄食量无显著性差异(P > 0.05);雌鱼的摄食量高于雄鱼, 但无显著性差异(P > 0.05)。青鳉鱼的摄食量同样受到盐度的显著影响(图 2c, d), 盐度25时摄食量最大, 高于或者低于25时摄食量均降低, 盐度为5时青鳉鱼摄食量最低。而相同盐度下, 雌鱼的摄食量高于雄鱼(P < 0.05), 单只与群体间无差异(P > 0.05)。
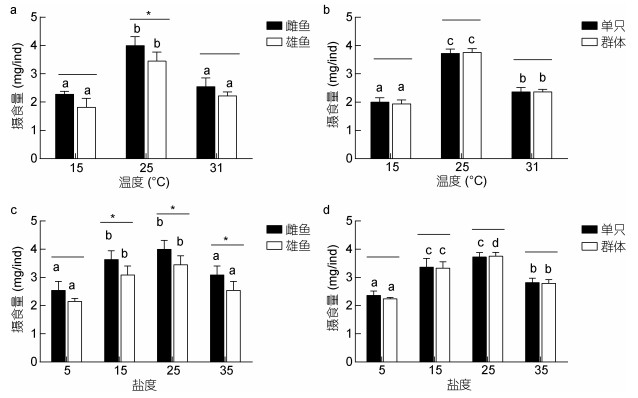 |
| 图 2 温度、盐度胁迫对青鳉鱼摄食量的影响 Fig. 2 Effects of short-term temperature or salinity stress on the feed intake of O. melastigma 注:不同字母表示相同性别或只数青鳉鱼在不同温度下差异显著(P < 0.05); *表示不同性别或只数组间在相同温度下差异显著: * P < 0.05, ** P < 0.01 |
随着温度的升高, 青鳉鱼的摄食速率逐渐增加, 15℃时最低, 31℃时最高(图 3a, b)。雌鱼的摄食速率明显高于雄性, 并且在25℃和31℃条件下差异显著(P < 0.05)。随着温度的升高, 群体的摄食速率迅速增长, 远高于同一温度下单只青鳉鱼的摄食速率(P < 0.01)。青鳉鱼摄食速率随着盐度的升高先升高后降低, 盐度为25时摄食速率均达到最大。在盐度为25时, 雌鱼的摄食速率显著性大于雄鱼(P < 0.05), 盐度为5时小于雄鱼; 所有盐度下, 青鳉鱼群体状态下的摄食速率大于单只(P < 0.01)。
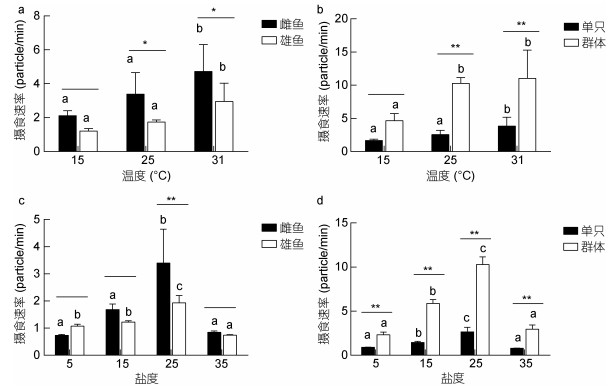 |
| 图 3 温度、盐度胁迫对青鳉鱼摄速率的影响 Fig. 3 Effects of short-term temperature or salinity stress on the feeding rate of O. melastigma 注:不同字母表示相同性别或只数青鳉鱼在不同温度下差异显著(P < 0.05); *表示不同性别或只数组间在相同温度下差异显著: * P < 0.05, ** P < 0.01 |
由结果分析可知(图 4a, b), 不同温度下, 青鳉鱼摄食成功率在15℃到25℃时随温度升高而升高, 31℃时显著性降低(P < 0.05)。25℃时雄鱼显著性高于雌鱼(P < 0.05), 其他温度下雌雄间、单只与群体之间摄食成功率无显著差异(P > 0.05)。
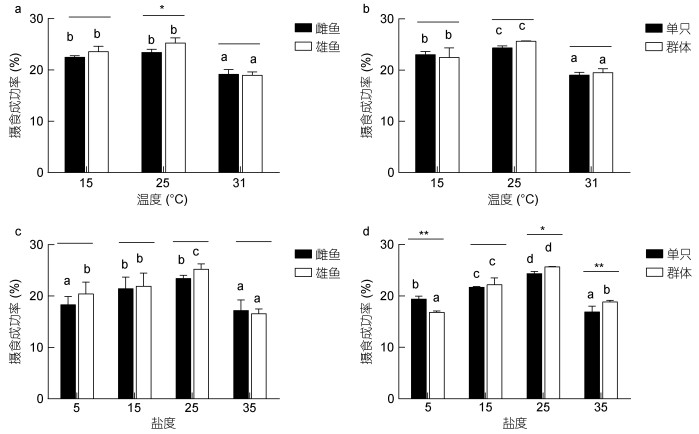 |
| 图 4 温度、盐度胁迫对青鳉鱼摄食成功率的影响 Fig. 4 Effects of short-term temperature or salinity stress on the feeding success rate of O. melastigma 注:不同字母表示相同性别或只数青鳉鱼在不同温度下差异显著(P < 0.05); *表示不同性别或只数组间在相同温度下差异显著: * P < 0.05, ** P < 0.01 |
青鳉鱼摄食成功率受盐度的影响较温度变化复杂, 在5—25范围内, 随盐度升高而增加, 盐度继续升高, 摄食成功率下降, 盐度35成功率最低(图 4c, d)。单只和群体的摄食成功率均在盐度25最高, 显著高于其他盐度组(P < 0.05)。
2.1.5 摄食效率由结果分析可见(图 5a, b), 青鳉鱼摄食速率随温度的升高先升高后降低, 在25℃时达到最大显著性高于5℃和31℃ (P < 0.05), 5℃时最小。其次, 同一温度下, 雌鱼的摄食效率高于雄鱼, 25℃和31℃差异显著(P < 0.01);群体的摄食效率显著性高于单只(P < 0.01)。而在不同盐度下(图 5c, d), 青鳉鱼的摄食速率随盐度的增加先增加后降低, 在盐度为25时摄食速率最大, 盐度过高或者过低都会抑制摄食效率。同一盐度下, 除盐度为5时, 雌鱼的摄食效率均高于雄鱼, 且在盐度为25时差异显著(P < 0.05);群体的摄食效率均显著性高于单只(P < 0.01)。
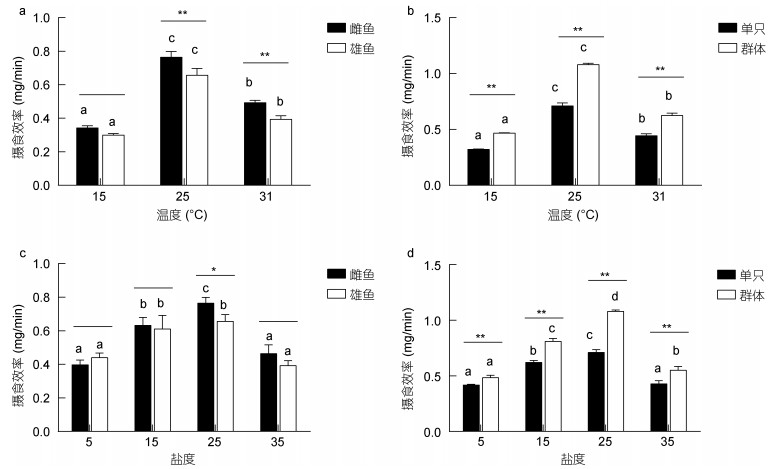 |
| 图 5 温度、盐度胁迫对青鳉鱼摄效率的影响 Fig. 5 Effects of short-term temperature or salinity stress on the feeding efficiency of O. melastigma 注:不同字母表示相同性别或只数青鳉鱼在不同温度下差异显著(P < 0.05); *表示不同性别或只数组间在相同温度下差异显著: * P < 0.05, ** P < 0.01 |
不同温度下, 同一时间内青鳉鱼体内SOD和CAT酶活性随温度的变化呈先下降后上升趋势(图 6a, b)。处理1天时, SOD和CAT酶活性都显著高于对照组(P < 0.05);随着养殖时间的延长, 同一温度下, 实验组各酶活性与对照组差异减小, 到第7天时间差异不显著(P > 0.05)。而MDA含量在25℃时最低, 并且同一温度下随着养殖时间的延长, 15℃和25℃下MDA含量先增加后减小, 而31℃下则逐渐升高。15℃下处理第4天MDA含量最高。
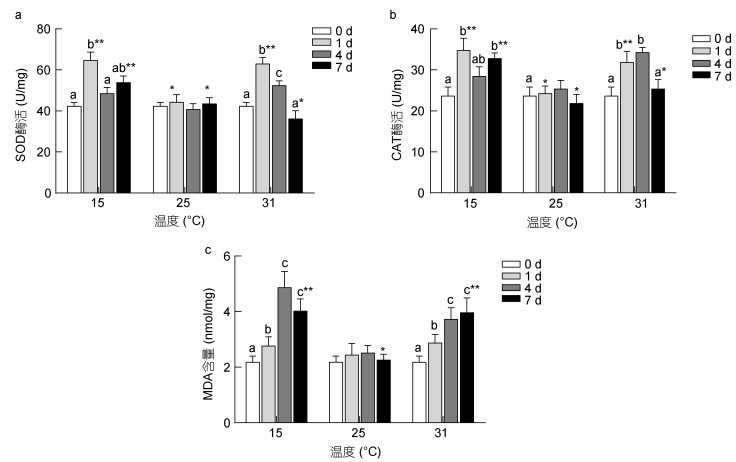 |
| 图 6 温度胁迫对青鳉鱼SOC、CAT酶活性及MDA含量的影响 Fig. 6 Effects of short-term temperature stress on the SOD, CAT activity, and MDA content of O. melastigma 注:不同字母表示相同温度, 不同时间下SOC、CAT酶活性及MDA含量的差异显著(P < 0.05); *表示不同温度, 相同时间下SOC、CAT酶活性及MDA含量的显著性差异P < 0.05 |
如图 7a, b所示, 青鳉鱼SOD、CAT活性受到盐度影响较小, 盐度过高(35)或过低时(5)呈现出变化。SOD酶活性在盐度为5和35时胁迫1天后即显著性降低(P < 0.05), 处理第4天、7天恢复升高。CAT酶盐度为最低和最高时, 处理4天后酶活性显著升高, 并且持续到第7天没有显著下降。而MDA含量在不同盐度下胁迫不同时间变化明显, 盐度高于或低于25时, MDA含量处理第1天时与对照组相比具有显著性差异(P < 0.05), 盐度为5或35时第7天含量仍然没有显著降低。
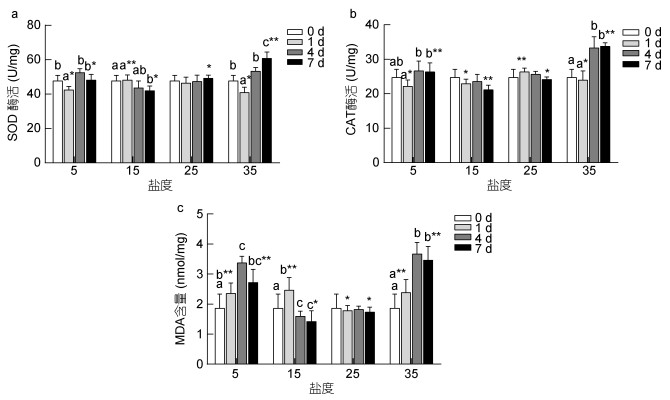 |
| 图 7 盐度胁迫对青鳉鱼酶活性及MDA含量的影响 Fig. 7 Effects of short-term salinity stress on the SOD, CAT activity, and MDA content of O. melastigma 注:不同字母表示相同温度, 不同时间下SOC、CAT酶活性及MDA含量差异显著(P < 0.05), 相同字母表示差异不显著(P > 0.05); *表示不同温度, 相同时间下SOC、CAT酶活性及MDA含量的显著性差异(P < 0.05) |
温度和盐度作为鱼类生命活动的重要因子, 直接影响鱼体的生理生化以及行为活动(Sergio et al, 2013), 如对鱼类的血糖水平、血液皮质醇(余德光等, 2011; 郭勤单等, 2014)等产生影响, 进而影响其行为, 但不同个体间由于生理状况的差异, 影响的程度和方式会有差异。在本实验中, 不同温度下, 青鳉鱼摄食响应时间随温度的增加先降低后增加, 在25℃群体状态下摄食响应时间最短。而摄食量、摄食成功率、摄食效率则随温度的升高先升高(25℃时最高), 超过25℃则随着温度的进一步升高显著性降低。已有报道显示, 温度会直接影响鱼体内消化酶的活性(Silverstein et al, 2000; Gabillard et al, 2003), 温度过低时, 鱼体内的消化酶活性降低, 食欲下降导致摄食欲望降低(Luo et al, 2008); 而温度过高时, 鱼类摄食能力减弱可能是由于随着温度升高, 水中溶氧降低, 静息代谢的耗能上升, 使得鱼体用于食物消化的能量不足, 食欲减退(孙儒泳等, 1982; Jobling, 1993), 表现出摄食行为的滞缓, 摄食成功率、摄食速率、摄食量均出现降低。
其次, 由实验结果可知, 雄鱼与雌鱼的摄食行为有一定的差异性, 雄鱼在不同温度、盐度下摄食响应时间(除盐度为35时)均比雌鱼短, 这可能是由于雄性个体对于生存环境具有较强的试探性和侵略性引起(Rambo et al, 2017); 而雌鱼的摄食量、摄食速率、摄食效率等参数均大于雄鱼, 可能是由于所用青鳉鱼均为繁殖亲体, 一般繁殖期间雌鱼投入能量更多, 摄食获得能量、营养主要用于性腺的发育和产卵繁殖等(Xiu et al, 2015), 而雄鱼相对投入少, 摄食能量主要用于运动。此外, 在所有盐度处理组中雌鱼的摄食量均大于雄鱼。鱼体摄食量的大小与鱼体体重、转化率和代谢率有关(Meyer et al, 2016), 雌鱼摄食量大的原因可能是与其繁殖期有关(Xiu et al, 2015)。盐度15、25、35时雌鱼的摄食速率与摄食效率比雄鱼快。总体看, 雄性个体较雌性所适应的盐度范围窄。
与其他鱼类一样, 青鳉鱼在群体状态下的游动行为及摄食行为活跃度要高于单只状态下。Hergenrader等(1967)的试验得出, 黄鲈(yellow perch)单独个体游泳速度仅为其群体游泳速度的一半。Foster等(2004)认为, 当鱼类生存环境具有竞争性, 食物有限, 生存空间受到限制时, 鱼群紧张状态提升, 活跃度增强, 能量消耗增大。Mork等(1999)则发现大西洋鲑(Salmo salar L.)在群体状态比单只状态下对环境适应性更强, 紧张状态放松, 从而表现出对食物更加敏感, 摄食行为更加活跃。还有报道认为鱼类集群时体内的胆碱与嘌呤含量会升高, 能进一步促进鱼类摄食(Bisazza et al, 2014; Canzian et al, 2017)。
3.2 温度和盐度胁迫对鱼体抗氧化的影响鱼体为应对水环境的变化, 会产生不同程度的应激反应, 引发机体一系列生理变化进而影响内环境的稳定。温度变化可以影响鱼类新陈代谢等生理活动, 盐度通过渗透压调节影响机体的各项生理机能(De Azevedo et al, 2015; Lee et al, 2018)。温度、盐度的骤变会使得鱼体产生多余的自由基, 可能导致正常细胞和组织损坏, 而生物体内的抗氧化防御体系, 可以护机体免受氧化伤害, 并与体产生的活性氧物质之间达到一种平衡的状态, 维持细胞和机体正常生理活动(Mourente et al, 2002; 刘峰等, 2016; 崔前进等, 2017)。SOD和CAT是鱼体抗氧化防御系统的重要组成部分, SOD将环境胁迫产生的有毒代谢物转化为H2O2, 而CAT一步将H2O2彻底清除, 分解为H2O和O2, 维持细胞和机体的正常生理活动(尹飞等, 2011)。MDA是常用的膜脂过氧化指标, MDA含量过高会引起蛋白质、核酸等生命大分子的交联聚合, 且具有细胞毒性。肝脏中的脂质过氧化产物MDA含量会随着胁迫加强而升高(王奇等, 2010)。因此, 通过MDA含量多少来间接判断机体受到自由基损伤的程度, 结合SOD、CAT活性和MDA含量更能说明机体的抗氧化能力。
本实验中, 温度为15℃、31℃时鱼体内SOD、CAT酶活性在处理1天后均显著性升高, 显著性高于25℃对照组(P < 0.05), 并且两种酶的酶活性随时间变化趋势相似, 推测这是由于二者在功能上的具有协同性导致(Livingstone, 2001)。MDA含量在第4天最高, SOD、CAT酶活性第4天、第7天开始恢复(P < 0.05)。这表明环境温度偏离25℃时, 鱼体的呼吸频率与耗氧量升高、细胞受胁迫程度增加以及代谢活动升高, 因此抗氧化酶SOD及CAT活性和MDA含量升高, 发挥有效功能, 维持细胞正常的代谢活动(郭黎等, 2012; 廖雅丽等, 2016)。随着对温度适应时间的增长, 机体逐渐适应环境, 酶活性逐渐恢复。而温度为31℃时处理第7天, SOD酶活性显著性低于25℃对照组, 说明31℃已经超过适温范围, 可能过度高温下长时间胁迫导致机体代谢紊乱抑制抗氧化酶的活性(刘峰等, 2016)。因此, 温度越适宜, 鱼体酶活性稳定, 用于抗胁迫所消耗能量越少, 生长速度越快。盐度对SOD、CAT酶活性和MDA含量的影响程度较温度要低, 不同盐度下胁迫第4天出现显著变化。盐度为5和35时鱼体SOD和CAT酶活性和MDA含量显著高于盐度为25时。MDA含量受到低盐、高盐胁迫变化明显, 推测可能是由于盐度胁迫下, 鱼体为维持渗透压平衡消耗额外能量产生活性氧自由基将脂质氧化, 导致MDA含量增多。当第7天SOD、CAT酶活性增加时, MDA含量开始下降(张晨捷等, 2015; 王海亮等, 2016)。
4 结论综上所述, 海洋青鳉鱼作为模式生物, 在短期温度、盐度胁迫下摄食行为及抗氧化酶活性均发生显著性改变。海洋青鳉鱼在盐度15—25, 水温25℃环境中摄食行为活跃, 用于抗氧化调节的能量较少, 生长能力旺盛。本次实验也为对其他鱼类摄食行为的观察建立了初步模型。关于青鳉摄食行为与生理生化指标变化之间的相互关系、深层机理有还待进一步深入研究。
王奇, 范灿鹏, 陈锟慈, 等. 2010. 三种磺胺类药物对罗非鱼肝脏组织中谷胱甘肽转移酶(GST)和丙二醛(MDA)的影响. 生态环境学报, 19(5): 1014-1019 DOI:10.3969/j.issn.1674-5906.2010.05.002 |
王涛, 苗亮, 李明云, 等. 2013. 突降盐度胁迫对大黄鱼(Pseudosciaena crocea)血清生理生化及鳃丝Na+/K+-ATP酶活性的影响. 海洋与湖沼, 44(2): 421-426 |
王晓杰, 连丞, 降瑞婵, 等. 2018. 海洋酸化对青鳉鱼(Oryzias melastigma)耳石形态和成分的影响. 海洋环境科学, 37(2): 168-174 |
王晓杰, 肖潇, 李超, 等. 2015. 海洋酸化对海水青鳉胚胎骨骼发育的影响. 海洋学报, 37(12): 116-122 DOI:10.3969/j.issn.0253-4193.2015.12.012 |
王海亮, 温海深, 张晓燕. 2016. 盐度胁迫对花鲈幼鱼肠道抗氧化和非特异性免疫能力的影响. 现代农业科技, (4):261-263, (4): 261-263, 269 |
尹飞, 孙鹏, 彭士明, 等. 2011. 低盐度胁迫对银鲳幼鱼肝脏抗氧化酶、鳃和肾脏ATP酶活力的影响. 应用生态学报, 22(4): 1059-1066 |
叶富良, 张健东. 2002. 鱼类生态学. 广州: 广东高等教育出版社
|
伍辛泷, 黄乾生, 方超, 等. 2012. 新兴海洋生态毒理学模式生物——海洋青鳉鱼(Oryzias melastigma). 生态毒理学报, 7(4): 345-353 |
刘峰, 刘阳阳, 楼宝, 等. 2016. 温度对小黄鱼体内抗氧化酶及消化酶活性的影响. 海洋学报, 38(12): 76-85 DOI:10.3969/j.issn.0253-4193.2016.12.008 |
孙儒泳, 张玉书. 1982. 温度对罗非鱼生长的影响. 生态学报, 2(2): 181-188 |
余德光, 杨宇晴, 王海英, 等. 2011. 盐度变化对斜带石斑鱼生理生化因子的影响. 水产学报, 35(5): 719-728 |
张春禄, 陈超, 李炎璐, 等. 2017. 盐度对条纹锯鮨(Centropristis striata)仔鱼的活力、开口、摄食的影响. 渔业科学进展, 38(2): 77-82 |
张晨捷, 张艳亮, 高权新, 等. 2015. 低盐胁迫对黄姑鱼幼鱼肝脏抗氧化功能的影响. 南方水产科学, 11(4): 59-64 DOI:10.3969/j.issn.2095-0780.2015.04.009 |
陈瑶, 方志俊, 郑金树, 等. 2010. 海洋青鳉鱼专用型基因芯片的设计及其在生态毒理学上的应用研究. 应用海洋学学报, 29(3): 359-366 DOI:10.3969/J.ISSN.1000-8160.2010.03.009 |
陈漪, 王晓杰, 冉皓宇, 等. 2016. 海水模式种青鳉鱼(Oryzias melastigma)的胚胎发育观察. 海洋与湖沼, 47(1): 71-82 |
周银环, 曹伏君, 罗杰, 等. 2017. 不同温度梯度和规格体重对大弹涂鱼(Boleophthalmus pectinirostris)耗氧率(RO)和排氨率(RN)的影响. 海洋与湖沼, 48(2): 392-397 |
柳旭东, 张利民, 王际英, 等. 2008. 盐度对水产动物体组成与组织结构的影响. 养殖与饲料, (9): 60-64 DOI:10.3969/j.issn.1671-427X.2008.09.030 |
徐革锋, 牟振波, 韩英, 等. 2015. 温度和流速对细鳞鲑(Brachymystax lenok)幼鱼游泳能力的影响及其与呼吸代谢的关系. 海洋与湖沼, 46(4): 786-792 |
郭黎, 马爱军, 王新安, 等. 2012. 盐度和温度对大菱鲆幼鱼抗氧化酶活性的影响. 大连海洋大学学报, 27(5): 422-428 DOI:10.3969/j.issn.2095-1388.2012.05.008 |
郭勤单, 王有基, 吕为群. 2014. 温度和盐度对褐牙鲆幼鱼渗透生理及抗氧化水平的影响. 水生生物学报, 38(1): 58-67 |
黄玉瑶. 1988. 青鳉的生物学特性与饲养管理技术. 动物学杂志, 23(6): 28-31 |
崔前进, 陈冰, 邱丽华, 等. 2017. 低盐胁迫对钝吻黄盖鲽幼鱼鳃Na+/K+-ATP酶、肝脏抗氧化酶和非特异免疫酶的影响. 广东海洋大学学报, (6): 26-32 DOI:10.3969/j.issn.1673-9159.2017.06.005 |
梁国栋, 王辉, 刘加慧, 等. 2014. 罗非鱼仔鱼开口率与温度、盐度间模型的建立与优化. 广东海洋大学学报, 34(4): 33-34 DOI:10.3969/j.issn.1673-9159.2014.04.006 |
廖雅丽, 张晨捷, 彭士明, 等. 2016. 盐度对云纹石斑鱼抗氧化酶及溶菌酶活性的影响. 上海海洋大学学报, 25(2): 169-176 |
Abou Anni I S, Bianchini A, Barcarolli I F et al, 2016. Salinity influence on growth, osmoregulation and energy turnover in juvenile pompano Trachinotus marginatus Cuvier 1832. Aquaculture, 455: 63-72 DOI:10.1016/j.aquaculture.2016.01.010 |
Bisazza A, Butterworth B, Piffer L et al, 2014. Collective enhancement of numerical acuity by meritocratic leadership in fish. Scientific Reports, 4: 4560 |
Canzian J, Fontana B D, Quadros V A et al, 2017. Conspecific alarm substance differently alters group behavior of zebrafish populations:Putative involvement of cholinergic and purinergic signaling in anxiety- and fear-like responses. Behavioural Brain Research, 320: 255-263 DOI:10.1016/j.bbr.2016.12.018 |
Chen X P, Li L, Wong C K et al, 2009. Rapid adaptation of molecular resources from zebrafish and medaka to develop an estuarine/marine model. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 149(4): 647-655 |
De Azevedo R V, Dos Santos-Costa K, De Oliveira K F et al, 2015. Responses of Nile tilapia to different levels of water salinity. Latin American Journal of Aquatic Research, 43(5): 828-835 |
Foster S J, Vincent A C J, 2004. Life history and ecology of seahorses:implications for conservation and management. Journal of Fish Biology, 65(1): 1-61 |
Gabillard J C, Weil C, Rescan P Y et al, 2003. Effects of environmental temperature on IGF1, IGF2, and IGF type I receptor expression in rainbow trout (Oncorhynchus mykiss). General and Comparative Endocrinology, 133(2): 233-242 DOI:10.1016/S0016-6480(03)00167-9 |
Handeland S O, Berge, Bj rnsson B T et al, 2000. Seawater adaptation by out-of-season Atlantic salmon (Salmo salar L. ) smolts at different temperatures. Aquaculture, 181(3-4): 377-396 |
Handeland S O, Imsland A K, Stefansson S O, 2008. The effect of temperature and fish size on growth, feed intake, food conversion efficiency and stomach evacuation rate of Atlantic salmon post-smolts. Aquaculture, 283(1-4): 36-42 DOI:10.1016/j.aquaculture.2008.06.042 |
Hergenrader G L, Hasler A D, 1967. Seasonal changes in swimming rates of Yellow Perch in lake Mendota as measured by sonar. Transactions of the American Fisheries Society, 96(4): 373-382 DOI:10.1577/1548-8659(1967)96[373:SCISRO]2.0.CO;2 |
Huang Z H, Ma A J, Wang X A et al, 2015. Interaction of temperature and salinity on the expression of immunity factors in different tissues of juvenile turbot Scophthalmus maximus based on response surface methodology. Chinese Journal of Oceanology and Limnology, 33(1): 28-36 DOI:10.1007/s00343-015-4016-y |
Jain K E, Farrell A P, 2003. Influence of seasonal temperature on the repeat swimming performance of rainbow trout Oncorhynchus mykiss. Journal of Experimental Biology, 206: 3569-3579 DOI:10.1242/jeb.00588 |
Jobling M, 1993. Bioenergetics: Feed intake and energy partitioning. In: Rankin J C, Jensen F B eds. Fish Ecophysiology. Dordrecht: Springer
|
Keen J E, Farrell A P, 1994. Maximum prolonged swimming speed and maximum cardiac performance of rainbow trout, Oncorhynchus mykiss, acclimated to two different water temperatures. Comparative Biochemistry and Physiology Part A:Physiology, 108(2-3): 287-295 DOI:10.1016/0300-9629(94)90097-3 |
Kinoshita M, Murata K, Naruse K et al, 2009. Medaka: Biology, Management, and Experimental Protocols. Iowa City, IA, Iowa, USA: Wiley-Blackwell, 9-11, 23-24
|
Lee H B, Kim D S, Gil H W et al, 2018. Pysiological responses of diploid and triploid far eastern catfish, Silurus asotus to water temperature stress. Development & Reproduction, 22(2): 165-174 |
Livingstone D R, 2001. Contaminant-stimulated reactive oxygen species production and oxidative damage in aquatic organisms. Marine Pollution Bulletin, 42(8): 656-666 DOI:10.1016/S0025-326X(01)00060-1 |
Luo Y P, Xie X J, 2008. Effects of temperature on the specific dynamic action of the southern catfish, Silurus meridionalis. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 149(2): 150-156 |
Meyer H A, Chipps S R, Graeb B D S et al, 2016. Growth, food consumption, and energy status of juvenile pallid sturgeon fed natural or artificial diets. Journal of Fish and Wildlife Management, 7(2): 389-396 |
Mork O I, Bjerkeng B, Rye M, 1999. Aggressive interactions in pure and mixed groups of juvenile farmed and hatchery-reared wild Atlantic salmon Salmo salar L. in relation to tank substrate. Aquaculture Research, 30(8): 571-578 |
Mourente G, Díaz-Salvago E, Bell J G et al, 2002. Increased activities of hepatic antioxidant defence enzymes in juvenile gilthead sea bream (Sparus aurata L. ) fed dietary oxidised oil:attenuation by dietary vitamin E. Aquaculture, 214(1-4): 343-361 |
Rambo C L, Mocelin R, Marcon M et al, 2017. Gender differences in aggression and cortisol levels in zebra fish subjected to unpredictable chronic stress. Physiology and Behavior, 171: 50-54 DOI:10.1016/j.physbeh.2016.12.032 |
Rome L C, Funke R P, Alexander R M, 1990. The influence of temperature on muscle velocity and sustained performance in swimming carp. Journal of Experimental Biology, 154: 163-178 |
Russell N R, Fish J D, Wootton R J, 1996. Feeding and growth of juvenile sea bass:the effect of ration and temperature on growth rate and efficiency. Journal of Fish Biology, 49(2): 206-220 DOI:10.1111/jfb.1996.49.issue-2 |
Sergio C V, Jesús T P P, Gerónimo R C et al, 2013. Effects of temperature and salinity on growth and survival of the Pacific red snapper Lutjanus peru (Pisces:Lutjanidae) juvenile. Latin American Journal of Aquatic Research, 41(5): 1013-1018 DOI:10.3856/vol41-issue5-fulltext-22 |
Silverstein J T, Wolters W R, Shimizu M et al, 2000. Bovine growth hormone treatment of channel catfish:strain and temperature effects on growth, plasma IGF-I levels, feed intake and efficiency and body composition. Aquaculture, 190(1-2): 77-88 DOI:10.1016/S0044-8486(00)00387-2 |
Xiu M, Pan L Q, Jin Q et al, 2015. Gender differences in detoxification metabolism of polycyclic aromatic hydrocarbon (chrysene) in scallop Chlamys farreri during the reproduction period. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 170: 50-59 |
Zhou C, Zhang B H, Lin K et al, 2017. Near-infrared imaging to quantify the feeding behavior of fish in aquaculture. Computers and Electronics in Agriculture, 135: 233-241 DOI:10.1016/j.compag.2017.02.013 |
 2019, Vol. 50
2019, Vol. 50


