
中国海洋湖沼学会主办。
文章信息
- 闫茂仓, 王瑶华, 胡利华, 张炯明, 刘亚南, 唐明, 罗奎, 黄贤克, 周前进, 陈炯. 2019.
- YAN Mao-Cang, WANG Yao-Hua, HU Li-Hua, ZHANG Jiong-Ming, LIU Ya-Nan, TANG Ming, LUO Kui, HUANG Xian-Ke, ZHOU Qian-Jin, CHEN Jiong. 2019.
- 副溶血弧菌特异性卵黄抗体(AHPND-VpIgY)对凡纳滨对虾幼体被动免疫和育苗成活率的影响
- EFFECT OF SPECIFIC ANTI-VIBRIO PARAHAEMOLYTICUS IgY ON PASSIVE IMMUNOLOGY AND SURVIVAL RATE OF LITOPENAEUS VANNAMEI LARVAL
- 海洋与湖沼, 50(2): 443-448
- Oceanologia et Limnologia Sinica, 50(2): 443-448.
- http://dx.doi.org/10.11693/hyhz20181200303
-
文章历史
- 收稿日期:2018-12-25
- 收修改稿日期:2019-01-19
2. 浙江省海洋水产养殖研究所 浙江省近岸水域生物资源开发与保护重点实验室 温州 325005;
3. 应用海洋生物技术教育部重点实验室 宁波 315832
2. Zhejiang Key Laboratory of Exploitation and Preservation of Coastal Bio-resource, Zhejiang Mariculture Research Institute, Wenzhou 325005, China;
3. Key Laboratory of Applied Marine Biotechnology of Ministry of Education, Ningbo 315832, China
凡纳滨对虾(Litopenaeus vannamei)俗称南美白对虾, 是一种在全球范围内养殖的品种(Bailey et al, 1992), 具有环境适应性强、海水淡水均可养殖、养殖产量高、周期短、市场需求量大、价格较稳定的优点, 是我国水产养殖主导产业。近年来由于凡纳滨对虾养殖过程中苗种投放量超过了环境容纳量、环境恶化等原因, 全球该虾养殖发生了新的病害危机, 包括中国在内的全球对虾主要养殖国家都出现大面积受损的情况, 导致这场危机的重要原因是凡纳滨对虾急性肝胰腺坏死症的暴发(Tran et al, 2013; Kondo et al, 2015; Soto-Rodriguez et al, 2015;唐小千等, 2016), 经常规生化和分子鉴定确定其主要病原之一为高致病性副溶血弧菌(Vibrio parahaemolyticus) (Tran et al, 2014)。
国内外学者已开展了凡纳滨对虾急性肝胰腺坏死症的防控技术研究, 业界也一直探索绿色健康的防控方法。卵黄抗体(Immunoglobulin of yolk, IgY)作为一种免疫球蛋白, 是近年来新兴的抗体治疗研究方向, 已有大量报道可利用特异性卵黄抗体预防和治疗疾病。在水产方面也有报道, 并表现出了较好的被动免疫保护效果。Xu等(2019)利用IgY预防刺参(Apostichopus japonicus)海洋产电菌(Shewanella marisflavi); Yi等(2018)报道了卵黄抗体可促进赤点石斑鱼(Epinephelus akaara)抵抗神经坏死病毒的感染; Gao等(2017)报道了抗non-O1霍乱弧菌(Vibrio cholerae)卵黄抗体可防控霍乱弧菌的感染; Li等(2014)报道了卵黄抗体可有效防控香鱼(Plecoglossus altivelis)的鳗弧菌(V. anguilarum); Hatta等(1994)利用卵黄抗体防控迟缓爱德华菌(Edwardsiella tarda)。这些研究都是针对养殖阶段的, 而在育苗阶段的应用还未见报道。凡纳滨对虾在5—8月份的育苗成活率低于2—4月份, 特别是溞状Ⅱ期淘汰特别严重, 主要原因在于水体中微生物数量增多、空气质量下降、环境恶化, 主要病原包括副溶血弧菌、哈维氏弧菌(V. harveyi)、欧文斯弧菌(V. owensii)和坎贝氏弧菌(V. campbellii)等。本研究采用抗高致病性副溶血弧菌特异性卵黄抗体应用于育苗水体, 直接作为凡纳滨对虾幼体的饵料, 以提高凡纳滨对虾幼体对有害微生物的抵抗力, 达到有效预防疾病、提高育苗成活率的目的。
1 材料与方法 1.1 实验材料高致病性副溶血弧菌W4为本实验室分离、鉴定并保存。SPF海兰蛋鸡来源于山东农业大学动物实验中心。育苗用凡纳滨对虾(Litopenaeus vannamei)幼体来源于浙江省海洋水产养殖研究所清江试验场, 整个实验在该场同一幢温室中进行。
1.2 副溶血弧菌灭活疫苗的制备副溶血弧菌菌株接种于Zobell 2216E液体培养基, 28℃培养过夜, 甲醛灭活24h, 用TCBS培养基检测灭活效果。确认彻底灭活后, 离心收集菌体, 无菌生理盐水洗3次, 调节浓度为108 cells/mL, 加入等体积的弗氏完全佐剂或弗氏不完全佐剂, 充分乳化后制成全菌灭活疫苗, 1500r/min离心5min, 没有分层, 表明疫苗乳化彻底, 室温保存。
1.3 蛋鸡的免疫健康SPF海兰蛋鸡随机分成2个组, 每组1000只。免疫组注射灭活疫苗, 对照组注射无菌生理盐水。免疫采取胸、颈、翼下多点皮下免疫接种, 首次免疫注射含弗氏完全佐剂的抗原, 剂量为每只注射1.0mL。10d后第1次加强免疫, 每只注射1.5mL, 第1次加强免疫注射含弗氏不完全佐剂的疫苗; 20d后进行第2次加强免疫, 每只注射2.0mL, 第2次加强免疫注射; 不含佐剂的灭活疫苗; 第2次加强免疫后1周开始收集鸡蛋。
1.4 卵黄抗体的制备第2次加强免疫后1周, 通过ELISA检测抗体滴度, 抗体滴度达到1:20000以上开始收集鸡蛋, 免疫组和对照组各收集5000枚。将鸡蛋打破, 倒入收集盘, 用矿泉水瓶吸入蛋黄, 留下蛋清。收集的蛋黄液用0.65%无菌生理盐水1︰1稀释后, 放入冷冻干燥机进行冷冻干燥。冷冻干燥48h后, 将冻干的蛋黄块取出, 用粉碎机将其粉碎、包装, 获得卵黄抗体粉。免疫组获得的蛋黄粉为特异性卵黄抗体。对照组获得的蛋黄粉为非特异性卵黄抗体。
1.5 实验设计与分组实验分为4个组, 每组设3个平行, 2个处理组为投喂0.1g/m3和0.2g/m3特异性IgY蛋黄粉, 1个对照组投喂0.2g/m3非特异性IgY蛋黄粉, 1个空白对照组不投喂蛋黄粉。实验在同一幢温室12个20m3水泥池中进行, 每个水泥池投放无节幼体300万尾, 即密度均为15万尾/m3。整个实验进行12d, 其中溞状幼体期5d, 糠虾期3d, 仔虾至仔虾4期(P4期)4d。实验开始后, 每2d采集水样1次, 测定氨氮和亚硝酸盐。细菌总数、弧菌总数和相对保护率取样时间点为每个阶段变态前, 即第5天(溞状Ⅲ期)、第8天(糠虾Ⅲ期)和第12天(P4期)。在第5天、第8天和第12天测定水泥池中细菌总数和弧菌总数。人工感染测定相对保护率实验在5L烧杯中进行, 待水泥池中凡纳滨对虾发育到第5天(溞状Ⅲ期)、第8天(糠虾Ⅲ期)和第12天(P4期), 从每个水泥池中取样进行人工感染, 测定对高致病性副溶血弧菌的相对保护率。实验结束时, 统计各水泥池育苗成活率。
1.6 相对保护率的测定在溞状Ⅲ期、糠虾Ⅲ期和P4期(第5、8和12天), 每个平行组取样1000尾, 在5 L烧杯中进行人工感染实验, 攻毒量为105cells/mL, 浸泡时间为24h;另在空白对照组取1000尾, 不进行人工感染作为攻毒对照。24h后统计成活率。实验结束后计算相对保护率(Relative percentage of survival, RPS):
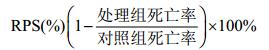
实验结束时, 即凡纳滨对虾幼体全部发育至P4期, 翻池统计每个育苗池数量, 计算育苗成活率。
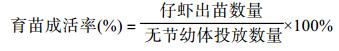
采用Excel 2010和STATISTICA 7.0软件对实验数据进行整理和单因素方差分析, 组间差异采用Duncan’s方法进行多重比较, 显著水平为0.05。
2 结果与分析 2.1 卵黄抗体对育苗期水质的影响投喂抗高致病性副溶血弧菌卵黄抗体对凡纳滨对虾育苗期间的水质影响不显著, 整个育苗期间, 投喂抗高致病性副溶血弧菌卵黄抗体组的氨氮和亚硝酸盐与对照组无显著差异(P > 0.05)。随着育苗时间的推移, 各组育苗水体氨氮和亚硝酸盐均逐步升高(图 1和图 2)。整个育苗期间氨氮0.04—0.543mg/L, 亚硝酸盐0.030—0.162mg/L。其中, 溞状期(第2天和第4天)和糠虾期(第6天和第8天)的氨氮变化较缓慢, 从糠虾期(第8天)进入仔虾期后(第10天)氨氮和亚硝酸盐急剧升高。
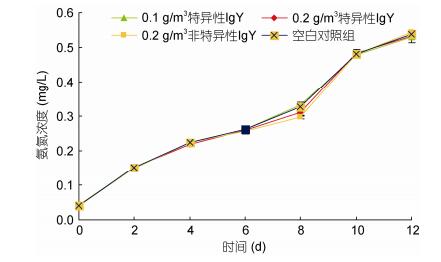 |
| 图 1 育苗期间氨氮变化情况 Fig. 1 Ammonia nitrogen transformation during seedling cultivation |
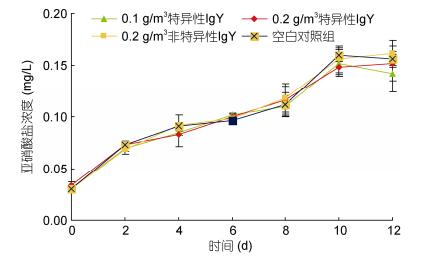 |
| 图 2 育苗期间亚硝酸盐变化情况 Fig. 2 Nitrite transformation during seedling cultivation |
投喂卵黄抗体对凡纳滨对虾育苗期间水体中的细菌总数和弧菌总数影响不显著, 与对照组相比无显著差异(P > 0.05)(图 3和图 4)。随着育苗时间的推移, 各组育苗水体细菌总数和弧菌总数不断升高。溞状末期细菌总数为3.45×104—3.74×104 cells/mL, 弧菌总数2.15×102—2.40×102 cells/mL; 糠虾末期细菌总数为4.24×104—4.72×104 cells/mL, 弧菌总数5.15×102—5.33×102 cells/mL; 仔虾4期, 细菌总数为6.02×104—6.42×104 cells/mL, 弧菌总数6.39×102—6.76×102 cells/mL。
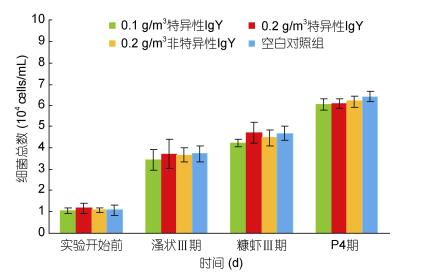 |
| 图 3 不同变态期的细菌总数 Fig. 3 The total bacterial count in different metamorphoses |
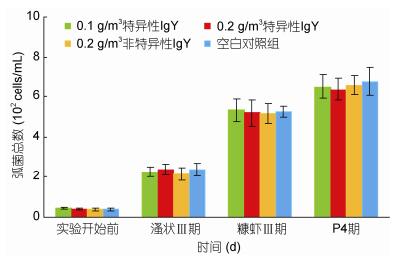 |
| 图 4 不同变态期的弧菌总数 Fig. 4 The total vibrio count in different metamorphoses |
人工感染实验结果表明(图 5和图 6), 连续投喂抗副溶血弧菌卵黄抗体可提高凡纳滨对虾对高致病性副溶血弧菌的抗病力。实验条件下, 投喂特异性IgY组的存活率、相对保护率显著高于投喂非特异性IgY和空白对照组(P < 0.05)。溞状Ⅲ期, 0.1g/m3特异性IgY组和0.2g/m3特异性IgY组的存活率分别为46.9%和49.7%, 对照组仅为24.3%; 0.1g/m3特异性IgY组和0.2g/m3特异性IgY组的相对保护率为30.0%和33.6%。糠虾Ⅲ期, 0.1g/m3特异性IgY组和0.2g/m3特异性IgY组的存活率分别为50.4%和50.5%, 对照组仅为27.7%; 0.1g/m3特异性IgY组和0.2g/m3特异性IgY组的相对保护率为31.4%和44.0%。仔虾P4期, 0.1g/m3特异性IgY组和0.2g/m3特异性IgY组的存活率分别为53.9%和69.3%, 对照组仅为28.3%; 0.1g/m3特异性IgY组和0.2g/m3特异性IgY组的相对保护率为35.7%和57.2%。仔虾P4期0.2g/m3特异性IgY组存活率显著优于0.1g/m3特异性IgY组(P < 0.05), 在溞状Ⅲ期和糠虾Ⅲ期无显著差异(P > 0.05)。
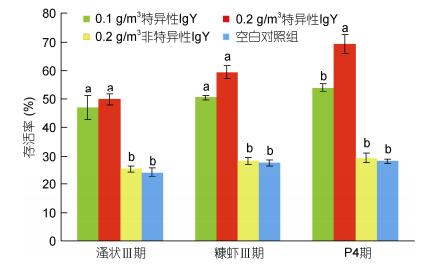 |
| 图 5 人工感染条件下不同处理的存活率 Fig. 5 Survival rate of different treatments in artificial infection 注:柱上方字母不同代表有显著差异(P < 0.05);相同则无显著差异性(P > 0.05) |
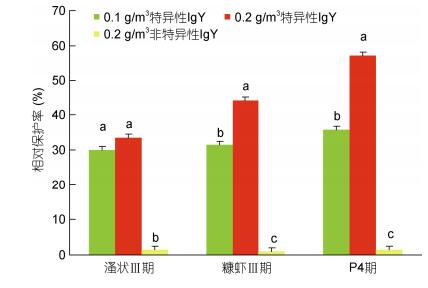 |
| 图 6 不同处理的相对保护率比较 Fig. 6 Comparison in the relative protection rates in different treatments 注:柱上方字母不同代表有显著差异(P < 0.05);相同则无显著差异性(P > 0.05) |
连续投喂抗副溶血弧菌卵黄抗体能显著提高凡纳滨对虾的育苗成活率, 投喂0.1g/m3和0.2g/m3抗副溶血弧菌特异性IgY的育苗成功率显著高于空白对照组和投喂非特异性卵黄抗体组(P < 0.05), 投喂0.1g/m3和0.2g/m3特异性卵黄抗体组的育苗池, 300万无节幼体可育出P4仔虾152.3万尾和171.7万尾, 育苗成活率分别可达到50.8%和57.2%, 比空白对照组提高19.1%和25.6%, 效果显著(图 7)。
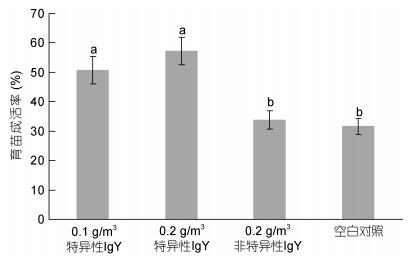 |
| 图 7 不同处理条件下凡纳滨对虾育苗成活率 Fig. 7 The seedling survival rate of different treatments 注:柱上方字母不同代表有显著差异(P < 0.05);相同则无显著差异性(P > 0.05) |
卵黄抗体作为一种新兴的抗体治疗手段, 国内外已有大量报道可用来预防和治疗疾病, 在水产动物疾病防控方面也得到了广泛的应用(Hatta et al, 1993a, 1993b, 1994; Lee et al, 2002;陈强等, 2001; Shin et al, 2003; Kim et al, 2004;庄政, 2008; Winkelbach et al, 2017; Eto et al, 2018; Kumaran et al, 2018; Qin et al, 2018)。Li等(2014)发现抗鳗弧菌IgY能减少香鱼体内的细菌量, 提高非特异性免疫因子活性。Gao等(2017)报道了特异性抗non-O1霍乱弧菌(Vibrio cholerae)卵黄抗体有显著的抑菌作用, 可提高相对免疫保护率。Yi等(2018)发现特异性卵黄抗体能够有效识别神经坏死病毒(Nervous necrosis virus, NNV), 中和并完全抑制NNV在石斑鱼鳍细胞系(GF-1)中的复制, 提高赤点石斑鱼(Epinephelus akaara)抵抗病毒感染的能力。王斌等(2006)等发现口服抗迟缓爱德华菌卵黄抗体对大菱鲆(Scophthalmus maximus)的免疫保护率为83.3%, 而通过注射方式没有免疫保护效果。朱香萍等(2008)制备了斑节对虾(Penaeus monodon)鳗弧菌卵黄抗体, 口服免疫后, 在斑节对虾的直肠、血淋巴、肝胰脏中均可检测到卵黄抗体, 在体内可持续12—24h, 提高了相对免疫保护率。本研究将抗高致病性副溶血弧菌特异性卵黄抗体应用于凡纳滨对虾人工育苗, 结果表明特异性卵黄抗体对凡纳滨对虾的早期发育具有良好的免疫保护效果, 投喂方式可以将仔虾的存活率和相对保护率提高到69.3%和57.2% (0.2g/m3), 却不影响水质条件。仔虾期0.2g/m3特异性卵黄抗体组存活率优于0.1g/m3特异性卵黄抗体组, 但在溞状期和糠虾期无显著差异(P > 0.05)。本研究首次探索性的将特异性卵黄抗体应用于对虾的苗种繁育, 为水产动物苗种繁育阶段病害的绿色防控开辟了新途径。
3.2 抗副溶血弧菌卵黄抗体对凡纳滨对虾育苗成活率的影响国内外已有文献报道, 特异性卵黄抗体可有效提高水产养殖动物的养殖成功率。Gutierrez等(1993)和Hatta等(1994)认为抗迟缓爱德华菌特异性卵黄抗体可有效防治日本鳗鲡(Anguilla japonica)的迟缓爱德华菌, 降低养殖死亡率。Arasteh等(2004)发现口服抗鳗弧菌卵黄抗体15d可显著增强虹鳟(Oncorhynchus mykiss)对鳗弧菌的抵抗力, 提高虹鳟养殖的成活率。朱香萍等(2008)的结果表明口服抗鳗弧菌卵黄抗体可提高斑节对虾的存活率。上述结果阐述了特异性卵黄抗体对水产动物养成阶段养殖成活率的影响, 至今未见卵黄抗体对水产动物育苗期间的育苗成活率影响的报道。本研究将抗高致病性副溶血弧菌特异性卵黄抗体应用于凡纳滨对虾育苗, 统计了仔虾P4期的育苗成活率。结果表明, 在不影响水质的前提下, 投喂特异性IgY可有效提高凡纳滨对虾育苗成活率。投喂0.1g/m3和0.2g/m3特异性IgY分别将育苗成活率提高到了50.8%和57.2%, 在对虾育苗阶段显示出巨大的应用潜力。
4 结论本研究评价了抗副溶血弧菌特异性卵黄抗体对育苗期凡纳滨对虾幼体的免疫保护效果, 证实抗副溶血弧菌特异性卵黄抗体可显著提高凡纳滨对虾幼体的存活率、相对保护率和育苗成活率。0.2g/m3特异性卵黄抗体组仔虾相对保护率57.1%, 育苗成活率57.2%, 育苗成活率比对照组提高25.6%。因此, 特异性卵黄抗体作为一种有效的生物制剂, 应用于凡纳滨对虾的苗种繁育。
王斌, 刘永波, 刘双凤, 等. 2006. 鸡抗迟缓爱德华氏菌卵黄抗体的应用研究. 大连海洋大学学报, 21(3): 203-206 DOI:10.3969/j.issn.1000-9957.2006.03.002 |
朱香萍, 张再生, 刘宗柱. 2008. 对虾鳗弧菌卵黄抗体(IgY)的制备及其对人工感染的保护研究. 海洋科学, 32(2): 25-28 |
庄政, 2008.嗜水气单胞菌亚单位成分卵黄抗体在鳗鲡养殖中应用.福州: 福建农林大学硕士学位论文
|
陈强, 周建武, 饶平凡, 等. 2001. 卵黄抗体在防治中华鳖气单胞菌病中的应用. 福州大学学报(自然科学版), 29(5): 115-118, 126 DOI:10.3969/j.issn.1000-2243.2001.05.030 |
唐小千, 徐洪森, 战文斌. 2016. 对虾急性肝胰腺坏死综合症研究进展. 海洋湖沼通报, (2): 90-93 |
Arasteh N, Aminirissehei A H, Yousif A N et al, 2004. Passive immunization of rainbow trout (Oncorhynchus mykiss) with chicken egg yolk immunoglobulins (IgY). Aquaculture, 231(1-4): 23-36 DOI:10.1016/j.aquaculture.2003.11.004 |
Bailey J H, Moss M S, 1992. Penaeid taxonomy, biology and zoogeography. In: Fast A W, Lester L J eds. Marine Shrimp Culture. The Netherlands: Elsevier Science Publishers, 9-73
|
Eto S F, Fernandes D C, Moraes A C et al, 2018. Validation of IgY for the diagnosis of Streptococcus agalactiae-caused endocarditis and bacterial meningitis in Nile tilapia (Oreochromis niloticus). Fish & Shellfish Immunology, 76: 153-160 |
Gao X J, Chen N, Zhang Y et al, 2017. Non-O1 Vibrio cholerae pathogen from Cyprinus carpio and control with anti-non-O1 V. cholerae egg yolk powder (IgY). Aquaculture, 479: 69-74 DOI:10.1016/j.aquaculture.2017.05.015 |
Gutierrez M, Miyazaki A, Hatta T et al, 1993. Protective properties of egg yolk IgY containing anti-Edwardsiella tarda antibody against paracolo disease in the Japanese eel, Anguilla japonica Temminck & Schlegel. Journal of Fish Diseases, 16(2): 113-122 DOI:10.1111/jfd.1993.16.issue-2 |
Hatta H, Tsuda K, Akachi S et al, 1993a. Productivity and some properties of egg yolk antibody (IgY) against human rotavirus compared with rabbit IgG. Bioscience Biotechnology and Biochemistry, 53(3): 450-454 |
Hatta H, Tsuda K, Akachi S et al, 1993b. Oral passive immunization effect of anti-human rotavirus IgY and its behavior against proteolytic enzymes. Bioscience Biotechnology and Biochemistry, 57(7): 1077-1081 DOI:10.1271/bbb.57.1077 |
Hatta H, Mabe K, Kim M et al, 1994. Prevention of fish disease using egg yolk antibody. In: Sim J S, Nakai S eds. Egg Uses and Processing Technologies. Wallingford: CAB International
|
Kim D K, Jang I K, Seo H C et al, 2004. Shrimp protected from WSSV disease by treatment with egg yolk antibodies (IgY) against a truncated fusion protein derived from WSSV. Aquaculture, 237(1-4): 21-30 DOI:10.1016/j.aquaculture.2004.03.015 |
Kondo H, Van P T, Dang L T et al, 2015. Draft genome sequence of non-Vibrio parahaemolyticus acute hepatopancreatic necrosis disease strain KC13.17.5. isolated from diseased shrimp in Vietnam. Genome Announcements, 3(5): e00978-15 |
Kumaran T, Thirumalaikumar E, Lelin C et al, 2018. Physicochemical properties of anti Vibrio harveyi egg yolk antibody (IgY) and its immunological influence in Indian white shrimp Fenneropenaeus indicus. Fish & Shellfish Immunology, 74: 349-362 |
Lee E N, Sunwoo H H, Menninen K et al, 2002. In vitro studies of chicken egg yolk antibody (IgY) against Salmonella enteritidis and Salmonella typhimurium. Poultry Science, 81(5): 632-641 DOI:10.1093/ps/81.5.632 |
Li C H, Lu X J, Li D F et al, 2014. Passive protective effect of chicken egg yolk immunoglobulins against experimental Vibrio anguillarum infection in ayu (Plecoglossus altivelis). Fish & Shellfish Immunology, 37(1): 108-114 |
Qin Z D, Babu V S, Li N Q et al, 2018. Protective effects of chicken egg yolk immunoglobulins (IgY) against experimental Aeromonas hydrophila infection in blunt snout bream (Megalobrama amblycephala). Fish & Shellfish Immunology, 78: 26-34 |
Shin J H, Nam S W, Kim J T et al, 2013. Identification of immunodominant Helicobacter pylori proteins with reactivity to H. pylori-specific egg-yolk immunoglobulin. Journal of Medical Microbiology, 52(3): 217-222 |
Soto-Rodriguez S A, Gomez-Gil B, Lozano-Olvera R et al, 2015. Field and experimental evidence of Vibrio parahaemolyticus as the causative agent of acute hepatopancreatic necrosis disease of cultured shrimp (Litopenaeus vannamei) in northwestern Mexico. Applied and Environmental Microbiology, 81(5): 1689-1699 DOI:10.1128/AEM.03610-14 |
Tran L, Nunan L, Redman R M et al, 2013. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp. Diseases of Aquatic Organisms, 105(1): 45-55 DOI:10.3354/dao02621 |
Tran L H, Fitzsimmons K, Lightner D V, 2014. Ecological approaches in controlling the acute hepatopancreatic necrosis disease. In: The Ninth Symposium on Diseases in Asian Aquaculture. Vietnam: Ho Chi Minh City
|
Winkelbach A, Wuertz S, Schade R et al, 2017. Effects of oral passive immunization against somatostatin-14 on growth performance, body composition and IgY delivery in rainbow trout (Oncorhynchus mykiss) and common carp (Cyprinus carpio). Aquaculture Nutrition, 23(2): 387-396 DOI:10.1111/anu.12404 |
Xu L, Xu Y P, He L Y et al, 2019. Immunomodulatory effects of chicken egg yolk antibodies (IgY) against experimental Shewanella marisflavi AP629 infections in sea cucumbers (Apostichopus japonicus). Fish & Shellfish Immunology, 84: 108-119 |
Yi L Z, Qin Z D, Lin H Z et al, 2018. Features of chicken egg yolk immunoglobulin (IgY) against the infection of red-spotted grouper nervous necrosis virus. Fish & Shellfish Immunology, 80: 534-539 |
 2019, Vol. 50
2019, Vol. 50


