
中国海洋湖沼学会主办。
文章信息
- 俞志明, 陈楠生. 2019.
- YU Zhi-Ming, CHEN Nan-Sheng. 2019.
- 国内外赤潮的发展趋势与研究热点
- EMERGING TRENDS IN RED TIDE AND MAJOR RESEARCH PROGRESSES
- 海洋与湖沼, 50(3): 474-486
- Oceanologia et Limnologia Sinica, 50(3): 474-486.
- http://dx.doi.org/10.11693/hyhz20190200041
文章历史
-
收稿日期:2019-02-25
收修改稿日期:2019-03-29
2. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室 青岛 266071;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
从科学上讲, 赤潮是由于海洋中微型浮游生物快速增殖、聚集, 导致生态系统结构与功能破坏的一种生态异常现象。由于这种现象常常伴随着海水颜色的改变, 以红色为常见, 故称之为赤潮。实际上, 这种海水颜色的改变与赤潮生物的颜色、密度等因素有关, 所以通常我们所说的赤潮并非都是红色。为了更科学地描述这一生态异常现象, 目前国际上更多称其为有害藻华(Harmful Algal Blooms, HABs)(Berdalet et al, 2017)。有害藻华包括了各种藻华现象, 如海水、淡水、大型藻、微型藻以及浮游和底栖藻等, 本文中的赤潮主要指那些发生在海水中由微型藻形成的有害藻华。
1 国内外赤潮发生的新特点作为一种海洋生态系统中的异常现象, 赤潮自古有之。据记载, 最早描述海洋中赤潮现象是出自于圣经中的《出埃及记(7: 20, 21)》, 将赤潮描绘为古埃及的一种灾难。进入17世纪, 赤潮现象越来越多地被科学记载和描述:例如1828年发生在秘鲁沿岸的赤潮导致大量海鸟死亡(Rojas de Mendiola, 1979); 1832年Darwin(1839)在智利近海发现的红色中缢虫(Mesodinium rubrum)赤潮现象等等。由此可见, 赤潮是一种海洋中存在已久的自然现象, 如同人体的免疫功能, 是海洋生态系统自我调整的一种方法。但是, 进入20世纪, 随着人类社会的发展、人类活动对环境影响的增加, 导致赤潮发生的原因发生了根本的变化, 已从海洋生态系统一种自我调整的正常自然现象, 演变为在人类活动胁迫下、频繁发生的异常生态灾害(图 1)。特别是近年来, 在全球变化的大背景下, 赤潮灾害遍布全球, 呈现愈演愈烈的态势, 已经成为制约近海经济发展、威胁人类食品安全、破坏海洋生态系统的典型海洋生态灾害(图 2)。
 |
| 图 1 1830—2017年中国近海赤潮记录次数(Ho et al, 1991; 周名江等, 2001; 国家海洋局, 1989—2017) Fig. 1 Number of red tide records in China offshore waters from 1830 to 2017 |
 |
| 图 2 1970年到2005年麻痹性贝类毒素(PSP)分布在全球扩展情况(Anderson, 2009) Fig. 2 The global expansion in the distribution of PSP toxins during1970—2005 (Anderson, 2009) |
例如, 2015年北起美国北部的阿拉斯加、南至墨西哥沿岸暴发了前所未有的大规模拟菱形藻赤潮, 海水中的神经性毒素软骨藻酸(Domoic acid)突破历史记录, 导致美国政府长时间禁止商业捕捞太平洋大竹蛏(Pacific razor clam)、太平洋黄道蟹(Rock crab)、珍宝蟹(Dungeness crab)等海洋生物(McCabe et al, 2016)。2017年10月美国佛罗里达近海暴发了近十年来持续最久、灾情最严重的短凯伦藻[Karenia brevis, 原称为短裸甲藻(Gymnodinium breve)]赤潮(Soto et al, 2018), 持续时间达15个月之久, 截至2018年8月当地政府已清理海滩上因赤潮死亡的海洋生物两千多吨(凤凰美洲, 2018)。类似的赤潮灾害还包括2016年发生在南美智利近海的链状亚历山大藻(Alexandrium catenella)赤潮和Pseudochattonella verruculosa赤潮等, 造成了智利近海养殖业10多亿美元的经济损失(Mascareño et al, 2018)。
在我国, 最早的赤潮记录是1933年发生在浙江沿海一带夜光藻和骨条藻赤潮(周名江等, 2001), 进入20世纪70—80年代, 赤潮记录次数呈几何倍数增长。特别是2000年以来增长趋势更加明显, 至2010年仅仅10年间的赤潮记录次数高达800多次(图 1), 比1952—1998年46年间的322次增加了近3倍; 2000—2017年赤潮累计暴发面积达到21万平方公里(国家海洋局, 1989—2017)。尽管赤潮记录次数的增加与我国赤潮监测体系的建立与不断完善有关, 但还是反映出近海赤潮的暴发次数与我国沿海经济的快速增长存在一定的相关性, 折射出当今赤潮的发生已不是海洋生态系统自我调整的自然现象, 而是人类活动干扰下近海生态系统不断退化的一种信号。进一步证明了人类活动是当今近海赤潮频发的主要幕后推手。
纵观赤潮发生和发展历史, 目前赤潮的暴发显示出很多新特点。
1.1 暴发规模加大上文提到的2015年在北美洲西海岸暴发的拟菱形藻赤潮充分显示出这一特点, 该赤潮6月份在加州近海开始形成, 逐渐向北蔓延, 至8月份已蔓延至加拿大不列颠哥伦比亚省的北部沿海(图 3), 其规模之大前所未有。研究者们将其归咎于气候变化引起的反常的海水温度升高, 将赤潮的暴发与全球气候变化紧密地联系在了一起。从另外一个角度也说明, 富营养化已成为当今全球近海一个不争的事实, 赤潮物种已成为富营养化环境中普遍存在的“隐患”, 在其他环境因子适宜的条件下, 赤潮原因种就像星星之火可以燎原一样, 不断“传染”和蔓延, 从以前的只是局部暴发, 发展到现在成片、大规模暴发的态势。
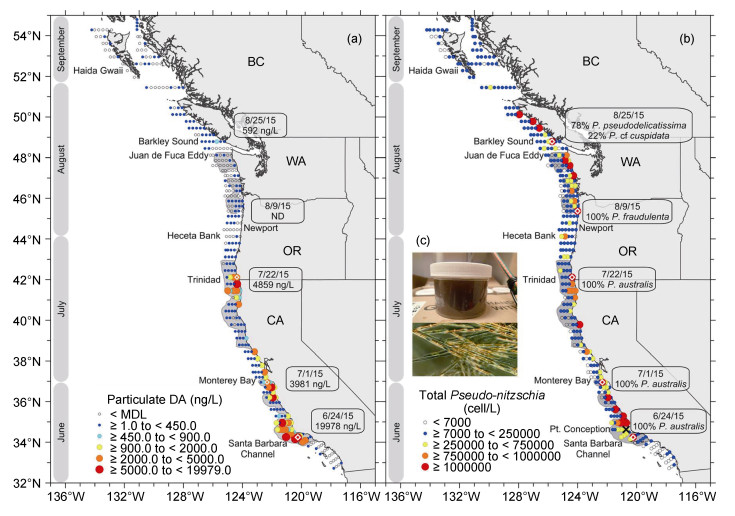 |
| 图 3 美国国家海洋大气局2015年6月20日到9月7日对加利福尼亚州南部到不列颠哥伦比亚省北部近海海域浮游植物丰度和软骨藻酸的航次调查(McCabe et al, 2016) Fig. 3 A research cruise aboard the National Oceanic and Atmospheric Administration (NOAA) Ship Bell M. Shimada from 20 June to 7 September sampled phytoplankton abundance and pDA from southern California to northern British Columbia (McCabe et al, 2016) 注: a.表层水中颗粒态软骨藻酸pDA的丰度; b.表层水中拟菱形藻的丰度; c. 6月24日在取样点浓缩后的样品以及显微镜观察图像 |
2017年10月发生在美国佛罗里达近海的短凯伦藻赤潮持续了15个月, 被称为近十年来持续最久的赤潮。但是就在2005年, 佛罗里达近海发生了一次持续18个多月的赤潮, 称之为佛罗里达有记录以来持续时间最长的赤潮(Glibert et al, 2018)。当今赤潮持续时间动辄几个月甚至一年, 与以前报道的赤潮暴发几天、几周相比发生了明显的变化。导致该变化的原因很多, 除了气候因素之外, 充足的营养补充应是其维持生长的必要条件, 由此也反映出近海富营养化程度的加重应是其主要原因之一。
1.3 致灾效应加重近海地区通常是一个国家经济较为发达和集中的区域, 随着全球经济的不断发展, 赤潮给各个沿海国家带来的危害效应也明显加重。例如, 智利是全球第二大三文鱼出口国, 2016年因赤潮导致全国12%的养殖三文鱼死亡(León-Muñoz et al, 2018), 直接经济损失高达10多亿美元, 给智利近海养殖业产生了极大的影响, 并由此引发社会动乱。2012年5月至6月, 中国福建近岸海域发生米氏凯伦藻(Karenia mikimotoi)赤潮, 影响面积近300km2, 导致养殖鲍鱼大面积死亡, 经济损失达20亿元人民币, 创了当时中国近海因赤潮导致的经济损失之最(林佳宁等, 2016)。上述致灾效应加重除了与当地的经济发展有关之外, 还与目前赤潮发生种类向甲藻类、有毒藻类演变有关, 由此导致的人类中毒现象也时有报道(新华网, 2017), 给食品安全和公共健康带来严重威胁。另外, 由于一些赤潮藻可以形成较大的具有黏性的囊体(如球形棕囊藻)能够堵塞核电冷源系统, 近年来赤潮又成为威胁近海核电冷源安全的新隐患(Yu et al, 2017)。
1.4 全球扩张明显全球气候变化与全球一体化加剧了赤潮灾害在全球范围的传播与扩散。越来越多的证据表明随着全球温度的升高, 暖水种的赤潮生物分布会得到进一步扩展, 赤潮暴发的窗口期会提前和加大(Hallegraeff, 2010), 其结果不仅会导致赤潮发生的频次增加, 而且发生规模也会加大, 2015年北美西海岸大规模拟菱形藻赤潮就说明了这一点(McCabe et al, 2016)。1985年由海金藻纲的抑食金球藻(Aureococcus anophagefferens)、Aureoumbra lagunensis等引发的褐潮首次出现于美国东北部的一些沿海海湾, 后来又于1997年在南非的萨尔达尼亚湾暴发; 2009年我国秦皇岛海域暴发的以抑食金球藻为优势种的褐潮使中国成为世界上第三个受其影响的国家(Zhang et al, 2012)。根据目前的研究结果, 这些赤潮生物均来自于相同物种, 折射出全球一体化也加剧了赤潮在全球范围的扩散。
2 国际赤潮研究主要计划与研究热点 2.1 国际赤潮研究主要计划赤潮问题引起了全球的关注, 1998年联合国教科文组织(UNESCO)和海洋研究科学委员会(SCOR)共同发起了有害藻华全球生态与海洋学计划(GEOHAB) (Glibert et al, 2018), 协调全球范围内有害藻华生态学及藻华生物生理学、遗传特性等方面的研究。GEOHAB计划的核心任务是支持国际间合作, 通过比较不同海域的赤潮, 研究各种海洋环境中赤潮物种的关键特征及种群动力学等。该计划共设置5个研究主题:生物多样性和生物地理学; 营养和富营养化; 适应策略; 比较分析方法; 观测、建模和预测。除此之外, GEOHAB与地区、国家、国际等不同层次的研究计划互动和合作, 包括全球海洋观测系统(GOOS)、美国的有害藻华的生态和海洋研究计划(ECOHAB)、欧洲有害藻华计划(EUROHAB)以及我国的有害藻华计划(CEOHAB)(Glibert et al, 2018)。GEOHAB对国际赤潮研究产生了很大影响,截至2016年, 共产生了1000多篇相关学术论文。
2013年GEOHAB计划结束以后, 鉴于有害藻华暴发的新趋势和新特点, 联合国教科文组织(UNESCO)和海洋研究科学委员会(SCOR)继续支持形成了全球有害藻华计划(GlobalHAB)。该计划除了吸收GEOHAB计划的关注点外, 还聚焦于有害藻华的各种新变化, 增加了对淡水和咸淡水有害藻华、更宽泛的藻华物种(包括底栖藻类、蓝藻、大型藻类)以及对社会的影响(人类健康、社会文化、经济冲击)等方面的内容(Berdalet et al, 2017)。GlobalHAB强调利用学科交叉研究不同水体系统中各种类型的有害藻华。为了应对近年来藻华暴发和藻华研究领域的进展, GlobalHAB计划在GEOHAB计划的基础上增加了7个新研究主题, 包括毒素、淡水HABs和蓝藻HABs、底栖HABs、HABs与水产养殖、HABs与健康和经济、气候变化与HABs。
2.2 目前国内外赤潮研究的主要热点 2.2.1 组学技术(Omics)在赤潮研究中的应用自20世纪70年代DNA测序技术发明以来, 人们就发现该技术可以用于代替形态特征的分子标记(Fox et al, 1977), 进而发展形成了能够表征物种特征的DNA条码(Hebert et al, 2003), 很大程度上改写了包括藻类物种在内的真核生物分类(Adl et al, 2019)。近10年来, 国际上已经形成各类分子标记数据库, 包括藻类细胞器16S rDNA数据库PhytoREF (Decelle et al, 2015)、核糖体18S rDNA数据库PR2 (Guillou et al, 2013)和EukRef (del Campo et al, 2018), 以及ITS2数据库(Koetschan et al, 2010)和SILVA数据库(Quast et al, 2013), 还有专门针对甲藻核糖体基因18S rDNA的数据库DINOREF(Mordret et al, 2018)等。这些不断完善的分子标记数据库系统建立了物种与分子标记之间的对应关系, 为物种鉴定、发现新物种、跟踪有害藻华物种的组成、分布、动态变化奠定了逐步坚实的基础。
随着测序技术的更新换代, 极大推动了藻类物种的宏基因组学研究, 包括利用16S rDNA和18S rDNA等分子标记, 研究藻类物种的空间分布、随时间的动态变化、物种稳定性(resilience)、相互间的作用(De Vargas et al, 2015; Ser-Giacomi et al, 2018), 以及赤潮暴发规律和机理等(Fuhrman et al, 2015)。比如, Tara Oceans项目完成了对全球海域的海水样本的分析, 发现了大量新物种、新基因(De Vargas et al, 2015; Ser-Giacomi et al, 2018)。近年来, 包括PacBio测序技术(Schloss et al, 2016; Tedersoo et al, 2018)和Oxford Nanopore测序技术(Benítez-Páez et al, 2016; Calus et al, 2018)的第三代单分子DNA测序技术成功用于测定全长分子标记序列, 使宏基因组学方法达到了可以分辨不同物种以及相同物种的不同株系水平。不过由于真核藻类的基因组比较大, 迄今为止, 已构建参考基因组的赤潮物种还不多(赖晓娟等, 2013; Casabianca et al, 2017)。甲藻类物种的全基因组构建困难更大, 已完成的有限几种甲藻均是基因组比较小的物种(LaJeunesse et al, 2005; Lin et al, 2015)。利用上述方法和思路研究有害藻华物种的组成和动态变化, 构建赤潮物种的参考基因组是未来非常重要、具有挑战性的研究内容(Sibbald et al, 2017)。
近10年来, 利用转录组(transcriptomics)和宏转录组(metatranscriptomics)方法研究赤潮物种的生长、增殖以及对各种环境因子的响应, 也是一个热点研究领域(Caron et al, 2017)。国际海洋真核微生物转录组项目(MMETSP)计划完成650个藻类转录组的构建, 其中包括若干赤潮物种(Keeling et al, 2014)。Ji等人(2018)通过宏转录组方法, 研究了赤潮异弯藻暴发过程中藻类物种组成和基因表达变化, 观察到可溶性有机磷(DOP)吸收相关的基因表达迅速上调, 并伴随吞噬食性相关基因上调, 发现混合食性在赤潮暴发过程中的重要性。有证据表明, 基因的表达和功能比物种组成更能决定浮游生物群落的特性(Rynearson, 2017), 这也为研究有害藻华暴发提供了方法和思路。
基于质谱分析的蛋白组(proteomics)和宏蛋白组(metaproteomics)可以高通量跟踪赤潮物种中蛋白质产物的表达和功能。与转录组和宏转录组分析相比, 蛋白组和宏蛋白组分析更加准确地反映藻类细胞的组成和功能(Wang et al, 2014; Morse et al, 2018), 可以用于验证宏转录组结果(Tse et al, 2018)。所以, 蛋白组和宏蛋白组方法被广泛用于研究赤潮物种合成毒素的机理、对环境因子的响应等。但是由于蛋白组分析方法需要比较多的蛋白质量, 而不能有效地(类似PCR扩增DNA的方法)扩增蛋白质, 加上蛋白组分析依赖高质量相关数据库, 导致蛋白组学方法的应用发展较慢(Wang et al, 2014)。随着更多赤潮物种的基因组得到构建和数据库的完善, 蛋白组学方法也将会更多地用于赤潮研究。
2.2.2 食品安全与公共健康赤潮暴发除了因高生物量而对生态环境和其他生物产生影响之外, 一些赤潮生物产生毒素也对人类和其他生物造成巨大的威胁(van Dolah, 2000)。所以, 长期以来赤潮对食品安全与人类健康的影响也是人们所关注的热点问题。
迄今为止, 已经从包括甲藻、硅藻、蓝藻等赤潮物种中分离出200多种毒素, 包括腹泻性贝类毒素(DSP)、氮杂螺环酸毒素(AZP)、神经性贝类毒素(NSP)、西加鱼毒素(CFP)、麻痹性贝类毒素(PSP)、河豚毒素(TTX)、失忆性贝类毒素(ASP)等(Daguer et al, 2018)。不同类型的毒素具有不同的致毒机理, 造成的危害也不相同, 所以研发不同种类的参考毒素(即有证参考物质, certified reference material, CRM)、定量分析各种毒素的毒性当量因子(Daguer et al, 2018)十分重要。至今国际上已有40余种有证参考物质, 但西加鱼毒素、神经贝类毒素等有证参考物质尚匮乏, 亟待加强研发。
针对藻毒素的分析方法很多, 包括动物模型分析方法、细胞分析方法、受体(离子通道、谷氨酸受体、乙酰胆碱受体、石房蛤毒素结合蛋白等)结合分析方法、酶抑制性分析方法、细胞毒性分析、分子结构分析方法、HPLC、LC-MS、LC-MS/MS、毛细管电泳等分析方法。其中, 对藻毒素检测最有效的方法是液相质谱联用检测技术(LC-MS/MS), 该方法对发现新毒素起到了重要作用(Daguer et al, 2018; Rutkowska et al, 2019)。除化学分析方法外, 目前分子生物学方法(包括DNA微阵列、定量PCR方法、全基因组测序)常常被用于研究藻毒素的合成, 分析参与毒素合成的基因和生物通路(Zhang et al, 2015)。
在毒素作用机理方面, 利用老鼠作为模式动物的传统思路已经逐步被淘汰, 鱼、牡蛎幼体、细胞系(如人小肠细胞系HT-29)已经成为比较普遍的研究对象。但是, 利用组学方法研究赤潮藻毒素的作用机理还比较少, 应该是未来重要的发展方向。
藻毒素的综合利用也是目前的一个研究热点, 一些海洋蓝藻合成的毒素正在被开发成为有效的药物(Sathasivam et al, 2017)。比如, 蓝藻Moorea bouillonii合成的apratoxins和Symploca sp.合成的carmaphycins被证明具有抗癌活性。其他毒素包括石房蛤毒素(saxitoxin)、河豚毒素(tetrodotoxin)、裸藻毒素(brevetoxin)、螺环内脂毒素(spirolide)、西加鱼毒素和软骨藻酸等神经毒素, 都在被开发成包括止疼药在内的药物。
2.2.3 赤潮生物分类、生活史等基础生物学传统的赤潮生物分类主要根据其形态学特征, 分子生物学技术的引入推动了赤潮物种分类的发展(Hebert et al, 2003; Leliaert et al, 2014)。近年来, 赤潮物种分子分类方法具有以下几个特点:第一, 不同分子标记用于分类不同类别的赤潮物种(Moniz et al, 2010; Mordret et al, 2018); 第二, 利用更长的分子标记(包括全长18S rDNA和28S rDNA序列)替代段片段分子标记; 第三, 多个分子标记替代单一分子标记, 提高物种分辨率(Glaeser et al, 2015; Leliaert et al, 2017); 第四, 分子标记与形态、生理特征相结合, 提高分类准确性。分子分类方法的建立, 使赤潮物种的分类逐步完善, 分辨率也逐步提高。一方面发现很多新的有害藻华物种, 包括发现很多赤潮物种事实上是“复合种”(species complex),即代表很多不同形态相似的“隐种”(cryptic species)(Dolan, 2016)。比如, 赤潮物种塔玛亚历山大藻事实上是5个“隐种”的复合种: A. fundyense, A. mediterraneum, A. tamarense, A. pacificum和A. australiense (John et al, 2014)。因此, 分子分类方法建立后, 赤潮物种的分类逐步完善, 分辨率也逐步提高, 发现了更多的物种, 这个趋势还将继续。另一方面, 很多基于形态分类的不同赤潮物种, 被证明是相同的物种在不同地理位置、不同生态环境、不同生活史阶段的不同表现, 导致同一个物种可能具有多个不同名称, 大大高估了赤潮物种的数目(Caron et al, 2019)。分子分类方法的引入, 逐步解决了这些物种分类冗余问题(Dolan, 2016; Leliaert et al, 2017)。
赤潮生物一般都具有比较复杂的生活史。根据生活史的差异, 赤潮生物还可以分为终生浮游生物(holoplankton), 即整个生活史均为浮游阶段(如拟菱形藻); 阶段性浮游生物(meroplankton), 即除浮游阶段外还包括其他阶段的生活史, 例如可以形成孢囊(cyst), 沉降在底质中等(Figueroa et al, 2018)。在过去10年中, 越来越多的赤潮生物被发现可以形成休眠孢囊(Ellegaard et al, 2018), 改变了人们对这些赤潮生物生活史的传统认识, 也为赤潮的形成与预测提供新的判断依据。除此之外, 藻-藻/藻-菌相互作用、营养动力学等相关问题对赤潮的发生和演变都具有重要作用, 也不断受到人们的关注(Sörenson et al, 2019; Lawson et al, 2018)。
2.2.4 赤潮监测、预测预报与模型研究准确、实时监测海域中赤潮物种和毒素的动态变化是预测、治理赤潮的基础。国内外对赤潮的监测已经有了相关的技术规程, 主要包括赤潮生物、藻毒素、水域富营养化以及一些常规理化、生物、水文和气象等参数(中华人民共和国国家海洋局, 2005; Anderson et al, 2001)。随着国际上海洋监测技术水平的整体提高, 赤潮监测技术也得到了快速的发展, 一些新的方法和技术不断应用到赤潮监测中, 以满足赤潮监测快速、灵敏、可靠的要求。如在原有光学显微镜基础上, 又发展了针对赤潮生物的流式细胞仪、特征色素等分析方法, 以及基于抗体、原位荧光杂交(FISH)、生物传感器、定量PCR等分子生物学方法, 研发了相应的现场监测分析设备、试剂盒以及浮标系统等, 实现了一些典型赤潮生物的快速识别和原位检测(Doucette et al, 2018)。
遥感技术是目前国际上对赤潮发生、发展的一个重要监测手段, 特别是随着可监测参数和可搭载方式(如无人机等)的增加, 遥感技术是未来一个十分重要的发展方向, 可广泛应用于赤潮发生机制、预测预报等方面研究。目前赤潮的预测预报还是一个国际难题, 但是人们还是根据赤潮发生的各种要素, 进行不断尝试, 如利用气象条件(如降雨、温度、台风等)(Katano et al, 2012)、营养盐水平(Anderson et al, 2002)、生活史特点(如孢囊)(Anderson et al, 2014)、水文特征(Dippner et al, 2011)等进行预测预报, 这些方法主要基于对赤潮发生的概念模型、经验模型和统计模型等(McGillicuddy, 2010)。最近, 针对美国佛罗里达赤潮, Karki等人(2018)基于MODIS数据, 建立预测模型, 可以提前3天做出预测预报。随着当今海洋生态系统模型的兴起, 从上述赤潮发生的概念模型、经验模型和统计模型等发展至赤潮生消数值模型是一个热点研究领域(Lanerolle et al, 2006; Wang et al, 2016), 由于赤潮生消数值模型不仅需要依赖于可靠的、参数化的生态系统模型, 而且要对赤潮发生机制有深入的了解, 所以目前建立一个准确、可靠的赤潮数值模型还非常困难。尽管如此, 该方面研究对于赤潮发生机制、预测预报, 乃至赤潮科学的整体发展都具有十分重要的意义。
2.2.5 赤潮应急处置技术与方法赤潮是一种全球性海洋生态灾害, 对人类健康、生态环境产生巨大危害。作为一种突发性的灾害, 需要有像处置火灾一样的应急方法和手段。所以, 长期以来如何应急处置赤潮一直是赤潮研究领域的热点问题。
由于赤潮是海水中微型生物暴发性增殖或聚集而产生的生态灾害, 只要能够控制住水体中赤潮生物的数量即可控制赤潮。所以, 从理论上讲能够治理赤潮的方法有很多, 包括物理方法、化学方法、生物方法等(俞志明等, 1993; Gallardo-Rodríguez et al, 2018)。但鉴于赤潮突发性强、影响面积大, 且治理方法须满足无二次污染、成本低、见效快、可大规模应用等条件, 国际上长期以来缺乏一种像“灭火器”一样的应急处置技术, 相关研究大都停留在实验室阶段, 有效的应急处置方法是赤潮研究领域的一个国际难题。20世纪70年代, 日本科学家代田昭彦(1977)提出了利用天然粘土矿物治理赤潮的应急处置方法, 并在日本鹿儿岛海域进行了现场示范研究(Shirota, 1989; 俞志明等, 1993; Imai et al, 2006)。作为大地土壤的基本单元, 天然粘土方法具有无二次污染、成本低、使用方便等优点。所以, 该方法一经提出, 立刻得到了广泛关注(Yu et al, 1994a; Anderson, 1997; Sengco et al, 2001, 2004; Beaulieu et al, 2005; Kim, 2006; Park et al, 2013), 成为当时能够大规模应用于赤潮应急处置的极少数方法之一(俞志明等, 1993; Anderson et al, 2001; Kim, 2006; Getchis et al, 2017)。然而, 天然粘土溶胶性质差, 絮凝赤潮生物能力低, 实际应用中量少时难以完全消除赤潮, 必须大量、反复散播。如日本现场用量约110—400t/km2(Shirota, 1989); 韩国约400t/km2, 一次用量可达60000t (Anderson et al, 2001)。由此给大面积治理赤潮带来了原料量和淤渣量过大的问题(Sengco et al, 2001; Yu et al, 2004; Getchis et al, 2017), 天然粘土絮凝效率较低成为制约粘土治理赤潮最大的瓶颈。
针对天然粘土治理赤潮效率低的国际难题, 20世纪90年代, 我国科学家通过研究粘土颗粒与赤潮生物作用机制, 发现了天然粘土的表面性质是控制赤潮治理效率的关键因子(俞志明等, 1994; Yu et al, 1995), 创新性地构建了改性粘土治理赤潮的DLVO絮凝作用模型, 提出了提高粘土絮凝赤潮生物效率的表面改性理论与方法(Yu et al, 1994a, b, 1995, 2017), 并利用吸附、插入等方法, 制备出各类高效改性粘土材料(俞志明等, 1994; Yu et al, 1994b, 1995; 曹西华等, 2003; 张雅琪, 2013; Liu et al, 2016)。改性后的粘土材料治理赤潮效率提高几十到几百倍, 现场使用量由国际上的100—400t/km2降低为4—10t/km2 (Yu et al, 2017)。
改性粘土高效治理赤潮的原理主要基于将天然粘土表面的负电性, 转变为正电, 使原来天然粘土与赤潮生物之间的负负相斥, 转变为正负相吸。除了改变静电相互作用之外, 粘土表面改性后还会增加了粘土与赤潮生物之间的桥连作用和网捕作用等, 这些改变均导致改性后的粘土絮凝赤潮生物效率大大提升。近期Zhu等(2018)和Liu等(2017)的研究发现, 改性粘土除了能够提高絮凝效率之外, 还能够对赤潮生物产生更强的胁迫作用, 导致赤潮生物即使没有被絮凝沉降, 也不能够再进一步繁殖和生长。他们分别从分子生物学和生理生化等角度进一步揭示了改性粘土的高效机制。综合这些研究, 改性粘土高效治理赤潮的机制可总结如图 4所示。
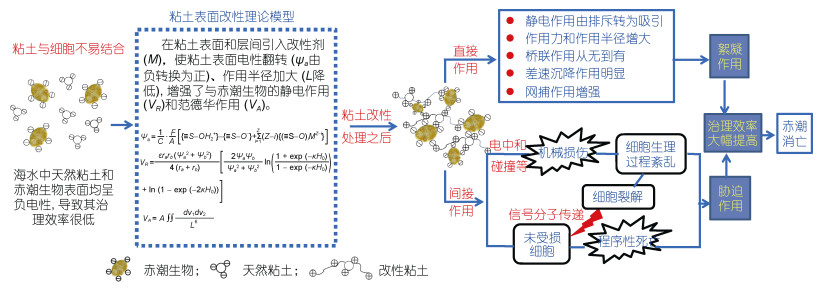 |
| 图 4 改性粘土高效治理赤潮原理与机制图 Fig. 4 The principle and mechanism of HAB controlling by modified clay treatment |
为了确保改性粘土治理赤潮方法的绿色、环保和安全, 研究者们还分别考察了改性粘土对水质(俞志明等, 1995; Lu et al, 2017)、养殖生物(孙晓霞等, 2000; 王志富等, 2014a, b)、藻毒素(俞志明等, 1998; Lu et al, 2015a)和底栖环境(Lu et al, 2015b)等方面的影响, 发现改性粘土可以吸附营养盐、有效改善水质(Lu et al, 2015a, b; 2017), 使用改性粘土后水体赤潮藻毒素可降低80%(Lu et al, 2015a), 对典型鱼、虾、贝等养殖生物、底栖环境等没有不良影响, 是一种安全、可靠的赤潮应急处置技术。2005年, 改性粘土治理赤潮技术首次应用于现场, 成功治理了南京玄武湖蓝藻水华。自此以来, 该技术已成功应用于我国沿海7个省、市、自治区的20多个水域。2014年列入我国“赤潮灾害处理技术指南”, 成为我国近海赤潮应急处置的标准方法, 也是唯一在我国近海大规模应用的方法(Yu et al, 2017)。2016年以来, 我国科学家分别与美国、智利等相关机构签署了利用我国改性粘土技术合作治理美国佛罗里达近海、智利养殖海域赤潮的相关协议, 反映出该技术在国际上的影响力。
3 国内赤潮研究的主要发展过程和发展趋势 3.1 国内赤潮研究的主要发展过程几十年来, 我国的赤潮研究经历起步、发展、追赶和并行等阶段。
20世纪80年代之前可以说是我国赤潮研究的起步或初始阶段。在这一阶段人们对赤潮问题还没有形成一个科学的认识, 也没有一个专门学科, 有关赤潮生物的研究与普通的藻类学混为一谈, 没有开展相关的专项研究, 对赤潮问题主要停留在对一些现象零散的描述。如1952年, 原中央水产所记述了发生在黄河口邻近水域的夜光藻赤潮, 后经费鸿年在“学艺杂志”正式发表; 周贞英在1962年、陈亚瞿在1972年分别报道了发生在福建平潭岛近海和长江口邻近海域的束毛藻赤潮等(Qi et al, 1993; 周名江等, 2001)。
20世纪80年代至20世纪末是我国赤潮研究的重要发展阶段。该阶段是我国改革开放、沿海经济从起步到高速发展的时期, 也是我国近海生态环境承受人类活动压力最大的时间段, 导致赤潮发生频繁、规模和危害不断增大。据不完全统计, 此二十年间我国有记录的赤潮事件300多起, 仅1998年全年达22起, 直接经济损失达10亿元以上。由此也推动了我国赤潮研究的快速发展, 各种科研项目相继展开, 其中最具标识性的是国家基金委分别在1990年和1997年启动了“七五”和“九五”赤潮重大项目。该项目由我国资深赤潮专家齐雨藻教授、邹景忠研究员领衔, 联合了我国当时从事赤潮研究的主要科研力量, 选择我国沿海典型养殖区作为重点研究海区, 围绕赤潮生物及种群生态动力学、赤潮生消动态过程和机制、赤潮藻毒素及生态毒理学、赤潮防治机理等, 开展了相关调查、实验与综合性研究。该项目的实施不仅取得了一系列重要科研成果, 而且完善了我国赤潮科学的学科建设, 形成了一支全国性的赤潮研究队伍, 对推动我国赤潮科学的发展起到了奠基性和开创性的作用。
20世纪末至21世纪初, 赤潮问题越来越引起国际上的重视。1998年国际上组织发起了“全球有害赤潮的生态学和海洋学(简称GEOHAB)”研究计划。与之对应, 美国等西方国家也分别开展了各自国家的赤潮研究计划。我国在经历了两个赤潮重大项目之后, 针对国家的迫切需求和国际赤潮研究的发展趋势, 分别启动了赤潮973、863和赤潮公益专项等多个相关项目, 其中由周名江研究员领衔实施的赤潮973项目, 与国际GEOHAB计划接轨, 是该阶段我国赤潮研究追赶国际先进水平、与国际赤潮研究接轨的主要标识。该赤潮973项目历经两期(2002—2007年、2010—2015年)、十余年的研究, 面向国家需求, 瞄准国际前沿, 通过多学科交叉, 在东海大规模原甲藻赤潮形成机制、硅甲藻演替、大规模赤潮的危害机理以及赤潮的应急治理等研究方面取得了重大的创新性成果。在该研究阶段, 我国的赤潮研究充分与国际接轨, 启动了我国的CEOHAB计划, 将科学目标聚焦于赤潮形成过程中的生物、化学和物理海洋学的多学科交叉与综合, 阐释了影响赤潮种类动态演替的生态学和和海洋学机制(周名江等, 2006), 很多研究工作被国际GEOHAB计划纳入其重要进展和成果之中(GEOHAB, 2003, 2006, 2010)。
目前, 我国的赤潮研究在历经了起步、发展和追赶的不同发展阶段之后, 正处于整体与国际并行、局部领先的阶段, 在赤潮研究的某些方面更具特色, 在国际上也更具优势。现阶段我国的赤潮研究更聚焦于国家需求、更注重实验室研究与现场应用的结合。近年来, 我国在赤潮监测体系的建设、大规模赤潮的现场调查与预测防治研究、赤潮形成机制的多学科综合与交叉等方面进展明显, 整体上处于国际先进水平。特别是随着组学研究的兴起, 利用分子生物学方法和技术研究赤潮问题在我国发展更为迅速, 例如, 2015年我国厦门大学等科学家在国际上首次完成了甲藻(Symbiodinium kawagutii)的基因测序, 该成果在Science上发表(Lin et al, 2015), 为今后甲藻赤潮生物的全基因组分析, 奠定了重要基础。如上文所述, 我国在赤潮应急处置方面的研究成果已经在国际上产生了重要影响, 相关技术已经输出至美国、智利等国家, 在该研究领域起到了示范与引领作用。由此可见, 目前我国已在国际赤潮研究的多个领域显示出其特色和优势, 相关科技成果产出增幅明显。相信在不远的将来, 我国赤潮研究的整体水平会进一步提高, 在国际上占据更重要地位, 对国际赤潮科学的发展做出更大的贡献。
3.2 国家重点研发计划“我国近海致灾赤潮形成机理、监测预测及评估防治技术”近年来, 在人类活动和气候变化共同影响下, 我国的赤潮问题呈现致灾危害加剧、致灾藻种增多的变化趋势, 不仅严重威胁近海养殖业和水产品安全, 甚至给近海核电安全带来新的隐患。为此, 科技部在2017年启动了国家重点研发计划“我国近海致灾赤潮形成机理、监测预测及评估防治技术”项目。该项目要求掌握我国近海赤潮灾害的发生风险、演变趋势和关键环境因素; 建立赤潮的预警预测模型, 实现业务化应用; 研发赤潮生物和典型藻毒素的快速检测产品, 以及一些重要水域赤潮的防控和应急处置技术与装备, 实现示范应用。由此可见, 该项目更加关注我国赤潮问题的新变化、新特点, 在研究思路上立足基础研究、突破关键技术、注重推广应用, 更加体现“理论-技术-示范”全链条设计, 从一定程度上反映了我国赤潮研究的发展趋势, 简单介绍如下:
该项目以影响核电冷源安全的球形棕囊藻赤潮、危害养殖业发展与人类健康的米氏凯伦藻等有毒赤潮为典型致灾赤潮, 围绕其发生机理、演变规律、毒素污染、早期诊断、预警预报和防控示范等方面开展综合研究。项目研究目标为: (1)揭示典型致灾赤潮发生的关键生态学过程和演变规律, 阐明环境驱动机制和分子调控机理; (2)厘清我国近海藻毒素分布特征, 研发高纯度藻毒素抗原制备技术, 形成藻毒素快速检测的商品化产品; (3)构建重点海域致灾赤潮形成与演变的数值模型, 实现早期预警、风险评估和预测预报; (4)阐明改性粘土防控典型致灾赤潮的机理, 研发特效改性粘土材料及其配套装备, 在重点海域应用。
围绕上述目标, 该项目重点开展“典型致灾赤潮的生态学机理与演变规律”、“典型致灾赤潮形成的分子机理及调控网络”、“典型致灾赤潮藻毒素分布特征及快速检测技术”、“典型致灾赤潮的早期诊断、监测预警与风险评估”、“典型致灾赤潮形成的数值模拟及预测预报”和“典型致灾赤潮的防控和应急处置技术与装备”等方面研究, 解决三大关键科学问题:典型致灾赤潮形成的关键触发因子和分子调控机制、典型致灾赤潮藻种特异性检测和新型藻毒素甄别、典型致灾赤潮形成的早期诊断信息提取与解析; 攻克三大关键技术难题:典型致灾赤潮藻毒素快速检测技术及其商品化产品、典型致灾赤潮数值模型与预测预报技术、有效防控典型致灾赤潮的特效改性粘土材料及应急处置技术。
该项目计划3年半完成, 拟在前期工作基础上, 通过现场调查、围隔实验、实验室模拟和应用示范等技术路线, 揭示我国典型致灾赤潮的发生机理和演变规律, 产出原创性、高水平学术成果; 攻克早期诊断、预测预报等关键技术, 研发有毒藻和藻毒素的检测技术, 形成典型藻毒素快速检测商品化产品; 实现典型致灾赤潮防控技术在重点海域中的示范应用, 形成在国内外赤潮研究领域具有领先水平的综合性科技成果。
综上所述, 该项目将目前国际上的赤潮研究热点与我国赤潮问题的特点相结合, 以国家需求为导向, 反映出我国赤潮研究的发展趋势。研究成果将会进一步提升我国赤潮研究在国际上的水平和地位, 提高人类社会对赤潮灾害的应对和防控能力, 为全球近海生态系统健康和沿海经济的可持续发展, 提供科学依据和技术保障。
致谢 本文得到宋秀贤研究员、梁玉波研究员、唐赢中研究员的相关建议; 朱迦囡、姜文彬、邱丽霞、刘淑雅等同学在资料检索、排版等方面给予了协助, 在此一并表示感谢。
王志富, 俞志明, 宋秀贤, 等. 2014a. 改性粘土治理有害藻华方法对虾夷扇贝(Patinopectenyessoensis)稚贝的影响. 海洋环境科学, 33(6): 817-821, 236 |
王志富, 俞志明, 宋秀贤, 等. 2014b. 有害藻华治理过程中改性粘土对仿刺参(Apostichopus japonicas Selenka)稚参的影响. 海洋与湖沼, 45(2): 233-238 |
中华人民共和国国家海洋局, 2005. HY/T 069-2005赤潮监测技术规程.北京: 中国标准出版社
|
凤凰美洲, 2018.佛罗里达州"赤潮"造成2000吨海洋生物死亡, 企业损失超过800万美元. http://wemedia.ifeng.com/75119119/wemedia.shtml
|
代田昭彦. 1977. 赤潮防止策(特集). 海洋污染, 產業と環境, 6: 37-42 |
孙晓霞, 张波, 俞志明. 2000. 赤潮防治剂对中国对虾的毒性研究. 海洋环境科学, 19(4): 6-8 DOI:10.3969/j.issn.1007-6336.2000.04.002 |
张雅琪, 2013.改性粘土对褐潮生物种——Aureococcus anophagefferens的去除研究.青岛: 中国科学院研究生院(海洋研究所)硕士学位论文
|
林佳宁, 颜天, 张清春, 等. 2016. 福建沿海米氏凯伦藻赤潮对皱纹盘鲍的危害原因. 海洋环境科学, 35(1): 27-34 |
国家海洋局, 1989-2017.中国海洋灾害公报.北京: 国家海洋局
|
周名江, 朱明远. 2006. "我国近海有害赤潮发生的生态学、海洋学机制及预测防治"研究进展. 地球科学进展, 21(7): 673-679 DOI:10.3321/j.issn:1001-8166.2006.07.003 |
周名江, 朱明远, 张经. 2001. 中国赤潮的发生趋势和研究进展. 生命科学, 13(2): 54-59, 53 DOI:10.3969/j.issn.1004-0374.2001.02.002 |
俞志明, Rao D V S. 1998. 粘土矿物对尖刺拟菱形藻多列型生长和藻毒素产生的影响. 海洋与湖沼, 29(1): 47-52 |
俞志明, 马锡年, 谢阳. 1995. 粘土矿物对海水中主要营养盐的吸附研究. 海洋与湖沼, 26(2): 208-214 |
俞志明, 邹景忠, 马锡年. 1994. 一种去除赤潮生物更有效的粘土种类. 自然灾害学报, 3(2): 105-109 |
俞志明, 邹景忠, 马锡年, 等. 1993. 治理赤潮的化学方法. 海洋与湖沼, 24(3): 314-318 |
曹西华, 俞志明. 2003. 有机改性粘土去除有害赤潮藻的研究. 应用生态学报, 14(7): 1169-1172 DOI:10.3321/j.issn:1001-9332.2003.07.029 |
赖晓娟, 陈海敏, 杨锐, 等. 2013. 藻类基因组研究进展. 遗传, 35(6): 735-744 |
新华网, 2017.如何避免赤潮反复成灾?-福建沿海赤潮导致群众中毒事件追踪. http://www.xinhuanet.com/2017-06/13/c_1121136303.htm
|
Adl S M, Bass D, Lane C E et al, 2019. Revisions to the classification, nomenclature, and diversity of eukaryotes. Journal of Eukaryotic Microbiology, 66(1): 4-119 |
Anderson D M, 1997. Turning back the harmful red tide. Nature, 388(6642): 513-514 DOI:10.1038/41415 |
Anderson D M, 2009. Approaches to monitoring, control and management of harmful algal blooms (HABs). Ocean & Coastal Management, 52(7): 342-347 |
Anderson D M, Andersen P, Bricelj V M et al, 2001. Monitoring and management strategies for harmful algal blooms in coastal waters. Paris, France: Asia Pacific Economic Program, Singapore, and Intergovernmental Oceanographic Commission
|
Anderson D M, Glibert P M, Burkholder J M, 2002. Harmful algal blooms and eutrophication:Nutrient sources, composition, and consequences. Estuaries, 25(4): 704-726 DOI:10.1007/BF02804901 |
Anderson D M, Keafer B A, Kleindinst J L et al, 2014. Alexandrium fundyense cysts in the Gulf of Maine:long-term time series of abundance and distribution, and linkages to past and future blooms. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 103: 6-26 DOI:10.1016/j.dsr2.2013.10.002 |
Beaulieu S E, Sengco M R, Anderson D M, 2005. Using clay to control harmful algal blooms:deposition and resuspension of clay/algal flocs. Harmful Algae, 4(1): 123-138 DOI:10.1016/j.hal.2003.12.008 |
Benítez-Páez A, Portune K J, Sanz Y, 2016. Species-level resolution of 16S rRNA gene amplicons sequenced through the MinIONTM portable nanopore sequencer. GigaScience, 5: 4 DOI:10.1186/s13742-016-0111-z |
Berdalet E, Kudela R, Urban Ed et al, 2017. GlobalHAB:A new program to promote international research, observations, and modeling of harmful algal blooms in aquatic systems. Oceanography, 30(1): 70-81 DOI:10.5670/oceanog |
Calus S T, Ijaz U Z, Pinto A J, 2018. NanoAmpli-Seq:a workflow for amplicon sequencing for mixed microbial communities on the nanopore sequencing platform. GigaScience, 7(12) |
Caron D A, Alexander H, Allen A E et al, 2017. Probing the evolution, ecology and physiology of marine protists using transcriptomics. Nature Reviews Microbiology, 15(1): 6-20 DOI:10.1038/nrmicro.2016.160 |
Caron D A, Hu S K, 2019. Are we overestimating protistan diversity in nature?. Trends in Microbiology, 27(3): 197-205 DOI:10.1016/j.tim.2018.10.009 |
Casabianca S, Cornetti L, Capellacci S et al, 2017. Genome complexity of harmful microalgae. Harmful Algae, 63: 7-12 DOI:10.1016/j.hal.2017.01.003 |
Daguer H, Hoff R B, Molognoni L et al, 2018. Outbreaks, toxicology, and analytical methods of marine toxins in seafood. Current Opinion in Food Science, 24: 43-55 DOI:10.1016/j.cofs.2018.10.006 |
Darwin C, 1839. Journal of researches into the geology and natural history of the various countries visited by H.M.S. Beagle. London: Henry Colburn
|
De Vargas C, Audic S, Henry N et al, 2015. Eukaryotic plankton diversity in the sunlit ocean. Science, 348(6237): 1261605 DOI:10.1126/science.1261605 |
Decelle J, Romac S, Stern R F et al, 2015. PhytoREF:a reference database of the plastidial 16S rRNA gene of photosynthetic eukaryotes with curated taxonomy. Molecular Ecology Resources, 15(6): 1435-1445 DOI:10.1111/1755-0998.12401 |
Del Campo J, Kolisko M, Boscaro V et al, 2018. EukRef:phylogenetic curation of ribosomal RNA to enhance understanding of eukaryotic diversity and distribution. PLoS Biology, 16(9): e2005849 DOI:10.1371/journal.pbio.2005849 |
Dippner J W, Nguyen-Ngoc L, Doan-Nhu H et al, 2011. A model for the prediction of harmful algae blooms in the Vietnamese upwelling area. Harmful Algae, 10(6): 606-611 |
Dolan J R, 2016. Planktonic protists:little bugs pose big problems for biodiversity assessments. Journal of Plankton Research, 38(4): 1044-1051 DOI:10.1093/plankt/fbv079 |
Doucette G J, Medlin L K, McCarron P et al, 2018. Detection and surveillance of harmful algal bloom species and toxins. In: Shumway S E, Burkholder J M, Morton S L eds. Harmful Algal Blooms: A Compendium Desk Reference. Hoboken, NJ: John Wiley & Sons, Ltd., 39-114
|
Ellegaard M, Ribeiro S, 2018. The long-term persistence of phytoplankton resting stages in aquatic 'seed banks'. Biological Reviews, 93(1): 166-183 DOI:10.1111/brv.2018.93.issue-1 |
Figueroa R I, Estrada M, Garcés E, 2018. Life histories of microalgal species causing harmful blooms:haploids, diploids and the relevance of benthic stages. Harmful Algae, 73: 44-57 DOI:10.1016/j.hal.2018.01.006 |
Fox G E, Pechman K R, Woese C R, 1977. Comparative cataloging of 16s ribosomal ribonucleic acid:molecular approach to procaryotic systematics. International Journal of Systematic and Evolutionary Microbiology, 27(1): 44-57 DOI:10.1099/00207713-27-1-44 |
Fuhrman J A, Cram J A, Needham D M, 2015. Marine microbial community dynamics and their ecological interpretation. Nature Reviews Microbiology, 13(3): 133-146 DOI:10.1038/nrmicro3417 |
Gallardo-Rodríguez J J, Astuya-Villalón A, Llanos-Rivera et al, 2018. A critical review on control methods for harmful algal blooms. Reviews in Agriculture: 1-24 DOI:10.1111/raq.12251 |
GEOHAB, 2003. Global Ecology and Oceanography of Harmful Algal Blooms, Implementation Plan. Baltimore and Paris:SCOR and IOC: 24 |
GEOHAB, 2006. Global Ecology and Oceanography of Harmful Algal Blooms:HABs in Eutrophic Systems. Paris and Baltimore:IOC and SCOR: 74 |
GEOHAB, 2010. Global Ecology and Oceanography of Harmful Algal Blooms:Harmful algal blooms in Asia. Paris and Newark, Delaware:IOC and SCOR: 68 |
Getchis T L, Shumway S E, 2017. Harmful algae: an executive summary. Connecticut Sea Grant College Program, CTSG-17-08 (16pp.)
|
Glaeser S P, Kämpfer P, 2015. Multilocus sequence analysis (MLSA) in prokaryotic taxonomy. Systematic and Applied Microbiology, 38(4): 237-245 DOI:10.1016/j.syapm.2015.03.007 |
Glibert P M, Al-Azri A, Allen J I et al, 2018. Key questions and recent research advances on harmful algal blooms in relation to nutrients and eutrophication. In: Glibert P M, Berdalet E, Burford M A et al eds. Global Ecology and Oceanography of Harmful Algal Blooms. Cham: Springer, 229-259
|
Guillou L, Bachar D, Audic S et al, 2013. The protist ribosomal reference database (PR2):a catalog of unicellular eukaryote Small Sub-Unit rRNA sequences with curated taxonomy. Nucleic Acids Research, 41(D1): D597-D604 |
Hallegraeff G M, 2010. Ocean climate change, phytoplankton community responses, and harmful algal blooms:a formidable predictive challenge. Journal of Phycology, 46(2): 220-235 DOI:10.1111/jpy.2010.46.issue-2 |
Hebert P D N, Cywinska A, Ball S L et al, 2003. Biological identifications through DNA barcodes. Proceedings of the Royal Society of London. Series B:Biological Sciences, 270(1512): 313-321 DOI:10.1098/rspb.2002.2218 |
Ho K C, Hodgkiss I J, 1991. Red tides in subtropical waters:an overview of their occurrence. Asian Marine Biology, 8: 5-23 |
Imai I, Yamaguchi M, Hori Y, 2006. Eutrophication and occurrences of harmful algal blooms in the Seto Inland Sea, Japan. Plankton & Benthos Research, 1(2): 71-84 |
Ji N J, Lin L X, Li L et al, 2018. Metatranscriptome analysis reveals environmental and diel regulation of a Heterosigma akashiwo (raphidophyceae) bloom. Environmental Microbiology, 20(3): 1078-1094 DOI:10.1111/emi.2018.20.issue-3 |
John U, Litaker R W, Montresor M et al, 2014. Formal revision of the Alexandrium tamarense species complex (Dinophyceae) taxonomy:the introduction of five species with emphasis on molecular-based (rDNA) classification. Protist, 165(6): 779-804 DOI:10.1016/j.protis.2014.10.001 |
Karki S, Sultan M, Elkadiri R et al, 2018. Mapping and forecasting onsets of harmful algal blooms using MODIS data over coastal waters surrounding charlotte county, Florida. Remote Sensing, 10(10): 1656 DOI:10.3390/rs10101656 |
Katano T, Yoshino K, Matsubara T et al, 2012. Wax and wane of Chattonella (Raphidophyceae) bloom with special reference to competition between Skeletonema (Bacillariophyceae) in the Ariake Sea, Japan. Journal of Oceanography, 68(4): 497-507 DOI:10.1007/s10872-012-0112-1 |
Keeling P J, Burki F, Wilcox H M et al, 2014. The marine microbial eukaryote transcriptome sequencing project (MMETSP):illuminating the functional diversity of eukaryotic life in the oceans through transcriptome sequencing. PLoS Biology, 12(6): e1001889 DOI:10.1371/journal.pbio.1001889 |
Kim H G, 2006. Mitigation and controls of HABs. In: Granéli E, Turner J T eds. Ecology of Harmful Algae. Berlin, Heidelberg: Springer, 327-338
|
Koetschan C, Förster F, Keller A et al, 2010. The ITS2 database Ⅲ-sequences and structures for phylogeny. Nucleic Acids Research, 38(D1): D275-D279 |
LaJeunesse T C, Lambert G, Andersen R A et al, 2005. Symbiodinium (pyrrhophyta) genome sizes (DNA content) are smallest among dinoflagellates. Journal of Phycology, 41(4): 880-886 DOI:10.1111/jpy.2005.41.issue-4 |
Lanerolle L W J, Tomlinson M C, Gross T F et al, 2006. Numerical investigation of the effects of upwelling on harmful algal blooms off the west Florida coast. Estuarine, Coastal and Shelf Science, 70(4): 599-612 DOI:10.1016/j.ecss.2006.06.015 |
Lawson C A, Raina J B, Kahlke T et al, 2018. Defining the core microbiome of the symbiotic dinoflagellate, Symbiodinium. Environmental Microbiology Reports, 10(1): 7-11 DOI:10.1111/emi4.2018.10.issue-1 |
Leliaert F, De Clerck O, 2017. Refining species boundaries in algae. Journal of Phycology, 53(1): 12-16 DOI:10.1111/jpy.2017.53.issue-1 |
Leliaert F, Verbruggen H, Vanormelingen P et al, 2014. DNA-based species delimitation in algae. European Journal of Phycology, 49(2): 179-196 DOI:10.1080/09670262.2014.904524 |
León-Muñoz J, Urbina M A, Garreaud R et al, 2018. Hydroclimatic conditions trigger record harmful algal bloom in western Patagonia (summer 2016). Scientific Reports, 8(1): 1330 DOI:10.1038/s41598-018-19461-4 |
Lin S J, Cheng S F, Song B et al, 2015. The Symbiodinium kawagutii genome illuminates dinoflagellate gene expression and coral symbiosis. Science, 350(6261): 691-694 DOI:10.1126/science.aad0408 |
Liu S Y, Yu Z M, Song X X et al, 2017. Effects of modified clay on the physiological and photosynthetic activities of Amphidinium carterae Hulburt. Harmful Algae, 70: 64-72 DOI:10.1016/j.hal.2017.10.007 |
Liu Y, Cao X H, Yu Z M et al, 2016. Controlling harmful algae blooms using aluminum-modified clay. Marine Pollution Bulletin, 103(1-2): 211-219 DOI:10.1016/j.marpolbul.2015.12.017 |
Lu G Y, Song X X, Yu Z M et al, 2015a. Environmental effects of modified clay flocculation on Alexandrium tamarense and paralytic shellfish poisoning toxins (PSTs). Chemosphere, 127: 188-194 DOI:10.1016/j.chemosphere.2015.01.039 |
Lu G Y, Song X X, Yu Z M et al, 2015b. Effects of modified clay flocculation on major nutrients and diatom aggregation during Skeletonema costatum blooms in the laboratory. Chinese Journal of Oceanology and Limnology, 33(4): 1007-1019 DOI:10.1007/s00343-015-4162-2 |
Lu G Y, Song X X, Yu Z M et al, 2017. Application of PAC-modified kaolin to mitigate Prorocentrum donghaiense:effects on cell removal and phosphorus cycling in a laboratory setting. Journal of Applied Phycology, 29(2): 917-928 DOI:10.1007/s10811-016-0992-3 |
Mascareño A, Cordero R, Azócar G et al, 2018. Controversies in social-ecological systems:lessons from a major red tide crisis on Chiloe Island, Chile. Ecology and Society, 23(4): 15 DOI:10.5751/ES-10300-230415 |
McCabe R M, Hickey B M, Kudela R M et al, 2016. An unprecedented coastwide toxic algal bloom linked to anomalous ocean conditions. Geophysical Research Letters, 43(19): 10366-10376 DOI:10.1002/2016GL070023 |
McGillicuddy D J Jr, 2010. Models of harmful algal blooms:conceptual, empirical, and numerical approaches. Journal of Marine Systems, 83(3-4): 105-107 DOI:10.1016/j.jmarsys.2010.06.008 |
Moniz M B J, Kaczmarska I, 2010. Barcoding of diatoms:nuclear encoded ITS revisited. Protist, 161(1): 7-34 DOI:10.1016/j.protis.2009.07.001 |
Mordret S, Piredda R, Vaulot D et al, 2018. DINOREF:a curated dinoflagellate (Dinophyceae) reference database for the 18S rRNA gene. Molecular Ecology Resources, 18(5): 974-987 DOI:10.1111/men.2018.18.issue-5 |
Morse D, Tse S P K, Lo S C L, 2018. Exploring dinoflagellate biology with high-throughput proteomics. Harmful Algae, 75: 16-26 DOI:10.1016/j.hal.2018.03.010 |
Park T G, Ae Lim W, Park Y T et al, 2013. Economic impact, management and mitigation of red tides in Korea. Harmful Algae, 30(Suppl 1): S131-S143 |
Qi Y Z, Zhang Z, Hong Y et al, 1993. Occurrence of red tides on the coasts of China. In: Smayda T J, Shimizu Y eds. Toxic Phytoplankton Blooms in the Sea. Beijing, China: World Publishing Corporation, 43-46
|
Quast C, Pruesse E, Yilmaz P et al, 2013. The SILVA ribosomal RNA gene database project:improved data processing and web-based tools. Nucleic Acids Research, 41(D1): D590-D596 |
Rojas de Mendiola B, 1979. Red tide along the Peruvian coast. In: Taylor D L, Seliger H H eds. Toxic Dinoflagellate Blooms. Amsterdam: Elsevier, 183-190
|
Rutkowska M, Plotka-Wasylka J, Majchrzak T et al, 2019. Recent trends in determination of neurotoxins in aquatic environmental samples. TrAC Trends in Analytical Chemistry, 112: 112-122 DOI:10.1016/j.trac.2019.01.001 |
Rynearson T A, 2017. Navigating in a sea of genes. Science, 358(6367): 1129-1130 DOI:10.1126/science.aar3431 |
Sathasivam R, Radhakrishnan R, Hashem A et al, 2017. Microalgae metabolites: a rich source for food and medicine. Saudi Journal of Biological Sciences, http://doi.org/10.1016/j.sjbs.2017.11.003
|
Schloss P D, Jenior M L, Koumpouras C C et al, 2016. Sequencing 16S rRNA gene fragments using the PacBio SMRT DNA sequencing system. PeerJ, 4: e1869 DOI:10.7717/peerj.1869 |
Sengco M R, Anderson D M, 2004. Controlling harmful algal blooms through clay flocculation. Journal of Eukaryotic Microbiology, 51(2): 169-172 DOI:10.1111/jeu.2004.51.issue-2 |
Sengco M R, Li A S, Tugend K et al, 2001. Removal of red-and brown-tide cells using clay flocculation. I. Laboratory culture experiments with Gymnodinium breve and Aureococcus anophagefferens. Marine Ecology Progress Series, 210: 41-53 DOI:10.3354/meps210041 |
Ser-Giacomi E, Zinger L, Malviya S et al, 2018. Ubiquitous abundance distribution of non-dominant plankton across the global ocean. Nature Ecology & Evolution, 2(6): 1243-1249 |
Shirota A, 1989. Red tide problem and countermeasures (2). International Journal of Aquatic Fish Technology, 1: 195-223 |
Sibbald S J, Archibald J M, 2017. More protist genomes needed. Nature Ecology & Evolution, 1(5): 0145 |
Sörenson E, Bertos-Fortis M, Farnelid H et al, 2019. Consistency in microbiomes in cultures of Alexandrium species isolated from brackish and marine waters. Environmental Microbiology Reports, doi: 10.1111/1758-2229.12736
|
Soto I M, Cambazoglu M K, Boyette A D et al, 2018. Advection of Karenia brevis blooms from the Florida panhandle towards Mississippi coastal waters. Harmful Algae, 72: 46-64 DOI:10.1016/j.hal.2017.12.008 |
Tedersoo L, Tooming-Klunderud A, Anslan S, 2018. PacBio metabarcoding of Fungi and other eukaryotes:errors, biases and perspectives. New Phytologist, 217(3): 1370-1385 DOI:10.1111/nph.14776 |
Tse S P K, Beauchemin M, Morse D et al, 2018. Refining transcriptome gene catalogs by MS-validation of expressed proteins. Proteomics, 18(1): 1700271 DOI:10.1002/pmic.v18.1 |
van Dolah F M, 2000. Marine algal toxins:origins, health effects, and their increased occurrence. Environmental Health Perspectives, 108(Suppl 1): 133-141 DOI:10.1289/ehp.00108s1133 |
Wang D Z, Xie Z X, Zhang S F, 2014. Marine metaproteomics:current status and future directions. Journal of Proteomics, 97: 27-35 DOI:10.1016/j.jprot.2013.08.024 |
Wang F B, Hsu S B, Wang W D, 2016. Dynamics of harmful algae with seasonal temperature variations in the cove-main lake. Discrete & Continuous Dynamical System-B, 21(1): 313-335 |
Yu Z M, Sengco M R, Anderson D M, 2004. Flocculation and removal of the brown tide organism, Aureococcus anophagefferens (Chrysophyceae), using clays. Journal of Applied Phycology, 16(2): 101-110 DOI:10.1023/B:JAPH.0000044775.33548.38 |
Yu Z M, Song X X, Cao X H et al, 2017. Mitigation of harmful algal blooms using modified clays:Theory, mechanisms, and applications. Harmful Algae, 69: 48-64 DOI:10.1016/j.hal.2017.09.004 |
Yu Z M, Zou J Z, Ma X N, 1994a. pplication of clays to removal of red tide organisms I. Coagulation of red tide organisms with clays. Chinese Journal of Oceanology and Limnology, 12(3): 193-200 DOI:10.1007/BF02845163 |
Yu Z M, Zou J Z, Ma X N, 1994b. Application of clays to removal of red tide organisms Ⅱ. Coagulation of different species of red tide organisms with montmorillonite and effect of clay pretreatment. Chinese Journal of Oceanology and Limnology, 12(4): 316-324 DOI:10.1007/BF02850491 |
Yu Z M, Zou J Z, Ma X N, 1995. Application of clays to removal of red tide organisms Ⅲ. The coagulation of kaolin on red tide organisms. Chinese Journal of Oceanology and Limnology, 13(1): 62-70 DOI:10.1007/BF02845350 |
Zhang C L, Zhang J Y, 2015. Current techniques for detecting and monitoring algal toxins and causative harmful algal blooms. Journal of Environmental Analytical Chemistry, 2(1): 123 |
Zhang Q C, Qiu L M, Yu R C et al, 2012. Emergence of brown tides caused by Aureococcus anophagefferens Hargraves et Sieburth in China. Harmful Algae, 19: 117-124 DOI:10.1016/j.hal.2012.06.007 |
Zhu J N, Yu Z M, He L Y et al, 2018. Molecular mechanism of modified clay controlling the brown tide organism Aureococcus anophagefferens revealed by transcriptome analysis. Environmental Science & Technology, 52(12): 7006-7014 |
 2019, Vol. 50
2019, Vol. 50

