中国海洋湖沼学会主办。
文章信息
- 袁涌铨, 吕旭宁, 吴在兴, 贺成, 宋秀贤, 曹西华, 俞志明. 2019.
- YUAN Yong-Quan, LÜ Xu-Ning, WU Zai-Xing, HE Cheng, SONG Xiu-Xian, CAO Xi-Hua, YU Zhi-Ming. 2019.
- 北部湾典型海域关键环境因子的时空分布与影响因素
- TEMPORAL AND SPATIAL DISTRIBUTION OF MAIN ENVIRONMENTAL FACTORS IN TYPICAL SEA AREA OF THE BEIBU GULF AND ITS INFLUENCING FACTORS
- 海洋与湖沼, 50(3): 579-589
- Oceanologia et Limnologia Sinica, 50(3): 579-589.
- http://dx.doi.org/10.11693/hyhz20181100279
文章历史
-
收稿日期:2018-11-24
收修改稿日期:2019-03-22
2. 青岛海洋科学与技术国家试点实验室 海洋生态与环境科学功能实验室 青岛 266071;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory of Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
北部湾作为中国南海大陆架的天然半封闭浅海湾, 有其特定的生境特点。20世纪初广西沿海地区开始进行开发, 进入21世纪后, 北部湾经济区开发上升为国家战略, 广西的产业结构也发生了重大变化, 随着北部湾的快速发展其海洋环境面临的压力逐渐增大。近年来北部湾海域形成的赤潮频率和影响范围均呈现逐年扩大的态势, 该海域的生态安全问题成为社会关注的热点(Liu et al, 2011; Meng et al, 2013)。2014年12月该海域球形棕囊藻(Phaeocystis globosa)赤潮的暴发, 对防城港核电冷源安全构成威胁, 引起了业内学者和公众的广泛关注。
球形棕囊藻属于定鞭藻纲(Prymnesiophyceae)棕囊藻属, 是近几年我国南方近海常见的赤潮藻种。不同于一般的藻华生物, 其具有特殊的异型生活史, 包括游离单细胞和囊体两种形态(Baumann et al, 1994; Rousseau et al, 2007)。游离单细胞直径一般为3—8μm, 囊体大约几百微米, 而我国沿海发现的棕囊藻囊体直径甚至达到了3cm (Chen et al, 2002; Qi et al, 2004), 明显大于其他海域中发现的囊体(Larson et al, 1992)。囊体像一个“装满水的球”, 外被为一层薄而有弹性的半透膜, 细胞分布于外被的内表层, 内部含有一些液体(Hamm et al, 1999)。形成藻华时, 球形棕囊藻多以囊体形态存在, 除了产生溶血毒素和温室气体外(Baudoux et al, 2005; Tan et al, 2016), 大至数厘米的囊体还会堵塞滨海核电冷源用水系统, 从而威胁核电冷源安全(曹西华等, 2017)。近些年, 东南亚的大部分地区, 包括中国(Qi et al, 2004; Chen et al, 2011)、越南(Tang et al, 2004; Hai et al, 2010)、泰国、巴基斯坦、缅甸和阿拉伯海(Madhupratap et al, 2000)均有大囊体出现的报道, 球形棕囊藻赤潮对核电的潜在威胁不容忽视。
营养盐中的氮(N)和磷(P)是赤潮生物细胞中蛋白质、核苷酸等代谢过程中的必需元素, 其在水体中的浓度会直接影响浮游植物的生长, 是控制大部分赤潮生物生长的关键因子。由于不同的藻类对于N和P的需求比例不同, 因此其含量组成可以直接影响海洋初级生产力与生态系统的结构和功能(Hodgkiss et al, 1997; Flynn, 2002), 国外学者早在1963年就提出浮游植物按照N︰P=16︰1吸收海水中营养盐(Redfield et al, 1963), 且两者的比例是限制藻类生长的重要因素(Baird et al, 2004), 因此营养盐的含量和结构变化可反映海域潜在的生态安全。赤潮形成的本质是赤潮生物细胞分裂增殖的过程, 必然高度依赖营养盐、微量元素、溶解氧(DO)、pH等理化因子, 因此对该海域进行关键环境因子的调查, 了解其时空分布及影响因素, 对海区的合理开发及球形棕囊藻的藻华防控其均具有重要的现实意义。
1 材料方法 1.1 研究区域本研究海域范围为20°9'55″—21°39′55″N、108°19'39"—110°11'45"E, 覆盖北部湾大部分区域。潮流是研究海域环流的主控因素之一。除此之外, 春、夏季表层风生流弱的时候, 底层密度流加强, 从南海涌入的底部上升流影响程度高; 秋、冬季北风控制风生流加强, 底层密度流减弱, 上升流影响程度减弱。琼州海峡流对研究海域的影响较大, 风场对海峡流的强弱和流向改变起重要作用, 冬季受大陆冷空气的影响, 多东北风, 夏季风从热带海洋上来, 多西南风, 因此秋、冬季节海峡流涌入湾内的流量会季节性的加大; 由于北部湾四季整体被一个大的不闭合逆时针环流控制, 因此海峡流进入湾内后会沿雷州半岛西侧到达湾底, 并影响近岸的水体的理化条件。夏季北部湾底层存在冷水团, 呈现低温高盐的特点, 其生长周期可大致分为三个阶段:成长期(3月至5月), 强盛期(6月至8月), 消衰期(9月至11月), 受季风气候影响, 形成时间有所变化, 但基本规律不变(徐振华等, 2010;赵昌等, 2010;陈振华, 2013)。北部沿岸海域拥有众多港湾, 素有“港群”之称。湾内海底地形较为平坦, 等深线分布趋势与海岸线大致平行, 平均水深约为38m, 近湾口附近, 水深变化较大, 属于浅海半封闭性大陆海域。
1.2 样品采集与分析方法 1.2.1 采样站位2016年9月至2017年8月于北部湾进行了共计9个航次的调查。共布设29个调查站位, 详见图 1。根据调查站位的水深设置采样水层, 一般按照标准层进行采样(0、10、20、30、50m和底层)。调查参数包括:温度(T)、盐度(S)、pH、DO、溶解有机碳(DOC)、总有机碳(TOC)、亚硝氮(NO2--N)、硝氮(NO3--N)、铵氮(NH4+-N)、活性磷酸盐(SRP)、溶解硅酸盐(DSi), 共11个环境要素。
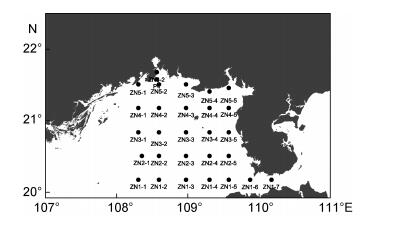 |
| 图 1 北部湾北部海域采样站位图 Fig. 1 Sampling stations in the northern Beibu Gulf |
在调査站位利用温盐深剖面仪(CTD)(SEB911 plus, Sea-Bird, 美国)配备的Niskin瓶采集各层水样。溶解氧样品采集后立即加入MnCl2和KI-NaOH固定。营养盐样品采集后立即用GF/F滤膜(Whatman)过滤, 滤液分装60、20mL各一份, 未经过滤的水样20mL一份。60mL样品加入氯仿和两份20mL样品加入氯化汞后, 同滤膜一起置于-20℃冷冻保存。60mL滤液用于测定各项营养盐浓度(NH4+-N、NO3--N、NO2--N、SRP、DSi); 过滤与未过滤的20mL滤液分别用于测定DOC、TOC。冷冻保存的各项样品均带回至实验室进行分析。
1.2.2.2 样品分析方法通过CTD获得现场温盐数据, pH在水样采集后立即用pH计(PHS-3C, 雷磁, 中国)测定, 精确度为±0.01; DO测定通过Winkler碘量法现场完成; 借助连续流动分析仪(San++ system, Skalar, 荷兰)测定样品中各项营养盐浓度, 对NO3--N、SRP、NO2--N、NH4+-N、DSi的检出限分别为0.05、0.03、0.05、0.07、0.03μmol/L; TOC和DOC样品采用高温催化氧化法, 利用总有机碳分析仪(Multi N/C 2100S, Analytik jena, 德国)测定, 检出限为4.00μg/L。
1.2.2.3 数据分析方法文中数据主要采用Suffer 13.0 (Golden Software, 美国)进行图例绘制, 利用Excel 2016(Microsoft Company, 美国)进行表格制作, 利用SPSS v19 (IBM Company, 美国)进行各项参数的显著性分析及主成分分析。
2 结果 2.1 主要N、P营养盐的时空分布特征调查期间NO3--N浓度普遍介于0—13.00μmol/L (图 2), 近岸NO3--N浓度高值区主要位于钦州湾海域和琼州海峡邻近海域, 在水温较高的6、9月, 调查海域的西南侧底层出现了浓度高于8.00μmol/L的高值区。调查期间, NO3--N浓度的最高值出现在11月份的钦州湾海域表层, 可达17.25μmol/L。2016年12月至2017年2月海峡口附近海域的表底层NO3--N浓度均高于8.00μmol/L, 且2016年12月与2017年1月NO3--N的6.00μmol/L与8.00μmol/L等浓度线基本与32等盐线吻合; 2017年3月至4月, 虽然海峡口附近有较高浓度的NO3--N出现, 但均未超过8.00μmol/L。高温季节(6、9月)调查区域西南侧浓度超过8.00μmol/L的高值区主要覆盖20°—21°N、108°—109°E, 这可能与低温高盐水的季节性上涌有关。个别月份, NO3--N在空间分布上存在反常现象, 如在海峡流加强、水体表底混合较为均匀的2月至4月, NO3--N浓度的表底分布出现了明显差异。以2月为例, 与底层相比, 表层6.00μmol/L的NO3--N等浓度线向海峡口附近出现了内缩, 3、4月的情况与2月类似。
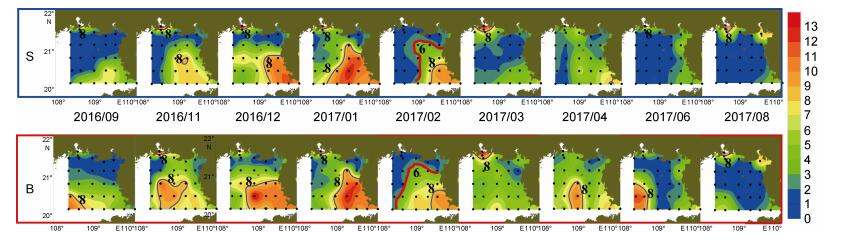 |
| 图 2 北部湾北部海域硝酸盐的表底分布 Fig. 2 The distribution of nitrate at surface and bottom in the northern Beibu Gulf 注: S为表层, B为底层 |
调查期间SRP浓度介于0.40—1.30μmol/L(图 3), 高值区在不同月份的分布规律与NO3--N类似, 浓度最高值出现在11月份底层的ZN3-2站位, 可达1.22μmol/L。表层仅茅尾海海域在2016年11月和2017年1月, 出现了浓度高于1.00μmol/L的站位, 其余月份的SRP浓度均处于较低水平, 最低值出现于2017年8月, 平均浓度为0.34μmol/L。受海峡流和低温高盐水的共同影响, 底层SRP的浓度整体高于表层, 且浓度高于0.60μmol/L的海域面积较表层更广。2016年9月至12月, 底层浓度高于1.00μmol/L的高值区逐渐向东移动, 12月移至109°13′E。2017年1月至3月表底层SRP的平均浓度逐渐降低, 最低值出现于3月份的表层, 为0.55μmol/L, 4月表底层浓度均有所回升。6月底层浓度高于1.0μmol/L的高值区覆盖海域最广, 主要位于30m等深线以深, 这可能与冷水团的出现有关。2月至4月, 表层SRP浓度与NO3--N类似, 异常低于底层; 以2月为例、与底层相比, 0.60μmol/L的SRP等浓度线向海峡口附近出现了内缩, 3、4月的情况与2月类似。
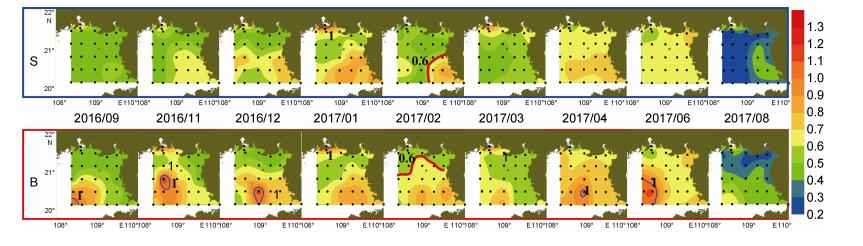 |
| 图 3 北部湾北部海域磷酸盐的表底分布 Fig. 3 The distribution of phosphate at surface and bottom in the northern Beibu Gulf |
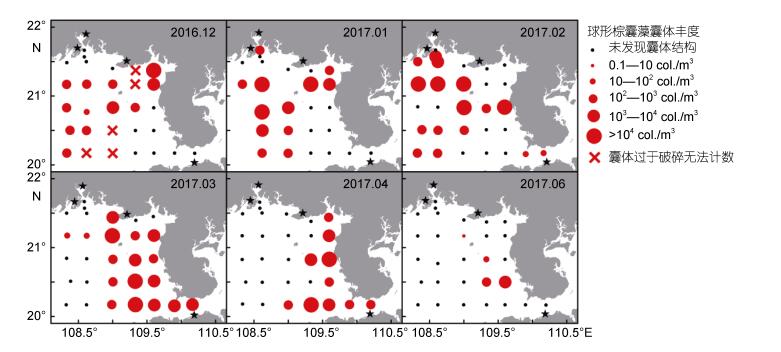
调查期间TOC浓度(以C计, 下同)普遍介于0—4.00mg/L之间(图 4), 整体呈近岸高、远岸低的分布态势, 最高值出现于2017年3月的英罗港附近海域, 浓度可达11.21mg/L。调查期间钦州湾海域始终存在浓度大于2.00mg/L的站位, 其中夏秋季节浓度可达3.00mg/L, 这可能与该季节降水增多带来的陆源污染有关。2017年3月在表底层均出现了浓度高于7.00mg/L的高值区, 均值可达2.92mg/L; 当月表底层的TOC平均浓度分别达到了2.20、3.14mg/L, 显著高于2月(1.37mg/L)、4月(1.44mg/L)平均浓度(P < 0.05)。调查过程中3月份在109°E以东海域的大部分站位, 囊体密度高于100ind./m3, 这与底层高值区的位置较为吻合, 底层浓度的升高可能与囊体衰亡期的沉降有关。除3月和9月外, 其他月份平均TOC浓度介于1.20—1.90mg/L, 最低值出现于1月份, 为1.27mg/L。调查期间各月份表底均值之间均无显著性差异(P > 0.05)。
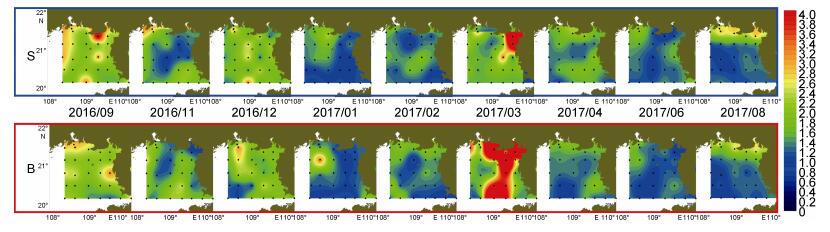 |
| 图 4 北部湾北部海域TOC的表底分布 Fig. 4 The distribution of TOC at surface and bottom in the northern Beibu Gulf |
调查期间DOC的浓度(以C计, 下同)普遍介于0—2.50mg/L (图 5), 最高值出现于2016年9月的钦州湾附近海域, 浓度可达3.51mg/L。与TOC分布类似, 秋季的9、11月的DOC浓度较高, 均值大于1.70mg/L, 高于其他月份。2016年12月DOC浓度有所下降, 均值浓度为1.64mg/L, 1月份浓度进一步降低, 均值浓度为0.95mg/L。2月至4月浓度有所升高, 均值浓度均超过了1.14mg/L, 8月浓度又降至1.10mg/L以下。2月至4月为囊体丰度较高(贺成等, 2019), DOC浓度的回升可能与囊体的出现有关。各月份的表底DOC平均浓度均无显著性差异(P > 0.05), 且表底分布较为一致, 平均浓度介于0.94—1.80mg/L, 与渤海、黄海相比, 调查海域的DOC浓度普遍偏低(丁雁雁等, 2012)。
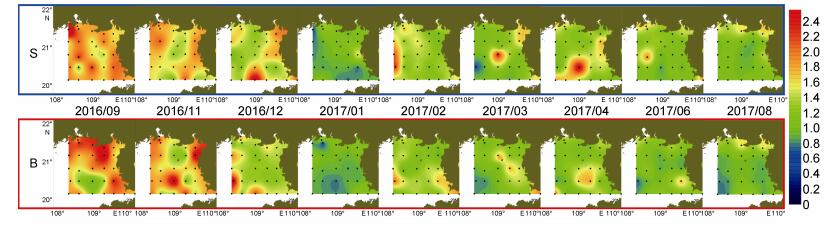 |
| 图 5 北部湾北部海域DOC的表底分布 Fig. 5 The distribution of DOC at surface and bottom in the northern Beibu Gulf |
调查期间DO浓度介于2.00—10.00mg/L (图 6), 整体呈表层高、底层低, 低温季节高、高温季节低的分布趋势。DO低值区主要位于20°—21°N、108°—109°E的底层海域, 最低值出现于2016年9月的底层, 为1.98mg/L。月度分布上, DO浓度小于5mg/L的低值区影响范围自2016年9月至2017年1月不断缩小, 2016年9月底层DO均值低于5.20mg/L, 而2017年1月底层DO均值高于7.70mg/L。2017年2月至3月在雷州半岛西侧的部分站位, 表层DO浓度高于9.50mg/L, 且表层DO浓度均值分别达到了8.38、8.54mg/L, 其他月份表层DO浓度均值均不超过7.80mg/L。4月至8月调查海域西南侧的底层出现了浓度低于4.00mg/L的低值区。
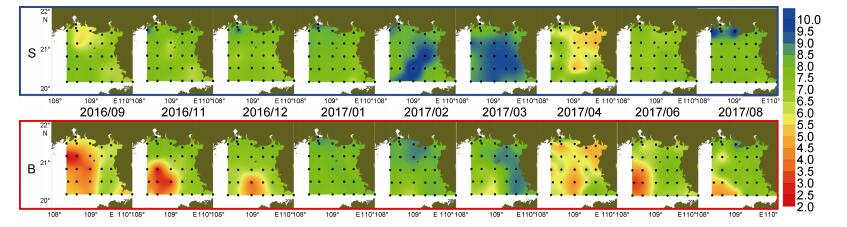 |
| 图 6 北部湾北部海域DO的表底分布 Fig. 6 The distribution of DO at surface and bottom in the northern Beibu Gulf |
调查海域pH介于7.80—8.40, 整体呈表层高、底层低的分布态势(图 7)。pH低于8.10的站位主要位于20°—21°N、108°—109°E的底层海域, 该低值区与2016年9月至12月DO浓度小于5.50mg/L的低值区相对应, 2016年9月ZN4-1站位pH值最低、仅为7.83。自2016年9月至2017年12月pH低值区影响范围不断缩小。2017年1月至2月, pH的表底分布较为一致, 且高于其他月份, 表底层的pH均值均大于8.17。2017年4月表底层的pH均值低于8.12, 表层均值略高于底层; 同期DO浓度也出现了下降(图 6), 且表层高于底层, 鉴于4月份整体温度不高, 未产生层化现象, 因此推测4月pH与DO浓度的整体下降及表底差异可能与生物活动有关。4月至8月调查海域的pH逐渐升高, 8月表底层的pH均值均高于8.15。
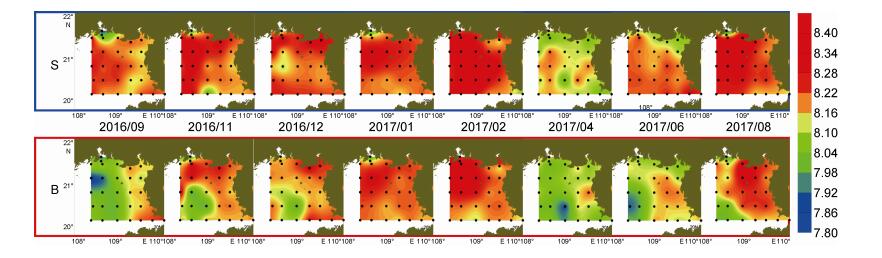 |
| 图 7 北部湾北部海域pH的表底分布 Fig. 7 The distribution of pH at surface and bottom in the northern Beibu Gulf 注: 3月因仪器故障, 未获得pH数据 |
海洋中各生态因子之间的相互关系较为复杂, 因此常采用多元统计分析方法从诸多参数中找到获取一定的规律。其中, 主成分分析可以去掉冗余信息因子以提高分析的准确性, 是目前进行环境因子综合分析的常用方法。为此, 本文选择T、S、DO、pH、TOC、DOC、NO3--N、SRP、NO2--N、NH4+-N、DSi等可能影响该海区浮游植物生长的环境因子进行主成分分析, 根据特征值大于1的原则, 提取主成分。对各月份第一主成份的方差贡献率进行统计后发现, 不同月份的第一主成分方差贡献率介于30.88%—45.18%之间, 这表明第一主成分能较为全面地反映原来11个环境因子的信息。对不同月份得分系数矩阵中的第一主成分进行统计后(表 1), 可以看出物理因子中的DO、pH, 化学因子中的NO3--N、SRP、DSi在各个月份中均有较高得分(各月份得分系数的绝对值均值均高于0.16), 因此可以认为NO3--N、SRP、DSi为影响该海域浮游植物生长的主要化学因子, 其分布和月度变化能够较为客观的反映该海域的生物活动。
| 环境因子 | 不同月份第一主成分中的得分系数 | ||||||||
| 2016.09 | 2016.11 | 2016.12 | 2017.01 | 2017.02 | 2017.03 | 2017.04 | 2017.06 | 2017.08 | |
| T | –0.17 | –0.05 | 0.14 | –0.21 | 0.01 | –0.13 | –0.17 | –0.18 | –0.06 |
| S | 0.10 | 0.04 | 0.10 | –0.23 | 0.01 | –0.10 | 0.19 | 0.08 | –0.10 |
| DO | –0.20 | –0.23 | –0.20 | 0.16 | –0.14 | –0.17 | –0.10 | –0.20 | –0.08 |
| pH | –0.19 | –0.06 | –0.19 | –0.11 | –0.18 | - | –0.15 | –0.19 | –0.18 |
| TOC | –0.04 | –0.02 | –0.08 | 0.07 | –0.12 | 0.00 | –0.15 | 0.01 | 0.00 |
| DOC | –0.03 | 0.00 | 0.05 | 0.13 | 0.04 | 0.01 | –0.03 | 0.03 | 0.04 |
| NO3--N | 0.14 | 0.27 | 0.17 | 0.05 | 0.20 | 0.23 | 0.16 | 0.17 | 0.18 |
| SRP | 0.21 | 0.29 | 0.21 | 0.16 | 0.20 | 0.24 | 0.21 | 0.20 | 0.16 |
| NO2--N | 0.07 | 0.00 | 0.06 | –0.06 | 0.20 | 0.12 | 0.06 | 0.05 | 0.18 |
| NH4+-N | 0.01 | 0.07 | –0.02 | 0.18 | –0.02 | 0.15 | –0.03 | –0.03 | 0.16 |
| DSi | 0.19 | 0.28 | 0.19 | 0.17 | 0.18 | 0.23 | 0.21 | 0.15 | 0.18 |
| 注: T:温度; S:盐度; DO:溶解氧; DOC:溶解有机碳; TOC:总有机碳; NO2--N:亚硝氮; NO3--N:硝氮; NH4+-N:铵氮; SRP:活性磷酸盐; DSi:溶解硅酸盐; 2016.09表示采样时间为2016年9月, 余同; “-”代表数据缺失 | |||||||||
进一步对9个航次中叶绿素和五项营养盐(NO3--N、SRP、NO2--N、NH4+-N、DSi)的水柱平均值进行相关性分析后发现, NO3--N、SRP、DSi与叶绿素均呈极显著负相关(P < 0.01)(表 2), 相关系数也高于NO2--N和NH4+-N。这表明相比NO2--N和NH4+-N, 浮游植物的生长会大量消耗NO3--N、SRP、DSi, 同时也印证了主成分分析的结果。
| 指标 | NO3--N | SRP | NO2--N | NH4+-N | DSi |
| 相关系数 | -0.25** | -0.45** | -0.17* | 0.01 | -0.22** |
| 置信度 | 0.00 | 0.00 | 0.03 | 0.88 | 0.00 |
| 样本数 | 172 | 172 | 172 | 172 | 172 |
| 注: *表示在置信度(双测)为0.05时, 相关性显著; **表示在置信度(双测)为0.01时, 相关性显著 | |||||
北部湾海域的水团组成主要受季风和入海河流、琼州海峡流、外海底层上升流等主要流系影响(徐振华等, 2010;赵昌等, 2010;陈振华, 2013)。为了解不同海域影响NO3--N和SRP分布的水文条件, 依据调查期间的现场温度、盐度资料, 将研究海域被划分为3个区域(图 8), 分别为区域Ⅰ: 10m以浅站位所处海域、主要受陆源输入影响, 区域Ⅱ:除区域Ⅰ和Ⅲ外, 剩余站位所处海域, 受海峡流、外海高盐水输入影响的混合水体, 区域Ⅲ: 109°E以西, 30m等深线以深站位所处海域, 底层受外海高盐水输入影响; 在不同调查时期对不同区域内的NO3--N、SRP与盐度进行了相关性分析, 结果如表 2所示。
 |
| 图 8 调查站位区域划分 Fig. 8 The division of sampling stations 注:区域Ⅰ: 10m以浅站位所处海域; 区域Ⅱ:除区域Ⅰ和Ⅲ外, 剩余站位所处海域; 区域Ⅲ: 109°E以西, 30m等深线以深站位所处海域。 |
如表 3所示, 区域Ⅰ中NO3--N与盐度在不同时期呈显著负相关(P < 0.01), 表明地表径流为该区域中NO3--N的主要来源。SRP在2016年9月至2017年4月与盐度呈显著负相关(P < 0.01), 在2017年6月至8月与盐度的相关性较弱(P > 0.05)。SRP作为重要的非保守性营养要素, 一方面受到浮游植物的吸收消耗所转移, 另一方面受到泥沙吸附和释放的影响(徐明德等, 2006)。由于北部湾的降水集中在7月至9月(苏志等, 2009), 因此6月至8月受降水影响, 靠近河口的浑浊带海域蕴含的泥沙会对SRP的浓度产生一定的影响, 这可能是导致SRP与盐度相关性较弱的原因。国内学者于2014年对广西北部湾的主要入海河流防城江、茅岭江、钦江、大风江、南流江的污染物的入海量进行监测, 结果表明主要河流的污染物入海通量约为175596.02吨, 其中总氮约占37.8%, 总磷约占2.0%(李斌等, 2018)。本文的分析与前人的研究结果类似, 均表明近岸以NO3--N为主的氮源污染主要来自于地表径流。本研究结果与我国其他近岸海域的研究结果类似(郑丙辉等, 2008;周毅频等, 2012)。
| 区域 | 调查月份 | 样本数(ind.) | NO3--N(μmol/L) | SRP (μmol/L) |
| 区域Ⅰ | 2016.09—2016.12 | 52 | -0.59** | -0.53** |
| 2017.01—2017.04 | 72 | -0.68** | -0.65** | |
| 2017.06—2017.08 | 35 | -0.76** | 0.06 | |
| 区域Ⅱ | 2016.09—2016.12 | 112 | 0.23* | 0.55** |
| 2017.01—2017.04 | 147 | -0.22** | -0.12 | |
| 2017.06—2017.08 | 69 | -0.39** | 0.31** | |
| 区域Ⅲ | 2016.09—2016.12 | 94 | 0.33** | 0.57** |
| 2017.01—2017.04 | 113 | 0.02 | 0.31** | |
| 2017.06—2017.08 | 51 | 0.42** | 0.46** | |
| 注: **表示P < 0.01水平下极显著相关; *表示P < 0.05水平下显著相关; 其他均为P > 0.05, 相关性不显著。 | ||||
据苏纪兰(2005)对北部湾的水团划分, 区域Ⅱ主要为琼州海峡流和外海高盐水组成的混合水团。该水团影响范围随季节而异: 8月至9月最小, 12月至翌年3月最大, 10月后沿岸水范围逐渐缩小, 混合水团逐步扩大, 4月至6月因沿岸水势力的扩展, 混合水团的范围也逐步退缩。2016年9月至12月, NO3--N, SRP与盐度均呈显著正相关(P < 0.01), 此时的NO3--N、SRP主要来自于盐度较高的南海水。2017年1月至4月, NO3--N、SRP与盐度均呈负相关, 这是由于琼州海峡流的季节性加强, 低盐的沿岸水带来了高浓度的NO3--N和SRP所致; 但NO3--N与盐度的相关系数却低于6月至8月, 表明区域Ⅱ在1月至4月可能发生了NO3--N的大量消耗。
在调查期间, 区域Ⅲ中NO3--N、SRP与盐度均呈显著正相关, 且SRP与盐度均呈显著正相关(P < 0.01), 这表明该海域的NO3--N、SRP主要来自于高盐度的南海水, 在1月至4月NO3--N、SRP与盐度相关系数的减小可能是由于琼州海峡流的季节性加强, 深层南海水向南衰退所致。
3.2.2 生物活动对N、P营养盐的影响如前所述, 在海峡流加强、水体表底混合较为均匀的2月至4月, 表层的NO3--N、SRP浓度低于底层。同期囊体丰度最高(图 9), 因此可能是囊体对表层的NO3--N、SRP进行了同步吸收, 导致了表底差异。已有研究发现球形棕囊藻囊体具有正向的浮力, 暴发季节多位于水体上层(Skreslet, 1988; Peperzak et al, 2003)。由于囊体能够大量利用硝酸盐(Riegman et al, 1996; Smith et al, 2014), 喜好较高的氮磷比(王艳等, 2007), 且Arrigo等(2002)对南极棕囊藻的研究也表明其吸收NO3--N与SRP的比例高于16, 因此推测在囊体大规模出现的月份, 调查海域表层的氮磷比(NO3--N/SRP)会有所降低。为此在囊体丰度较高的2月至3月, 对表底层站位的NO3--N/SRP进行了均值统计(图 9), 其中站位分为两类, 包含有囊体且表底层NO3--N浓度差值大于1.00μmol/L的站位和无囊体站位。结果如表 4所示, 在2017年2月至3月, 有囊体站位表层的NO3--N/SRP显著低于底层(P < 0.01), 底层与表层之差均大于4.5μmol/L, 无囊体站位表底层的NO3--N/SRP之差不超过2μmol/L, 表底之间无显著性差异(P > 0.05)。通过进一步分析2月和3月NO3--N和SRP表底层差值与囊体丰度的相关性, 发现两者均与囊体丰度呈正相关(图 10), 但NO3--N表底层差值与囊体丰度之间的相关性强于SRP, 且两个月份NO3--N拟合方程的斜率均高于SRP, 这验证了我们的猜想。
| NO3--N/SRP | 调查月份 | |||
| 2017.02 (有囊体站位) |
2017.02 (无囊体站位) |
2017.03 (有囊体站位) |
2017.03 (无囊体站位) |
|
| 表层 | 1.07 ± 0.50 | 5.23 ± 4.52 | 1.46 ± 0.94 | 4.49 ± 4.60 |
| 底层 | 9.06 ± 1.65 | 5.21 ± 4.50 | 6.36 ± 1.71 | 6.29 ± 3.98 |
| 表层-底层 | -7.98 ± 1.16 | 0.02 ± 0.79 | -4.90 ± 1.70 | -1.80 ± 2.08 |
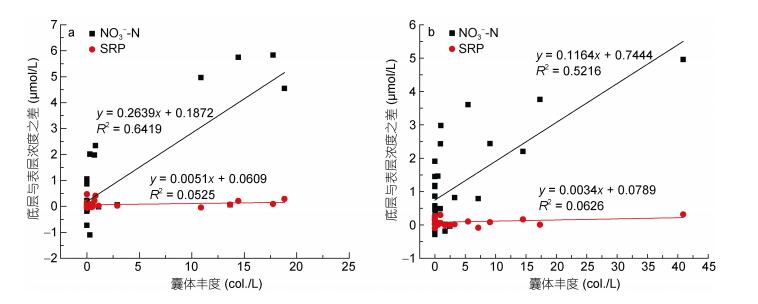 |
| 图 10 2月(a)和3月(b) NO3--N/SRP表底层差值与囊体丰度的相关性 Fig. 10 Correlation of NO3--N/SRP difference in surface and bottom layer to the colony abundance in February (a) and March |
(1) NO3--N、SRP的时空分布具有一致性, 高值区主要出现在近岸钦州湾海域、海峡口附近海域及30m等深线以深海域, 各月份TOC、DOC的表底浓度无明显差异(P < 0.05), 高温季节DO、pH的低值区主要位于30m等深线以深的底层海域;
(2) DO、pH、NO3--N、SRP、DSi为影响该海域浮游植物生长的主要理化因子;
(3) 10m以浅站位所处海域中NO3--N浓度主要受地表径流带来的陆源污染影响; 109°E以西, 30m等深线以深站位所处海域中NO3--N、SRP全年受到南海高盐水的影响; 剩余站位所处海域中NO3--N、SRP在秋季受到南海水向北入侵影响, 春冬季受来自琼州海峡的混合水影响;
(4) 在囊体丰度较高的2017年2月至3月, 有囊体站位表层的NO3--N/SRP显著低于底层(P < 0.01), 无囊体站位表底层的NO3--N/SRP之间无显著性差异(P > 0.05), 这表明春季NO3--N与SRP的表底分布差异及月度变化可能与该海域内球形棕囊藻囊体的生消有关。
致谢 自然资源部第二海洋研究所管卫兵研究员课题组提供温度、盐度数据, 中国科学院海洋研究所李才文研究员课题组提供囊体丰度相关数据, 在此深表感谢。
丁雁雁, 张传松, 石晓勇, 等. 2012. 春季黄渤海溶解有机碳的平面分布特征. 环境科学, 33(1): 37-41 |
王艳, 齐雨藻, 李韶山. 2007. 球形棕囊藻生长的营养需求研究. 水生生物学报, 31(1): 24-29 DOI:10.3321/j.issn:1000-3207.2007.01.004 |
苏志, 余纬东, 黄理, 等. 2009. 北部湾海岸带的地理环境及其对气候的影响. 气象研究与应用, 30(3): 44-47 DOI:10.3969/j.issn.1673-8411.2009.03.012 |
苏纪兰. 2005. 中国近海水文. 北京: 海洋出版社
|
李斌, 谭趣孜, 李蕾鲜, 等. 2018. 2014年北部湾主要河流污染状况及污染物入海通量. 广西科学, 25(02): 172-180 |
陈振华, 2013.北部湾环流季节变化的数值模拟与动力机制分析.青岛: 中国海洋大学博士学位论文, 92
|
周毅频, 李绪录, 张军晓, 等. 2012. 大鹏湾中溶解态总氮和总磷的多年调查结果分析. 生态环境学报, 21(4): 706-710 DOI:10.3969/j.issn.1674-5906.2012.04.020 |
郑丙辉, 曹承进, 秦延文, 等. 2008. 三峡水库主要入库河流氮营养盐特征及其来源分析. 环境科学, 29(1): 1-6 |
赵昌, 吕新刚, 乔方利. 2010. 北部湾潮波数值研究. 海洋学报, 32(4): 1-11 DOI:10.3969/j.issn.1009-5470.2010.04.001 |
贺成, 宋书群, 李才文. 2019. 广西北部湾海域球形棕囊藻囊体时空分布及其影响因素. 海洋与湖沼, 50(3) |
徐明德, 韦鹤平, 李敏, 等. 2006. 长江口泥沙与沉积物对磷酸盐的吸附和解吸研究. 太原理工大学学报, 37(1): 48-50 DOI:10.3969/j.issn.1007-9432.2006.01.015 |
徐振华, 雷方辉, 娄安刚, 等. 2010. 北部湾潮汐潮流的数值模拟. 海洋科学, 34(2): 10-14 |
曹西华, 俞志明, 邱丽霞. 2017. 改性黏土法消除球形棕囊藻赤潮的现场实验与效果评估. 海洋与湖沼, 48(4): 753-759 |
Arrigo K R, Dunbar R B, Lizotte M P et al, 2002. Taxon‐specific differences in C/P and N/P drawdown for phytoplankton in the Ross Sea, Antarctica. Geophysical Research Letters, 29(19): 1938 |
Baird M E, Middleton J H, 2004. On relating physical limits to the carbon: nitrogen ratio of unicellular algae and benthic plants. Journal of Marine Systems, 49(1-4): 169-175 DOI:10.1016/j.jmarsys.2003.10.007 |
Baudoux A C, Brussaard C P D, 2005. Characterization of different viruses infecting the marine harmful algal bloom species Phaeocystis globosa. Virology, 341(1): 80-90 DOI:10.1016/j.virol.2005.07.002 |
Baumann M E M, Lancelot C, Brandini F P et al, 1994. The taxonomic identity of the cosmopolitan prymnesiophyte Phaeocystis: a morphological and ecophysiological approach. Journal of Marine Systems, 5(1): 5-22 DOI:10.1016/0924-7963(94)90013-2 |
Chen S W, Gao K S, 2011. Solar ultraviolet radiation and CO2-induced ocean acidification interacts to influence the photosynthetic performance of the red tide alga Phaeocystis globosa (Prymnesiophyceae). Hydrobiologia, 675(1): 105-117 DOI:10.1007/s10750-011-0807-0 |
Chen Y Q, Wang N, Zhang P et al, 2002. Molecular evidence identifies bloom-forming Phaeocystis (Prymnesiophyta) from coastal waters of southeast China as Phaeocystis globosa. Biochemical Systematics and Ecology, 30(1): 15-22 DOI:10.1016/S0305-1978(01)00054-0 |
Flynn K J, 2002. How critical is the critical N:P ratio?. Journal of Phycology, 38(5): 961-970 DOI:10.1046/j.1529-8817.2002.t01-1-01235.x |
Hai D N, Lam N N, Dippner J W, 2010. Development of Phaeocystis globosa blooms in the upwelling waters of the South Central coast of Viet Nam. Journal of Marine Systems, 83(3-4): 253-261 DOI:10.1016/j.jmarsys.2010.04.015 |
Hamm C E, Simson D A, Merkel R et al, 1999. Colonies of Phaeocystis globosa are protected by a thin but tough skin. Marine Ecology Progress Series, 187: 101-111 DOI:10.3354/meps187101 |
Hodgkiss I J, Ho K C, 1997. Are changes in N: P ratios in coastal waters the key to increased red tide blooms?. Hydrobiologia, 352(1-3): 141-147 |
Larson A, Kirk M M, Kirk D L, 1992. Molecular phylogeny of the volvocine flagellates. Molecular Biology and Evolution, 9(1): 85-105 |
Liu Z H, Yu J H, Zhang D, 2011. Study on low-carbon building ecological city construction in harmonious Beibu Gulf culture. Procedia Environmental Sciences, 10: 1881-1886 DOI:10.1016/j.proenv.2011.09.294 |
Madhupratap M, Sawant S, Gauns M, 2000. A first report on a bloom of the marine prymnesiophycean, Phaeocystis globosa from the Arabian Sea. Oceanologica Acta, 23(1): 83-90 DOI:10.1016/S0399-1784(00)00109-2 |
Meng F P, Wang Z F, Cheng F L et al, 2013. The assessment of environmental pollution along the coast of Beibu Gulf, northern South China Sea: An integrated biomarker approach in the clam Meretrix meretrix. Marine environmental research, 85: 64-75 DOI:10.1016/j.marenvres.2013.01.003 |
Peperzak L, Colijn F, Koeman R et al, 2003. Phytoplankton sinking rates in the Rhine region of freshwater influence. Journal of Plankton Research, 25(4): 365-383 DOI:10.1093/plankt/25.4.365 |
Qi Y Z, Chen J F, Wang Z H et al, 2004. Some observations on harmful algal bloom (HAB) events along the coast of Guangdong, southern China in 1998. Hydrobiologia, 512(1-3): 209-214 DOI:10.1023/B:HYDR.0000020329.06666.8c |
Redfield A C, Ketchum B H, Richards F A, 1963. The influence of organisms on the chemical composition of seawater. In: Hill M N ed. The Sea. New York: Wiley Interscience, 26—79
|
Riegman R, Van Boekel W, 1996. The ecophysiology of Phaeocystis globosa: a review. Journal of Sea Research, 35(4): 235-242 DOI:10.1016/S1385-1101(96)90750-9 |
Rousseau V, Chrétiennot-Dinet M J, Jacobsen A et al, 2007. The life cycle of Phaeocystis: state of knowledge and presumptive role in ecology. Biogeochemistry, 83(1-3): 29-47 DOI:10.1007/s10533-007-9085-3 |
Skreslet S, 1988. Buoyancy in Phaeocystis pouchetii (Hariot) Lagerheim. Journal of Experimental Marine Biology and Ecology, 119(2): 157-166 DOI:10.1016/0022-0981(88)90230-4 |
Smith W O Jr, Liu X, Tang K W et al, 2014. Giantism and its role in the harmful algal bloom species Phaeocystis globosa. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 101: 95-106 DOI:10.1016/j.dsr2.2012.12.005 |
Tan S, Hu X L, Yin P H et al, 2016. Photosynthetic inhibition and oxidative stress to the toxic Phaeocystis globosa caused by a diketopiperazine isolated from products of algicidal bacterium metabolism. Journal of Microbiology, 54(5): 364-375 DOI:10.1007/s12275-016-6012-0 |
Tang D L, Kawamura H, Doan-Nhu H et al, 2004. Remote sensing oceanography of a harmful algal bloom off the coast of southeastern Vietnam. Journal of Geophysical Research: Oceans, 109(C3): C03014 |
 2019, Vol. 50
2019, Vol. 50