
中国海洋湖沼学会主办。
文章信息
- 赵越, 于仁成, 张清春, 孔凡洲, 亢振军, 曹振轶, 耿慧霞, 郭伟, 周名江. 2019.
- ZHAO Yue, YU Ren-Cheng, ZHANG Qing-Chun, KONG Fan-Zhou, KANG Zhen-Jun, CAO Zhen-Yi, GENG Hui-Xia, GUO Wei, ZHOU Ming-Jiang. 2019.
- 北部湾海域微型、微微型浮游植物类群季节变化及其与棕囊藻赤潮的关系初探
- RELATIONSHIP BETWEEN SEASONAL VARIATION OF PICO-AND NANO-PHYTOPLANKTON ASSEMBLAGES AND PHAEOCYSTIS RED TIDES IN BEIBU GULF
- 海洋与湖沼, 50(3): 590-600
- Oceanologia et Limnologia Sinica, 50(3): 590-600.
- http://dx.doi.org/10.11693/hyhz20180700183
文章历史
-
收稿日期:2018-07-24
收修改稿日期:2018-09-26
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071;
5. 北部湾大学 广西北部湾海洋灾害研究重点实验室 钦州 535011;
6. 自然资源部第二海洋研究所 卫星海洋环境动力学国家重点实验室 杭州 310012;
7. 中国海洋大学食品科学与工程学院 青岛 266003
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
5. Beibu Gulf University, Guangxi Key Laboratory of Marine Disaster in the Beibu Gulf, Guangxi, Qinzhou 535011, China;
6. State Key Laboratory of Satellite Ocean Environment Dynamics, Second Institute of Oceanography, Ministry of Natural Resources, Hangzhou 310012, China;
7. Ocean University of China, College of Food Science and Engineering, Qingdao 266003, China
浮游植物是海洋中重要的初级生产者, 对渔业资源、生物地球化学循环和气候变化等具有重要的支撑和调控作用。根据浮游植物粒径大小, 可以将其分为小型(20—200μm)、微型(2—20μm)和微微型(< 2μm)浮游植物(Sieburth et al, 1978)。其中, 微型和微微型浮游植物又可以分为微型真核藻类、微微型真核藻类、以及微微型原核藻类聚球藻(Synechococcus spp.)和原绿球藻(Prochlorococcus spp.)等。微型和微微型浮游植物具有重要的生态学功能, 如微微型浮游植物贡献了热带寡营养盐大洋海域超过50%的初级生产力(Agawin et al, 2000);在近海生态系统中, 尽管小型浮游植物的比例会随营养盐浓度的升高而有所增加, 但是微型和微微型浮游植物仍是重要的初级生产力贡献者(Wang et al, 1997;刘子琳等, 1998)。此外, 许多微型真核藻类, 如棕囊藻(Phaeocystis)、东海原甲藻(Prorocentrum donghaiense)和米氏凯伦藻(Karenia mikimotoi)等, 均是我国近海重要的赤潮原因种。
棕囊藻(Phaeocystis)隶属定鞭藻门(Haptophyta)、颗石藻纲(Coccolithophyceae), 是一类具有单细胞和囊状群体两种生活形态的浮游微藻, 在南、北极海域、欧洲北海、东南亚和阿拉伯海等海域均有分布(Lancelot et al, 1987; Smith et al, 1991; Baumann et al, 1994b; Schoemann et al, 2005)。棕囊藻对全球碳、硫循环和气候变化具有重要调节作用(Keller et al, 1989; Baumann et al, 1994a; DiTullio et al, 2000)。目前已报道的棕囊藻共有10种, 其中球形棕囊藻(Phaeocystis globosa)、波切棕囊藻(P. pouchetii)和南极棕囊藻(P. antarctica)等都是常见的赤潮原因种, 通常以囊状群体形式形成赤潮。在我国东南沿海, 由球形棕囊藻形成的赤潮非常常见, 造成了巨大的经济损失(陈菊芳等, 1999; Chen et al, 2002;于仁成等, 2016)。自2011年以来, 北部湾海域开始出现球形棕囊藻赤潮。球形棕囊藻形成的巨型囊体(giant colony), 直径可达数厘米, 极易引起网具堵塞, 对北部湾沿海一线核电厂冷源安全构成了潜在威胁。因此, 北部湾海域球型棕囊藻赤潮的成因及其预警预测问题受到高度关注。
球形棕囊藻具有复杂的生活史, 能够以游离细胞和囊状群体两种形式存在于海水中, 赤潮时常为囊状群体。球形棕囊藻游离细胞微小, 粒径仅有3—9μm (Rousseau et al, 1994; Peperzak et al, 2000), 通过传统的镜检手段难以及时进行检测和预警。目前, 对于自然环境中球形棕囊藻生活史过程及其调控因素等认识仍然非常有限, 难以确定球型棕囊藻自游离细胞向囊状群体转换的关键控制因子。这在很大程度上限制了对球型棕囊藻赤潮的有效监测和预警。以往研究表明, 棕囊藻赤潮发生时, 浮游植物群落也会发生相应的改变。棕囊藻赤潮常常出现在硅藻赤潮之后(Sanderson et al, 2008), 推测是硅藻的硅质壳为棕囊藻游离细胞提供了附着基质, 有利于其囊状群体的形成。也有研究发现, 球形棕囊藻能够抑制另外一种有害藻华原因种——卡盾藻(Chattonella sp.)的生长(Liu et al, 2010)。在棕囊藻赤潮生消过程中, 异养细菌和病毒的丰度和群落结构也会发生变化(Seymour et al, 2008)。因此, 通过对目标海域球形棕囊藻赤潮生消过程中典型浮游植物类群的跟踪调查, 有可能找出与棕囊藻赤潮密切相关的微藻种类, 为棕囊藻赤潮的监测和预警提供手段和依据。
本研究以北部湾海域浮游植物群落为对象, 通过9个航次的调查, 跟踪研究了球型棕囊藻赤潮生消过程中典型浮游植物类群以及主要环境因子的变化状况, 以期揭示各典型浮游植物类群的季节变化特征, 进而探讨将其用于球形棕囊藻赤潮监测和预警的可能性与有效性。
1 材料与方法 1.1 调查海域本研究分别于2016年9、11、12月, 2017年1、2、3、4、6和8月期间, 搭载“海顺六号”科学考察船, 在北部湾海域开展了浮游植物样品的采集和分析。调查站位如图 1所示, 在调查海域自南至北共设置5条断面(ZN1—5), 共29个调查站位。
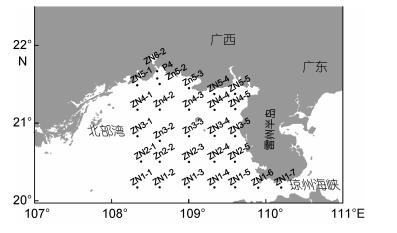 |
| 图 1 北部湾海域调查站位示意图 Fig. 1 The sampling sites in the Beibu Gulf |
采用CTD(海鸟911)观测各站位的温度和盐度, 并采集不同水层(表层, 10m, 30m, 底层等)海水样品。自每层取4mL海水样品, 经20μm筛娟过滤后, 加入400μL 10%的多聚甲醛溶液(终浓度1%)固定, 用于流式细胞仪分析。海水样品在室温下固定10—15min后, 先置于液氮中保存, 待运回实验室后在–80℃冰箱中保存直至检测。
1.3 流式细胞仪分析采用流式细胞仪对海水样品中原绿球藻、聚球藻、微微型真核藻类和微型真核藻类等4类典型浮游植物类群进行鉴别, 并测定其丰度。固定的海水样品在20℃解冻后, 用流式细胞仪(BD Accuri, C6, 美国)进行分析。该流式细胞仪配备488nm和635nm双激光, 样品检测时阈值调至红色荧光通道, 以区分自养生物和异养细菌。对4类浮游植物类群的判别标准主要根据以下参数:与细胞大小有关的前向散射信号(FSC), 与细胞内部复杂程度有关的侧向散射信号(SSC), 与藻红蛋白荧光有关的橙色荧光信号(FL2, 585±40nm), 以及与叶绿素荧光相关的红色荧光信号(FL3, > 670nm)。4类浮游植物的流式细胞分析图如图 2所示, 其中微型真核藻类在4个类群中个体最大、叶绿素含量最高, 因此FL3—H和FSC—H信号最高; 微微型真核藻类粒径小于2μm, 可参照2μm荧光微球(Polysciences)的FSC信号鉴别, 但其FL3信号大于自养原核藻类; 聚球藻富含藻红蛋白, 可以通过较高的FL2信号与其他类群区分; 原绿球藻细胞最小, 叶绿素含量也相对较低, 可以通过FSC和FL3信号进行判别。每一样品在“慢速”状态下测量3min, 并记录各类群的丰度。
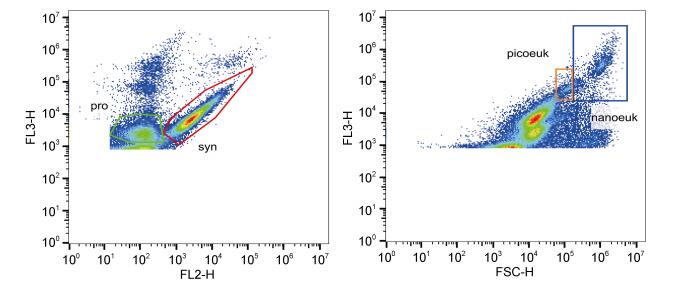 |
| 图 2 海水样品中4类浮游植物类群流式分析结果示意图 Fig. 2 Flow-cytometry plots of four major phytoplankton assemblages in seawater samples 注: pro:原绿球藻; syn:聚球藻; picoeuk:微微型真核藻类; nanoeuk:微型真核藻类; 样品来自8月航次ZN5-2站位7m层 |
采用CFlow Plus和Flow Jo V10软件, 对流式细胞仪测量的4类浮游植物类群丰度数据进行处理和分析。采用SPSS 21.0进行统计分析, 通过t-test进行差异显著性检验, 通过Pearson相关系数进行相关性检验。文中折线图、箱形图采用Origin 9.1软件绘制, 等值线图采用Surfer 12软件绘制。
2 结果 2.1 北部湾海域温度和盐度的季节变化北部湾海域调查期间海水温度和盐度平均值的变化情况如图 3和图 4所示。在执行的9个航次中, 2017年8月海水平均温度最高, 达29.88℃; 2017年2月海水平均温度最低, 仅有19.89℃。调查期间北部湾海域各月份盐度平均值没有显著差异, 以春、秋两季略高, 冬、夏两季略低。平均盐度最高值(32.26)出现在2016年11月, 最低值(31.59)出现在2017年1月。调查海域夏季和秋季盐度变幅较大, 而冬季和春季盐度变幅较小。棕囊藻赤潮发生时, 海域平均温度下降至约20℃左右, 并在赤潮期间维持在19—22℃左右。而盐度在赤潮发生时没有明显变化。
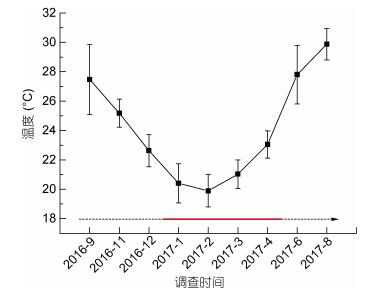 |
| 图 3 北部湾海域调查期间海水平均温度季节变化情况 Fig. 3 Seasonal variation of seawater temperature on average in the Beibu Gulf 注:虚线代表非赤潮期间, 实线代表棕囊藻赤潮发生期间 |
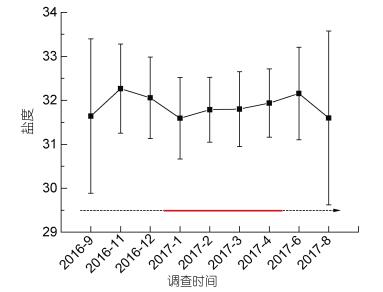 |
| 图 4 北部湾海域调查期间海水平均盐度季节变化情况 Fig. 4 Seasonal variation of salinity on average in the Beibu Gulf 注:虚线代表非赤潮期间, 实线代表棕囊藻赤潮发生期间 |
调查期间北部湾海域微微型真核藻类的丰度变化情况如图 5所示。微微型真核藻类的丰度在春、秋两季略高, 而冬、夏两季略低, 与调查海域平均盐度的变化趋势相似。2017年2月记录的微微型真核藻类平均丰度最高, 可达5.66×103cells/mL。2017年1月记录的微微型真核藻类平均丰度最低, 仅有1.02×103cells/mL。9个航次调查期间, 微微型真核藻类丰度最大值(5.28×104cells/mL)出现在2017年6月ZN6-2站位表层。
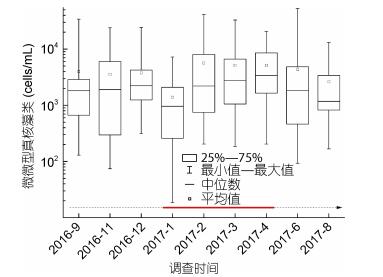 |
| 图 5 北部湾海域微微型真核藻类丰度季节变化情况 Fig. 5 Seasonal variation of picoeukaryotes abundance in the Beibu Gulf 注:虚线代表非赤潮期间, 实线代表棕囊藻赤潮发生期间 |
北部湾海域微微型真核藻类的空间分布状况也具有明显的季节变化。分别以2016年9月、2017年1月、3月和6月作为秋、冬、春、夏四个季节的代表, 表层分布情况作为垂直分布的代表。所得到的北部湾海域微微型真核藻类分布状况如图 6所示。可以看出, 秋季表层海水中微微型真核藻类主要分布在调查区北部钦州湾附近海域, 但是, 在调查区南部还存在一条自西南向东北延伸的微微型真核藻类高值分布区。与秋季相比, 冬季微微型真核藻类的丰度明显下降, 主要分布在调查区北部及雷州半岛西侧近岸海域。春季微微型真核藻类丰度有明显升高, 但分布区与秋季相似, 主要集中在调查区北部和东部近岸海域。夏季微微型真核藻类的分布仍延续春季的特点, 但分布区更加接近岸线, 丰度也明显下降。
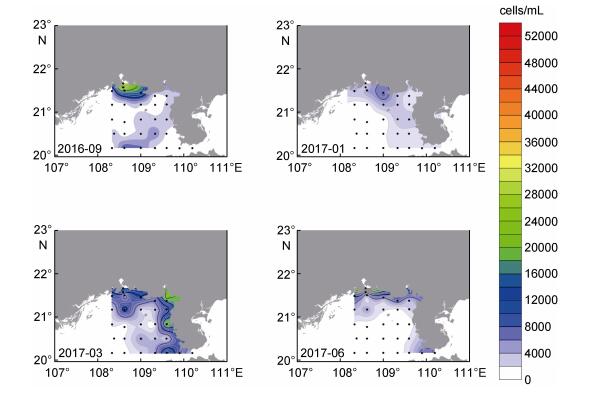 |
| 图 6 北部湾海域表层海水中微微型真核藻类季节分布状况 Fig. 6 Seasonal variation of picoeukaryotes distribution in the surface waters of the Beibu Gulf 注:秋: 2016年9月; 冬: 2017年1月; 春: 2017年3月; 夏: 2017年6月 |
北部湾海域微型真核藻类丰度的季节变化情况如图 7所示。总体来看, 微型真核藻类平均丰度在夏、秋季丰度较高, 在冬、春季丰度较低。2017年8月, 微型真核藻类平均丰度达到最高值, 为8.47×103cells/mL; 2017年1月平均丰度出现最低值, 仅有1.40×103cells/mL。整个调查期间, 微型真核藻类最高丰度值出现在2017年8月的调查站位P4表层, 为7.31×104cells/mL。
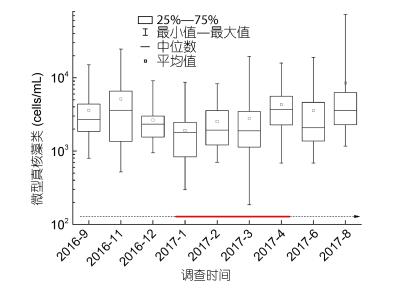 |
| 图 7 北部湾海域微型真核藻类丰度季节变化情况 Fig. 7 Seasonal variation of nanoeukaryotes abundance in the Beibu Gulf 注:虚线代表非赤潮期间, 实线代表棕囊藻赤潮发生期间 |
北部湾海域表层海水中微型真核藻类的季节分布状况如图 8所示。秋季微型真核藻类主要分布在钦州湾和铁山港外侧, 以及自调查区西南部向东北部延伸的一条带状分布区。冬季微型真核藻类丰度明显下降, 主要分布在钦州湾外侧。此外, 在调查区西南部微型真核藻类的丰度也相对较高。春季微型真核藻类主要分布在调查区西部海域, 以及铁山港至雷州半岛西侧近岸海域。夏季微型真核藻类和微微型真核藻类分布特征相似, 主要分布在钦州湾和雷州半岛西侧近岸海域。
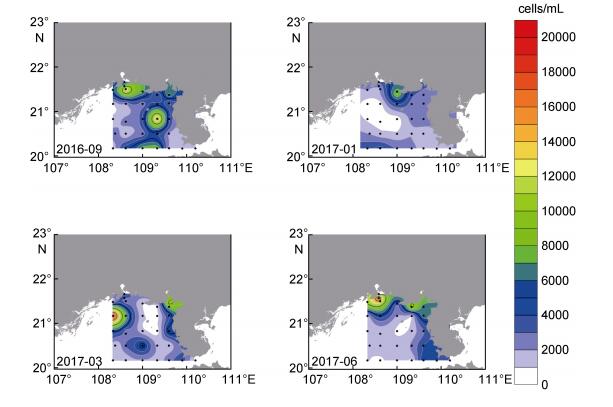 |
| 图 8 北部湾海域表层海水中微型真核藻类季节分布状况 Fig. 8 Seasonal variation of nanoeukaryotes distribution in the surface waters of the Beibu Gulf 注:秋: 2016年9月; 冬: 2017年1月; 春: 2017年3月; 夏: 2017年6月 |
北部湾海域聚球藻平均丰度显著高于两类真核藻类(P < 0.05)。调查期间聚球藻平均丰度变化曲线呈“V”型(图 9), 自2016年9月开始快速下降, 至2017年1月达到最低值3.65×103cells/mL, 之后又快速上升, 到2017年8月达到最高, 平均为1.66×105cells/mL。9个航次调查期间, 聚球藻丰度最高的样品采自ZN5-3站位5m层, 可达1.14×106cells/mL。
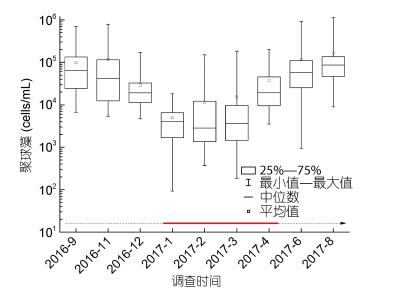 |
| 图 9 北部湾海域聚球藻丰度季节变化情况 Fig. 9 Seasonal variation of Synechococcus abundance in the Beibu Gulf 注:虚线代表非赤潮期间, 实线代表棕囊藻赤潮发生期间 |
调查海域表层海水中聚球藻丰度的季节变化情况如图 10所示。秋季聚球藻主要分布在调查区北部近岸海域和中部海域。冬、春季聚球藻丰度处于较低水平, 没有明显的分布特征。夏季聚球藻丰度明显升高, 主要分布在钦州湾外侧海域, 以及铁山港和雷州半岛西侧近岸海域。
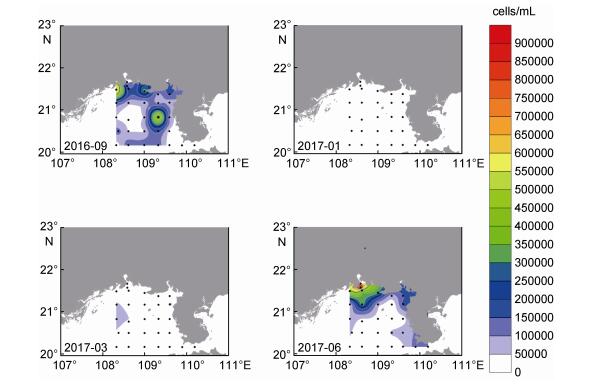 |
| 图 10 北部湾海域表层海水中聚球藻季节分布状况 Fig. 10 Seasonal variation of Synechococcus distribution in the surface waters of the Beibu Gulf 注:秋: 2016年9月; 冬: 2017年1月; 春: 2017年3月; 夏: 2017年6月 |
北部湾海域原绿球藻平均丰度季节变化情况总体上与聚球藻相似, 在冬、春季较低, 夏、秋季较高(图 11), 但变化幅度不如聚球藻显著。原绿球藻平均丰度最高值出现在2017年8月, 为1.07×104cells/mL。最低值(1.15×102cells/mL)出现在2016年12月。调查期间, 原绿球藻最高丰度可达1.91×105cells/mL, 于2017年8月航次期间在站位ZN5-2表层检出。
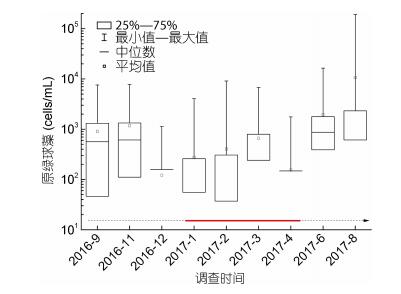 |
| 图 11 北部湾海域原绿球藻丰度季节变化情况 Fig. 11 Seasonal variation of Prochlorococcus abundance in the Beibu Gulf 注:虚线代表非赤潮期间, 实线代表棕囊藻赤潮发生期间 |
调查海域表层海水中原绿球藻丰度的季节变化情况如图 12所示。秋季原绿球藻主要分布在钦州湾近岸海域, 另外, 自调查区西南部到东北部有一带状分布区。冬、春季原绿球藻丰度相对较低, 呈斑块状分布, 没有明显的分布特征。夏季原绿球藻丰度明显增加, 主要分布在调查区北部海域, 以及雷州半岛西侧近岸海域。
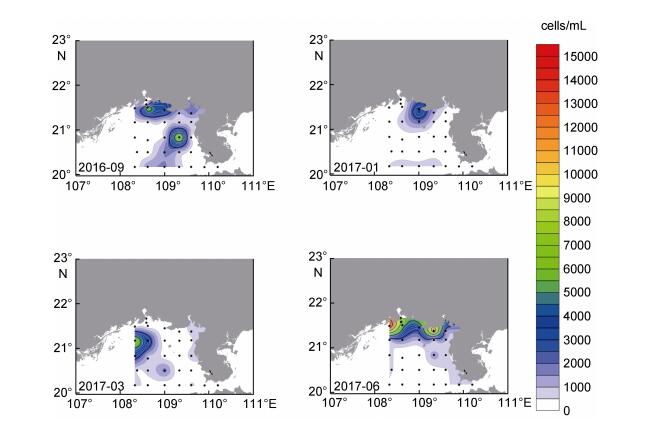 |
| 图 12 北部湾海域表层海水中原绿球藻季节分布状况 Fig. 12 Seasonal variation of Prochlorococcus distribution in the surface waters of the Beibu Gulf 注:秋: 2016年9月; 冬: 2017年1月; 春: 2017年3月; 夏: 2017年6月 |
本研究应用流式细胞仪, 对2016年9月至2017年8月期间北部湾海域原绿球藻、聚球藻、微微型真核藻类和微型真核藻类等4类浮游植物类群的时空变化特征进行了调查和分析。在以往研究中, 对北部湾海域聚球藻和原绿球藻等微微型浮游植物类群的季节变化研究较少, 但是对其他真核浮游植物类群的研究表明, 该海域浮游植物丰度冬季较低, 春、夏季较高。球形棕囊藻通常在水温较低的枯水期占据优势, 而角毛藻、拟菱形藻、骨条藻和海线藻等硅藻多在温度较高的春、夏季占优势, 并在近岸形成高值区(刘国强等, 2008;庄军莲等, 2010;姜发军等, 2012;徐姗楠等, 2014)。
从此次调查结果来看, 北部湾海域4类浮游植物类群分布状况具有一定的相似性, 在夏、秋季浮游植物丰度较高的季节, 各类群主要分布在调查区北部钦州湾外侧海域和雷州半岛西侧近岸海域。令人关注的是, 9月份调查区还存在一条自调查区西南部向东北部延伸的带状分布区, 这一现象在其他季节并不明显。北部湾海域具有较为独特的环流体系, 以往研究表明, 该海域总体上呈现逆时针环流特征(刘凤树等, 1980;侍茂崇, 2014;高劲松等, 2015), 在冬季尤为明显。此外, 北部湾内存在上升流(侍茂崇, 2014), 这主要是由于北部湾终年存在气旋式环流, 东部近岸水西流, 引起外部底层水向近岸流动、补充, 从而导致上升流形成。9月份调查区自西南部向东北部延伸的浮游植物带状分布区, 有可能是受到上升流影响。
对比4类浮游植物类群的季节分布状况可以看出, 在原绿球藻和聚球藻丰度较高的季节, 其分布特征与两类真核微藻相似, 主要分布在近岸海域; 但在其丰度较低的季节(冬季和春季), 则呈现出离岸斑块状分布特征。真核藻类的分布特征与其他近海海域调查结果相似(Pan et al, 2007;屈佩等, 2010; Le et al, 2010)。调查区北部钦州湾外侧海域和雷州半岛西侧近岸海域受陆源污染影响大, 营养物质含量丰富, 为浮游植物生长奠定了重要物质基础。其中调查区北部的钦州湾有钦江、茅岭江、大风江等河流汇入, DIN浓度可达265μg/L, 无机氮入海通量高达7655t (赖俊翔等, 2013;闭文妮等, 2014)。因此, 在钦州湾和北海一带, 一直是浮游植物的高丰度分布区(蓝文陆等, 2011;姜发军等, 2013)。在雷州半岛西侧, 除受到当地入海河流的影响外, 还受到自琼州海峡流入海水的影响。琼州海峡流终年自东向西流过琼州海峡进入北部湾海域, 是构成北部湾海域逆时针气旋式环流的重要组成部分(Shi et al, 2002;陈达森等, 2006;杨士瑛等, 2006)。部分珠江冲淡水会随粤西沿岸流, 经过琼州海峡进入雷州半岛西侧近岸海域, 给该海域带来丰富的营养盐(Shi et al, 2002;杨士瑛等, 2003), 因此, 该海域也是以往调查中浮游植物的主要分布区(姜发军等, 2013;徐姗楠等, 2014)。除两类真核藻类之外, 夏、秋季聚球藻和原绿球藻在北部湾近岸海域也有较高的丰度。通常认为原绿球藻属于大洋性藻种, 但在近岸海域偶尔也会检测到原绿球藻(Campbell et al, 1994; Moore et al, 1995; Pan et al, 2007; Flombaum et al, 2013; Guo et al, 2014)。在东海的调查发现, 春季长江口邻近海域可以检测到较高丰度的原绿球藻, 这与东海黑潮分支的输入密切相关(于仁成等, 2017)。我们推测北部湾近岸海域夏、秋季较高丰度的原绿球藻应当也是来自外海输入, 只是在适宜的环境下能够在近岸海域维持存活或生长。
北部湾海域4类浮游植物类群与温度、盐度的相关关系见表 1。4类浮游植物的丰度与盐度均呈负相关关系, 而微型真核藻类、聚球藻和原绿球藻丰度与温度呈正相关关系。对比4类浮游植物的季节变化与温度的变化趋势(图 3, 图 5, 图 7, 图 9, 图 11)可以看出, 聚球藻和原绿球藻对温度变化的响应更为敏感, 尤其是聚球藻丰度变化与温度变化的同步性更明显。冬季微型真核藻类、聚球藻和原绿球藻的丰度相对较低, 在一定程度上反映了低温对各浮游植物类群生长的抑制作用。原绿球藻的生长受到温度和光照调控(Moore et al, 1995; Buck et al, 1996), 而聚球藻的生长主要受温度影响。聚球藻更适应亚热带至热带海域的水温, 其生物量常常与温度呈正相关(Campbell et al, 1997;白晓歌, 2010);在温带海域聚球藻丰度有明显的季节变化, 其丰度通常在夏季最高(Jochem, 1988; Chang et al, 1996)。两类真核藻类的生长受到营养盐影响更大(Pan et al, 2007;钟瑜等, 2008; Le et al, 2010;), 因此在近岸海域丰度更高, 与盐度的负相关关系也更为显著。
| 浮游植物类群 | 温度 | 盐度 |
| 微微型真核藻类 | –0.051 | –0.370** |
| 微型真核浮藻类 | 0.248** | –0.443** |
| 聚球藻 | 0.427** | –0.245** |
| 原绿球藻 | 0.177** | –0.317** |
| 注: **P < 0.01 | ||
北部湾海域历史上记录的赤潮事件较少。根据1995年以来对有记录赤潮的分析, 北部湾海域的赤潮主要分布在涠洲岛东南部海域和防城港—北海近岸海域, 但是, 赤潮规模通常很小, 造成的经济损失不大。2006年涠洲岛附近海域浮游植物调查中发现, 球形棕囊藻是该海域浮游植物优势种之一(刘国强等, 2008)。2007年秋季调查中, 棕囊藻成为浮游植物群落中第一优势种, 主要分布在防城港和北海附近海域(郑白雯, 2014)。2011年10月, 北部湾防城港海域记录到一次棕囊藻赤潮。2014年后, 棕囊藻赤潮在防城港—北海一带开始连年发生。此次调查期间, 自2017年1月至4月期间可以观察到明显的棕囊藻赤潮现象(贺成等, 2019)。赤潮区主要分布在调查区北部钦州湾外侧海域和雷州半岛西侧近岸海域, 与各浮游植物类群的分布区一致。
对比调查期间各浮游植物类群与棕囊藻赤潮生消过程可以看出, 棕囊藻赤潮发生期间, 微微型真核藻类仍然维持较高的丰度, 其他浮游植物类群在此期间丰度均处于较低水平。球形棕囊藻的胶质囊体直径可达8—9mm, 但游离单细胞的大小仅有3—8μm (Rousseau et al, 1994; Peperzak et al, 2000), 粒径接近微微型真核藻类。冬季北部湾近岸海域相对较高的微微型真核藻类丰度可能在一定程度上受到了球形棕囊藻赤潮的影响。尤其令人关注的是, 在棕囊藻赤潮发生早期, 聚球藻和原绿球藻丰度就已明显下降, 在赤潮发生期间其丰度也维持较低水平, 而赤潮过后又恢复到较高丰度, 与球形棕囊藻赤潮动态过程构成镜像关系。
三类浮游植物类群丰度变化与棕囊藻赤潮生消过程的镜像关系, 与不同浮游植物类群之间的相互作用及其对环境适应性的差异有关。以往研究发现, 棕囊藻赤潮常发生在硅藻赤潮之后, 棕囊藻游离细胞能够利用有机态营养物质, 可以适应低浓度营养盐的环境, 此外, 死亡硅藻的硅质壳也为游离棕囊藻的附着和囊体生长提供了便利条件(Sanderson et al, 2008; Borkman et al, 2016)。同时, 球形棕囊藻也能够通过化感作用抑制其他微藻的生长(Liu et al, 2010), 这有可能导致棕囊藻赤潮期间其他浮游植物丰度下降。就原绿球藻和聚球藻而言, 原绿球藻的最适温度为24—30℃ (Moore et al, 1995;冯宪栋等, 2007), 聚球藻最适生长温度可达28℃左右(Moore et al, 1995), 二者均更适应高温环境。球形棕囊藻适温范围宽, 在4—20℃的海域环境中都有球形棕囊藻游离细胞存在, 但其最适生长温度在15—20℃, 在20℃时达到最大生长速率(Wang et al, 2010)。北部湾冬季海水温度(19—22℃左右)正处于球形棕囊藻生长的最适温度, 因此, 聚球藻和原绿球藻丰度变化与棕囊藻赤潮生消过程的镜像关系应当与其对温度的不同适应性有关。而北部湾海域海水下降至20℃左右时, 是球形棕囊藻形成囊体赤潮的重要预警温度。
棕囊藻游离细胞小, 形态特征不明显, 在赤潮早期不易监测。一旦形成赤潮, 则会对核电安全和海洋生态环境造成威胁。聚球藻和原绿球藻尽管细胞微小, 但具有独特的色素组成特征, 可以通过流式细胞仪快速进行分析。根据本研究结果, 海域温度降低至20℃左右, 以及聚球藻和原绿球藻丰度的快速下降, 均有望用于球形棕囊藻赤潮的预警, 以便尽早采取控制措施, 降低棕囊藻赤潮的危害效应。
4 结论北部湾海域的棕囊藻赤潮发生规模大, 对核电冷源安全和海水养殖业构成潜在威胁。基于对北部湾海域2016年9月至2017年8月期间9个航次的调查, 应用流式细胞仪分析了原绿球藻、聚球藻、微微型真核藻类和微型真核藻类等4类浮游植物类群的变化情况, 并初步探讨了其与棕囊藻赤潮的关系, 得到以下结论:
(1) 北部湾海域各浮游植物类群主要分布在调查区北部钦州湾外侧海域和雷州半岛西侧近岸海域, 与该海域海水中丰富的营养盐有关。此外, 9月还存在一条自调查区西南部向东北部延伸的浮游植物带状分布区, 可能受到海域上升流的影响。
(2) 北部湾海域浮游植物类群的丰度具有明显的季节变化。微微型真核藻类丰度在春、秋季较高, 而冬、夏季较低。微型真核藻类、聚球藻和原绿球藻的丰度均呈现出夏季高、冬季低的特点, 其中聚球藻丰度的季节变化最为显著, 与水温变化密切相关。
(3) 结合对球形棕囊藻赤潮生消过程的分析可以看出, 北部湾海域球形棕囊藻赤潮发生过程中, 海水温度下降至20℃左右, 聚球藻和原绿球藻丰度也具有明显变化, 有望作为预警指标, 为该海域棕囊藻赤潮的预报和防控提供依据。
于仁成, 刘东艳. 2016. 我国近海藻华灾害现状、演变趋势与应对策略. 中国科学院院刊, 31(10): 1167-1174 |
于仁成, 张清春, 孔凡洲, 等. 2017. 长江口及其邻近海域有害藻华的发生情况、危害效应与演变趋势. 海洋与湖沼, 48(6): 1178-1186 |
白晓歌, 2010.泛三大洋微微型浮游生物的分布及其与环境因子的相关性.青岛: 中国海洋大学博士学位论文
|
冯宪栋, 蒋霞敏, 符方尧. 2007. 理化因子对原绿球藻生长及其色素含量的影响. 水产科学, 26(12): 643-647 DOI:10.3969/j.issn.1003-1111.2007.12.001 |
庄军莲, 许铭本, 张荣灿, 等. 2010. 广西防城港湾浮游植物数量周年变化特征. 广西科学, 17(4): 387-390 DOI:10.3969/j.issn.1005-9164.2010.04.029 |
刘子琳, 蔡昱明, 宁修仁. 1998. 象山港中、西部秋季浮游植物粒径分级、叶绿素a和初级生产力. 东海海洋, 16(3): 19-25 |
刘凤树, 于天常. 1980. 北部湾环流的初步探讨. 海洋湖沼通报, (1): 9-14 |
刘国强, 史海燕, 魏春雷, 等. 2008. 广西涠洲岛海域浮游植物和赤潮生物种类组成的初步研究. 海洋通报, 27(3): 43-48 DOI:10.3969/j.issn.1001-6392.2008.03.008 |
闭文妮, 唐艳葵, 洪鸣, 等. 2014. 钦州湾无机氮入海通量及其富营养化症状分析. 环境科学与技术, 37(1): 174-178 |
杨士瑛, 陈波, 李培良. 2006. 用温盐资料研究夏季南海水通过琼州海峡进入北部湾的特征. 海洋湖沼通报, (1): 1-7 DOI:10.3969/j.issn.1003-6482.2006.01.001 |
杨士瑛, 鲍献文, 陈长胜, 等. 2003. 夏季粤西沿岸流特征及其产生机制. 海洋学报, 25(6): 1-8 |
陈达森, 陈波, 严金辉, 等. 2006. 琼州海峡余流场季节性变化特征. 海洋湖沼通报, (2): 12-17 DOI:10.3969/j.issn.1003-6482.2006.02.003 |
陈菊芳, 徐宁, 江天久, 等. 1999. 中国赤潮新记录种-球形棕囊藻(Phaeocystis globosa). 暨南大学学报(自然科学版), 20(3): 124-129 |
侍茂崇. 2014. 北部湾环流研究述评. 广西科学, 21(4): 313-324 DOI:10.3969/j.issn.1005-9164.2014.04.001 |
郑白雯, 2014.北部湾北部浮游生物生态学研究.厦门: 厦门大学硕士学位论文
|
屈佩, 张学雷, 王宗灵, 等. 2010. 南黄海夏季微微型浮游植物丰度的分布. 海洋学报, 32(4): 155-167 |
钟瑜, 黄良民. 2008. 海洋微型和微微型浮游生物的区域分布与影响因素. 生态科学, 27(3): 179-185 DOI:10.3969/j.issn.1008-8873.2008.03.010 |
姜发军, 陈波, 何碧娟, 等. 2012. 广西钦州湾浮游植物群落结构特征. 广西科学, 19(3): 268-275 DOI:10.3969/j.issn.1005-9164.2012.03.018 |
姜发军, 赖俊翔, 庄军莲, 等. 2013. 2010年秋季北部湾广西沿岸表层浮游植物分布特征. 海洋环境科学, 32(3): 414-418 |
贺成, 宋书群, 李才文. 2019. 广西北部湾海域球形棕囊藻囊体时空分布及其影响因素. 海洋与湖沼, 50(3): 630-643 |
徐姗楠, 林华剑, 戴明, 等. 2014. 广西近岸海域浮游植物群落的生态特征. 生态学杂志, 33(10): 2733-2739 |
高劲松, 陈波, 侍茂崇. 2015. 北部湾夏季环流结构及生成机制. 中国科学:地球科学, 45(1): 99-112 |
蓝文陆, 王晓辉, 黎明民. 2011. 应用光合色素研究广西钦州湾丰水期浮游植物群落结构. 生态学报, 31(13): 3601-3608 |
赖俊翔, 柯珂, 姜发军, 等. 2013. 广西钦州湾及邻近海域营养盐特征与富营养化评价. 海洋环境科学, 32(6): 860-866 |
Agawin N S R, Duarte C M, Agustí S, 2000. Nutrient and temperature control of the contribution of picoplankton to phytoplankton biomass and production. Limnology and Oceanography, 45(8): 1891 |
Baumann M E M, Brandini F P, Staubes R, 1994a. The influence of light and temperature on carbon-specific DMS release by cultures of Phaeocystis antarctica and three Antarctic diatoms. Marine Chemistry, 45(1-2): 123-129 |
Baumann M E M, Lancelot C, Brandini F P et al, 1994b. The taxonomic identity of the cosmopolitan prymnesiophyte Phaeocystis: a morphological and ecophysiological approach. Journal of Marine Systems, 5(1): 5-22 DOI:10.1016/0924-7963(94)90013-2 |
Borkman D G, Libby P S, Mickelson M J et al, 2016. Variability of winter-spring bloom Phaeocystis pouchetii abundance in Massachusetts Bay. Estuaries and Coasts, 39(4): 1084-1099 DOI:10.1007/s12237-016-0065-5 |
Buck K R, Chavez F P, Campbell L, 1996. Basin-wide distributions of living carbon components and the inverted trophic pyramid of the central gyre of the North Atlantic Ocean, summer 1993. Aquatic Microbial Ecology, 10(3): 283-298 |
Campbell L, Liu H B, Nolla H A et al, 1997. Annual variability of phytoplankton and bacteria in the subtropical North Pacific Ocean at Station ALOHA during the 1991-1994 ENSO event. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 44(2): 167-192 DOI:10.1016/S0967-0637(96)00102-1 |
Campbell L, Nolla H A, Vaulot D, 1994. The importance of Prochlorococcus to community structure in the central North Pacific Ocean. Limnology and Oceanography, 39(4): 954-961 DOI:10.4319/lo.1994.39.4.0954 |
Chang J, Chung C C, Gong G C, 1996. Influences of cyclones on chlorophyll a concentration and Synechococcus abundance in a subtropical western Pacific coastal ecosystem. Marine Ecology Progress Series, 140: 199-205 DOI:10.3354/meps140199 |
Chen Y Q, Wang N, Zhang P et al, 2002. Molecular evidence identifies bloom-forming Phaeocystis (Prymnesiophyta) from coastal waters of southeast China as Phaeocystis globosa. Biochemical Systematics and Ecology, 30(1): 15-22 DOI:10.1016/S0305-1978(01)00054-0 |
DiTullio G R, Grebmeier J M, Arrigo K R et al, 2000. Rapid and early export of Phaeocystis antarctica blooms in the Ross Sea, Antarctica. Nature, 404(6778): 595-598 DOI:10.1038/35007061 |
Flombaum P, Gallegos J L, Gordillo R A et al, 2013. Present and future global distributions of the marine Cyanobacteria Prochlorococcus and Synechococcus. Proceedings of the National Academy of Sciences of the United States of America, 110(24): 9824-9829 DOI:10.1073/pnas.1307701110 |
Guo C, Liu H, Zheng L et al, 2014. Seasonal and spatial patterns of picophytoplankton growth, grazing and distribution in the East China Sea. Biogeosciences, 11(7): 1847-1862 DOI:10.5194/bg-11-1847-2014 |
Jochem F, 1988. On the distribution and importance of picocyanobacteria in a boreal inshore area (Kiel Bight, Western Baltic). Journal of Plankton Research, 10(5): 1009-1022 DOI:10.1093/plankt/10.5.1009 |
Keller M D, Bellows W K, Guillard R R L, 1989. Dimethyl sulfide production in marine phytoplankton. ACS Symposium Series, 393: 167-182 DOI:10.1021/symposium |
Lancelot C, Billen G, Sournia A et al, 1987. Phaeocystis blooms and nutrient enrichment in the continental coastal zones of the North Sea. Ambio, 16(1): 38-46 |
Le F F, Ning X R, Liu C G et al, 2010. Community structure of picoplankton abundance and biomass in the southern Huanghai Sea during the spring and autumn of 2006. Acta Oceanologica Sinica, 29(1): 58-68 DOI:10.1007/s13131-010-0008-0 |
Liu J S, Van Rijssel M, Yang W D et al, 2010. Negative effects of Phaeocystis globosa on microalgae. Chinese Journal of Oceanology and Limnology, 28(4): 911-916 DOI:10.1007/s00343-010-9061-y |
Moore L R, Goericke R, Chisholm S W, 1995. Comparative physiology of Synechococcus and Prochlorococcus: influence of light and temperature on growth, pigments, fluorescence and absorptive properties. Marine Ecology Progress Series, 116(1-3): 259-275 |
Pan L A, Zhang J, Zhang L H, 2007. Picophytoplankton, nanophytoplankton, heterotrohpic bacteria and viruses in the Changjiang Estuary and adjacent coastal waters. Journal of Plankton Research, 29(2): 187-197 DOI:10.1093/plankt/fbm006 |
Peperzak L, Colijn F, Vrieling E G et al, 2000. Observations of flagellates in colonies of Phaeocystis globosa (Prymnesiophyceae); a hypothesis for their position in the life cycle. Journal of Plankton Research, 22(12): 2181-2203 DOI:10.1093/plankt/22.12.2181 |
Rousseau V, Vaulot D, Casotti R et al, 1994. The Life cycle of Phaeocystis (Prymnesiophycaea): evidence and hypotheses. Journal of Marine Systems, 5(1): 23-39 DOI:10.1016/0924-7963(94)90014-0 |
Sanderson M P, Bronk D A, Nejstgaard J C et al, 2008. Phytoplankton and bacterial uptake of inorganic and organic nitrogen during an induced bloom of Phaeocystis pouchetii. Aquatic Microbial Ecology, 51(2): 153-168 |
Schoemann V, Becquevort S, Stefels J et al, 2005. Phaeocystis blooms in the global ocean and their controlling mechanisms: a review. Journal of Sea Research, 53(1-2): 43-66 DOI:10.1016/j.seares.2004.01.008 |
Seymour J R, Seuront L, Doubell M J et al, 2008. Mesoscale and microscale spatial variability of bacteria and viruses during a Phaeocystis globosa bloom in the Eastern English Channel. Estuarine, Coastal and Shelf Science, 80(4): 589-597 DOI:10.1016/j.ecss.2008.09.011 |
Shi M C, Chen C S, Xu Q C et al, 2002. The role of Qiongzhou Strait in the seasonal variation of the South China Sea circulation. Journal of Physical Oceanography, 32(1): 103-121 DOI:10.1175/1520-0485(2002)032<0103:TROQSI>2.0.CO;2 |
Sieburth J M, Smetacek V, Lenz J, 1978. Pelagic ecosystem structure: heterotrophic compartments of the plankton and their relationship to plankton size fractions. Limnology and Oceanography, 23(6): 1256-1263 DOI:10.4319/lo.1978.23.6.1256 |
Smith W O Jr, Codispoti L A, Nelson D M et al, 1991. Importance of Phaeocystis blooms in the high-latitude ocean carbon cycle. Nature, 352(6335): 514-516 DOI:10.1038/352514a0 |
Wang H L, Huang B Q, Hong H S, 1997. Size-fractionated productivity and nutrient dynamics of phytoplankton in subtropical coastal environments. Hydrobiologia, 352(1-3): 97-106 |
Wang X D, Tang K W, Wang Y et al, 2010. Temperature effects on growth, colony development and carbon partitioning in three Phaeocystis species. Aquatic Biology, 9(3): 239-249 DOI:10.3354/ab00256 |
 2019, Vol. 50
2019, Vol. 50


