中国海洋湖沼学会主办。
文章信息
- 胡晓坤, 张清春, 陈振帆, 孔凡洲, 王锦秀, 于仁成. 2019.
- HU Xiao-Kun, ZHANG Qing-Chun, CHEN Zhen-Fan, KONG Fan-Zhou, WANG Jin-Xiu, YU Ren-Cheng. 2019.
- 北部湾海域球形棕囊藻遗传多样性分析
- GENETIC DIVERSITY OF PHAEOCYSTIS GLOBOSA STRAINS ISOLATED FROM THE BEIHU GULF, THE SOUTH CHINA SEA
- 海洋与湖沼, 50(3): 601-610
- Oceanologia et Limnologia Sinica, 50(3): 601-610.
- http://dx.doi.org/10.11693/hyhz20180700184
文章历史
-
收稿日期:2018-07-24
收修改稿日期:2018-10-04
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266071;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
棕囊藻(Phaeocystis globosa)是一类广温广盐性的浮游微藻, 是海洋中重要的初级生产者(Kornmann, 2011)。棕囊藻能产生二甲基丙磺酸(DMSP)和二甲基硫(DMS), 对全球碳、硫元素的生物地球化学循环和气候变化具有重要调控作用(Charlson et al, 1987; Wassmann et al, 2005; Whipple et al, 2005)。部分棕囊藻藻种具有复杂的异形生活史, 可以游离单细胞和囊状群体两种形态存在于海水中, 每一形态又有其独特的生理和生态特征(齐雨藻等, 2001)。在已知的棕囊藻藻种中, 球形棕囊藻是一种常见的有害藻华(harmful algal bloom)原因种, 它常以囊状群体形式形成赤潮(Qi et al, 2004)。由于球形棕囊藻能够产生溶血毒素, 球形棕囊藻赤潮经常造成大量养殖动物死亡(危蔚等, 2005)。球形棕囊藻赤潮主要出现在东亚和东南亚近海海域、欧洲北海、阿拉伯海以及北美东部海域(Schoemann et al, 2005)。从20世纪90年代起, 球形棕囊藻赤潮在我国沿海开始出现(Qi et al, 2004)。1997年底至1998年初, 福建省近岸海域首次暴发大规模球形棕囊藻赤潮, 导致大量养殖鱼类死亡, 造成了巨大的经济损失(陈菊芳等, 1999; Qi et al, 2004);随后, 广东、海南和香港近海也陆续暴发棕囊藻赤潮(黄天吾, 2012); 2004年至2006年期间, 渤海黄河口、天津和河北黄骅附近海域也暴发球形棕囊藻赤潮(黄长江等, 1999;曲凌云等, 2008)。近年来, 南海北部湾海域连年暴发球形棕囊藻赤潮, 不仅对当地水产养殖业、生态环境和海滨景观造成影响, 大量棕囊藻囊状群体还对沿海地区核电冷源系统构成潜在威胁, 亟待解析棕囊藻赤潮成因, 为赤潮监测和防控提供依据。藻种是赤潮形成的生物学基础, 对藻种的准确鉴定和遗传特征的研究是揭示赤潮成因的重要途径之一。但是, 由于棕囊藻游离细胞微小, 形态特征不明显, 而囊状群体形态特征变异较大, 因此对棕囊藻的分类鉴定高度依赖分子生物学方法。
随着分子生物学技术的发展, Medlin等(1994)首次从分子水平上把球形棕囊藻和波切棕囊藻P. pouchetii区分开, 认为棕囊藻可能是一种暖水性起源的全球广布种。球形棕囊藻作为暖水种主要分布于温带至热带海域, 经过长时间的地理隔离, 已经形成不同的地理种群, 应出现种下遗传分化(Lange et al, 2002; Chen et al, 2003; Decelle et al, 2012), 曾有学者怀疑球形棕囊藻是一个复合种(species complex) (Lange, 1996; Lange et al, 2002; Vaulot et al, 1994), 至少包括3个物种(Medlin et al, 2007)。但目前对球形棕囊藻的遗传多样性认识依然不清晰, 有待于深入研究。
对于北部湾海域的棕囊藻, 通过对2014年1月分离于广西钦州湾的棕囊藻藻株进行18S rDNA部分序列分析, 可以将其鉴定为球形棕囊藻(覃仙玲等, 2016), 但对该海域球形棕囊藻是否存在遗传多样性并不清楚。此外, 开展球形棕囊藻的遗传多样性研究也有助于深化对棕囊藻囊状群体形成过程的认识。随着分子生物学技术的发展, 从基因水平进行系统进化分析逐渐成为遗传多样性研究的主要手段。前期研究发现, 18S rDNA和28S rDNA基因、叶绿体psaA和psbA基因, 以及RUBISCO基因间隔区等序列都较为保守, 适用于开展棕囊藻种上水平或属内种间的分类学研究(王宁等, 2000;陈月琴等, 2002; Chen et al, 2002, 2003; Lange et al, 2002;陈丽芬等, 2003;杨泽民等, 2004a, b ; 刘海林等, 2010)。与编码的核糖体基因序列相比, 非编码的核糖体基因间隔区(ITS)进化速率更快, 具有区分不同株系球形棕囊藻的潜力(Lange et al, 2002; Chen et al, 2003;刘海林等, 2010)。因此, 本文针对多株分离于北部湾海域的球形棕囊藻藻株, 通过构建28S rDNA和ITS区序列克隆文库, 分析了球形棕囊藻的遗传多样性状况, 为深入探讨球形棕囊藻赤潮成因提供依据。
1 材料及方法 1.1 藻株分离培养在2014年冬至2017年春广西北部湾棕囊藻赤潮暴发期间, 采集含有棕囊藻囊状群体的表层海水带回实验室内, 挑取单个囊体, 用无菌海水洗去囊体表面附着的杂质, 以无菌注射器抽取囊体内液, 添加至L1培养基(不含Na2SiO3)中培养。培养温度为(18±1)℃, 光照度为50μmol, 光暗比为14h︰10h。实验所用藻株的相关信息如表 1所示。
| 藻株 | 分离日期 | 分离地点 | 分离方式 |
| PG2015 | 2014年冬至2015年春 | 广西北部湾 | 单个囊体培养 |
| PG2016 | 2015年冬至2016年春 | 广西北部湾 | 单个囊体培养 |
| PG2017 | 2016年冬至2017年春 | 广西北部湾 | 单个囊体培养 |
| PG2017FM | 2016年冬至2017年春 | 广西北部湾 | 挑取PG2017囊体内的单个细胞进行克隆培养 |
取球形棕囊藻各藻株对数生长期藻液各10mL, 分别过滤至孔径为0.4μm聚碳酸酯滤膜(Millipore, USA)上, 过滤时控制真空泵压力不高于0.4kPa以避免藻细胞破裂, 过滤后滤膜于–80℃保存。采取改良的十六烷基三甲基溴化铵(Hexadecyl trimethyl ammonium Bromide, CTAB)进行DNA提取(Winnepenninckx et al, 1993)。将膜样置于700μL CTAB裂解缓冲液中, 加入2μL蛋白酶K(浓度为500mg/mL), 于65℃温浴90min; 加入700μL酚/氯仿/异戊醇溶液(25:24:1; V:V:V)抽提, 去除上清液; 再加入600μL氯仿/异戊醇溶液(24:1; V:V)抽提两次, 去除上清液; 加入600μL预冷的异丙醇混匀, 于4℃沉淀过夜; 离心后去除上清液后, 用预冷的70%乙醇清洗沉淀两次; 室温晾干后加入50μL TE溶液溶解沉淀, 置于4℃下保存。
以28S rDNA D1—D2区和ITS区为靶区进行PCR扩增。核糖体28S rDNA D1—D2区序列扩增引物为LSU-F2 (5′-ASAGYCGCCTCCTGAATTGTAGT C-3′)和LSU-R3 (5′-TCGAGCTTGCCACTCTAGTA CTC-3′); ITS区扩增引物为Euk P18S (1705-)-F (5′- GCCGGACGCGACGCTCC-3′) (Lange et al, 2002)和ITS-2R (5′-GCTTATTGATATGCTTAAGTTCAGCGGGT-3′) (Blomster et al, 1998)。PCR反应条件均为98℃预变性2min, 98℃变性20s, 52℃退火20s, 72℃延伸30s, 30个循环后, 72℃延伸5min。用1%琼脂糖凝胶电泳检测PCR扩增产物。
1.3 克隆文库构建和测序将PCR产物与T载体按摩尔比7︰1混合, 补水至5μL, 于37℃连接10min; 将连接产物加入50μL大肠杆菌感受态细胞中, 冰浴30min; 42℃热激30s后, 迅速于冰上放置2min, 加入250μL无氨苄培养液, 于37℃摇菌1h;离心去上清, 剩余约100μL菌液, 加入8μL IPTG和40μL X-GAL, 将菌液均匀涂在含有氨苄的培养基上, 37℃培养过夜。每个文库选择20—30个阳性克隆送至上海生工生物技术有限公司进行两端测序。所得序列用Invitrogen软件ContigExpress程序手动拼接和碱基校正。
将拼接的序列于GenBank进行BLAST搜索, 确定同源性最高的物种。从NCBI数据库中下载现有球形棕囊藻28S rDNA D1—D2区和ITS区序列, 结合测序获得4株藻株序列, 通过MEGA7.0软件以最大似然法(maximum likelihood, ML)构建系统进化树(bootstrap=1000), 选择近缘种南极棕囊藻P. antarctica和波切棕囊藻P. pouchetii作为外群。
2 结果 2.1 棕囊藻藻种鉴定对分离于北部湾海域的棕囊藻藻株分别构建28S rDNA D1—D2区和ITS间隔区序列克隆文库, 通过测序共获得28S rDNA D1—D2区序列81条, 其中PG2015藻株25条, PG2016藻株30条, PG2017藻株26条; ITS区序列共73条, 其中PG2015藻株21条, PG2016藻株26条, PG2017藻株26条。通过BLAST在线比对, 所得到的28S rDNA D1—D2区和ITS区同源性最高的序列均为球形棕囊藻。通过最大似然法构建的28S rDNA D1—D2区和ITS区系统进化树中, 北部湾棕囊藻的序列与其它海域分离的球形棕囊藻聚成一簇, 远离其近缘种南极棕囊藻和波切棕囊藻(图 1, 图 2)。这些结果表明2015年至2017年分离于北部湾的4株棕囊藻均为球形棕囊藻。另外, GenBank中3株未定种(EU502882, JX660940, KT390023)也可初步判定为球形棕囊藻(Decelle et al, 2012)。
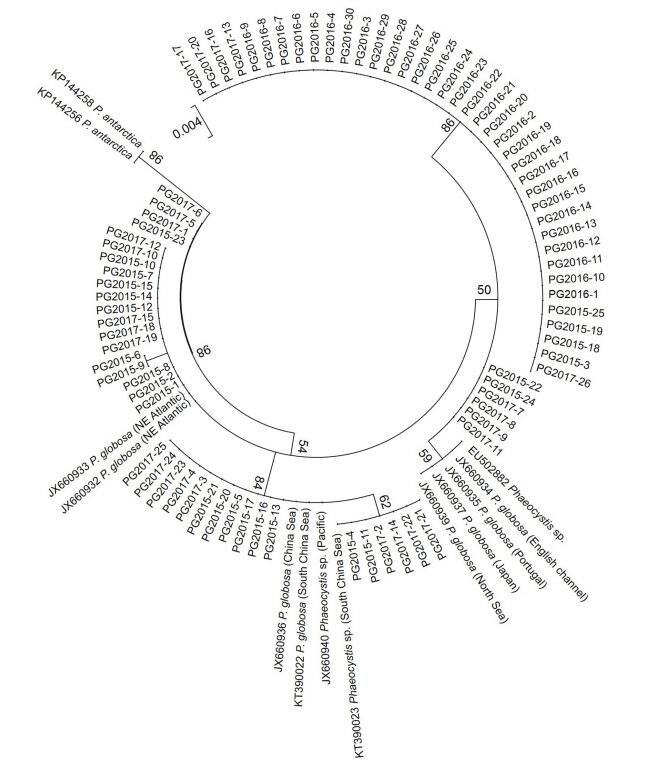 |
| 图 1 基于28S rDNA D1—D2区序列信息构建的球形棕囊藻系统进化树(最大似然法) Fig. 1 The unrooted maximum likelihood (ML) phylogenetic tree based on the sequences of 28S rDNA D1—D2 domain of P. globosa |
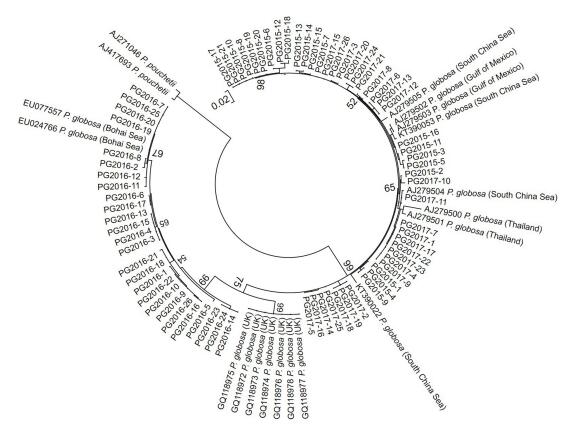 |
| 图 2 基于ITS区序列信息构建的球形棕囊藻无根系统进化树(最大似然法) Fig. 2 The unrooted maximum likelihood (ML) phylogenetic tree based on the sequences of ITS region of P. globosa |
将分离于北部湾的球形棕囊藻藻株PG2015、PG2016和PG2017的28S rDNA D1—D2区序列与GenBank中下载的球形棕囊藻序列, 用最大似然法构建系统进化树(图 1), 所有球形棕囊藻序列聚成四簇, 可看出球形棕囊藻不同株系之间和同一株系内均存在遗传差异。其中PG2016藻株的全部30条28S rDNA D1—D2序列间没有任何碱基差异, 它们与PG2015藻株的4条序列和PG2017藻株的5条序列聚在一起, 与这些序列亲缘关系最近的是PG2015藻株的2条序列和PG2017藻株的4条序列, 以及3株分离于欧洲近海、1株分离于日本近海以及1株分离于不明海域的球形棕囊藻藻株, 这些序列聚成第一簇。PG2015藻株的2条序列、PG2017藻株的4条序列与1株分离于中国南海的藻株(KT390023)序列完全一致, 它们与PG2015藻株的另外6条序列、PG2017藻株的另外5条序列, 以及分离于太平洋海域和中国近海的3株球形棕囊藻藻株共同构成第二簇。PG2015藻株的10条序列和PG2017藻株的5条序列与2株分离于西北大西洋的藻株(JX660932和JX660933)聚成第三簇, 其中PG2015-6和PG2015-9与其他序列仅有1个碱基差异。PG2015-23和PG2017藻株的3条序列(PG2017-1, PG2017-5, PG2017-6)距离其它三簇较远, 独立成为第四簇。
对ITS区序列的分析(图 2)同样表明北部湾的球形棕囊藻具有很高的遗传多样性。从三株球形棕囊藻中得到的73条ITS区序列中仅有少部分序列完全一致。基于ITS区序列的系统进化树分成两大簇, 其中PG2016的26条序列与2条分离于渤海的球形棕囊藻(EU024766和EU077557)聚在一起, 与7株分离于英国近海的藻株(GQ118975, GQ118976, GQ118972, GQ118976, GQ118974, GQ118977, GQ118973)亲缘关系较近, 共同构成一大簇。在这一簇中, PG2016藻株的4条序列与渤海分离的2株球形棕囊藻序列无任何碱基差异。PG2015和PG2017藻株的ITS区序列与分离于中国南海(AJ279504, AJ279505, KT390053, KT390022)、墨西哥湾(AJ279502和AJ279503)和泰国(AJ279501和AJ279500)的球形棕囊藻藻株共同形成第二大簇, 这一簇中ITS区序列多态性更高。
2.3 球形棕囊藻克隆培养株的遗传多样性对PG2015、PG2016和PG2017藻株的28S rDNA和ITS区序列进行分析发现, PG2015和PG2017藻株的28S rDNA D1—D2区序列存在遗传多样性。为进一步解析球形棕囊藻遗传多样性来源, 从PG2017囊体中挑取单个藻细胞培养获得克隆培养株PG2017FM, 分别针对其28S rDNA D1—D2区和ITS区进行序列测定, 共获得28S rDNA D1—D2区序列28条, ITS区序列26条, 分别与PG2017藻株的相应序列共同构建最大似然法系统进化树(图 3, 图 4)。与图 1相似, 自PG2017藻株和PG2017FM藻株得到的28S rDNA D1—D2区序列同样形成四簇, 每簇中都包含有PG2017藻株和PG2017FM藻株的序列(图 3)。这说明球形棕囊藻28S rDNA区的遗传多样性可能来自藻细胞内多拷贝的28S rDNA序列。PG2017藻株和PG2017FM藻株的ITS区序列系统进化树非常复杂, 多态性很高(图 4), 也侧面反映了球形棕囊藻ITS区序列的高变性。
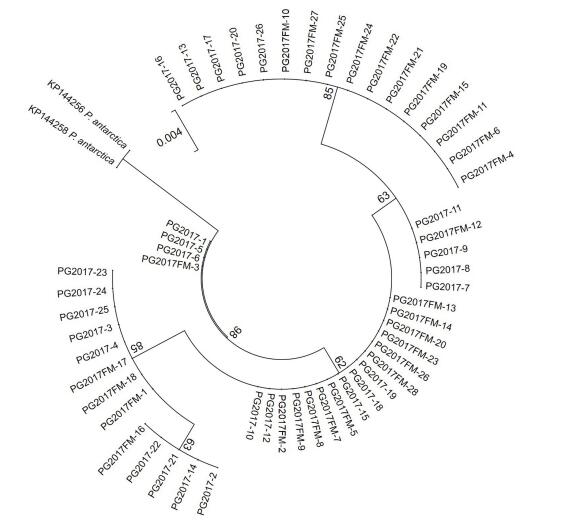 |
| 图 3 基于28S rDNA D1—D2区序列信息构建的球形棕囊藻藻株PG2017和克隆培养株PG2017FM扩增序列的进化树(最大似然法) Fig. 3 The unrooted maximum likelihood (ML) phylogenetic tree based on the sequences of 28S rDNA D1—D2 domain amplified from Phaeocystis globosa strains PG2017 and PG2017FM |
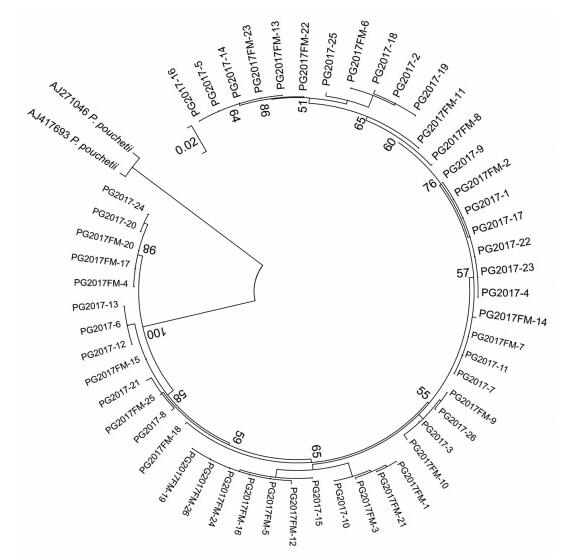 |
| 图 4 基于ITS区序列信息构建的球形棕囊藻藻株PG2017和克隆培养株PG2017FM扩增序列进化树(最大似然法) Fig. 4 The unrooted maximum likelihood (ML) phylogenetic tree based on the sequences of ITS region amplified from P. globosa strains PG2017 and PG2017FM |
大量研究表明球形棕囊藻具有遗传多样性。本研究结果也发现不论是基于28S rDNA还是ITS区序列, 北部湾海域的球形棕囊藻均具有较高的遗传多样性。其中, PG2016藻株28S rDNA序列仅有1种核糖体型, 而PG2015和PG2017藻株则存在4种核糖体型, 且包含PG2016藻株的核糖体型, 存在遗传重叠现象, 类似现象在其他海域的球形棕囊藻藻株中也有报道(Lange et al, 2002; Chen et al, 2003; Medlin et al, 2007)。而且PG2017藻株的4种核糖体型共存于由一个藻细胞培养形成的克隆培养株(PG2017FM)中, 说明其遗传多样性是来自杂合子的单细胞(图 1), 该株系遗传物质可能经历多次基因融合。球形棕囊藻是一种具有复杂异型生活史的物种(齐雨藻等, 2001), 存在单倍体和双倍体交替或共存的生活阶段(Whipple et al, 2005; Peperzak et al, 2012), 有性生殖过程会引起不同细胞间的基因交流和融合。球形棕囊藻广泛分布于受航运活动影响的温带至热带海域, 不同地理种群之间的有性生殖可能时常发生, 从而导致不同种群间的基因交流, 形成遗传多样性特征。目前对球形棕囊藻不同株系以及同一株系的不同克隆间遗传重叠现象和多态性没有深入揭示其原因, 推测与不同海域种群间的基因交流和有性繁殖促进基因融合有关。但是与球形棕囊藻不同, 南极棕囊藻中很少见到如此强烈的种内遗传重叠现象, 可能与南极海域受人类活动影响很小有关, 其遗传进化关系主要与德雷克海峡(Drake passage)形成和南极绕极流(Antarctic Circumpolar Current, ACC)相关(Lange et al, 2002; Medlin et al, 2007)。以往研究中也曾发现同一株系球形棕囊藻种的ITS区序列存在多态性(Chen et al, 2003; Lange et al, 2002), 极有可能也是基因高度杂合的体现(Medlin et al, 2007)。
目前, 对于球形棕囊藻遗传多样性与其地理种群之间的关系尚未形成明确认识。总体而言, 来源于同一海域的藻株序列差异小, 亲缘关系较近(Lange et al, 2002; Chen et al, 2003;曲凌云等, 2008;刘海林等, 2010), 本文的结果也支持这种认识(图 1, 图 2)。但是, 本研究也发现分离于日本近海的藻株JX660937并未与分离于太平洋海域和中国近海的球形棕囊藻藻株(KT390022、KT390023、JX660936和JX660940)聚在一起, 反而与欧洲海域的球形棕囊藻亲缘关系更近(图 1), 类似结果在以往研究中也有报道(Decelle et al, 2012), 有可能反映了球形棕囊藻的不同地理种群在自然或人为因素影响下的迁移或入侵。
本文发现不同株系的球形棕囊藻28S rDNA D1—D2区序列具有明显差别, 可见28S rDNA序列不仅可以作为球形棕囊藻的种间分类依据, 甚至有可能具备种下分辨能力。但曾有研究认为棕囊藻的28S rDNA序列较保守, 适合种以上水平的分类, 不宜用于种间或种下水平研究(杨泽民等, 2004b)。究其原因, 可能是以往研究通常采用对28S rDNA PCR产物直接测序的方法, 导致非优势核糖体基因型序列易被掩盖, 而本文采用的克隆文库方法有利于发现多种基因型(图 3)。在现有分子标记中, 18S rDNA、叶绿体psaA和psbA 基因以及RUBISCO基因间隔区序列都较为保守, 不适合作为种下遗传多样性的标记(王宁等, 2000;陈月琴等, 2002;陈丽芬等, 2003;杨泽民等, 2004a, 2005);而ITS区序列变异度高, 也不适合作为种下遗传多样性的标记(Lange et al, 2002; Medlin et al, 2007)。基于本文的研究结果, 球形棕囊藻28S rDNA D1—D2区序列具有作为分子标记指示球形棕囊藻地理种群的潜力, 但仍需深入研究。此外, 基于全基因组的分子标记目前已被用于物种遗传多样性与地理种群的关系研究。这些分子标记有利于对基因杂合度进行分析, 基因杂合度被认为是度量种群变异的一个重要参数, 对生活史过程中兼有有性繁殖与无性繁殖的球形棕囊藻而言, 基于全基因组的分子标记是研究其物种遗传多样性和种群遗传变异的重要工具。另外, 单亲遗传的一些细胞器, 如叶绿体和线粒体的基因组/基因, 能够排除因有性生殖过程带来的影响, 也可作为球形棕囊地理种群与遗传多样性研究的备选分子标记。随着第二代测序技术兴起的系统基因组学(phylogenomics), 使得分子系统学分析从对有限数量的几个基因提升到对成百上千个基因的系统学分析, 有望更全面的解析遗传多样性与地理种群的关系(Posada, 2016)。
3.2 北部湾海域球形棕囊藻遗传多样性及其对藻种来源的指示意义自1997年底我国东南沿海海域首次暴发大规模球形棕囊藻赤潮以来(陈菊芳等, 1999), 南海海域已逐渐成为球形棕囊藻赤潮的重灾区(黄天吾, 2012)。2004年至2006年期间, 渤海黄河口附近海域、天津近岸海域和河北黄骅附近海域也暴发球形棕囊藻赤潮(黄长江等, 1999;曲凌云等, 2008)。曾有报道我国近海存在多个球形棕囊藻地理株(李亚男等, 2012), 但这些株系划分多是根据赤潮暴发时间与地点, 并没有深入探究其遗传关系。对于北部湾的球形棕囊藻赤潮, 是由本地种群形成还是外来种群引发也缺乏清晰的认识。本文研究发现, 不论是基于28S rDNA序列还是ITS序列分析结果, 2016年球形棕囊藻赤潮期间分离的藻株PG2016都明显有别于2015年和2017年分离的藻株PG2015和PG2017。PG2016与分离于大西洋的藻株亲缘关系近(图 1), 与2006年分离于渤海的球形棕囊藻藻株也有相近的亲缘关系(图 2)。以往研究中也发现渤海的球形棕囊藻与分离于美国大西洋沿海的株系亲缘关系密切(曲凌云等, 2008)。而基于ITS区序列, PG2015和PG2017藻株则与分离于中国南海、泰国近海和墨西哥湾海域的棕囊藻藻株亲缘关系相近。这是否意味着北部湾海域的球形棕囊藻赤潮可能有不同的起源呢?
北部湾地处于南海西北部, 是一个三面靠陆、南面毗邻南海的半封闭海湾。北部湾的环流由外海高盐水、次高盐水构成的外海流系和沿岸低盐水构成的沿岸流系组成(苏纪兰, 2005)。北部湾海域常年存在气旋式环流, 潮致环流、密度流和风是驱动环流的主导因素(陈振华, 2014;侍茂崇, 2014)。此外, 琼州海峡水常年自东向西流入北部湾, 也是构成北部湾海域气旋式环流的重要组成部分(Shi et al, 2002), 有研究发现雷州半岛东岸及海南岛北岸的陆源输入可随海峡流进入北部湾(吴敏兰, 2014)。北部湾存在多处上升流区域, 在北部湾东北部海域有沿等深线自西南向东北的上升流(陈振华, 2014)。同期调查发现北部湾海域秋季上升流区浮游植物丰度较高, 推测与上升流的影响有关(赵越等, 2019)。这些研究表明, 北部湾海域的球形棕囊藻既有可能来自本地种群, 也有可能随琼州海峡水或上升流从广东沿海或南海外海输入。广东沿海是球形棕囊藻赤潮高发海区, 从1997年起开始出现球形棕囊藻赤潮(李亚男等, 2012)。因此, 广东沿海的球形棕囊藻极有可能通过琼州海峡进入北部湾。此外, 南海西部越南近海也是球形棕囊藻赤潮的多发海域, 每年8—9月份是球形棕囊藻赤潮的高发期, 与该海域的上升流明显相关(Doan et al, 2008; Hai et al, 2010)。因此, 在北部湾外部南海海域的球形棕囊藻也有可能随上升流被携带输入北部湾海域。
藻种是赤潮暴发的生物学基础, 揭示藻种来源不仅有助于阐明赤潮形成机制, 也可以为针对性地开展赤潮监控提供依据。本文研究结果为进一步梳理北部湾海域球形棕囊藻的遗传多样性提供了重要的基础信息, 也为深入探究球形棕囊藻遗传多样性与其地理种群之间的关系, 筛选具有地理种群指示作用的分子标记提供了方法依据, 有望为进一步解析北部湾海域球形棕囊藻赤潮原因种来源提供判据。
4 结论针对2015年至2017年分离于北部湾海域的4株球形棕囊藻藻株, 分别构建其28S rDNA D1—D2区和ITS区克隆文库, 通过测序分析了球形棕囊藻的遗传多样性状况, 得到主要结论如下:
(1) 根据28S rDNA D1—D2区和ITS区序列信息, 从北部湾分离的4株棕囊藻均为球形棕囊藻。球形棕囊藻存在明显的遗传多样性, 不同年份分离的球形棕囊藻藻株之间存在明显的遗传差别。
(2) 部分球形棕囊藻藻株(如PG2015和PG 2017)的不同克隆间存在遗传差异, 这种差异在由单一藻细胞建立的克隆培养系中仍然存在, 表明遗传多样性是来自细胞内多拷贝的基因序列, 可能源于不同地理种群球形棕囊藻之间的基因交流。
(3) 与ITS区相比, 28S rDNA D1—D2区能够更好地反映球形棕囊藻遗传多样性状况, 有作为分子标记指示球形棕囊藻地理种群的潜力。
致谢 厦门大学近海海洋环境科学国家重点实验室提供了从北部湾海域分离的球形棕囊藻PG2017藻株, 谨致谢忱。
王宁, 陈月琴, 屈良鹄, 等. 2000. 1997粤东海域棕囊藻赤潮原因种18SrDNA基因分析. 中山大学学报(自然科学版), 39(1): 127-128 DOI:10.3321/j.issn:0529-6579.2000.01.032 |
曲凌云, 吕颂辉, 高春蕾, 等. 2008. 棕囊藻渤海株核糖体18S rDNA和ITS基因结构序列分析. 海洋科学进展, 26(2): 200-206 DOI:10.3969/j.issn.1671-6647.2008.02.010 |
危蔚, 江天久. 2005. 有害赤潮生物球形棕囊藻对卤虫的毒性研究. 生态科学, 24(1): 38-41 DOI:10.3969/j.issn.1008-8873.2005.01.012 |
刘海林, 章群, 江启明, 等. 2010. 赤潮棕囊藻(Phaeocystis globosa) rDNA ITS区序列变异与二级结构分析. 生态科学, 29(5): 432-437 |
齐雨藻, 沈萍萍, 王艳. 2001. 棕囊藻属(Phaeocystis)的分类与生活史(综述). 热带亚热带植物学报, 9(2): 174-184 DOI:10.3969/j.issn.1005-3395.2001.02.016 |
苏纪兰. 2005. 中国近海水文. 北京: 海洋出版社
|
李亚男, 沈萍萍, 黄良民, 等. 2012. 棕囊藻的分类及系统进化研究进展. 生态学杂志, 21(3): 745-754 |
杨泽民, 章群, 谢数涛, 等. 2004a. 球形棕囊藻(Phaeocystis globosa)叶绿体psaA基因片段的序列分析. 热带亚热带植物学报, 12(5): 435-439 |
杨泽民, 章群, 谢数涛, 等. 2004b. Phaeocystis globosa核糖体大亚基(28S rDNA)的序列分析与分类学意义. 海洋环境科学, 23(3): 4-8 |
杨泽民, 章群, 谢数涛, 等. 2005. Phaeocystis globosa与Phaeocystis antarctica叶绿体psbA基因的比较. 海洋科学, 29(1): 24-28 DOI:10.3969/j.issn.1000-3096.2005.01.005 |
吴敏兰, 2014.北部湾北部海域营养盐的分布特征及其对生态系统的影响研究.厦门: 厦门大学硕士学位论文
|
陈月琴, 王宁, 周惠, 等. 2002. 棕囊藻赤潮原因种的分子鉴定和起源分析. 海洋学报, 24(6): 99-103 DOI:10.3321/j.issn:0253-4193.2002.06.011 |
陈丽芬, 章群, 骆育敏, 等. 2003. 18S rDNA序列分析鉴定棕囊藻香港株P2为球形棕囊藻. 生态科学, 22(4): 349-350 DOI:10.3969/j.issn.1008-8873.2003.04.013 |
陈振华, 2014.北部湾环流季节变化的数值模拟与动力机制分析.青岛: 中国海洋大学博士学位论文
|
陈菊芳, 徐宁, 江天久, 等. 1999. 中国赤潮新记录种--球形棕囊藻(Phaeocystis globosa). 暨南大学学报(自然科学版), 20(3): 124-129 |
侍茂崇. 2014. 北部湾环流研究述评. 广西科学, 21(4): 313-324 DOI:10.3969/j.issn.1005-9164.2014.04.001 |
赵越, 于仁成, 张清春, 等. 2019. 北部湾海域微型、微微型浮游植物类群季节变化及其与棕囊藻赤潮的关系初探. 海洋与湖沼, 50(3): 590-600 |
黄天吾, 2012.球形棕囊藻囊体形态特征及光和钙离子对囊体形成和囊体细胞分布的影响.广州: 暨南大学硕士学位论文
|
黄长江, 董巧香, 郑磊. 1999. 1997年底中国东南沿海大规模赤潮原因生物的形态分类与生态学特征. 海洋与湖沼, 30(6): 581-590 DOI:10.3321/j.issn:0029-814X.1999.06.001 |
覃仙玲, 赖俊翔, 陈波, 等. 2016. 棕囊藻北部湾株的18S rDNA分子鉴定. 热带亚热带植物学报, 24(2): 176-181 |
Blomster J, Maggs C A, Stanhope M J, 1998. Molecular and morphological analysis of Enteromorpha intestinalis and E compressa (Chlorophyta) in the British Isles. J Phycol, 34(2): 319-340 DOI:10.1046/j.1529-8817.1998.340319.x |
Charlson R J, Lovelock J E, Andreae M O et al, 1987. Oceanic phytoplankton, atmospheric sulphur, cloud albedo and climate. Nature, 326(6114): 655-661 DOI:10.1038/326655a0 |
Chen Y Q, Shao P, Wang N et al, 2003. Molecular identification of bloom-forming species Phaeocystis globosa (Prymnesiophyta) and its dispersal based on rDNA ITS sequence analysis. Acta Oceanol Sin, 22(2): 243-253 |
Chen Y Q, Wang N, Zhang P et al, 2002. Molecular evidence identifies bloom-forming Phaeocystis (Prymnesiophyta) from coastal waters of southeast China as Phaeocystis globosa. Biochem Syst Ecol, 30(1): 15-22 DOI:10.1016/S0305-1978(01)00054-0 |
Decelle J, Probert I, Bittner L et al, 2012. An original mode of symbiosis in open ocean plankton. P Natl Acad Sci USA, 109(44): 18000-18005 DOI:10.1073/pnas.1212303109 |
Doan N H, Nguyen N L, Nguyen M A et al, 2008. Red tides in south central coast of Viet Nam: biodiversity and planktonic community structure consequences. Poster Presentation at XIII HAB Conference, Hong Kong, November 2008
|
Hai D N, Lam N N, Dippner J W et al, 2010. Development of Phaeocystis globosa blooms in the upwelling waters of the South Central coast of Viet Nam. J Marine Syst, 83(3/4): 253-261 |
Kornmann P, 2011. Chapter 10 Phaeocystis globosa: autecological data and bloom phenomena. In: Auteology and Blooms, 168—194
|
Lange M, 1996. Phylogeny and taxonomy of the genus Phaeocystis. Germany: University of Bremen
|
Lange M, Chen Y Q, Medlin L K, 2002. Molecular genetic delineation of Phaeocystis species (Prymnesiophyceae) using coding and non-coding regions of nuclear and plastid genomes. Eur J Phycol, 37(1): 77-92 DOI:10.1017/S0967026201003481 |
Medlin L K, Zingone A, 2007. A taxonomic review of the genus Phaeocystis. Biogeochemistry, 83(1-3): 3-18 DOI:10.1007/s10533-007-9087-1 |
Medlin L K, Lange M, Baumann M E M, 1994. Genetic differentiation among 3 colony-forming species of Phaeocystis - Further evidence for the phylogeny of the prymnesiophyta. Phycologia, 33(3): 199-212 DOI:10.2216/i0031-8884-33-3-199.1 |
Peperzak L, Gäbler-Schwarz S, 2012. Current knowledge of the life cycles of Phaeocystis globosa and Phaeocystis antarctica (Prymnesiophyceae). J Phycol, 48(3): 514-517 DOI:10.1111/j.1529-8817.2012.01136.x |
Posada D, 2016. Phylogenomics for systematic biology. Syst Biol, 65(3): 353-356 DOI:10.1093/sysbio/syw027 |
Qi Y Z, Chen J F, Wang Z H et al, 2004. Some observations on harmful algal bloom (HAB) events along the coast of Guangdong, southern China in 1998. Hydrobiologia, 512(1-3): 209-214 DOI:10.1023/B:HYDR.0000020329.06666.8c |
Schoemann V, Becquevort S, Stefels J, Rousseau V, Lancelot C, 2005. Phaeocystis blooms in the global ocean and their controlling mechanisms: a review. J Sea Res, 53(1-2): 43-66 DOI:10.1016/j.seares.2004.01.008 |
Shi M C, Chen C S, Xu Q C et al, 2002. The role of Qiongzhou Strait in the seasonal variation of the South China Sea circulation. J Phys Oceanogr, 32(1): 103-121 DOI:10.1175/1520-0485(2002)032<0103:TROQSI>2.0.CO;2 |
Vaulot D, Birrien J L, Marie D et al, 1994. Morphology, ploidy, pigment composition, and genome size of cultured strains of Phaeocystis (Prymnesiophyceae). J Phycol, 30(6): 1022-1035 DOI:10.1111/j.0022-3646.1994.01022.x |
Wassmann P, Ratkova T, Reigstad M, 2005. The contribution of single and colonial cells of Phaeocystis pouchetii to spring and summer blooms in the north-eastern North Atlantic. Harmful Algae, 4(5): 823-840 DOI:10.1016/j.hal.2004.12.009 |
Whipple S J, Patten B C, Verity P G, 2005. Life cycle of the marine alga Phaeocystis: a conceptual model to summarize literature and guide research. J Mar Syst, 57(1-2): 83-110 DOI:10.1016/j.jmarsys.2005.04.006 |
Winnepenninckx B, Backeljau T, De Wachter R, 1993. Extraction of high molecular weight DNA from molluscs. Trends Genet, 9(12): 407 DOI:10.1016/0168-9525(93)90102-N |
 2019, Vol. 50
2019, Vol. 50


