
中国海洋湖沼学会主办。
文章信息
- 王锦秀, 孔凡洲, 陈振帆, 张清春, 于仁成, 周名江. 2019.
- WANG Jin-Xiu, KONG Fan-Zhou, CHEN Zhen-Fan, ZHANG Qing-Chun, YU Ren-Cheng, ZHOU Ming-Jiang. 2019.
- 六株球形棕囊藻的色素组成特征研究
- CHARACTERIZATION OF PIGMENT COMPOSITION OF SIX STRAINS OF PHAEOCYSTIS GLOBOSA
- 海洋与湖沼, 50(3): 611-620
- Oceanologia et Limnologia Sinica, 50(3): 611-620.
- http://dx.doi.org/10.11693/hyhz20180700182
文章历史
-
收稿日期:2018-07-24
收修改稿日期:2018-10-04
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
棕囊藻是一类广温广盐性的浮游. 04ennot-Dinet M J, Leblanc C strains of P.globosa植物, 从极地至热带海域均有分布, 是海洋中重要的初级生产者(Smith et al, 1991; Baumann et al, 1994)。它能够产生挥发性的二甲基硫(DMS), 对云核形成和气候变化有重要调控作用(Charlson et al, 1987)。棕囊藻中的球形棕囊藻(Phaeocystis globosa)、波切棕囊藻(P. pouchetii)和南极棕囊藻(P. antarctica)能够形成囊状群体(以下简称囊体), 曾在全球许多海域引发大规模赤潮(Schoemann et al, 2005)。在我国近海, 球形棕囊藻是主要的赤潮原因种。自1997年我国东南沿海首次暴发球形棕囊藻赤潮以来(王朝晖等, 1998), 从渤海至南海海域都有棕囊藻赤潮发生(梁玉波, 2012)。棕囊藻的胶质群体能够堵塞鱼鳃, 影响其呼吸和摄食, 造成鱼类窒息死亡; 棕囊藻产生的溶血毒素具有生物毒性, 会对海洋动物产生毒害效应, 严重时会导致鱼类大面积死亡(何家菀等, 1999)。因此, 棕囊藻赤潮对我国海水养殖业发展和海洋生态系统健康构成了严重威胁。
球形棕囊藻生活史复杂, 具有游离细胞和囊体两种存在形态。在球形棕囊藻赤潮中, 囊体是其主要存在形态, 但水体中也同时存在游离细胞。由于棕囊藻游离细胞个体微小, 而囊体在采样和固定过程中易受破坏, 使得对球形棕囊藻丰度和生物量的观测受到许多制约。因此, 在对棕囊藻的研究中, 常用特征色素来反映浮游植物群落组成情况(Wright et al, 1996), 并通过化学分类软件CHEMTAX来计算棕囊藻所属定鞭藻类的生物量(Mackey et al, 1996)。通常认为, 19′-己酰氧基岩藻黄素(19′- hexanoyloxyfucoxanthin, 简写为Hex-fuco)是棕囊藻的特征色素, 此外, 19′-丁酰氧基岩藻黄素(19′-Butanoyloxyfucoxanthin, 简写为But-fuco)也是棕囊藻的代表色素, 但其含量相对较低(Wright et al, 1987; Zapata et al, 2004)。因此, 在以CHEMTAX计算棕囊藻生物量时, 许多研究仅以Hex-fuco与叶绿素a(chl a)的比值进行计算, 也有部分研究将But-fuco的贡献考虑在内(Mackey et al, 1996; Wright et al, 2010; Gibberd et al, 2013)。
2015年, 广西北部湾海域暴发大规模球形棕囊藻赤潮。通过对赤潮过程中浮游植物样品的色素分析发现, 在球形棕囊藻囊体出现之前, 浮游植物样品中能够检测到Hex-fuco, 在棕囊藻赤潮暴发之后, 样品中却只能检测到But-fuco, 几乎检测不到Hex-fuco, 这明显有悖于以往对棕囊藻特征色素的认识。为了解我国近海球形棕囊藻的色素组成特征, 构建准确的棕囊藻生物量计算方法, 我们采用高效液相色谱方法, 对实验室培养的6株球形棕囊藻所产色素进行了分析, 以探讨不同株系棕囊藻和不同状态棕囊藻色素组成特征的差异, 为球形棕囊藻赤潮的监测提供科学依据。
1 材料与方法 1.1 实验藻株实验中分析的6株球形棕囊藻相关信息列于表 1。经28S rDNA测序分析遗传多样性(胡晓坤等, 2019), 所有藻株均为球形棕囊藻。所有藻株采用L1培养基进行培养, 所用海水经0.22μm醋酸纤维膜过滤, 煮沸两次后使用。光照为白色LED光源, 藻类培养光照强度约40μmol photons/(m2·s), 光暗比为14h︰10h, 培养温度(20±1)℃, 培养至指数生长期进行样品采集和色素分析。
| 藻株名称 | 形态 | 分离地点 | 藻种来源 |
| PG2016 | 囊体与游离细胞共存 | 广西北部湾 | 中国科学院海洋研究所 |
| PG2017 | 囊体与游离细胞共存 | 广西北部湾 | 厦门大学 |
| PGDH | 囊体与游离细胞共存 | 福建沿海 | 中国科学院海洋研究所 |
| PGDAB | 仅游离细胞 | 广东大亚湾 | 自然资源部第三海洋研究所 |
| GY-H37 | 囊体与游离细胞共存 | 广东珠江口 | 上海光语生物科技有限公司 |
| CCMP628 | 囊体与游离细胞共存 | 美国加勒比海 | NCMA藻种库 |
分析所用色素标准品(表 2)购自DHI公司。采用购自Sigma公司的8′-阿朴-β, ψ-胡萝卜醛(Apocarotenal)作为内标(Internal Standard, IS)。甲醇、乙腈、吡啶、乙酸和丙酮等有机溶剂均为色谱纯; 实验所用超纯水采用Millipore系统纯化制备。
| 英文名称 | 中文名称 | 简称 |
| 19'-Hexanoyloxy-4-ketofucoxanthin | 4-酮基-19′-己酰氧基岩藻黄素 | 4k-hex-fuco |
| 19'-Butanoyloxyfucoxanthin | 19′-丁酰氧基岩藻黄素 | But-fuco |
| 19'-Hexanoyloxyfucoxanthin | 19′-己酰氧基岩藻黄素 | Hex-fuco |
| β, ε-Carotene | α-胡萝卜素 | βε-Car |
| β, β-Carotene | β-胡萝卜素 | ββ-Car |
| Chlorophyll a | 叶绿素a | Chl a |
| Chlorophyll c2 | 叶绿素c2 | Chl c2 |
| Chlorophyll c3 | 叶绿素c3 | Chl c3 |
| Diadinoxanthin | 硅甲藻黄素 | Diad |
| Diatoxanthin | 硅藻黄素 | Diat |
| Divinyl-Protochlorophyllide | Mg-2, 4-二乙烯基脱镁卟啉a5单甲基酯 | MGDVP |
| Fucoxanthin | 岩藻黄素 | Fuco |
| Methy-chlorophyllide a | 甲基脱植基叶绿素a | Me-chlide a |
6株球形棕囊藻半连续培养至指数生长期后的培养液, 分别采集游离细胞、囊体和混合样品进行计数和色素分析, 每类色素样品设置三个平行。采用显微镜进行棕囊藻细胞计数, 其中游离细胞直接以血球计数板计数, 囊体则记录其直径, 并按照1.4中所述方法计算棕囊藻细胞数。用于色素分析的棕囊藻样品以直径25mm的GF/F玻璃纤维滤膜过滤, 其中混合样品是将培养液中游离藻细胞和囊体全部过滤到滤膜上。采集游离细胞时, 先采用10μm筛绢过滤培养液, 将滤液中的棕囊藻细胞过滤至GF/F玻璃纤维滤膜上进行分析; 筛绢上截留的棕囊藻作为囊体样品进行分析。对于能形成较大囊体的藻株, 则直接挑取囊体进行计数和色素分析。所有过滤后的滤膜经铝箔包被, 液氮冷冻后, 置于–80℃冰箱存放直至分析。
1.4 棕囊藻细胞计数在棕囊藻培养液中, 既存在游离细胞, 也存在囊体。游离细胞密度通过血球计数法获得, 而培养液中棕囊藻囊体的藻细胞密度, 则需要建立棕囊藻囊体中藻细胞的计数方法。在将棕囊藻培养至指数期后, 挑取一定数量不同直径的完整囊体, 直径超过1cm的囊体用刻度尺测量直径, 较小囊体在光学显微镜下进行直径测量。由于囊体中的棕囊藻细胞均匀包裹于多糖胶质外被中, 因此可通过显微镜变换焦距计数囊体表面的细胞数, 建立棕囊藻囊体直径与囊体总细胞数的标准曲线。在对棕囊藻培养液藻细胞计数时, 可以通过测量培养液中囊体的数量和直径, 并利用构建的标准曲线计算囊体中藻细胞总数。
1.5 色素分析 1.5.1 色素提取色素提取参照Zapata等(2000)的方法, 以95%甲醇作为萃取剂, 萃取体积有所不同。滤膜样品室温下解冻后, 剪成宽约1mm的细条, 放入1.5mL棕色样品瓶中, 加入1400μL 95%的甲醇水溶液提取色素, 同时加入100μL Apocarotenal (750μg/L)作为内标, 混匀, 冰浴超声处理5min后用玻璃注射器吸取提取液, 以孔径0.22μm有机相针头滤器过滤, 用微量进样针吸取800μL滤液至1.5mL棕色样品瓶中, 加入160μL超纯水, 震荡混匀, 立即上机检测。
1.5.2 HPLC分析方法采用Waters E2695高效液相色谱系统进行色素分析, 所用方法为Zapata等(2000)建立, 略有修订。分析所用色谱柱为Waters Symmetry C8色谱柱, 采用二元梯度洗脱(表 3), 流动相A为甲醇:乙腈:吡啶水(50:25:25, V:V:V), 流动相B为甲醇:乙腈:丙酮(20:60:20, V:V:V)。进样量为100μL, 洗脱时间45min。使用Waters 2998二极管阵列检测器检测, 检测波长为440nm, 同时记录300—750nm吸收光谱。
| 时间(min) | 洗脱液A(%) | 洗脱液B(%) |
| 0 | 100 | 0 |
| 22 | 50 | 50 |
| 28 | 20 | 80 |
| 40 | 5 | 95 |
| 43 | 5 | 95 |
| 43.1 | 100 | 0 |
| 45 | 100 | 0 |
检出色素通过比对色素标准品的保留时间和吸收光谱特征进行定性确认。
色素定量采用内标定量法, 将内标Apocarotenal与各种标准色素配制成不同浓度的混合标准溶液, 依次将各浓度的混合标准溶液上机检测, 绘制工作曲线, 得出各种标准色素相对于内标的响应因子。根据响应因子和内标回收率计算得出各类色素的含量。
各种标准色素相对于内标的响应因子(fpis)用公式(1)计算:
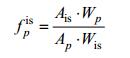 (1)
(1)各种色素浓度(Cp, 单位为μg/L)用公式(2)计算:
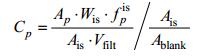 (2)
(2)其中, Ais为内标面积, Wis为内标质量, Ap为待测色素面积, Wp为待测色素质量, Vfilt为色素样品过滤体积, Ablank为用于计算回收率的空白内标面积。
1.6 数据处理和统计分析采用Waters公司Empower 2软件进行色素数据收集与分析。通过独立样本t检验进行差异显著性比较, 显著性水平为P < 0.05。
2 结果与分析 2.1 球形棕囊藻囊体中藻细胞计数结果棕囊藻具有囊体和游离细胞两种生活形态, 难以直接计数藻细胞总数。为方便获得棕囊藻囊体的细胞数量, 分别针对5株能够形成囊体的球形棕囊藻, 建立了囊体细胞总数与囊体直径之间的回归曲线(图 1a)。结果表明, 自中国近海分离的4株球形棕囊藻囊体细胞总数与囊体直径的回归曲线相近, 而分离自美国加勒比海的藻株CCMP628回归曲线与其他4株差异较大。在囊体直径相同的情况下, 根据CCMP628回归曲线换算出的细胞数高于其他藻株, 但未达到数量级上的差异。总体来说, 5株球形棕囊藻获得的回归曲线较为接近, 说明不同株系球形棕囊藻单位表面积囊体上细胞数差异较小, 可以拟合出一条适用于球形棕囊藻囊体细胞数量换算的曲线(图 1b), 各藻株回归曲线及总体曲线方程见表 4。
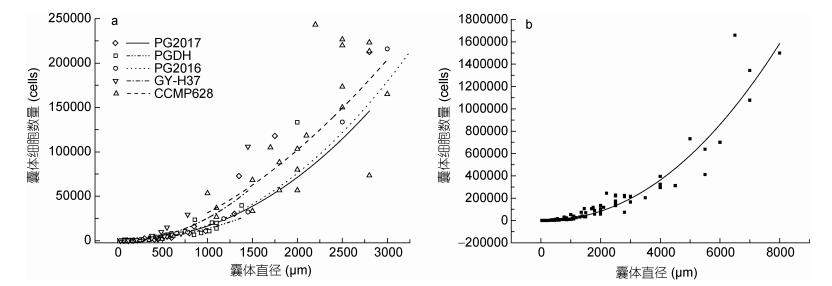 |
| 图 1 球形棕囊藻囊体细胞总数与囊体直径的关系 Fig. 1 Relationship between total cell number and the size of colony for P. globosa 注: a. 5株球形棕囊藻囊体细胞总数与囊体直径的回归曲线; b.球形棕囊藻囊体细胞总数与囊体直径的总体回归曲线 |
| 藻株名称 | 回归曲线方程 | R2 |
| PG2016 | Y=0.0076X 2.1204 | 0.9931 |
| PG2017 | Y =0.007X 2.1232 | 0.9480 |
| PGDH | Y =0.0144X 1.9908 | 0.9579 |
| GY-H37 | Y =0.0093X 2.145 | 0.9287 |
| CCMP628 | Y =0.2477X 1.7012 | 0.6491 |
| 总体曲线 | Y =0.0079X 2.1271 | 0.9710 |
对6株实验室培养的球形棕囊藻色素组成和含量进行了分析, 共检测到以下色素组分(图 2):叶绿素c3(chl c3)、Mg-2, 4-二乙烯基脱镁卟啉a5单甲基酯(MgDVP)、叶绿素c2(chl c2)、甲基脱植基叶绿素a (Me-chlide a)、19'-丁酰氧基岩藻黄素(But-fuco)、岩藻黄素(Fuco)、4-酮基-19'-己酰氧基岩藻黄素(4k-hex-fuco)、19'-己酰氧基岩藻黄素(Hex-fuco)、硅甲藻黄素(Diad)、硅藻黄素(Diat)、叶绿素a(chl a)、α-胡萝卜素(βε-Car)和β-胡萝卜素(ββ-Car)。在所检测到的色素中, Fuco和chl a是主要的色素组分。此外, 还有少数色素组分未能确定。
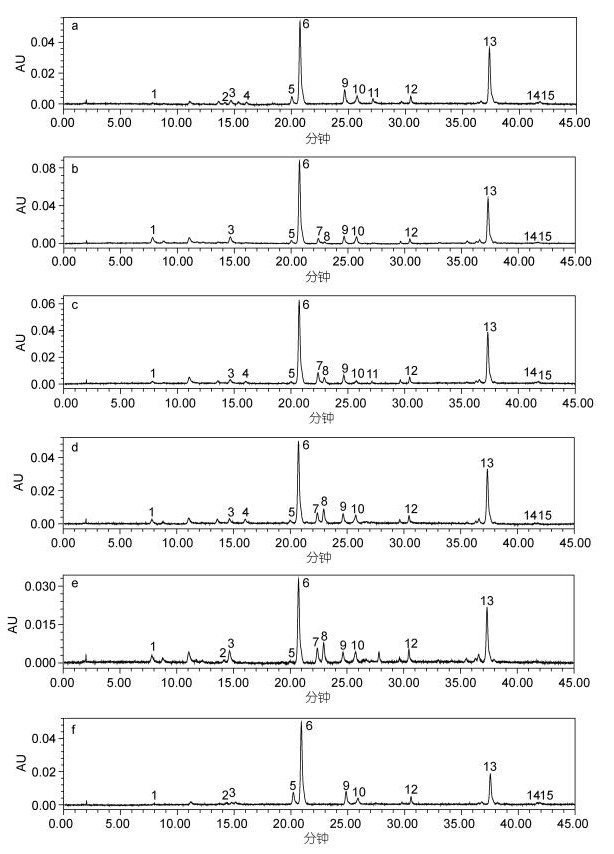 |
|
图 2 六株球形棕囊藻色素分析色谱图(440nm) Fig. 2 Chromatograms of six P. globosa strains (absorbance detected at 440nm) 注: a. PG 2016; b. PGDH; c. PG 2017; d. GY-H37; e. CCMP628; f. PGDAB 1. chl c3; 2. MgDVP; 3.chl c2; 4. Me-chlide a; 5. But-fuco; 6. Fuco; 7. 4k-hex-fuco; 8. Hex-fuco; 9. Diad; 10. Unknown carotenoid; 11. Diat; 12. IS; 13. chl a; 14. βε-Car; 15. ββ-Car |
6株球形棕囊藻的色素组成基本一致, 均以Fuco和chl a为主要色素组分, 且都含有But-fuco, 但通常被认为是棕囊藻特征色素的Hex-fuco反而存在较大株系间差异。在4株棕囊藻中检测到Hex-fuco, 其中3株分离自广西北部湾、广东沿海和美国加勒比海的藻株PG2017、GY-H37和CCMP628中的Hex-fuco色素含量高于But-fuco, 另外一株分离自东海的PGDH藻株But-fuco色素含量略高于Hex-fuco。而2株分离自广西北部湾和广东大亚湾的球形棕囊藻PG2016和PGDAB则未检测到Hex-fuco。4k-hex-fuco与Hex-fuco往往相伴出现, 在含有Hex-fuco的4株球形棕囊藻中都检测到了较高含量的4k-hex-fuco, 而在另外2株球形棕囊藻中, 两种色素均未检测到。
根据棕囊藻细胞计数结果, 计算了6株球形棕囊藻细胞中的色素含量(表 5)。其中, 藻株PG2016囊体较大, 部分直径超过1cm, 分布不均匀, 容易对棕囊藻细胞计数造成误差, 因此分别分析计算了囊体和游离细胞中的色素含量。结果表明, 各藻株中色素含量以PG2016、PGDH和PG2017略高, 另外3株稍低, 但没有明显差别。所检测到的各种色素中, chl a含量(0.0585—0.236pg/cell)最高, Fuco (0.0478— 0.205pg/cell)次之, 之后依次为Diad (0.0031— 0.0155pg/cell)、But-fuco (0.001—0.015pg/cell)、4k-hex-fuco (0.005—0.012pg/cell)、Hex-fuco (0.002— 0.01pg/cell)、Me-chlide a (0.0036—0.0087pg/cell)、ββ-Car (0.0007—0.0067pg/cell)、chl c2 (0.0009— 0.0092pg/cell)、chl c3 (0.0008—0.0107pg/cell)、Diat (0.0002—0.0023pg/cell)、MGDVP (0.0006—0.0013pg/cell)和βε-Car (0.0002—0.0012pg/cell)。在能够产生Hex-fuco的4株球形棕囊藻中, CCMP628的Hex-fuco含量最高, PGDH最低。But-fuco的单细胞色素含量在PG2016中最高, CCMP628中最低。
| 藻株名称 | 单细胞色素含量(pg/cell) | ||||||||||||
| chl c3 | MgDVP | chl c2 | Me-chlide a | But-fuco | Fuco | 4k-hex-fuco | Hex-fuco | Diad | Diat | chl a | βε-Car | ββ-Car | |
| PG2016-游离 | 0.0019 | 0.0013 | 0.0054 | 0.0087 | 0.0158 | 0.1720 | — | — | 0.0155 | 0.0023 | 0.2360 | 0.0012 | 0.0067 |
| PG2016-囊体 | — | 0.0009 | 0.0009 | 0.0058 | 0.0104 | 0.1140 | — | — | 0.0094 | 0.0018 | 0.1550 | 0.0011 | 0.0046 |
| PGDH | 0.0107 | 0.0006 | 0.0092 | 0.0027 | 0.0065 | 0.2050 | 0.0093 | 0.0020 | 0.0099 | 0.0005 | 0.2050 | 0.0008 | 0.0036 |
| PG2017 | 0.0018 | — | 0.0012 | 0.0040 | 0.0021 | 0.1060 | 0.0125 | 0.0065 | 0.0059 | 0.0009 | 0.1260 | 0.0006 | 0.0028 |
| GY-H37 | 0.0026 | — | 0.0010 | 0.0036 | 0.0014 | 0.0478 | 0.0052 | 0.0071 | 0.0031 | 0.0003 | 0.0703 | 0.0003 | 0.0012 |
| CCMP628 | 0.0024 | 0.0007 | 0.0019 | — | 0.0012 | 0.0485 | 0.0074 | 0.0095 | 0.0032 | 0.0003 | 0.0622 | 0.0002 | 0.0007 |
| PGDAB | 0.0008 | 0.0007 | 0.0100 | — | 0.0105 | 0.0772 | — | — | 0.0071 | 0.0002 | 0.0585 | 0.0008 | 0.0019 |
针对5株能够形成囊体的球形棕囊藻藻株, 对比分析了其囊体和游离细胞中色素组成与含量状况的差异。结果表明, 游离细胞中检测到的色素种类明显多于囊体, 大部分叶绿素c类色素(如: chl c3、chl c2和MgDVP)仅在游离细胞中检测到, 而在囊体细胞中极少检测到。考虑到在两类样品采集过程中, 囊体上的部分藻细胞可能脱落并进入游离细胞样品, 因此, 未对两类样品中色素的绝对含量进行对比, 而是分别针对各种色素计算了其与chl a含量的比值(表 6), 并对比了游离细胞和囊体之间色素比值的差异。大部分藻株游离细胞中的Fuco及其衍生色素(Hex-fuco, But-fuco, 4k-hex-fuco)与chl a的比值明显高于囊体, 在PGDH、PG2017和CCMP628等藻株中其差异达到显著水平。Diad/chl a的比值也在游离细胞中较高, 而囊体中Diat与chl a的比值则略高于游离细胞, 但差异不显著。而囊体中胡萝卜素(βε-Car, ββ-Car)与chl a的比值明显高于游离细胞。
| 色素比值(×10–3) | 形态 | PG2016 | PGDH | PG2017 | GY-H37 | CCMP628 | PGDAB |
| chl c3/chl a | 囊体 | — | — | — | — | — | |
| 游离 | 81.0±0.69 | 49.4±10.7 | 60.2±15.9 | 103.0±40.4 | 19.6±4.41 | 13.8±1.53 | |
| MgDVP/chl a | 囊体 | 5.92±1.63 | — | — | — | — | |
| 游离 | 5.66±1.23 | 2.64±0.39 | — | — | 11.4±3.00 | 11.4±0.52 | |
| chl c2/chl a | 囊体 | 5.93±2.82 | — | — | — | — | |
| 游离 | 22.8±16.6 | 31.0±21.1 | 17.8±18.5 | 33.1±24.9 | 26.5±21.2 | 6.06±6.09 | |
| Me-chlide a/chl a | 囊体 | 37.3±8.10 | — | — | — | — | |
| 游离 | 37.5±9.83 | 26.7±2.03 | 80.6±31.6 | 94.4±86.3 | 40.2±3.32 | — | |
| But-fuco/chl a | 囊体 | 67.3±6.89 | 19.7±1.93* | 16.6±6.48 | 17.42±5.77 | — | |
| 游离 | 67.0±1.83 | 36.7±4.67* | 21.5±5.44 | 45.0±34.7 | 29.1±4.89 | 180±11.3 | |
| Fuco/chl a | 囊体 | 733±33.4 | 538±15.6* | 531±6.59* | 590±22.3 | 526±108* | |
| 游离 | 733.±37.3 | 835±91.6* | 1081±242* | 1403±973 | 1257±311* | 1321±97.9 | |
| 4k-hex-fuco/chl a | 囊体 | — | 23.0±1.87* | 67.1±7.53* | 84.7±5.47 | — | |
| 游离 | — | 44.3±5.47* | 139.8±35.7* | 214±145 | 113±27.4 | — | |
| Hex-fuco/Chl a | 囊体 | — | 11.4±1.26 | 47.8±5.30 | 40.2±2.54 | 98.3±38.4 | |
| 游离 | — | 12.3±3.63 | 67.4±16.6 | 104±73.8 | 96.3±20.9 | — | |
| Diad/chl a | 囊体 | 60.8±3.58 | 41.4±2.12 | 27.4±1.86* | 38.5±6.91 | — | |
| 游离 | 65.7±0.99 | 50.9±6.52 | 76.5±171* | 123±7.92 | 60.9±14.2 | 122±8.35 | |
| Diat/chl a | 囊体 | 11.5±1.49 | 4.02±1.20 | 12.2±4.77 | 15.9±3.95 | — | |
| 游离 | 9.94±0.25 | 3.24±0.13 | 10.6±2.55 | 16.2±10.3 | 4.53±0.72 | 3.08±0.68 | |
| βε-Car/chl a | 囊体 | 6.93±1.76 | 4.35±1.55 | — | — | — | |
| 游离 | 5.28±0.35 | 3.81±0.16 | 3.97±0.93 | 1.87±1.05 | 5.98±0.48 | 13.2±1.10 | |
| ββ-Car/chl a | 囊体 | 29.6±2.50 | 24.1±6.46 | 31.0±6.84 | — | — | |
| 游离 | 28.6±3.84 | 17.4±0.69 | 25.2±6.44 | 28.7±16.5 | 20.7±6.84 | 31.8±3.73 | |
| 注: * P < 0.05 | |||||||
海洋中不同浮游植物类群在色素组成上具有一定差异, 因此, 可以基于特征色素对不同类群浮游植物进行区分, 并通过化学分类软件CHEMTAX等计算其生物量。Zapata等(2004)根据9种叶绿素c类色素和5种岩藻黄素的衍生物, 将定鞭藻类分成8个色素型, 其中棕囊藻被归类于同时含有Hex-fuco和But-fuco的第Ⅷ类色素型。以往国际上对棕囊藻色素的研究多集中于南极棕囊藻和波切棕囊藻, 在这两种棕囊藻中, Hex-fuco含量明显高于But-fuco。因此, 常以Hex-fuco作为棕囊藻生物量计算的主要特征色素。相对于南极棕囊藻和波切棕囊藻, 球形棕囊藻的Hex-fuco含量明显较低(Van Leeuwe et al, 2014), 本文对球形棕囊藻的研究结果也同样支持这一观点。另外, Vaulot等(1994)通过对16株棕囊藻的色素分析发现, 在不同藻株中chl c2、chl c3和chl a等常见色素的含量差异较小, 而Fuco和Hex-fuco的含量差异反而较大。由于棕囊藻中Hex-fuco含量不稳定, 已有研究开始尝试寻找新的棕囊藻特征色素指标。研究发现, 在拉布拉多海域的棕囊藻中Hex-fuco和But-fuco含量很低, 而chl c3色素含量较高, 因此在CHEMTAX计算中以chl c3和Fuco作为指示棕囊藻的特征色素(Stuart et al, 2000; Muylaert et al, 2006; Fragoso et al, 2017)。但在本文研究的6株球形棕囊藻中, chl c3含量均较低, 可能并不适于对球形棕囊藻生物量的评估; 而且一些硅藻、甲藻和金藻也能够产生chl c3(Zapata, 2005), 有可能对结果造成干扰。
本文研究结果表明, 棕囊藻的特征色素不仅具有明显的种间差别, 在不同株系之间也有差异。在所分析的6株球形棕囊藻中, 有2株球形棕囊藻没有检测到Hex-fuco。类似结果以往也有报道, 在3株分别分离自澳大利亚东部海域、英吉利海峡和比利时沿岸的球形棕囊藻中, Hex-fuco和But-fuco均未检出(Jeffrey et al, 1994; Breton et al, 2000; Antajan et al, 2004);而自西班牙沿岸海域和墨西哥湾分离的球形棕囊藻中则只含有Hex-fuco, 不含But-fuco (Seoane et al, 2009; Zapata et al, 2004)。一株自澳大利亚近海分离的球形棕囊藻中则只有高含量的But-fuco (Vaulot et al, 1994)。由此可见, 不同株系的球形棕囊藻可能具有其独特的色素组成特征。本研究的结果显示, 球形棕囊藻藻株的色素组成特征与其采集海域似乎没有明显关联, 同样采自广西北部湾的PG2016和PG2017藻株, 其特征色素组成明显不同; 采自广东沿海的GY-H37和PGDAB藻株特征色素组成也有明显差别。在同一海域分离的球形棕囊藻藻株具有不同的色素特征, 是否反映了棕囊藻来源地差异(胡晓坤等, 2019), 值得深入探讨。另外, 在运用CHEMTAX评估球形棕囊藻的生物量时, 也应充分调查海域棕囊藻的种类与特征色素组成情况, 采用合适的色素比例构建初始矩阵, 否则会影响结果的准确性。本研究中来自我国近海的五株球形棕囊藻, 其Hex-fuco与叶绿素a的比值存在较大差异, 根据特征色素与叶绿素a的比值可大致将五株球形棕囊藻分为三类(表 7):类型Ⅰ, PG2016和PGDAB, 不含Hex-fuco和4k-hex-fuco, 而具有较高的But-fuco/chl a比例; 类型Ⅱ与类型Ⅲ都含有Hex-fuco, 但在比例上有明显差异, 4k-hex-fuco的变化规律与Hex-fuco一致。类型Ⅱ中PGDH藻株Hex-fuco/chl a比值较低, 约为0.01;类型Ⅲ中具有较高含量的Hex-fuco和4k-hex-fuco, Hex-fuco/chl a约为0.04—0.1。因此, 在计算我国近岸海域球形棕囊藻的生物量时, 可参考此比值选择初始色素比例。
| 类型 | 色素比例 | |||
| Hex-fuco/chl a | 4k-hex-fuco/chl a | But-fuco/chl a | chl c3/chl a | |
| Ⅰ PG2016, PGDAB | 0 | 0 | 0.07—0.18 | 0.01—0.08 |
| Ⅱ PGDH | 0.01 | 0.02—0.04 | 0.02—0.04 | 0.05 |
| Ⅲ PG2017, GY-H37 | 0.04—0.1 | 0.07—0.2 | 0.02—0.05 | 0.06—0.1 |
以往研究结果表明, 棕囊藻的色素组成会受到光照和盐度等环境因子影响(Seoane et al, 2009; Liu et al, 2011; Van Leeuwe et al, 2014), 在特定条件下Fuco会向Hex-fuco或But-fuco转变(Stefels et al, 1998)。因此, 球形棕囊藻各藻株的特征色素组成是固有的, 还是会随环境条件变化转变, 还需继续研究。
3.2 球形棕囊藻色素组成特征与其存在形态的关系前期研究表明, 棕囊藻的游离细胞和囊体细胞之间在色素组成上有可能存在差异(Jeffrey et al, 1994; Vaulot et al, 1994)。本研究发现, 5株球形棕囊藻的游离细胞和囊体细胞在色素组成上存在一定差别。在游离细胞中普遍存在叶绿素c类色素, Fuco及其衍生物与chl a的比值相对较高; 而囊体中很少检测到叶绿素c类色素, Diat和胡萝卜素(βε-Car, ββ-Car)与chl a的比值相对较高。在以往研究中也有类似报道, 如Buma等(1991)研究发现, 南极棕囊藻囊体细胞中的Fuco/chl a的比值明显低于游离细胞。
在上述色素中, 叶绿素c类和Fuco都具有光捕获功能。Hex-fuco、4k-hex-fuco和But-fuco都是Fuco的衍生物, 具有相似的化学结构和吸收光谱特征, Hex-fuco也具有光捕获功能, 而But-fuco和4k-hex-fuco可能兼具光捕获和光保护色素功能(Van Leeuwe et al, 2014)。Diad、Diat和胡萝卜素则是常见的光保护色素(Gibb et al, 2000; Zapata et al, 2004)。在高光照条件下, 藻类通过叶黄素循环产生Diad和Diat, 来保护细胞免受光损伤。以往研究发现, 在高光照条件下, 叶绿素c类和Fuco等捕光色素与chl a的比值明显下降, 而Diad、Diat和ββ-Car等光保护色素的比例则会上升(Seoane et al, 2009; Van Leeuwe et al, 2014)。球形棕囊藻囊体细胞和游离细胞中色素组成的差异很可能反映了两种存在状态的棕囊藻对光照适应特征的差异。棕囊藻游离细胞散布于海水中, 接受的光照相对较弱, 需要叶绿素c类等光捕获色素辅助chl a获取光能, 进行光合作用。而棕囊藻囊体大部分漂浮于水体表层, 可以获得充足光照, 因此, 捕光色素含量降低, 而光保护色素含量上升。囊体细胞中捕光色素含量下降的另外一个原因可能是囊体形成后藻细胞营养方式改变, 可以依靠有机胶质膜为其异养生长提供能量和营养物质(Schoemann et al, 2001)。
在自然环境中, 以游离细胞和囊体两种形态存在的球形棕囊藻, 是其不同生活史阶段的代表, 通过生活史阶段的转换来适应环境条件的变化。在游离细胞和囊体的转换中, 可能存在有性生殖过程(杨和福, 2004;沈萍萍等, 2000;胡晓坤等, 2019)。本研究中所针对的球形棕囊藻游离细胞和囊体, 只是在同一培养阶段人为将囊体细胞和游离细胞分开, 可能难以完全反映自然海域中球形棕囊藻游离细胞和囊体在色素组成上的差别, 有必要通过对球形棕囊藻生活史阶段的控制实验, 进一步分析两种生活史状态棕囊藻在色素组成特征方面的差异。
4 结论本文针对在我国东南沿海连年暴发大规模赤潮的球形棕囊藻, 选择6株球形棕囊藻藻株, 对其色素组成与含量进行了分析和对比, 并通过分级过滤方法获得球形棕囊藻囊体和游离细胞样品, 对其色素组成情况进行了对比。得到主要结论如下:
(1) 不同株系球形棕囊藻色素组成相似, 但其特征色素存在明显株系间差异。在测试的6株球形棕囊藻中都可以检测到But-fuco, 但Hex-fuco仅在4株球形棕囊藻中检出。球形棕囊藻各藻株中Hex-fuco存在与否与其分离地没有明显关联, 即便是分离自同一海域的球形棕囊藻藻株也具有不同的特征色素组成。
(2) 球形棕囊藻囊体和游离细胞在色素组成上存在差异。游离细胞中叶绿素c类、Fuco和Hex-fuco等捕光色素与叶绿素a的比值较高, 而囊体细胞中Diat和胡萝卜素等光保护色素与叶绿素a的比值更高, 这一差异可能与不同生活史状态棕囊藻对光照的适应特征有关。
(3) 研究结果表明, 仅以Hex-fuco作为球形棕囊藻的特征色素并不合适。因此, 在以CHEMTAX方法计算球形棕囊藻生物量时, 应充分调查目标海域球形棕囊藻特征色素组成情况, 获取其特征色素信息, 构建合理色素比例初始矩阵, 为球形棕囊藻赤潮监测奠定基础。
致谢 承蒙厦门大学近海海洋环境科学国家重点实验室王大志教授提供从北部湾海域分离的球形棕囊藻PG2017藻株, 自然资源部第三海洋研究所顾海峰研究员提供从广东大亚湾分离的球形棕囊藻PGDAB藻株, 谨致谢忱。
王朝晖, 吕颂辉, 陈菊芳, 等. 1998. 广东沿海几种赤潮生物的分类学研究. 武汉植物学研究, 16(4): 310-314 DOI:10.3969/j.issn.2095-0837.1998.04.006 |
杨和福. 2004. 棕囊藻的生物学概述Ⅰ.形态分类和生理生态学. 东海海洋, 22(1): 49-63 DOI:10.3969/j.issn.1001-909X.2004.01.007 |
何家菀, 施之新, 张银华, 等. 1999. 一种棕囊藻的形态特征与毒素分析. 海洋与湖沼, 30(2): 172-179 DOI:10.3321/j.issn:0029-814X.1999.02.010 |
沈萍萍, 王艳, 齐雨藻, 等. 2000. 球形棕囊藻的生长特性及生活史研究. 水生生物学报, 24(6): 635-643 DOI:10.3321/j.issn:1000-3207.2000.06.010 |
胡晓坤, 张清春, 陈振帆, 等. 2019. 北部湾海域球形棕囊藻遗传多样性分析. 海洋与湖沼, 50(3): 601-610 |
梁玉波. 2012. 中国赤潮灾害调查与评价(1933-2009). 北京: 海洋出版社, 112-115
|
Antajan E, Chrétiennot-Dinet M J, Leblanc C et al, 2004. 19′-Hexanoyloxy fucoxanthin may not be the appropriate pigment to trace occurrence and fate of Phaeocystis: the case of P. globosa in Belgian coastal waters. Journal of Sea Research, 52(3): 165-177 DOI:10.1016/j.seares.2004.02.003 |
Baumann M E M, Lancelot C, Brandini F P et al, 1994. The taxonomic identity of the cosmopolitan prymnesiophyte Phaeocystis: a morphological and ecophysiological approach. Journal of Marine Systems, 5(1): 5-22 DOI:10.1016/0924-7963(94)90013-2 |
Breton E, Brunet C, Sautour B et al, 2000. Annual variations of phytoplankton biomass in the Eastern English Channel: comparison by pigment signatures and microscopic counts. Journal of Plankton Research, 22(8): 1423-1440 DOI:10.1093/plankt/22.8.1423 |
Buma A G J, Bano N, Veldhuis M J W et al, 1991. Comparison of the pigmentation of 2 strains of the Prymnesiophyte Phaeocystis sp. Netherlands Journal of Sea Research, 27(2): 173-182 DOI:10.1016/0077-7579(91)90010-X |
Charlson R J, Lovelock J E, Andreae M O et al, 1987. Oceanic phytoplankton, atmospheric sulphur, cloud albedo and climate. Nature, 326(6114): 655-661 DOI:10.1038/326655a0 |
Fragoso G M, Poulton A J, Yashayaev I M et al, 2017. Spring phytoplankton communities of the Labrador Sea (2005-2014): pigment signatures, photophysiology and elemental ratios. Biogeosciences, 14(5): 1235-1259 DOI:10.5194/bg-14-1235-2017 |
Gibb S W, Barlow R G, Cummings D G et al, 2000. Surface phytoplankton pigment distributions in the Atlantic Ocean: an assessment of basin scale variability between 50°N and 50°S. Progress in Oceanography, 45(3-4): 339-368 DOI:10.1016/S0079-6611(00)00007-0 |
Gibberd M J, Kean E, Barlow R et al, 2013. Phytoplankton chemotaxonomy in the Atlantic sector of the Southern Ocean during late summer 2009. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 78: 70-78 DOI:10.1016/j.dsr.2013.04.007 |
Jeffrey S W, Wright S W, 1994. Photosynthetic pigments in the Haptophyta. In: Green J C, Leadbeater B S C eds. The Haptophyte Algae. Oxford, UK: Clarendon Press, 111—132
|
Liu S X, Yu Z G, Yao P et al, 2011. Effects of irradiance on pigment signatures of harmful algae during growth process. Acta Oceanologica Sinica, 30(6): 46-57 DOI:10.1007/s13131-011-0160-1 |
Mackey M D, Mackey D J, Higgins H W et al, 1996. CHEMTAX-a program for estimating class abundances from chemical markers: application to HPLC measurements of phytoplankton. Marine Ecology Progress Series, 144: 265-283 DOI:10.3354/meps144265 |
Muylaert K, Gonzales R, Franck M et al, 2006. Spatial variation in phytoplankton dynamics in the Belgian coastal zone of the North Sea studied by microscopy, HPLC-CHEMTAX and underway fluorescence recordings. Journal of Sea Research, 55(4): 253-265 DOI:10.1016/j.seares.2005.12.002 |
Schoemann V, Wollast R, Chou L et al, 2001. Effects of photosynthesis on the accumulation of Mn and Fe by Phaeocystis colonies. Limnology and Oceanography, 46(5): 1065-1076 DOI:10.4319/lo.2001.46.5.1065 |
Schoemann V, Becquevort S, Stefels J et al, 2005. Phaeocystis blooms in the global ocean and their controlling mechanisms: a review. Journal of Sea Research, 53(1-2): 43-66 DOI:10.1016/j.seares.2004.01.008 |
Seoane S, Zapata M, Orive E, 2009. Growth rates and pigment patterns of haptophytes isolated from estuarine waters. Journal of Sea Research, 62(4): 286-294 DOI:10.1016/j.seares.2009.07.008 |
Smith W O Jr, Codispoti L A, Nelson D M et al, 1991. Importance of Phaeocystis blooms in the high-latitude ocean carbon cycle. Nature, 352(6335): 514-516 DOI:10.1038/352514a0 |
Stefels J, Van Leeuwe M A, 1998. Effects of iron and light stress on the biochemical composition of Antarctic Phaeocystis sp.(Prymnesiophyceae). Ⅰ. Intracellular DMSP concentrations.. Journal of Phycology, 34(3): 486-495 DOI:10.1046/j.1529-8817.1998.340486.x |
Stuart V, Sathyendranath S, Head E J H et al, 2000. Bio-optical characteristics of diatom and prymnesiophyte populations in the Labrador Sea. Marine Ecology Progress Series, 201: 91-106 DOI:10.3354/meps201091 |
Van Leeuwe M A, Visser R J W, Stefels J, 2014. The pigment composition of Phaeocystis antarctica (Haptophyceae) under various conditions of light, temperature, salinity, and iron. Journal of Phycology, 50(6): 1070-1080 DOI:10.1111/jpy.12238 |
Vaulot D, Birrien J L, Marie D et al, 1994. Morphology, ploidy, pigment composition, and genome size of cultured strains of Phaeocystis (Prymnesiophyceae). Journal of Phycology, 30(6): 1022-1035 DOI:10.1111/j.0022-3646.1994.01022.x |
Wright S W, Jeffrey S W, 1987. Fucoxanthin pigment markers of marine phytoplankton analysed by HPLC and HPTLC. Marine Ecology Progress Series, 38: 259-266 DOI:10.3354/meps038259 |
Wright S W, Thomas D P, Marchant H J et al, 1996. Analysis of phytoplankton of the Australian sector of the Southern Ocean: Comparisons of microscopy and size-frequency data with interpretations of pigment HPLC data using the CHEMTAX matrix factorisation program. Marine Ecology Progress Series, 144: 285-298 DOI:10.3354/meps144285 |
Wright S W, Van Den Enden R L, Pearce I et al, 2010. Phytoplankton community structure and stocks in the Southern Ocean (30°-80°E) determined by CHEMTAX analysis of HPLC pigment signatures. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 57(9-10): 758-778 DOI:10.1016/j.dsr2.2009.06.015 |
Zapata M, Rodríguez F, Garrido J L, 2000. Separation of chlorophylls and carotenoids from marine phytoplankton: a new HPLC method using a reversed phase C8 column and pyridine-containing mobile phases. Marine Ecology Progress Series, 195: 29-45 DOI:10.3354/meps195029 |
Zapata M, Jeffrey S W, Wright S W et al, 2004. Photosynthetic pigments in 37 species (65 strains) of Haptophyta: implications for oceanography and chemotaxonomy. Marine Ecology Progress Series, 270: 83-102 DOI:10.3354/meps270083 |
Zapata M, 2005. Recent advances in pigment analysis as applied to picophytoplankton. Vie et Milieu, 55(3-4): 233-248 |
 2019, Vol. 50
2019, Vol. 50


