中国海洋湖沼学会主办。
文章信息
- 贺成, 宋书群, 李才文. 2019.
- HE Cheng, SONG Shu-Qun, LI Cai-Wen. 2019.
- 广西北部湾海域球形棕囊藻囊体时空分布及其影响因素
- THE SPATIAL-TEMPERAL DISTRIBUTION OF PHAEOCYSTIS GLOBOSA COLONIES AND RELATED AFFECTING FACTORS IN GUANGXI BEIBU GULF
- 海洋与湖沼, 50(3): 630-643
- Oceanologia et Limnologia Sinica, 50(3): 630-643.
- http://dx.doi.org/10.11693/hyhz20180800192
文章历史
-
收稿日期:2018-08-02
收修改稿日期:2018-11-20
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
棕囊藻(Phaeocystis)是一类广温、广盐性定鞭藻类(Haptophytes或Prymnesiophyte) (Baumann et al, 1994), 在全球范围内广泛分布, 并频繁暴发大规模赤潮(Schoemann et al, 2005)。棕囊藻具有复杂的生活史, 能产生溶血性毒素, 同时还是二甲基丙磺酸(DMSP)和二甲基硫醚(DMS)的高产种(齐雨藻等, 2002);其赤潮暴发能显著影响海洋生态系统稳定性, 威胁养殖生物和人类健康, 并在一定程度上影响全球气候变化。因此, 棕囊藻赤潮受到学者们的高度关注, 相关研究在国内外得到广泛开展(Riegman et al, 1992; 徐宁等, 2003; Schoemann et al, 2005; 王艳等, 2006; Poulton et al, 2007; Grattepanche et al, 2011)。
北部湾三面环陆, 水交换条件较差, 径流输入的大量有机物和无机盐引起营养盐富集(高东阳等, 2001), 为赤潮暴发创造了便利条件。近年来, 球形棕囊藻(Phaeocystis globosa)赤潮频繁发生, 成为该海域的主要生态灾害。2015年1—2月暴发的一次球形棕囊藻赤潮几乎覆盖了整个广西近岸海域(罗金福等, 2016), 除影响海洋渔业、生态环境和滨海自然景观外, 还严重威胁了防城港核电厂的冷源安全。有关北部湾球形棕囊藻赤潮的研究主要涉及赤潮原因种的鉴定(覃仙玲等, 2016)、浮游生物生态学(高东阳等, 2001)以及近海环境因素的影响(陈振华, 2013; 李波等, 2015)等, 较为缺乏对球形棕囊藻囊体时空分布及相关影响因素的系统研究。本文基于在广西北部湾海域开展的6次现场调查, 研究了球形棕囊藻囊体的时空分布, 分析了其与主要环境因子和浮游植物群落的关系, 以期为深入探讨棕囊藻赤潮的生长和消亡机制提供基础资料, 并为棕囊藻赤潮的预警及防控提供科学依据。
1 材料与方法 1.1 航次信息于2016年12月至2017年6月间, 搭载“海顺6”号和“海科68”号科考船在北部湾海域开展了6个航次现场调查, 共布设29个站位(图 1), 每次调查的起止时间列于表 1。
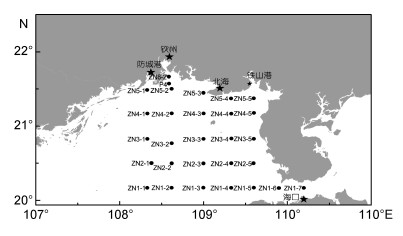 |
| 图 1 广西北部湾研究区域与调查站位 Fig. 1 The study area and sampling stations in the Beibu Gulf, Guangxi, South China Sea |
| 航次编号 | 调查站位数 | 起始日期 | 终止日期 |
| 1612 | 29 | 2016-12-10 | 2016-12-14 |
| 1701 | 25* | 2017-01-14 | 2017-01-19 |
| 1702 | 29 | 2017-02-22 | 2017-02-28 |
| 1703 | 29 | 2017-03-22 | 2017-03-27 |
| 1704 | 29 | 2017-04-20 | 2017-04-26 |
| 1706 | 29 | 2017-06-06 | 2017-06-10 |
| 注: * ZN1-1站、ZN1-2站、ZN1-3站和ZN4-3站因海况恶劣取消 | |||
现场样品的采集、保存及部分环境因子的测定按照《海洋调查规范》(GB/T 12763.2—2007, GB/T 12763.4—2007, GB/T 12763.6—2007)进行。利用船载CTD (SEB911 plus, Sea-Bird)获得海水温度、盐度和叶绿素荧光剖面, 使用Niskin瓶分别在表层、温盐跃层下上、叶绿素荧光最大层和底层采集水样。采用碘量滴定法现场测定水体溶解氧。取100mL水样经0.45μm孔径醋酸纤维滤膜过滤后加氯仿冷冻保存; 实验室内使用营养盐连续流动分析仪(San Plus, SKALAR)测定硝酸盐、磷酸盐和硅酸盐的浓度。取300—500mL水样在 < 50KPa负压下抽滤到GF/F滤膜上, –20℃避光保存; 实验室内在低温避光条件下, 90%丙酮萃取24h, 使用荧光计(Trilogy, Turner Design)测定叶绿素a浓度(Timothy et al, 1984)。
由底(底上2m)至表垂直拖曳浅水Ⅲ型浮游生物网采集浮游植物样品。取6mL网样使用体视显微镜(SZ61, Olympus)对棕囊藻囊体进行现场计数, 并利用测微尺测量囊体直径; 剩余网样加入中性甲醛溶液固定(终浓度5%), 实验室内取0.25mL亚样品置于Palmer-Maloney计数框内使用光学显微镜(BX53, Olympus)进行浮游植物物种鉴定与细胞计数(金德祥等, 1965; 孙军等, 2002)。
1.3 数据分析球形棕囊藻囊体丰度以每立方米出现的囊体数表示, 单位为col/m3; 其他浮游植物丰度以每立方米出现的细胞数表示, 单位为cell/m3。
浮游植物优势物种根据优势度(Y)确定, 其计算公式为:
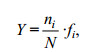
其中, ni为第i种的细胞数, fi为第i种在调查海域出现的频率, N为所有种的总细胞数; 将优势度Y≥0.02的物种定为优势物种。
浮游植物群落多样性采用Shannon-Wiener指数(H')表征, 其计算公式为:
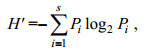
其中, Pi是第i种的细胞数和该站位总细胞数的比值, S为该站位的物种数。
浮游植物群落均匀度采用Pielou指数(J)表征, 其计算公式为:
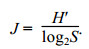
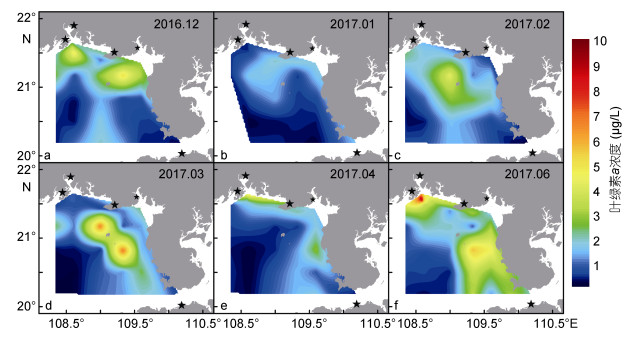
浮游植物物种丰富度采用Margalef指数(dMa)表征, 其计算公式为:
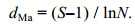
使用Golden Software Surfer 12.0软件绘制站位图和环境因子、球形棕囊藻囊体的平面分布图; 使用Origin 9.0软件绘制囊体丰度和粒径及典型站位浮游植物群落参数的月际变化图; 使用SPSS 19.0软件对囊体丰度和主要环境因子进行Spearman秩相关分析; 其他数据处理均通过Excel完成。环境数据取表层和底层的平均值。
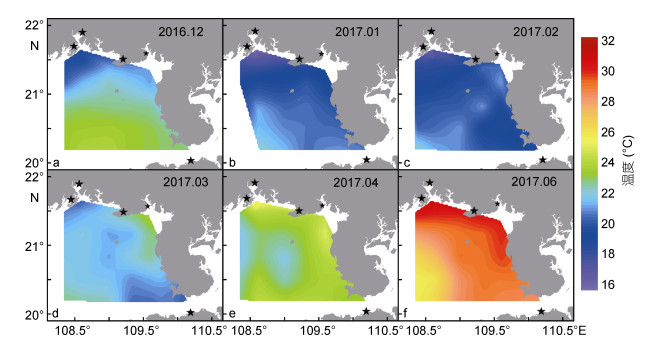
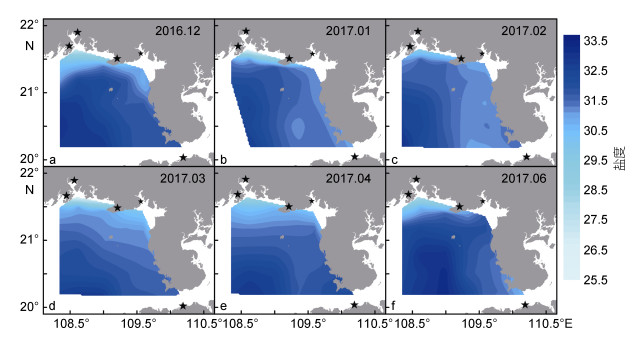
2 结果 2.1 环境特征调查期间水温变化幅度较大, 各航次平均水温介于19.76—28.39℃ (表 2); 水温在12月至次年2月呈现近岸低而离岸高的趋势(图 2a—c), 3月至6月近岸海域水温升高, 高于离岸深水区域(图 2d—f)。海水盐度变化幅度较小, 各航次平均盐度介于31.44—31.90(表 2); 盐度水平分布呈现近岸低而离岸高的趋势, 低值区主要出现在钦州湾附近海域(图 3)。水体叶绿素a浓度变化幅度较大, 各航次平均叶绿素a浓度介于0.89—2.29µg/L (表 2), 平面分布总体上呈现近岸高而离岸低的趋势(图 4); 高值区月际变化明显, 12月和次年1月高值区出现在广西近岸及涠洲岛附近海域(图 4a—b), 2月和3月高值区主要出现在涠洲岛附近海域(图 4c—d), 4月和6月高值区主要出现在雷州半岛西岸及钦州湾附近海域(图 4e—f)。
| 航次编号 | 水温(℃) | 盐度 | 叶绿素a (µg/L) | |||||
| 均值±SD | 范围 | 均值±SD | 范围 | 均值±SD | 范围 | |||
| 1612 | 22.33±1.30 | 19.31—24.38 | 31.81±1.18 | 25.86—33.56 | 1.57±1.31 | 0.27—5.62 | ||
| 1701 | 19.97±1.52 | 15.79—22.92 | 31.45±1.17 | 25.70—33.41 | 0.89±0.62 | 0.27—2.72 | ||
| 1702 | 19.76±1.24 | 16.25—22.79 | 31.62±0.76 | 28.79—33.58 | 1.45±1.10 | 0.28—5.36 | ||
| 1703 | 21.30±1.13 | 19.61—23.98 | 31.44±1.11 | 25.85—33.66 | 1.45±2.15 | 0.14—13.40 | ||
| 1704 | 23.26±1.14 | 21.08—25.94 | 31.68±0.99 | 27.62—33.43 | 1.15±0.98 | 0.16—5.33 | ||
| 1706 | 28.39±1.91 | 22.81—31.34 | 31.90±1.22 | 26.96—33.48 | 2.29±2.24 | 0.18—11.01 | ||
 |
| 图 2 广西北部湾海域水温的平面分布 Fig. 2 Horizontal distribution of temperature in Beibu Gulf, Guangxi, South China Sea |
 |
| 图 3 广西北部湾海域盐度的平面分布 Fig. 3 Horizontal distribution of salinity in Beibu Gulf, Guangxi, South China Sea |
 |
| 图 4 广西北部湾海域叶绿素a浓度的平面分布 Fig. 4 Horizontal distribution of chlorophyll a in Beibu Gulf, Guangxi, South China Sea |
调查期间球形棕囊藻囊体丰度介于0—4.09 ×104col/m3, 月际变化明显, 12月至次年3月逐渐升高, 3月达到最高值, 从4月开始降低, 6月仅有少量囊体在个别站位出现(图 5)。囊体粒径以直径1—5mm的居多, 其次是0—1mm, 在测量的512个囊体中, 前者有313个, 后者有144个。从月际变化看, 直径0—1mm囊体的丰度在1月份达到峰值, 在4月份出现次高峰, 6月份处于较低水平; 直径1—5mm和5—10mm的囊体从12月至次年3月不断增多, 之后迅速减少, 其中直径5—10mm的囊体减少更为显著; 直径10—15mm的囊体仅在2月份和3月份出现, 3月份还发现少量直径15—20mm的囊体(图 6)。
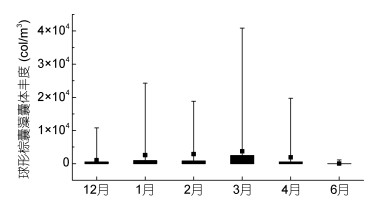 |
| 图 5 广西北部湾球形棕囊藻囊体丰度的月际变化 Fig. 5 Monthly variation of P. globosa colony abundance in Beibu Gulf, Guangxi, South China Sea |
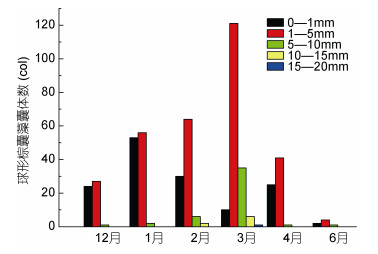 |
| 图 6 广西北部湾球形棕囊藻囊体直径的月际变化 Fig. 6 Monthly variation of P. globosa colony diameter in Beibu Gulf, Guangxi, South China Sea |
广西北部湾海域球形棕囊藻囊体的时空分布示于图 7。12月, 囊体丰度在北海铁山港和涠洲岛邻近海域较高, 最高值1.08×104col/m3出现在铁山港以南的ZN5-5站, 在琼州海峡和防城港—钦州湾水域未见分布(图 7a)。1月, 囊体分布范围与12月类似, 但防城港外水域也有囊体出现, 最高值2.43 ×104col/m3出现在涠洲岛西北侧的ZN3-2站(图 7b)。2月, 囊体在琼州海峡和防城港—钦州湾水域出现, 但从北海铁山港—涠洲岛海域消失; 囊体丰度超过104col/m3的站位有5个, 最高值1.88×104col/m3出现在雷州半岛附近的ZN3-5站(图 7c)。3月, 囊体几乎从调查区西部海域消失, 集中分布在北海以东海域, 最高值4.09×104col/m3出现在ZN2-4站(图 7d)。4月, 囊体分布范围继续向雷州半岛方向收缩, 完全从调查区中西部海域消失, 最高值1.97×104col/m3出现在海南岛西北侧的ZN1-4站(图 7e)。6月, 囊体仅在雷州半岛西侧3个站位和涠洲岛附近的ZN3-3站出现, 最高值0.11×104col/m3出现在ZN2-5站(图 7f)。
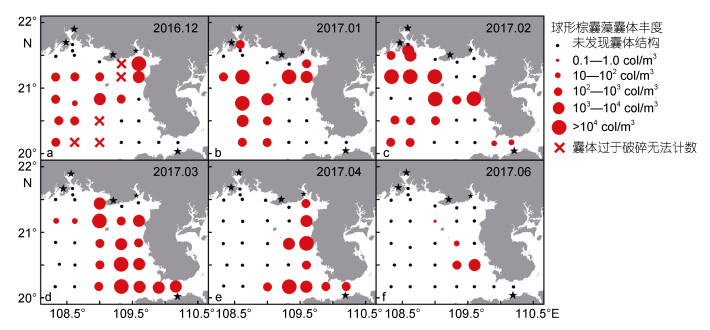 |
| 图 7 广西北部湾球形棕囊藻囊体丰度的平面分布 Fig. 7 The horizontal distribution of P. globosa colony abundance in Beibu Gulf, Guangxi, South China Sea |
根据球形棕囊藻囊体的时空分布特征将调查海域划分为四个区域(图 8), 分别对各区域内球形棕囊藻囊体与环境因子进行Spearman秩相关分析, 结果示于表 3。在区域Ⅰ, 囊体丰度与水温和磷酸盐浓度呈负相关, 与溶解氧呈显著正相关; 在区域Ⅱ, 囊体丰度与盐度、溶解氧呈显著正相关, 而与磷酸盐和硅
酸盐浓度呈显著负相关; 在区域Ⅲ, 囊体丰度与各环境因子没有显著的相关性; 在区域Ⅳ, 囊体丰度与叶绿素a浓度和溶解氧呈正相关, 而与三项营养盐浓度均呈显著的负相关。从整个调查海域来看, 囊体丰度与水温、磷酸盐浓度和硅酸盐浓度呈显著负相关(P < 0.01), 与叶绿素a浓度、溶解氧呈显著正相关(P < 0.01)。
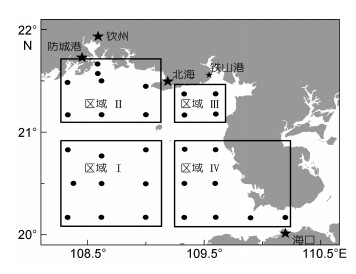 |
| 图 8 调查站位区域划分 Fig. 8 The division of sampling stations |
| 区域Ⅰ | 区域Ⅱ | 区域Ⅲ | 区域Ⅳ | 调查海域 | |
| 水温(℃) | –0.475** | –0.239 | –0.26 | 0.038 | –0.204** |
| 盐度 | –0.246 | 0.491** | –0.088 | 0.169 | 0.118 |
| 叶绿素a(µg/L) | 0.259 | 0.155 | 0.165 | 0.350* | 0.203** |
| 溶解氧(mg/L) | 0.470** | 0.412** | –0.045 | 0.371* | 0.330** |
| 硝酸盐(µmol/L) | 0.161 | –0.172 | –0.054 | –0.544** | –0.073 |
| 磷酸盐(µmol/L) | –0.299* | –0.438** | –0.182 | –0.620** | –0.344** |
| 硅酸盐(µmol/L) | –0.098 | –0.586** | –0.139 | –0.666** | –0.416** |
| 注: **表示P < 0.01水平下极显著相关; *表示P < 0.05水平下显著相关; 其他均为P > 0.05, 相关性不显著 | |||||
根据球形棕囊藻囊体的分布特征, 选取钦州湾内P4站、铁山港附近的ZN5-5站、调查区中部的ZN3-3站和ZN4-2站、雷州半岛西侧的ZN3-5站、调查区西南部深水区的ZN2-2站和琼州海峡西侧的ZN1-5站作为典型站位, 研究球形棕囊藻囊体与其他浮游植物的关系。
2.4.1 浮游植物种类组成及优势种典型站位共鉴定浮游植物(不包括球形棕囊藻)4门55属140种(表 4), 硅藻占绝对优势, 其次是甲藻。浮游植物优势种(Y≥0.02)共17种, 多为链状硅藻或较大型硅藻, 包括角毛藻(Chaetoceros sp.)、细弱海链藻(Thalassiosira subtilis)、菱形藻(Nitzschia spp.)和笔尖形根管藻(Rhizosolenia styliformis)等, 其中角毛藻在所有调查月份都占据优势(表 5)。甲藻优势种包括夜光藻(Noctiluca scintillans)、角藻(Ceratium spp.)、原多甲藻(Protoperidinium spp.)和具尾鳍藻(Dinophysis caudata)等(表 6)。
| 硅藻 | 甲藻 | 蓝藻 | 硅鞭藻 | 合计 | ||||||||||
| 属 | 种 | 属 | 种 | 属 | 种 | 属 | 种 | 属 | 种 | |||||
| 12月 | 32 | 76 | 7 | 15 | 1 | 1 | 1 | 1 | 41 | 93 | ||||
| 1月 | 31 | 70 | 7 | 19 | 1 | 1 | 39 | 90 | ||||||
| 2月 | 34 | 76 | 7 | 16 | 1 | 1 | 42 | 93 | ||||||
| 3月 | 28 | 57 | 5 | 15 | 1 | 1 | 34 | 73 | ||||||
| 4月 | 30 | 57 | 6 | 16 | 1 | 1 | 1 | 1 | 38 | 75 | ||||
| 6月 | 32 | 78 | 8 | 20 | 1 | 1 | 41 | 99 | ||||||
| 全部航次 | 43 | 108 | 10 | 30 | 1 | 1 | 1 | 1 | 55 | 140 | ||||
| 调查月份 | 种名 | 丰度比例(%) | 频率fi | 优势度Y | ||
| 2016年12月 | 角毛藻 | Chaetoceros sp. | 25.24 | 0.86 | 0.2163 | |
| 伏氏海线藻 | Thalassionema frauenfeldii | 14.11 | 1.00 | 0.1411 | ||
| 菱形海线藻 | Thalassionema nitzschioides | 16.05 | 0.86 | 0.1376 | ||
| 并基角毛藻 | Chaetoceros decipiens | 12.53 | 0.86 | 0.1074 | ||
| 骨条藻 | Skeletonema sp. | 5.94 | 0.86 | 0.0509 | ||
| 尖刺伪菱形藻 | Pseudo-nitzschia pungens | 4.11 | 1.00 | 0.0411 | ||
| 新月柱鞘藻 | Cylindrotheca closterium | 4.73 | 0.71 | 0.0338 | ||
| 布氏双尾藻 | Ditylum brightwellii | 2.61 | 0.86 | 0.0224 | ||
| 2017年1月 | 细弱海链藻 | Thalassiosira subtilis | 72.36 | 0.57 | 0.4135 | |
| 角毛藻 | Chaetoceros sp. | 5.44 | 0.71 | 0.0388 | ||
| 派格棍形藻 | Bacilaria paxillifera | 2.95 | 0.71 | 0.0211 | ||
| 2017年2月 | 角毛藻 | Chaetoceros sp. | 18.46 | 0.86 | 0.1582 | |
| 浮动弯角藻 | Eucampia zodiacus | 16.54 | 0.86 | 0.1418 | ||
| 菱形海线藻 | Thalassionema nitzschioides | 12.29 | 0.86 | 0.1053 | ||
| 细弱海链藻 | Thalassiosira subtilis | 12.15 | 0.57 | 0.0694 | ||
| 新月柱鞘藻 | Cylindrotheca closterium | 7.27 | 0.86 | 0.0623 | ||
| 笔尖形根管藻 | Rhizosolenia styliformis | 8.54 | 0.57 | 0.0488 | ||
| 2017年3月 | 菱形藻 | Nitzschia spp. | 42.66 | 0.57 | 0.2438 | |
| 细弱海链藻 | Thalassiosira subtilis | 24.90 | 0.86 | 0.2134 | ||
| 角毛藻 | Chaetoceros sp. | 10.13 | 1.00 | 0.1013 | ||
| 笔尖形根管藻 | Rhizosolenia styliformis | 6.05 | 0.57 | 0.0346 | ||
| 印度角毛藻 | Chaetoceros indicum | 3.70 | 0.57 | 0.0212 | ||
| 2017年4月 | 角毛藻 | Chaetoceros sp. | 39.71 | 0.71 | 0.2836 | |
| 细弱海链藻 | Thalassiosira subtilis | 34.05 | 0.57 | 0.1945 | ||
| 浮动弯角藻 | Eucampia zodiacus | 15.07 | 0.29 | 0.0431 | ||
| 洛氏菱形藻 | Nitzschia lorenziana | 4.78 | 0.86 | 0.0410 | ||
| 2017年6月 | 柔弱伪菱形藻 | Pseudo-nitzschia delicatissima | 39.09 | 0.71 | 0.2792 | |
| 角毛藻 | Chaetoceros sp. | 19.50 | 0.86 | 0.1671 | ||
| 菱形海线藻 | Thalassionema nitzschioides | 10.87 | 0.86 | 0.0932 | ||
| 尖刺伪菱形藻 | Pseudo-nitzschia pungens | 12.79 | 0.43 | 0.0548 | ||
| 环纹劳德藻 | Lauderia annulata | 3.35 | 1.00 | 0.0335 | ||
| 调查月份 | 种名 | 占甲藻丰度比例(%) | 频率fi | 占甲藻优势度Y | ||
| 2016年12月 | 叉状角藻 | Ceratium furca | 30.57 | 0.71 | 0.2183 | |
| 夜光藻 | Noctiluca scintillans | 15.67 | 0.43 | 0.0671 | ||
| 原多甲藻 | Protoperidinuim sp. | 10.50 | 0.57 | 0.0600 | ||
| 具尾鳍藻 | Dinophysis caudata | 9.14 | 0.57 | 0.0522 | ||
| 三角角藻 | Ceratium tripos | 3.76 | 0.57 | 0.0215 | ||
| 梭状角藻 | Ceratium fusus | 4.80 | 0.43 | 0.0206 | ||
| 2017年1月 | 波状角藻 | Ceratium trichoceros | 24.89 | 0.71 | 0.1778 | |
| 叉状角藻 | Ceratium furca | 18.48 | 0.57 | 0.1056 | ||
| 夜光藻 | Noctiluca scintillans | 17.09 | 0.57 | 0.0976 | ||
| 海洋原多甲藻 | Protoperidinium oceanicum | 9.01 | 1.00 | 0.0901 | ||
| 三角角藻 | Ceratium tripos | 10.40 | 0.86 | 0.0891 | ||
| 梭状角藻 | Ceratium fusus | 5.91 | 0.43 | 0.0253 | ||
| 2017年2月 | 夜光藻 | Noctiluca scintillans | 43.17 | 0.57 | 0.2467 | |
| 具尾鳍藻 | Dinophysis caudata | 14.03 | 0.43 | 0.0601 | ||
| 海洋原多甲藻 | Protoperidinium oceanicum | 8.79 | 0.43 | 0.0377 | ||
| 叉状角藻 | Ceratium furca | 8.54 | 0.43 | 0.0366 | ||
| 波状角藻 | Ceratium trichoceros | 5.71 | 0.57 | 0.0326 | ||
| 梭状角藻 | Ceratium fusus | 7.09 | 0.43 | 0.0304 | ||
| 2017年3月 | 夜光藻 | Noctiluca scintillans | 31.11 | 0.57 | 0.1778 | |
| 叉状角藻 | Ceratium furca | 17.30 | 0.86 | 0.1483 | ||
| 具尾鳍藻 | Dinophysis caudata | 17.57 | 0.71 | 0.1255 | ||
| 三角角藻 | Ceratium tripos | 13.14 | 0.86 | 0.1126 | ||
| 低顶角藻 | Ceratium humile | 7.19 | 0.71 | 0.0514 | ||
| 2017年4月 | 叉状角藻 | Ceratium furca | 25.35 | 1.00 | 0.2535 | |
| 夜光藻 | Noctiluca scintillans | 26.04 | 0.57 | 0.1488 | ||
| 具尾鳍藻 | Dinophysis caudata | 10.70 | 0.71 | 0.0765 | ||
| 海洋原多甲藻 | Protoperidinium oceanicum | 13.09 | 0.57 | 0.0748 | ||
| 梭状角藻 | Ceratium fusus | 8.70 | 0.86 | 0.0746 | ||
| 波状角藻 | Ceratium trichoceros | 5.26 | 0.71 | 0.0376 | ||
| 三角角藻 | Ceratium tripos | 3.64 | 0.57 | 0.0208 | ||
| 2017年6月 | 叉状角藻 | Ceratium furca | 16.00 | 0.86 | 0.1372 | |
| 梭状角藻 | Ceratium fusus | 10.56 | 0.86 | 0.0905 | ||
| 裸甲藻 | Gymnodinium sp. | 4.63 | 0.86 | 0.0397 | ||
| 原多甲藻 | Protoperidinuim sp. | 3.85 | 0.57 | 0.0220 | ||
| 海洋原多甲藻 | Protoperidinium oceanicum | 3.59 | 0.57 | 0.0205 | ||
在典型站位, 球形棕囊藻囊体与硅藻细胞丰度变化趋势大致相同, 高值几乎同步出现, 在ZN3-3站、ZN3-5站、ZN4-2站和ZN5-5站表现尤为明显(图 9)。球形棕囊藻囊体与甲藻细胞丰度的月际变化示于图 10。除ZN2-2站外, 囊体丰度较高的月份总伴随着较高丰度的甲藻; 但高丰度的甲藻却不一定对应高丰度的球形棕囊藻囊体, 比如在P4站、ZN3-5站和ZN5-5站。
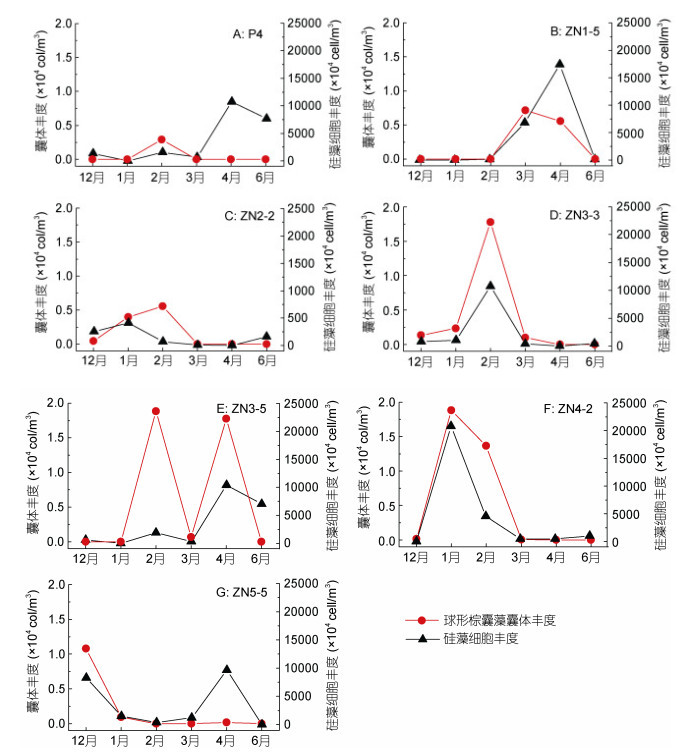 |
| 图 9 广西北部湾典型站位球形棕囊藻囊体和硅藻细胞丰度的月际变化 Fig. 9 Monthly variation of P. globosa colony and diatom cell abundance in typical station in Beibu Gulf, Guangxi, South China Sea |
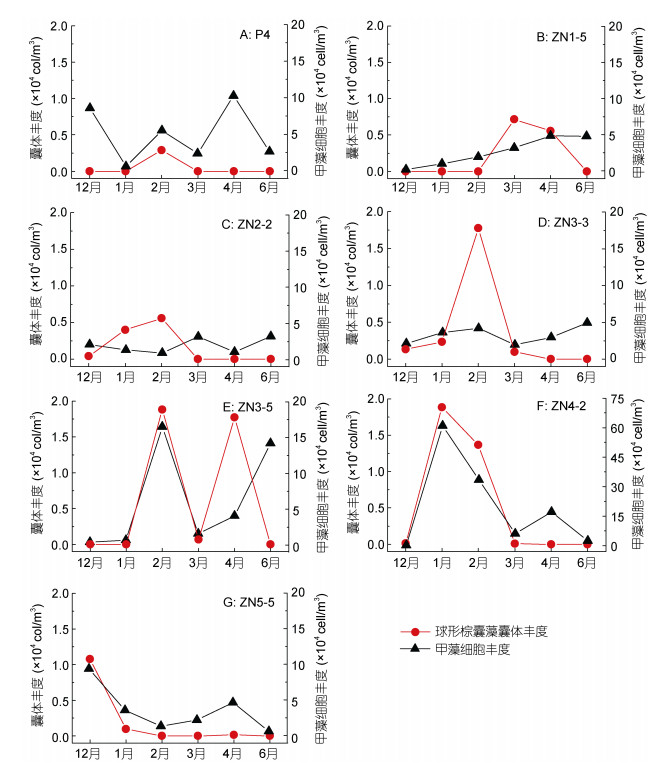 |
| 图 10 广西北部湾典型站位球形棕囊藻囊体和甲藻细胞丰度的月际变化 Fig. 10 Monthly variation of P. globosa colony and dinoflagellate cell abundance in typical station in Beibu Gulf, Guangxi, South China Sea |
在典型站位, 球形棕囊藻囊体丰度与浮游植物群落多样性指数的变化趋势大致相反, 囊体丰度较高时, 多样性指数总体上偏低; 囊体丰度降低时, 多样性指数出现升高趋势, 囊体未出现时多样性指数处于较高水平(图 11)。除ZN3-3站外, 其他站位与球形棕囊藻囊体伴生的浮游植物优势种较为单一, 如P4站2月的主要优势种为笔尖形根管藻(丰度占比95.65%)、ZN1-5站3月的主要优势种为菱形藻(丰度占比61.77%)、ZN2-2站1月的主要优势种为细弱海链藻(丰度占比85.15%)、ZN3-5站4月的主要优势种为浮动弯角藻(Eucampia zodiacus) (丰度占比70.36%), 这导致浮游植物群落的多样性指数偏低。在ZN3-3站囊体丰度从12月到2月骤增, 但浮游植物群落多样性指数保持较高水平, 几种优势种丰度占比相差较小。
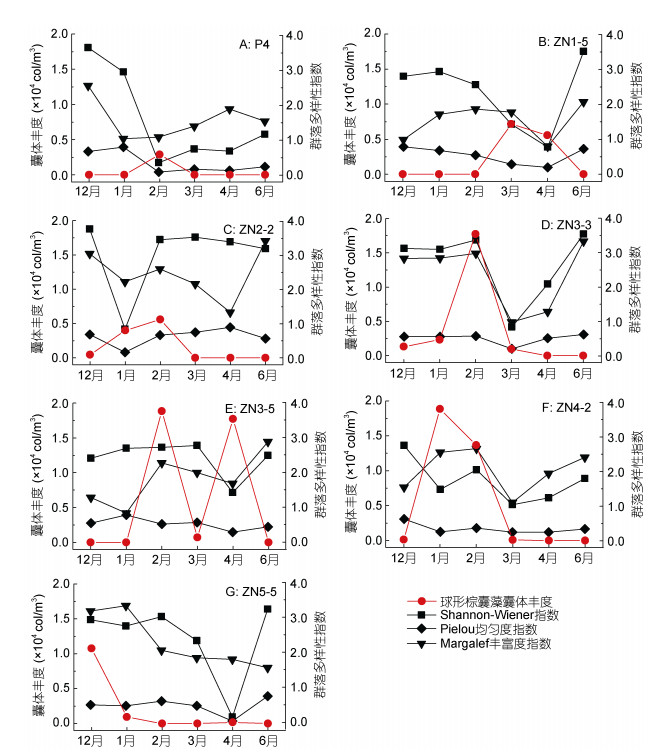 |
| 图 11 广西北部湾典型站位球形棕囊藻囊体丰度和浮游植物群落多样性指数的月际变化 Fig. 11 Monthly variation of P. globosa colony abundance and community biodiversity index in typical station in Beibu Gulf, Guangxi, South China Sea |
球形棕囊藻是广温性藻类, 低温能促进球形棕囊藻囊体的形成, 而高温会增加游离单细胞的比例, 不利于囊体的形成(王小冬, 2010; 田晶晶, 2010), 本研究中囊体丰度与水温的显著负相关也验证了这一点(表 3)。球形棕囊藻赤潮主要在我国东南沿海暴发, 赤潮期间水温一般介于15—27℃ (陈菊芳等, 1999; 徐宁等, 2003; 田晶晶, 2010; 李波等, 2015)。本次调查中, 1月至3月水温介于15.79—23.98℃, 平均值为20.10±1.46℃, 水温较低且相对稳定, 利于囊体的形成, 囊体丰度最大值出现在3月的ZN2-4站(表底水温均值20.88℃)。6月水温平均值为28.74℃, 但在该月航次雷州半岛西部海域少数站位(ZN2-5站水温低值28.88℃、ZN2-4站水温低值28.78℃、ZN3-4站平均水温29.01℃、ZN4-3站平均水温29.09℃)仍然残留极少量囊体, 这说明了水温在该区域不是主要影响因素。
3.1.2 盐度球形棕囊藻为广盐种, 室内实验发现其可以在较宽的盐度范围内(23—33)形成囊体(田晶晶, 2010)。在防城港—钦州湾外水域(区域Ⅱ), 囊体丰度与盐度呈显著正相关(P < 0.01, 表 3), 冬季钦州湾入海径流量较小, 盐度维持在较高水平(1月盐度均值30.41, 2月盐度均值31.09), 可能为囊体的形成提供了适宜的条件。在高盐的西南海域虽然也有囊体存在, 但其丰度明显低于低盐的近岸海域(图 7), 这说明适宜的盐度是球形棕囊藻囊体大量形成的基础。
3.1.3 叶绿素aWang等(2011)室内实验发现当硝酸盐作为主要氮源时, 球形棕囊藻对水体叶绿素a的贡献处于较高水平, 且在很长时间内趋于稳定; Riegman等(1992)发现北海(the North Sea)沿岸的棕囊藻赤潮引起了叶绿素a浓度的升高。本研究中球形棕囊藻囊体丰度高值区与叶绿素a浓度高值区存在良好的对应关系(图 4, 图 7), 相关性分析也表明囊体丰度与叶绿素a浓度呈显著正相关(P < 0.01, 表 3), 这与Poulton等(2007)调查结果一致。
3.1.4 溶解氧本次调查中, 在球形棕囊藻囊体丰度最高的3月, 溶解氧介于6.88—9.78mg/L, 与历史报道中棕囊藻赤潮期间溶解氧的水平相当(陈菊芳等, 1999; 李波等, 2015)。相关性分析显示囊体丰度与溶解氧呈显著正相关(P < 0.01, 表 3), 球形棕囊藻囊体丰度较高时水体溶解氧含量也升高; 而当囊体数量减少甚至消失时, 溶解氧含量也处于较低水平, 可能与囊体的老化分解有关。例如: ZN3-5站在1月中未出现囊体, 水体溶解氧含量为6.86mg/L; 2月囊体丰度升至1.88×104 col/m3, 溶解氧含量升高至8.66mg/L; 3月随着囊体丰度降低至0.07×104col/m3, 溶解氧含量也降低到7.76mg/L。
3.1.5 硝酸盐Riegman等(1992)发现在氮限制条件下依然有囊体存在, 指出自然环境中棕囊藻可能会随着水体中氮源的增加而暴发赤潮。相关研究表明硝酸盐是北海(the North Sea)球形棕囊藻暴发赤潮期间的主要氮源, 硝酸盐时空分布与春季棕囊藻赤潮关系密切(Riegman et al, 1992; Lancelot et al, 2007)。室内实验也表明棕囊藻囊体形成对氮源需求具有专一性, 硝酸盐是其囊体形成的基础, 而且在硝酸盐作为主要氮源条件下囊体细胞生长速率明显高于游离单细胞(Wang et al, 2011)。另外, 在棕囊藻培养基中添入硝酸盐会增加藻细胞对外源硝酸盐的吸收, 从而提高藻细胞密度, 当硝酸盐含量超过7.24µmol/L时棕囊藻细胞生长较快, 但在硝酸盐含量在3.62µmol/L时藻细胞密度最大(王艳等, 2006)。本调查发现区域Ⅳ硝酸盐含量较高且月际变化明显(1月硝酸盐含量均值11.04µmol/L, 2月硝酸盐含量均值7.32µmol/L, 3月硝酸盐含量均值3.92µmol/L, 数据未发表), 这说明较高的硝酸盐含量为囊体形成提供了营养盐基础, 而在囊体形成过程中消耗水体硝酸盐, 可能导致水体硝酸盐含量降低。
3.1.6 磷酸盐Riegman等(1992)室内试验发现囊体在磷限制条件下不能形成, Cariou(1991)研究发现磷酸盐在0.5—1µmol/L范围内是棕囊藻囊体细胞成囊的必要条件。在本次调查中磷酸盐平均值为0.66±0.12µmol/L(数据未发表), 处于磷源需求范围内, 这说明该海域磷酸盐不是球形棕囊藻囊体丰度分布的主要限制因子。相关性分析显示球形棕囊藻囊体丰度与磷酸盐呈显著负相关(P < 0.01, 表 3), 原因可能是棕囊藻及伴生浮游植物消耗了水体磷酸盐。
3.1.7 硅酸盐伴生硅藻的大量繁殖同时也消耗了大量硅酸盐, 致使水体硅酸盐含量降低, 所以球形棕囊藻囊体丰度与硅酸盐呈显著负相关(P < 0.01, 表 3)。因而推测球形棕囊藻囊体丰度与水体硅酸盐的关系主要是通过伴生硅藻间接产生的。在广西北部湾海域球形棕囊藻囊体丰度分布与水体营养盐存在着直接或间接关系, 其相互影响机制需要更加细致深入的研究。
3.2 球形棕囊藻成囊与伴生浮游植物的关系棕囊藻赤潮消长过程中伴生浮游植物多为较大型硅藻(如笔尖形根管藻、中华盒形藻等)和链状硅藻(如伪菱形藻、海链藻、海线藻、角毛藻和骨条藻等) (Rousseau et al, 1994; 徐宁等, 2003; Poulton et al, 2007; 王超等, 2010)。本次调查中球形棕囊藻囊体丰度较高的12月至次年4月, 浮游植物优势种全部为硅藻(表 5), 与其他海域研究结果较为一致。Rousseau等(1994)在棕囊藻赤潮现场发现囊体早期依附于某些角毛藻的角毛上, 认为其能够为提供囊体附着基质, 在囊体形成过程中扮演重要角色。棕囊藻囊体依附于硅藻的角毛或刺结构上更容易使其稳定悬浮于水体中(黎慧等, 2010), 相对稳定的环境更有利于囊体的进一步形成。另外, 球形棕囊藻与硅藻的伴生关系还表现在营养物质相互利用, Sazhin等(2007)研究表明囊体形成时会包埋某些硅藻, 硅藻在囊体形成初期可以为囊体细胞提供营养; 在囊体形成后期硅藻不仅仅利用囊体作为栖息地, 还会利用囊体多糖基质作为直接营养来源。
棕囊藻囊体在生态功能上与较大型、链状或群体硅藻相似, 在季节性水体中生态位较为相似, 硅藻与棕囊藻之间存在明显的竞争关系(徐宁等, 2003)。当水体硅酸盐含量充足时, 硅藻可能大量暴发成为主要优势种, 例如2月ZN1-5站硅酸盐达到12.60µmol/L, 菱形海线藻(Thalassionema nitzschioides)为主要优势种, 未在该站发现棕囊藻囊体; 3月P4站硅酸盐达到15.40µmol/L, 笔尖形根管藻为主要优势种, 同样未发现棕囊藻囊体。
本次调查发现甲藻细胞丰度与囊体丰度变化较为一致(图 10)。球形棕囊藻囊体的形成虽然有利于抵制其他生物的摄食, 降低死亡率, 但是当环境发生变化时会出现棕囊藻单细胞逸出现象(Verity et al, 1988)。异养甲藻具有摄食棕囊藻的能力, 其丰度会随着棕囊藻赤潮暴发而迅速增加(杨和福, 2004), 小型囊体及囊体逸出的单细胞可能成为甲藻的食物来源, 这就导致甲藻丰度在囊体丰度较高的月份处于较高水平。Grattepanche等(2011)在研究英吉利海峡东岸海域棕囊藻赤潮暴发期间浮游植物群落结构时也发现了类似现象, 并认为异养甲藻是该区域棕囊藻和其他浮游植物的最主要消费者。Weisse和Scheffel Möser(1990)认为异养甲藻对棕囊藻牧食作用意义重大, 其中夜光藻(Noctiluca scintillans)是棕囊藻游离单细胞和囊体的主要消费者。而本研究也发现在囊体丰度较高的2月和3月甲藻优势种主要为夜光藻(表 6), 囊体则以小型囊体为主, 并存在少量直径超过10mm的较大型完整囊体(图 6), 小型囊体以及囊体逸出单细胞可能为夜光藻提供了充足的食物来源。对比图 9和图 10可以发现硅藻丰度变化与甲藻丰度变化基本相同, 尤其在未发现或存在极少量棕囊藻囊体的站位(4月P4站和ZN5-5站; 6月ZN2-2站和ZN3-5站)硅藻丰度与甲藻丰度均维持较高水平。甲藻自身生长率较低, 其需要相对较高的食物丰度来支撑自身生长(Hansen, 1992), 甲藻可以通过复杂的方式捕食硅藻(孙军等, 2011), 伴生硅藻的大量存在也可能为甲藻提供了充足的食物来源。因此推测在该海域球形棕囊藻囊体丰度与甲藻丰度的关系可能受球形棕囊藻自身及伴生硅藻丰度变化共同影响。
4 结论(1) 球形棕囊藻囊体丰度介于0—4.09×104col/m3, 囊体丰度较高的月份为12月至次年3月, 6月在该区域也有极少量囊体出现。
(2) 球形棕囊藻囊体丰度在调查区西南水深较深海域棕囊藻囊体丰度呈现逐月递减趋势, 而广西近岸海域以及雷州半岛西部海域棕囊藻囊体丰度呈现先升高再降低的趋势。
(3) 球形棕囊藻囊体粒径以直径1—5mm的居多; 从月际变化看, 3月份囊体粒径较大, 有较多直径10—15mm和少量直径15—20mm的囊体出现。
(4) 球形棕囊藻囊体丰度时空分布受多种物理海洋学过程和生物化学过程的综合影响, 其中水温是主要影响因素, 在局部区域丰富的硝酸盐可能为囊体形成提供了营养盐基础。
(5) 球形棕囊藻囊体丰度与其他浮游植物细胞丰度变化趋势相同, 而与群落多样性指数变化趋势相反。
致谢 自然资源部第二海洋研究所管卫兵研究员提供温度和盐度数据, 中国科学院海洋研究所俞志明研究员提供溶解氧和营养盐数据, 谨致谢忱。
王艳, 唐海溶, 蒋磊, 等. 2006. 硝酸盐对球形棕囊藻生长和硝酸还原酶活性的影响. 植物学报, 23(2): 138-144 DOI:10.3969/j.issn.1674-3466.2006.02.002 |
王超, 李新辉, 赖子尼, 等. 2010. 珠江口球形棕囊藻(Phaeocystis globosa)赤潮后期的浮游植物群落结构特征研究. 生态科学, 29(2): 140-146 DOI:10.3969/j.issn.1008-8873.2010.02.009 |
王小冬, 2010.棕囊藻囊体形成及对环境压力的响应.青岛: 中国海洋大学博士学位论文, 55-73 http://cdmd.cnki.com.cn/article/cdmd-10423-1011030154.htm
|
田晶晶, 2010.环境因子对球形棕囊藻细胞群体形成的影响.广州: 暨南大学硕士学位论文, 9-43
|
齐雨藻, 徐宁, 王艳, 等. 2002. 中国赤潮研究的新进展——球形棕囊藻赤潮及其产硫的研究. 中国基础科学, (4): 23-28 DOI:10.3969/j.issn.1009-2412.2002.04.005 |
孙军, 刘东艳. 2002. 中国海区常见浮游植物种名更改初步意见. 海洋与湖沼, 33(3): 271-286 DOI:10.3321/j.issn:0029-814X.2002.03.008 |
孙军, 郭术津. 2011. 甲藻的异养营养型. 生态学报, 31(20): 6270-6286 |
李波, 蓝文陆, 李天深, 等. 2015. 球形棕囊藻赤潮消亡过程环境因子变化及其消亡原因. 生态学杂志, 34(5): 1351-1358 |
杨和福. 2004. 棕囊藻的生物学概述Ⅰ.形态分类和生理生态学. 东海海洋, 22(1): 49-63 |
陈振华, 2013.北部湾环流季节变化的数值模拟与动力机制分析.青岛: 中国海洋大学博士学位论文, 30-69 http://cdmd.cnki.com.cn/Article/CDMD-10423-1014369578.htm
|
陈菊芳, 徐宁, 江天久, 等. 1999. 中国赤潮新记录种——球形棕囊藻(Phaeocystis globosa). 暨南大学学报(自然科学与医学版), 20(3): 124-270 |
罗金福, 李天深, 蓝文陆. 2016. 北部湾海域赤潮演变趋势及防控思路. 环境保护, 44(20): 40-42 |
金德祥, 陈金环, 黄凯歌, 等. 1965. 中国海洋浮游硅藻类. 上海: 上海科学技术出版社
|
徐宁, 齐雨藻, 陈菊芳, 等. 2003. 球形棕囊藻(Phaeocystis globosa Scherffel)赤潮成因分析. 环境科学学报, 23(1): 113-118 |
高东阳, 李纯厚, 刘广锋, 等. 2001. 北部湾海域浮游植物的种类组成与数量分布. 广东海洋大学学报, 21(3): 13-18 DOI:10.3969/j.issn.1673-9159.2001.03.004 |
覃仙玲, 赖俊翔, 陈波, 等. 2016. 棕囊藻北部湾株的18S rDNA分子鉴定. 热带亚热带植物学报, 24(2): 176-181 |
黎慧, 高春蕾, 王小冬, 等. 2010. 小角毛藻对球形棕囊藻囊体形成的影响. 海洋科学进展, 28(1): 57-63 DOI:10.3969/j.issn.1671-6647.2010.01.008 |
Baumann M E M, Lancelot C, Brandini F P et al, 1994. The taxonomic identity of the cosmopolitan prymnesiophyte Phaeocystis:a morphological and ecophysiological approach. Journal of Marine Systems, 5(1): 5-22 DOI:10.1016/0924-7963(94)90013-2 |
Cariou V, 1991. Etude des mécanismes de formation des colonies de Phaeocystis: influence des phosphates. DEA Thesis, University of Pierre et Marie Curie, Paris, 6-41
|
Grattepanche J D, Breton E, Brylinski J M et al, 2011. Succession of primary producers and micrograzers in a coastal ecosystem dominated by Phaeocystis globosa blooms. Journal of Plankton Research, 33(1): 37-50 DOI:10.1093/plankt/fbq097 |
Hansen P J, 1992. Prey size selection, feeding rates and growth dynamics of heterotrophic dinoflagellates with special emphasis on Gyrodinium spirale. Marine Biology, 114(2): 327-334 DOI:10.1007/BF00349535 |
Lancelot C, Gypens N, Billen G et al, 2007. Testing an integrated river-ocean mathematical tool for linking marine eutrophication to land use:The Phaeocystis-dominated Belgian coastal zone (Southern North Sea) over the past 50 years. Journal of Marine Systems, 64(1-4): 216-228 DOI:10.1016/j.jmarsys.2006.03.010 |
Poulton A J, Moore C M, Seeyave S et al, 2007. Phytoplankton community composition around the Crozet Plateau, with emphasis on diatoms and Phaeocystis. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 54(18-20): 2085-2105 DOI:10.1016/j.dsr2.2007.06.005 |
Riegman R, Noordeloos A A M, Cadée G C, 1992. Phaeocystis blooms and eutrophication of the continental coastal zones of the North Sea. Marine Biology, 112(3): 479-484 DOI:10.1007/BF00356293 |
Rousseau V, Vaulot D, Casotti R et al, 1994. The life cycle of Phaeocystis (Prymnesiophycae):evidence and hypotheses. Journal of Marine Systems, 5(1): 23-39 DOI:10.1016/0924-7963(94)90014-0 |
Sazhin A F, Artigas L F, Nejstgaard J C et al, 2007. The colonization of two Phaeocystis species (Prymnesiophyceae) by pennate diatoms and other protists:a significant contribution to colony biomass. Biogeochemistry, 83(1-3): 137-145 DOI:10.1007/s10533-007-9086-2 |
Schoemann V, Becquevort S, Stefels J et al, 2005. Phaeocystis blooms in the global ocean and their controlling mechanisms:a review. Journal of Sea Research, 53(1-2): 43-66 DOI:10.1016/j.seares.2004.01.008 |
Timothy P, Yoshiaki M, Carol M L, 1984. A manual of chemical and biological methods for sea water analysis. Pergamon Press, 395: 475-490 |
Verity P G, Villareal T A, Smayda T J, 1988. Ecological investigations of blooms of colonialⅡ. The role of life-cycle phenomena in bloom termination. Phaeocystis pouchetti. Journal of Plankton Research, 10(4): 749-766 |
Wang X D, Wang Y, Smith W O Jr, 2011. The role of nitrogen on the growth and colony development of Phaeocystis globosa (Prymnesiophyceae). European Journal of Phycology, 46(3): 305-314 DOI:10.1080/09670262.2011.602430 |
Weisse T, Scheffel-Möser U, 1990. Growth and grazing loss rates in single-celled Phaeocystis sp.(Prymnesiophyceae). Marine Biology, 106(1): 153-158 DOI:10.1007/BF02114686 |
 2019, Vol. 50
2019, Vol. 50


