
中国海洋湖沼学会主办。
文章信息
- 文世勇, 林雨霏, 王紫竹, 孙田力, 李飞, 石晓勇, 刘永健, 赵建华. 2019.
- WEN Shi-Yong, LIN Yu-Fei, WANG Zi-Zhu, SUN Tian-Li, LI Fei, SHI Xiao-Yong, LIU Yong-Jian, ZHAO Jian-Hua. 2019.
- 米氏凯伦藻和东海原甲藻生长的光照强度生态幅研究
- ECOLOGICAL AMPLITUDE FOR LIGHT INTENSITY OF KARENIA MIKIMOTOI AND PROROCENTRUM DONGHAIENSE AT DIFFERENT TEMPERATURES IN LABORATORY CULTURES
- 海洋与湖沼, 50(3): 664-671
- Oceanologia et Limnologia Sinica, 50(3): 664-671.
- http://dx.doi.org/10.11693/hyhz20180800193
文章历史
-
收稿日期:2018-08-03
收修改稿日期:2019-01-07
2. 国家海洋局近岸海域生态环境重点实验室 大连 116023;
3. 自然资源部海洋减灾中心 北京 100194
2. Key Laboratory for Ecological Environment in Coastal Areas, State Oceanic Administration, Dalian 116023, China;
3. National marine hazard mitigation service, Beijing 100194, China
近几年的《中国海洋灾害公报》和《中国海洋环境状况公报》的统计数据表明, 东海是我国近岸海域赤潮发生最为严重的海域之一, 赤潮的主要常发优势种有米氏凯伦藻(Karenia mikimotoi)和东海原甲藻(Prorocentrum donghaiense)。已有的研究结果均表明藻类的生长受到营养盐、温度、光照强度等多种海洋环境的影响(Steel, 1962; Raven et al, 1988; Andersson et al, 1996)。光照强度是藻类进行光合作用的能量来源, 是藻类生长的必要条件, 也是影响赤潮发生的关键性因子之一。有研究结果也表明过低的光照强度限制藻类生长, 过高的光照强度抑制藻类生长, 只有在适宜的光照条件下藻类才能生长繁殖(Shelford, 1911, 1913; 沈国英等, 2002)。不同藻类生长对不同光照强度的响应机理互不相同, 导致不同藻类对光照的利用状况也不尽相同。光照强度在海洋中的分布及变化影响到浮游植物的繁殖、分布及初级生产力。
当前, 国内外开展光照与浮游植物生长的关系研究主要集中在以下两个方面:一是开展了浮游植物光合作用速率与光照的关系研究, 建立了浮游植物光合作用速率与光照强度的关系模型(P-I曲线)(Blackman, 1905; Baly, 1935; Smith, 1936; Steel, 1962; Jassby et al, 1976; Dubinsky et al, 1986; Geider et al, 1996), 定量表达了二者的响应关系, 为计算光合产量、水体初级生产力等方面提供基础; 二是开展了藻类生物-光学特性研究, 定性或定量分析了光照对浮游植物终止生物量(Bf)的影响(孙百晔等, 2008a, 2008b)、光照对浮游藻类吸收营养盐的影响(Nalewajko et al, 1983; Wynne et al, 1986; 黄邦钦等, 1993, 1994; Litchman et al, 2004)以及对浮游藻类种类演替的影响(王爱军等, 2006, 2008)等, 而定量表达藻类生长比生长率与光照强度的关系模型研究较少。
本文研究目的是拟通过一次性培养实验结果来探讨不同温度条件下不同光照对米氏凯伦藻和东海原甲藻生长的影响, 分别建立了米氏凯伦藻和东海原甲藻在不同温度条件下生长的光照生态幅模型, 并分别获取了米氏凯伦藻和东海原甲藻生长的最适光照、适光范围及耐受光照范围, 为研究藻类生长的光照强度生理生态提供支持, 以期为阐明光照强度对米氏凯伦藻和东海原甲藻这两种藻形成赤潮的机理提供支持。
1 材料与方法 1.1 实验材料实验藻种选取近几年来东海近岸海域多发藻种——米氏凯伦藻和东海原甲藻为实验藻种, 藻种由暨南大学赤潮与水环境研究中心藻种库提供。采用5000mL锥形烧瓶置于光照培养箱内静置培养。光暗比为12L︰12D。藻种培养用人工海水配置的f/2培养液, 其中氮的浓度为75.0μmol/L, 磷的浓度为1.0μmol/L, 实验用人工海水按照Harrison配方配制(盐度为30.5)。
1.2 实验方法实验设定六个光照强度水平[28.32、55.15、75.06、96.59、111.66和135.75μmol/(m2·s)]分别固定在18、22和25℃下进行。在无菌条件下, 分别将处于指数生长期的米氏凯伦藻和东海原甲藻藻液接种于3000mL新鲜的f/2培养液中(为保持藻种生长环境的前后一致, 实验结束后所剩藻液至少不少于初始藻液的2/3), 使藻数量约为50×104ce11s/L, 同一藻种相同温度各水平保持相同起始密度。每隔24h取样用鲁哥氏液固定后, 血球计数板计数, 然后换算为藻数量, 培养时间约25d。
1.3 数据处理分析方法在显微镜下用计数框每天计数, 每瓶计数3次, 后根据平行样的均值再取平均值作为当天的藻类细胞密度, 记录一个生长周期左右, 以培养时间为横坐标, 每1mL液体中的细胞数为纵坐标, 绘制细胞密度-培养时间t的藻类生长曲线。
根据公式(1)和公式(2)分别计算出藻类在不同条件下的最大比生长速率, 以环境要素为横坐标, 藻类最大比生长速率为纵坐标, 绘制藻类最大比生长率-环境要素的关系曲线。
 (1)
(1)其中, μ′表示藻类比生长速率(/d), N为藻类细胞数(cells/L), t表示藻类的生长时间(d)。
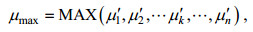 (2)
(2)其中, μmax表示藻类最大比生长速率(/d), μ′同公式(1)。
采用单因素方差分析法(One-Way ANOVA analysis)对不同培养条件下的细胞数、比生长速率和最大比生长速率差异显著性进行分析。
2 结果与分析 2.1 不同温度条件下不同光照水平对米氏凯伦藻和东海原甲藻生长的影响图 1和图 2分别显示了在三个不同温度条件下不同光照强度分别对米氏凯伦藻和东海原甲藻细胞密度及比生长率的影响。实验结果表明, 在不同温度和不同光照强度条件下, 米氏凯伦藻和东海原甲藻生长均经历了延滞期、指数增长期、稳定期和衰亡期四个阶段, 表现为“S”型生长曲线(图 1)。而且, 无论是米氏凯伦藻还是东海原甲藻, 在同一温度条件下, 在实验设定的光照强度水平范围内, 均分别存在一个适宜米氏凯伦藻和东海原甲藻生长的最适光照强度Iopt, 且当I ≤ Iopt时, 米氏凯伦藻和东海原甲藻细胞密度和比生长率均随着光照强度的升高而显著增大(ANOVA, P < 0.05);而当I ≥ Iopt时, 米氏凯伦藻和东海原甲藻细胞密度和比生长率随着光照强度的升高而显著减小(ANOVA, P < 0.01)(图 1, 图 2)。此外, 随着培养温度的升高, 米氏凯伦藻和东海原甲藻细胞密度和比生长率均呈现“先升后降”的变化趋势(图 1, 图 2)。
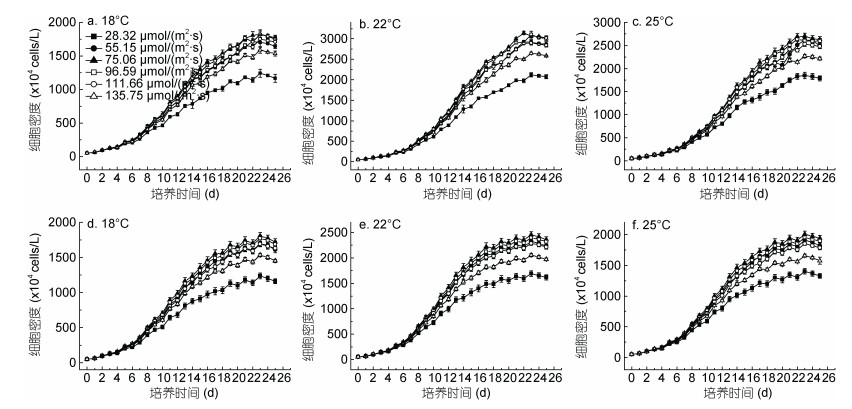 |
| 图 1 不同温度条件下不同光照强度对米氏凯伦藻和东海原甲藻细胞密度的影响 Fig. 1 Cell density of K. mikimotoi and P. donghaiense in various light intensities at 18, 22, 25℃ temperature 注: a、b、c分别为米氏凯伦藻在18、22、25℃的细胞密度生长情况; d、e、f分别为东海原甲藻在18、22、25℃的细胞密度生长情况 |
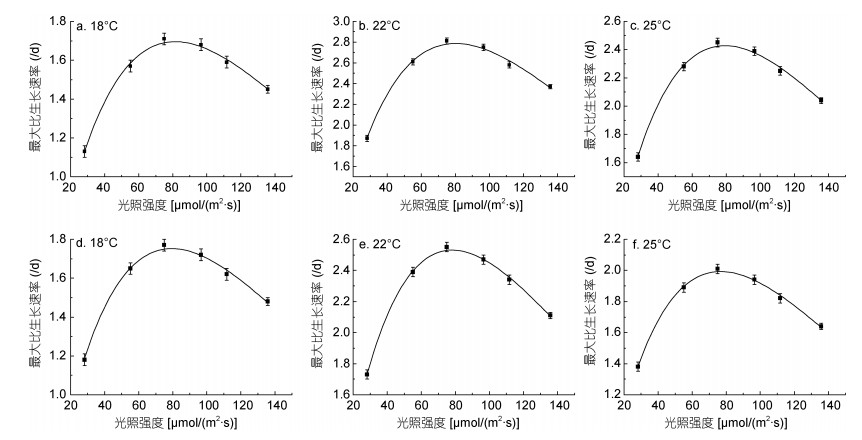 |
| 图 2 不同温度条件下米氏凯伦藻和东海原甲藻比生长率与光照强度的关系曲线 Fig. 2 Maximum specific growth rate of K. mikimotoi and P. donghaiense as a function of light intensities at 18, 22, 25℃ temperature 注: a、b、c分别为米氏凯伦藻在18、22和25℃的比生长率; d、e、f分别为东海原甲藻在18、22和25℃的比生长率; 关系曲线为拟合方程3的拟合曲线 |
根据图 2, 并结合藻类生长遵循的Shelford耐受性定律, 在数据分析平台(OriginLab 7.5)下进行模型拟合(图 2), 分别得到不同温度条件下米氏凯伦藻和东海原甲藻比生长速率与光照强度之间的定量响应关系模型(3)及其对应的模型参数(表 1)和模型的相关性分析(图 3)。
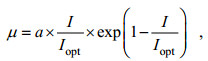 (3)
(3)| 实验藻种 | a | Iopt[μmol/(m2·s)] | R2 | 培养温度(℃) |
| 米氏凯伦藻 | 1.69 | 81.48 | 0.9958 | 18 |
| 2.79 | 80.15 | 0.9949 | 22 | |
| 2.22 | 79.27 | 0.9922 | 25 | |
| 东海原甲藻 | 1.75 | 79.39 | 0.9956 | 18 |
| 2.53 | 78.19 | 0.9983 | 22 | |
| 1.99 | 76.69 | 0.9950 | 25 | |
| 注: a为参数, Iopt为适宜藻类生长的最适光照强度, R表示相关系数。 | ||||
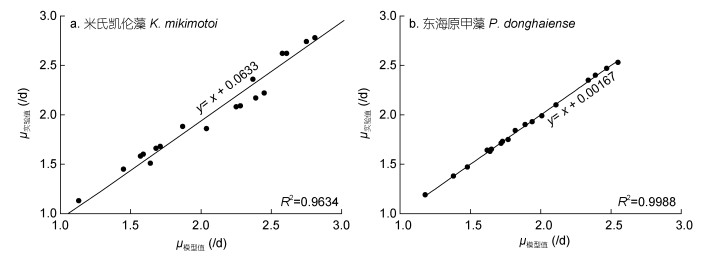 |
| 图 3 模型(3)得到的藻类比生长率模型值与实验值的相关性分析 Fig. 3 Correlation analysis of the model value and the experimental value (A. K. mikimotoi; B. P. donghaiense) 注: μ模型值表示根据模型(3)分别得到米氏凯伦藻和东海原甲藻的比生长率值; μ实验值表示根据本文实验分别得到米氏凯伦藻和东海原甲藻的比生长率值。 |
式中, μ为藻类比生长速率(/d); I为光照强度[μmol/(m2·s)]; Iopt为适宜藻类生长的最适光照强度[μmol/(m2·s)]; a为参数。
2.3 米氏凯伦藻和东海原甲藻的光照强度生态幅的定量表达藻类生长的最适光强是指在其他环境条件不变的情况下, 藻类处于最佳生长状态的光照强度。藻类生长的光强适宜生长范围是指藻类处于较好生长状态的光强范围。藻类生长的光强耐受范围是指当过低或过高都会使藻类生长受到抑制乃至死亡的光强范围。根据Shelford耐受定律可知, 藻类对光照强度的适应存在一个生态学上的适宜生长范围, 在这个适宜生长范围内, 赤潮藻类的生长处于较好的生长状态。当光强低于或高于赤潮藻类光强适宜生长范围的下限或上限时, 赤潮藻类生长受到光强的限制或抑制。因此, 本文根据原函数与其导数之间的关系来求解赤潮藻类的光强适宜生长范围、光强耐受范围的下限和上限的表达式。根据公式(1)和表 1, 分别获取了米氏凯伦藻和东海原甲藻在不同培养光照条件下的最适光强、光强适宜生长范围(适宜藻类生长的光强上限及下限)、光强耐受范围(藻类生存的光强上限及下限)(表 2)。
| 实验藻种 | 最适光强[μmol/(m2·s)] | 光强适宜生长范围[μmol/(m2·s)] | 光强耐受限度[μmol/(m2·s)] | 实验条件(℃) |
| 米氏凯伦藻 | 81.48 | 33.11-162.96 | 14.55-244.44 | 18 |
| 80.15 | 32.57-160.3 | 14.32-240.45 | 22 | |
| 79.27 | 32.03-158.54 | 14.09-237.81 | 25 | |
| 东海原甲藻 | 79.39 | 31.89-158.78 | 14.18-238.17 | 18 |
| 78.19 | 31.77-156.38 | 13.96-234.57 | 22 | |
| 76.69 | 31.18-153.38 | 13.69-230.07 | 25 |
与其他藻类生长状况类似, 无论是米氏凯伦藻还是东海原甲藻, 在藻类生长过程中均受多种因素的影响。光照强度是藻类进行光合作用的能量来源, 是藻类生长的必要条件, 也是影响赤潮发生的关键性因子之一。研究发现, 浮游植物的生长与光照强度的关系虽然因种类不同而有所差异, 但是一般都呈“先升后降”的抛物线关系, 即过低的光照强度不足以满足生长需要, 在低的光照强度下浮游植物的生物量随光照强度的增强而增大; 随着光照强度的继续升高, 在某一光照强度浮游植物生物量达到最大, 此光照强度为生长的最适光照; 之后, 光照强度继续升高发生强光抑制, 生物量反而下降(沈国英等, 2002)。目前, 浮游植物生长与光照强度之间的这种“先升后降”的抛物线关系主要用Steele方程、Platt方程、Eilers方程等来表达(孙百晔, 2008)。
本文分别在温度18、22、25℃条件下探讨了光照28.32、55.15、75.06、96.59、111.66和135.75μmol/ (m2·s)的范围内对米氏凯伦藻和东海原甲藻生长特性的影响。结果表明, 无论是米氏凯伦藻还是东海原甲藻, 在同一温度条件下, 在实验设定的光照强度水平范围内, 均分别存在一个适宜米氏凯伦藻和东海原甲藻生长的最适光照强度Iopt, 且当I ≤ Iopt时, 米氏凯伦藻和东海原甲藻细胞密度和比生长率均随着光照强度的升高而显著增大; 而当I ≥ Iopt时, 米氏凯伦藻和东海原甲藻细胞密度和比生长率随着光照强度的升高而显著减小, 藻类生长特性与光照强度呈现“先升后降”的抛物线关系, 并根据Steele方程建立了藻类比生长率与光照强度的定量模型, 这个结果与Shelford耐受性定律相一致(Shelford, 1911, 1913), 与其他研究者关于光照对藻类生长特性的影响机制得到的结论也是相一致的(Yamaguchi et al, 1989; Yamaguchi et al, 1997; 沈国英等, 2002; Kim et al, 2004)。此外, 随着培养温度的升高, 米氏凯伦藻和东海原甲藻细胞密度和比生长率均呈现“先升后降”的变化趋势, 表明过低和过高的温度都不利于实验藻种的生长, 只有在合适的温度条件下才有利于实验藻种生长, 这个结果与Shelford耐受性定律相一致(Shelford, 1911, 1913), 与其他研究者关于温度对藻类生长特性的影响机制得到的结论也相一致(Eppley, 1972; Moisana et al, 2002; Longhi et al, 2005; 陈艳拢等, 2009)。
由表 2可知, 在相同的温度条件下, 不同种类浮游植物之间存在差异, 米氏凯伦藻的最适光强比东海原甲藻的高; 在不同的温度条件下, 同一藻种的最适光强随着温度的升高而降低的变化趋势(表 2)。不同温度条件下最适生长光照强度的变化导致了相应的藻类光照强度适宜生长范围和光照强度生态幅(耐受限度)也随之变化(表 2)。Yamaguchi等(1989)在实验室条件下得到了米氏凯伦藻(Karenia mikimotoi)的光补偿点和最适光强(饱和光强)分别为0.7和110μmol/(m2·s), 这与本实验结果存在较大的差异; 孙百晔等(孙百晔等, 2008a; 孙百晔, 2008)利用船基现场培养实验并利用Steele模型定量表达了东海原甲藻生长与光照的关系, 并获得东海原甲藻生长的最适光照强度(Iopt)为(38.2±3.8)W/m2 [约(76.4± 7.6)μmol/(m2·s)], 这与本实验结果较为相似。产生这些差异性的原因主要是: (1)同一种类浮游植物, 由于生物对环境的适应性和环境对生物的驯化, 在不同海区生长的最适光照也有所不同; (2)其他实验条件存在差异, 导致了实验结果的差异性。因此, 不同学者在不同实验条件下得到的研究结果也不相同。不同种类的浮游植物对光照强度的需求和反映并不相同。如Morton等(1992)在实验室条件下分别得到了克氏前沟藻Amphidinium klebsii、利玛原甲藻Prorocentrum lima、墨西哥原甲藻Prorocentrum mexicanum和岗比亚毒藻Gambierdiscus toxicus的最适光强均为45 W/m2, 七角砺甲藻Ostreopsis heptagona和暹罗砺甲藻Ostreopsis siamensis的最适光强均为40 W/m2, 有毒甲藻Coolia monotis的最适光强均为53 W/m2, 凹形原甲藻Prorocentrum concavum的最适光强均为55 W/m2, 邓华健等(2004)在实验室条件下根据模型拟合得到海洋针杆藻的最适光强为33.4W/m2, 这些结果均表明了不同种类的浮游植物对光照强度的需求和反映并不相同, 存在差异。
赤潮的发生是营养盐、光照、温度等诸多因子综合作用的结果(Andersson et al, 1996)。环境温度的变化会导致浮游植物细胞新陈代谢的化学反应速率发生变化, 对酶的活性、营养盐的吸收利用效率及细胞的分裂周期等诸多方面都存在着不同程度的影响, 进而影响到种群增殖, 对浮游植物的生长繁殖起着重要的作用。光照是浮游植物生长繁殖的能量来源, 只有在光照充足的条件下, 浮游植物才能合成足够的有机物质进行生长繁殖, 进而才有可能形成赤潮。有研究结果表明浮游植物的光合作用速率和最佳生长光照与温度有密切的关系(Cloern, 1978; 杨东方等, 2002)。当光照充足时, 温度升高, 酶活力增强, 光合作用速率增大, 但温度过高将导致酶的失活, 光合作用速率降低。最适光强下, 在不超出最适宜温度范围时, 藻类的光合作用速率随着温度的增加而增加, 当光强低于最适光强时, 温度的改变对光合作用的影响不大。颜天等(2002)利用多因子实验设计研究了主要环境因子温度、盐度和光照强度对塔玛亚历山大藻生长的影响研究中提出光照强度和温度因子之间存在显著的相互作用。本文实验结果(表 2)也表明了温度和光照对米氏凯伦藻和东海原甲藻生长特性存在着显著的相互作用。
4 结论(1) 建立了米氏凯伦藻和东海原甲藻比生长率的光照耐受性模型, 该模型与Shelford耐受定律较为吻合, 均分别存在一个适宜米氏凯伦藻和东海原甲藻生长的最适光照强度Iopt, 且当I ≤ Iopt时, 米氏凯伦藻和东海原甲藻细胞密度和比生长率均随着光照强度的升高而显著增大; 而当I ≥ Iopt时, 米氏凯伦藻和东海原甲藻细胞密度和比生长率随着光照强度的升高而显著减小, 该模型定量表达了光照强度对实验藻种比生长率的影响机制。
(2) 分别定量得到了米氏凯伦藻在18、22、25℃下的最适生长光照强度分别为81.48、80.15、79.27μmol/(m2·s); 光照强度适宜生长范围分别为33.11—162.96、32.57—160.3、32.03— 158.54μmol/(m2·s); 光照强度耐受限度分别为14.55—244.44、14.32— 240.45、14.09—237.81μmol/(m2·s); 东海原甲藻在18、22、25℃下的最适生长光照强度分别为79.39、78.19、76.69μmol/(m2·s); 光照强度适宜生长范围分别为31.89—158.78、31.77—156.38、31.18— 153.38μmol/(m2·s); 光照强度耐受限度分别为14.18—238.17、13.96—234.57、13.69—230.07μmol/(m2·s)。
(3) 在相同的温度条件下, 在不同种类浮游植物之间存在差异, 米氏凯伦藻的最适光强比东海原甲藻的高; 在不同的温度条件下, 同一藻种的最适光强随着温度的升高而降低。
王爱军, 王修林, 王江涛, 等. 2006. 光照对东海赤潮高发区春季硅藻生长的影响. 中国海洋大学学报, 36(S1): 173-178, 162 |
王爱军, 王修林, 韩秀荣, 等. 2008. 光照对东海赤潮高发区春季赤潮藻种生长和演替的影响. 海洋环境科学, 27(2): 144-148 DOI:10.3969/j.issn.1007-6336.2008.02.011 |
邓华健, 陶建华. 2004. 浮游植物增长光响应动力学实验研究. 河北建筑科技学院学报, 21(1): 28-30 DOI:10.3969/j.issn.1673-9469.2004.01.008 |
孙百晔, 2008.长江口及邻近海域浮游植物生长的光照效应研究[D].青岛: 中国海洋大学博士学位论文 http://cdmd.cnki.com.cn/Article/CDMD-10423-2008176336.htm
|
孙百晔, 王修林, 李雁宾, 等. 2008a. 光照在东海近海东海原甲藻赤潮发生中的作用. 环境科学, 29(2): 362-367 |
孙百晔, 梁生康, 王长友, 等. 2008b. 光照与东海近海中肋骨条藻(Skeletonema costatum)赤潮发生季节的关系. 环境科学, 29(7): 1849-1854 |
杨东方, 高振会, 王培刚, 等. 2002. 光照时间和水温对浮游植物生长影响的初步剖析--以胶州湾为例. 海洋科学, 26(12): 18-22 DOI:10.3969/j.issn.1000-3096.2002.12.006 |
沈国英, 施并章. 2002. 海洋生态学. 2版. 北京: 科学出版社
|
陈艳拢, 赵冬至, 杨建洪, 等. 2009. 赤潮藻类温度生态幅的定量表达模型研究. 海洋学报, 31(5): 156-161 |
黄邦钦, 洪华生. 1994. 几种藻类吸收磷酸盐动力学的初步研究. 厦门大学学报(自然科学版), 33(S1): 7-11 |
黄邦钦, 洪华生, 戴民汉. 1993. 环境因子对海洋浮游植物吸收磷酸盐速率的影响. 海洋学报, 15(4): 64-67 |
颜天, 周名江, 钱培元. 2002. 环境因子对塔玛亚历山大藻生长的综合影响. 海洋学报, 24(2): 114-120 DOI:10.3321/j.issn:0253-4193.2002.02.014 |
Andersson A, Hajdu S, Haecky P et al, 1996. Succession and growth limitation of phytoplankton in the Gulf of Bothnia (Baltic Sea). Marine Biology, 126(4): 791-801 DOI:10.1007/BF00351346 |
Baly E C C, 1935. The kinetics of photosynthesis. Proceedings of the Royal Society B: Biological Sciences, 117(804): 218-239 |
Blackman F F, 1905. Optima and limiting factors. Annals of Botany, 19(2): 281-296 |
Cloern J E, 1978. Empirical model of Skeletonema costatum photosynthetic rate, with applications in the San Francisco bay estuary. Advances in Water Resources, 1(5): 267-274 DOI:10.1016/0309-1708(78)90040-4 |
Dubinsky Z, Falkowski P G, Wyman K, 1986. Light harvesting and utilization by phytoplankton. Plant and Cell Physiology, 27(7): 1335-1349 DOI:10.1093/oxfordjournals.pcp.a077232 |
Eppley R W, 1972. Temperature and phytoplankton growth in the sea. Fishery Bulletin, 70(4): 1063-1085 |
Geider R J, MacIntyre H L, Kana T M, 1996. A dynamic model of photoadaptation in phytoplankton. Limnology and Oceanography, 41(1): 1-15 DOI:10.4319/lo.1996.41.1.0001 |
Jassby A D, Platt T, 1976. Mathematical formulation of the relationship between photosynthesis and light for phytoplankton. Limnology and Oceanography, 21(4): 540-547 DOI:10.4319/lo.1976.21.4.0540 |
Kim D I, Matsuyama Y, Nagasoe S et al, 2004. Effects of temperature, salinity and irradiance on the growth of the harmful red tide dinoflagellate Cochlodinium polykrikoides Margalef (Dinophyceae). Journal of Plankton Research, 26(1): 61-66 DOI:10.1093/plankt/fbh001 |
Litchman E, Klausmeier C A, Bossard P, 2004. Phytoplankton nutrient competition under dynamic light regimes. Limnology and Oceanography, 49(4): 1457-1462 |
Longhi M L, Schloss I R, Wiencke C, 2005. Effect of irradiance and temperature on photosynthesis and growth of two Antarctic benthic diatoms, Gyrosigma subsalinum and Odontella litigiosa. Botanica Marina, 46(3): 276-284 |
Moisan J R, Moisan T A, Abbott M R, 2002. Modelling the effect of temperature on the maximum growth rates of phytoplankton populations. Ecological Modelling, 153(3): 197-215 DOI:10.1016/S0304-3800(02)00008-X |
Morton S L, Norris D R, Bomber J W, 1992. Effect of temperature, salinity and light intensity on the growth and seasonality of toxic dinoflagellates associated with ciguatera. Journal of Experimental Marine Biology and Ecology, 157(1): 79-90 DOI:10.1016/0022-0981(92)90076-M |
Nalewajko C, Garside C, 1983. Methodological problems in the simultaneous assessment of photosynthesis and nutrient uptake in phytoplankton as functions of light intensity and cell size. Limnology and Oceanography, 28(3): 591-597 DOI:10.4319/lo.1983.28.3.0591 |
Raven J A, Geider R J, 1988. Temperature and algal growth. New Phytologist, 110(4): 441-461 DOI:10.1111/nph.1988.110.issue-4 |
Shelford V E, 1911. Physiological animal geography. Journal of Morphology, 22(3): 551-618 DOI:10.1002/(ISSN)1097-4687 |
Shelford V E, 1913. Animal Communities in Temperate America. Chicago, Illinois: University of Chicago Press
|
Smith E L, 1936. Photosynthesis in relation to light and carbon dioxide. Proceedings of the National Academy of Sciences of the United States of America, 22(8): 504-511 DOI:10.1073/pnas.22.8.504 |
Steele J H, 1962. Environmental control of photosynthesis in the sea. Limnology and Oceanography, 7(2): 137-150 DOI:10.4319/lo.1962.7.2.0137 |
Wynne D, Rhee G Y, 1986. Effects of light intensity and quality on the relative N and P requirement (the optimum N:P ratio) of marine planktonic algae. Journal of Plankton Research, 8(1): 91-103 DOI:10.1093/plankt/8.1.91 |
Yamaguchi M, Honjo T, 1989. Effects of temperature, salinity and irradiance on the growth of the noxious red tide flagellate Gymnodinium nagasakiense (Dinophyceae). Nippon Suisan Gakkaishi, 55(11): 2029-2036 DOI:10.2331/suisan.55.2029 |
Yamaguchi M, Shigeru I, Nagasaki K et al, 1997. Effects of temperature and salinity on the growth of the red tide flagellates Heterocapsa circularisquama (Dinophyceae) and Chattonella verruculosa (Raphidophyceae). Journal of Plankton Research, 19(8): 1167-1174 DOI:10.1093/plankt/19.8.1167 |
 2019, Vol. 50
2019, Vol. 50


