
中国海洋湖沼学会主办。
文章信息
- 宫长宝, 冯志权, 王丽, 梁玉波. 2019.
- GONG Chang-Bao, FENG Zhi-Quan, WANG Li, LIANG Yu-Bo. 2019.
- 獐子岛海域浮游甲藻及有毒微藻的年际变化研究
- STUDY ON THE INTERANNUAL VARIATION OF PLANKTONIC DINOFLAGELLATES AND TOXIC MICROALGAE IN THE SEA AREA AROUND THE ZHANGZI ISLAND, NE CHINA
- 海洋与湖沼, 50(3): 672-683
- Oceanologia et Limnologia Sinica, 50(3): 672-683.
- http://dx.doi.org/10.11693/hyhz20180700187
文章历史
-
收稿日期:2018-07-27
收修改稿日期:2018-11-24
2. 大连市藻毒素重点实验室 大连 116023;
3. 大连海洋大学水产与生命学院 大连 116023
2. Dalian Phycotoxins Key Laboratory, Dalian 116023, China;
3. School of Aquaculture and Life, Dalian Ocean University, Dalian 116023, China
獐子岛海域位于黄海北部, 受鸭绿江等径流注入的影响, 海水营养盐丰富, 夏季和冬季分别受黄海冷水团和黄海暖流的影响, 海水温度周年变化小(鲍献文等, 2009), 非常适宜狭温性虾夷扇贝的养殖。自20世纪90年代起, 獐子岛海域就开始了虾夷扇贝的底播养殖, 至今仍为我国沿岸海域最大规模的双壳贝类底播养殖区。虾夷扇贝主要以海水中的浮游植物为食, 硅藻和甲藻是其摄食的主要门类。由于受海域生态环境因素(Suikkanen et al, 2013)、气候异常(Stephanie et al, 2015; Díaz et al, 2016)以及被摄食(Senft-Batoh et al, 2015)等影响, 浮游植物种群结构、有毒浮游植物的种类和密度及产毒能力会发生明显变化。甲藻中的亚历山大藻(Alexandrium sp.)、鳍藻(Dinophysis spp.)、网状原角藻(Protoceratium reticulatum)等及硅藻中的拟菱形藻(Pseudo-nitzschia simulans)均能产生毒素, 亚历山大藻(Gu et al, 2013b; Gao et al, 2015)和链状裸甲藻(Gymnodinium catenatum) (Gu et al, 2013a)等可产生麻痹性贝类毒素, 鳍藻(Gao et al, 2017)等可产生腹泻性贝类毒素, 网状原角藻(Liu et al, 2017)和具刺膝沟藻(Gonyaulax spinifera)(Rhodes et al, 2006)等可产生虾夷扇贝毒素, 拟菱形藻可产生失忆性贝类毒素(Li et al, 2017)等。
近些年来, 已有多位学者报道獐子岛海域虾夷扇贝体内毒素含量呈不同程度的增高(Chen et al, 2013; 陈建华等, 2014; Liu et al, 2017), 其主要原因可能在于海域中浮游甲藻和有毒微藻的增加, 导致虾夷扇贝虑食有毒微藻的比例增加, 有毒微藻产生的毒素在虾夷扇贝体内的富集增加, 因此, 有必要进行浮游甲藻以及有毒微藻种群结构的调查研究, 为研究獐子岛海域生态环境变化趋势提供依据, 为贝类毒素预警与海产品食用安全保障提供基础资料。
1 材料与方法 1.1 研究区域及站位布设在獐子岛海域(122°30′00″—123°00′00″E, 38°50′00″—39°10′00″N)共布设29个站位(图 1), 调查时间为2011年1月—2017年12月, 连续7年, 每月中旬调查1次。
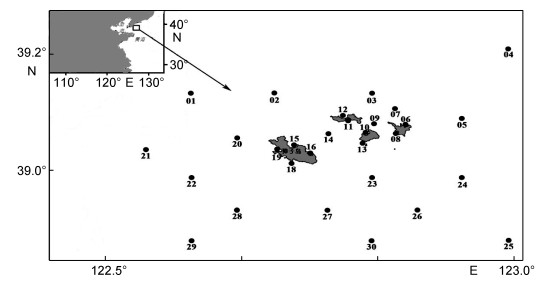 |
| 图 1 獐子岛海域采样站位 Fig. 1 The sampling stations around the Zhangzi Island |
2011—2013年, 采集表底2层水样; 2014—2017年采集表中底3层水样。每层采水样1L, 按1.5%的体积比加入鲁哥氏液固定。样品带回实验室后, 采用沉降法进行种类鉴定和计数, 将水样摇匀后倒入50mL沉降器中, 每瓶水样沉降三个平行, 静置24h后排出上液, 将沉降器轻轻移至倒置显微镜下(Nikon-ECLIPSE-TS100)进行鉴定和计数。
1.3 数据分析利用WPS Excel记录浮游甲藻鉴定数据, 计算其生物多样性指标, 包括优势度(Y) (Simpson, 1949)、香农-威纳指数(H')(Shannon et al, 1949)、均匀度(J)(Pielou, 1969)、丰富度指数(d) (Margalef, 1958), 各参数的计算公式如下:
优势度: 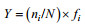
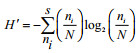
丰富度指数: 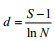
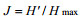
式中, ni为第i种藻类的个体总数, N为所有藻类总的个体数, fi为第i种藻类出现的频率。Y值大于0.02的种类为优势种。H'为香农-威纳多样性指数, Hmax为log2S, 表示多样性指数的最大值, S为样品种类数, J值在0—1之间, J值越大种间的个体分布越均匀。
采用Origin Pro 8.0绘制柱形图, 采用Surfer 13绘制丰度分布图, 采用SPSS 19.0分析显著性。
2 结果与讨论 2.1 浮游甲藻种类及年际变化2011—2017年獐子岛海域采集的样品, 共鉴定出浮游甲藻19属47种, 其中原多甲藻属(Protoperidinium)17种, 鳍藻属(Dinophysis)和角藻属(Ceratium)各4种, 原甲藻属(Prorocentrum)和裸甲藻属(Gymnodinium)各3种, 膝沟藻属(Gonyaulax)和环沟藻属(Gyrodinium)各2种, 亚历山大属(Alexandrium)(未鉴定到种)、原角藻属(Protoceratium)、夜光藻属(Noctiluca)、凯伦藻属(Karenia)等均为1种(图 2)。
 |
| 图 2 獐子岛海域浮游甲藻种类组成 Fig. 2 The species composition of planktonic dinoflagellates around the Zhangzi Island |
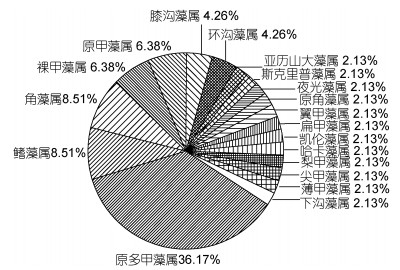
有毒藻的种类呈逐年递增, 有毒藻所占的比例也呈现递增趋势(表 1)。2011年5—10月在獐子岛赤潮监控区海域发现9属19种(姜珊等, 2017), 2011年9月—2012年11月发现10属23种(栾青杉等, 2018), 2012年周年调查发现了13属33种(张雪等, 2016), 2011—2015年夏季调查发现9属14种(刘汉超, 2016), 上述调查结果与本项同期獐子岛海域调查发现甲藻的种类数量基本一致, 种类夏季和秋季最多, 春季次之, 冬季最少(图 3)。
| 年份 | 甲藻种数 | 有毒藻种数 | 有毒藻占比 |
| 2011 | 19 | 6 | 0.3158 |
| 2012 | 21 | 8 | 0.3810 |
| 2013 | 22 | 9 | 0.4091 |
| 2014 | 25 | 10 | 0.4000 |
| 2015 | 29 | 12 | 0.4137 |
| 2016 | 31 | 13 | 0.4194 |
| 2017 | 35 | 15 | 0.4286 |
 |
| 图 3 獐子岛海域浮游甲藻种数年际变化 Fig. 3 The interannual variation of planktonic dinoflagellate species around the Zhangzi Island |
2011—2017年, 不同季节优势种类有相同性, 如三角角藻(Ceratium tripos)、梭角藻(Ceratium fusus)和亚历山大藻(Alexandrium spp.)为四季优势种, 但亦有差异, 如鳍藻属(Dinophysis spp.)、夜光藻(Noctiluca scintillans)、海洋原甲藻(Prorocentrum micans)和斯氏扁甲藻(Pyrophacus steinii)为夏、秋季优势种, 网状原角藻为冬、春季优势种(表 2)。其中亚历山大藻、渐尖鳍藻(Dinophysis acuta)、倒卵鳍藻(Dinophysis fortii)、圆形鳍藻(Dinophysis rotunda)、网状原角藻、具刺膝沟藻均为可产生毒素的微藻, 以前从未报道过这些有毒甲藻为北黄海海域浮游甲藻优势种(徐铭等, 1994; 董婧等, 1999; 杜秀宁等, 2009)。此外, 有毒的链状裸甲藻、米氏凯伦藻(Karenia mikimotoi)、具尾鳍藻(Dinophysis caudata)、利马原甲藻(Prorocentrum lima)等非优势种也在獐子岛海域发现。优势种数量季节变化为:夏季(17种) > 秋季(12种) > 春季(11种) > 冬季(5种)综上所述, 獐子岛海域有毒甲藻成为浮游甲藻优势种明显增多, 且有逐年加剧的趋势。
| 甲藻种类 | 拉丁名 | 冬季 | 春季 | 夏季 | 秋季 |
| 亚历山大藻 | Alexandrium sp. | + | + | + | + |
| 网状原角藻 | Protoceratium reticulatum | + | + | ||
| 微小原甲藻 | Prorocentrum minimum | + | + | + | |
| 海洋原甲藻 | Prorocentrum micans | + | + | ||
| 链状裸甲藻 | Gymnodinium catenatum | ||||
| 罗氏裸甲藻 | Gymnodinium lauskaga | + | + | + | |
| 裸甲藻 | Gymnodinium sp. | ||||
| 镰状环沟藻 | Gyrodinium falcatu | + | |||
| 螺旋环沟藻 | Gyrodinium spirale | ||||
| 渐尖鳍藻 | Dinophysis acuminata | + | + | ||
| 圆形鳍藻 | Dinophysis rotunda | + | + | ||
| 倒卵鳍藻 | Dinophysis fortii | + | + | ||
| 具尾鳍藻 | Dinophysis caudata | ||||
| 具刺膝沟藻 | Gonyaulax spinifera | + | |||
| 多纹膝沟藻 | Gonyaulax polydra | + | |||
| 米氏凯伦藻 | Karenia mikimotoi | ||||
| 血红哈卡藻 | Akashiwo sanguinea | ||||
| 灰甲原多甲藻 | Protoperidinium pellucidum | ||||
| 分枝原多甲藻 | Protoperidinium divaricatum | ||||
| 五角原多甲藻 | Protoperidinium pentagonum | ||||
| 里昂原多甲藻 | Protoperidinium leonis | + | |||
| 厚甲原多甲藻 | Protoperidinium crassipes | ||||
| 锥形原多甲藻 | Protoperidinium conicum | ||||
| 海洋原多甲藻 | Protoperidinium micans | ||||
| 光甲原多甲藻 | Protoperidinium pallidum | + | |||
| 扁平原多甲藻 | Protoperidinium depressum | ||||
| 方格原多甲藻 | Protoperidinium tborianum | ||||
| 渐尖原多甲藻 | Protoperidinium acutum | + | |||
| 点刺原多甲藻 | Protoperidinium punctulatum | ||||
| 二角原多甲藻 | Protoperidinium bipes | ||||
| 长形原多甲藻 | Protoperidinium oblongum | ||||
| 偏心原多甲藻 | Protoperidinium excentricum | ||||
| 叉形原多甲藻 | Peridinium divergens | ||||
| 原多甲藻 | Protoperidnium sp. | + | + | ||
| 梭角藻 | Ceratium fusus | + | + | + | + |
| 三角角藻 | Ceratium tripos | + | + | + | + |
| 长角角藻 | Ceratium macroceros | ||||
| 叉状角藻 | Ceratium furca | ||||
| 锥状斯克里普藻 | Scrippsiella trochoidea | + | + | ||
| 灰白下沟藻 | Katodinium glaucum | + | + | ||
| 夜光藻 | Noctiluca scintillans | + | + | ||
| 薄甲藻 | Glenodinium gymnodinium Pen | ||||
| 斯氏扁甲藻 | Pyrophacus steinii | + | + | ||
| 新月梨甲藻 | Pyrocystis lunuia | + | |||
| 翼甲藻 | Diplopsalopsis sp. | ||||
| 尖甲藻 | Oxytoxum sp. | ||||
| 注: +表示优势种 | |||||
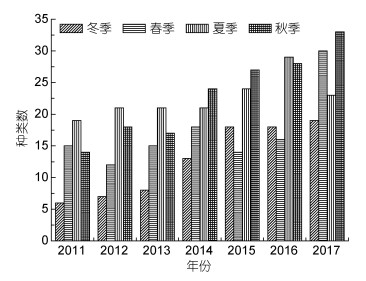
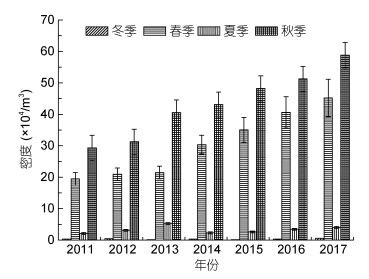
2011—2017年间, 獐子岛海域浮游甲藻细胞密度范围(2.376—339.323)×104/m3, 平均密度为65.479×104/m3, 呈逐年递减趋势(图 4)。浮游甲藻细胞平均密度秋季(125.879×104/m3) > 夏季(75.074× 104/m3) > 春季(63.545×104/m3) > 冬季(5.151×104/m3)。有毒甲藻密度逐年增加, 最高密度可达61.537×104/m3 (图 5)。
 |
| 图 4 獐子岛海域浮游甲藻细胞密度的年际变化 Fig. 4 The interannual variation in cell density of planktonic dinoflagellates around the Zhangzi Island |
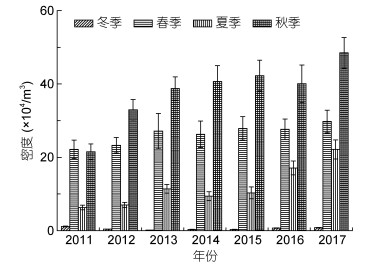 |
| 图 5 獐子岛海域有毒浮游甲藻细胞密度年际变化 Fig. 5 The interannual variation in cell density of toxic planktonic dinoflagellates around the Zhangzi Island |
不同季节浮游甲藻细胞丰度的水平分布差距也较大, 春季獐子岛西南部海域丰度较高, 夏季在岛周边海域丰度较高, 秋季在岛周边海域以及东南部丰度较高(图 6)。
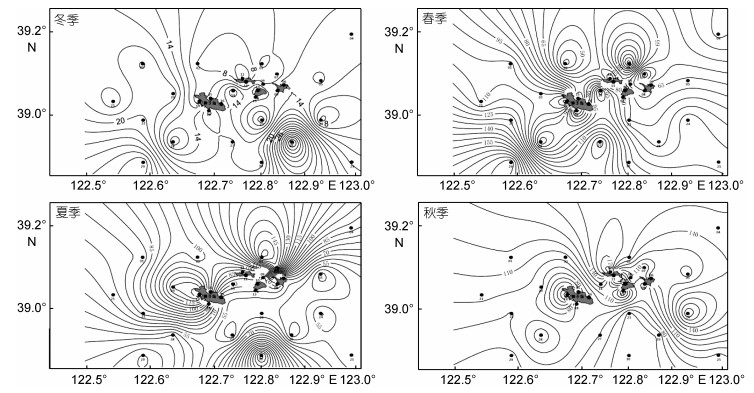 |
| 图 6 獐子岛海域不同季节浮游甲藻丰度(×104/m3)的水平分布 Fig. 6 The horizontal distribution in abundance of planktonic dinoflagellates in different seasons around the Zhangzi Island |
2006年冬季, 獐子岛附近海域浮游甲藻与硅藻丰度比为0.26(杜秀宁等, 2009); 2011年夏季北黄海甲藻与硅藻丰度比14.105(张翠霞等, 2014), 2011年秋季北黄海甲藻与硅藻丰度比0.263(郭术津等, 2013); 2011年6月—2012年6月期间, 调查范围基本与本项调查一致的獐子岛周边海域浮游甲藻与硅藻周年平均丰度比为0.717(张雪等, 2016)。2011—2012年间, 虽然不同调查季节的北黄海海域甲藻与硅藻比例有较大的差异, 但都高于这一海域在2006年时的甲藻与硅藻比例, 由此说明甲藻在浮游生物群落中比例明显升高。
2.4 浮游有毒微藻的年际变化 2.4.1 产生麻痹性贝类毒素的浮游甲藻亚历山大藻和链状裸甲藻能够产生麻痹性贝类毒素, 2011—2017年间, 獐子岛海域亚历山大藻主要出现在秋季和春季(图 7), 秋季平均密度为43.228×104/m3, 春季平均密度为30.446×104/m3。在普通光学显微镜下, 难以鉴定亚历山大藻种类, 北黄海海域可能是芬迪亚历山大藻(Alexandrium fundyense) (Gao et al, 2015)或太平洋亚历山大藻(Alexandrium pacificum) (Gu et al, 2013b)和近缘亚历山大藻(Alexandrium affine) (石雅君等, 2011)。芬迪亚历山大藻或太平洋亚历山大藻均可产生麻痹性毒素, 且毒性较大; 近缘亚历山大藻不产生毒素的; 链状裸甲藻仅在2015—2017年夏秋季出现, 最高密度可达3.37×104/m3。北黄海虾夷扇贝体内麻痹性贝类毒素高峰期为4—7月份(韩华等, 2011)。由此可推断, 獐子岛海域春季海水中亚历山大藻为毒性较大的芬迪亚历山大藻或太平洋亚历山大藻; 夏季和秋季的亚历山大藻属于近缘亚历山大藻, 不产生麻痹性贝类毒素; 而夏秋季, 毒素可能主要是链状裸甲藻产生的。
 |
| 图 7 獐子岛海域亚历山大藻细胞密度的年际变化 Fig. 7 The interannual variation in cell density of Alexandrium sp. around Zhangzi Island |
渐尖鳍藻、圆形鳍藻、具尾鳍藻、倒卵鳍藻和利马原甲藻(Prorocentrum lima)能够产生腹泻性贝类毒素, 2011—2017年间, 獐子岛海域渐尖鳍藻每年都有出现, 主要出现在夏季, 平均密度为5.666×104/m3, 其次为秋季1.707×104/m3, 密度呈逐年升高的趋势(图 8a)。2014—2017年, 圆形鳍藻每年都有出现, 主要在夏季, 密度呈逐年增多趋势(图 8b)。在2011—2012年, 2015—2017年, 有倒卵鳍藻出现, 在夏季密度较高。仅在2017秋季发现了具尾鳍藻。腹泻性贝类毒素主要包括大田软海绵酸(Okadaic acid, OA)、鳍藻毒素-1(Dinophysis toxin 1, DTX1)、扇贝毒素-2(Pectenotoxin 2, PTX2), 2011年在北黄海虾夷扇贝体内检出了这三种毒素(陈建华等, 2014), 而这三种毒素恰是由渐尖鳍藻等产生的(罗璇等, 2014), 圆形鳍藻、具尾鳍藻、倒卵鳍藻等都可产生毒素(Gao et al, 2017)。利马原甲藻可产生大田软海绵酸(OA)和鳍藻毒素-1(DTX1)(Bravo et al, 2001), 在2016年夏秋季和2017年冬季发现了利马原甲藻, 最大密度为0.143×104/m3。总的来看, 獐子岛海域产生腹泻性贝类毒素的微藻密度及种类, 呈逐年增多的趋势, 因而腹泻性贝类毒素污染有逐年加重的风险。
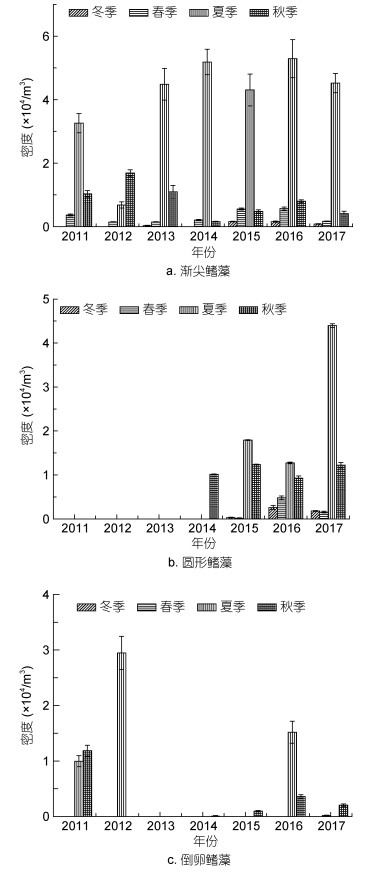 |
| 图 8 獐子岛海域可产生腹泻性贝类毒素的浮游甲藻细胞密度的年际变化 Fig. 8 The interannual variation in cell density of planktonic dinoflagellates producing diarrheic shellfish poisoning around the Zhangzi Island |
网状原角藻和具刺膝沟藻能够产生虾夷扇贝毒素, 2012—2017年间, 每年在獐子岛海域网状原角藻均有出现, 在春季密度最高(图 9a)。獐子岛海域网状原角藻可产生虾夷扇贝毒素, 这一毒素虾夷扇贝体内在春季含量较高(Liu et al, 2017), 可能主要是由网状原角藻产生的。2011—2017年间, 獐子岛海域每年都发现具刺膝沟藻, 春季密度最高, 为2.837×104/m3, 夏季次之(图 9b)。具刺膝沟可产生虾夷扇贝毒素(Riccardi et al, 2009), 但在我国近海尚无有关具刺膝沟产毒的研究报道。
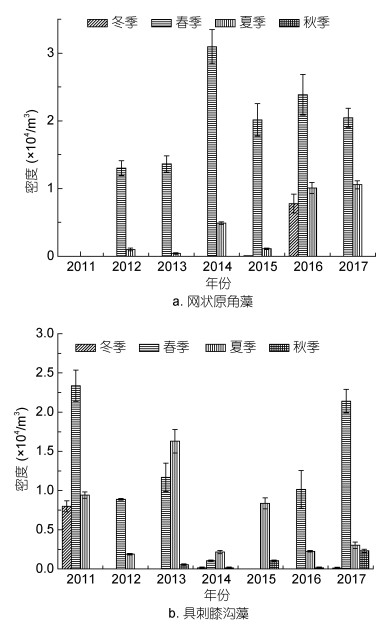 |
| 图 9 獐子岛海域产生虾夷扇贝毒素的浮游甲藻细胞密度的年际变化 Fig. 9 The interannual variation in cell density of planktonic dinoflagellates producing yessotoxins around the Zhangzi Island |
米氏凯伦藻可产生溶血性毒素, 对海洋动物危害大(崔伟民等, 2009)。在2011—2015年夏秋季, 獐子岛海域均发现了米氏凯伦藻, 最高密度为7.584×104/m3。
2.4.5 产生失忆性贝类毒素的浮游硅藻拟菱形藻能够产生失忆性贝类毒素, 2011—2017年, 獐子岛海域每年四季都有拟菱形藻出现, 且密度较大; 在冬季和春季密度较高, 分别为336.253×104/m3和93.885×104/m3, 密度有逐年增多的趋势(图 10)。在我国沿岸海域已发现产生失忆性贝类毒素的拟菱形藻(Li et al, 2017), 在大连沿岸海域的栉孔扇贝体内曾检出失忆性贝类毒素的主要成分软骨藻酸(李大志等, 2002), 但在獐子岛海域至今尚无发现软骨藻酸。
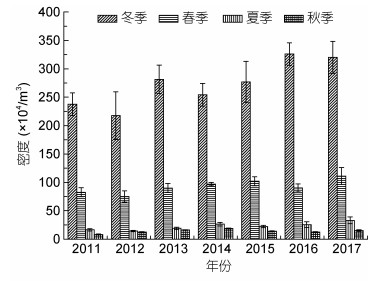 |
| 图 10 獐子岛海域拟菱形藻细胞密度的年际变化 Fig. 10 The interannual variation in cell density of Pseudo-nitzschia simulans around the Zhangzi Island |
2011—2017年, 獐子岛海域浮游甲藻群落的香农-威纳指数(H')、均匀度指数(J)、丰富度指数(d)均呈现秋季 > 夏季 > 春季 > 冬季(表 3), 季节差异显著(P < 0.05)并且呈逐年上升趋势(图 11)。獐子岛海域浮游甲藻种群香农-威纳指数、均匀度指数和丰富度指数, 基本上均呈逐年增加趋势, 说明这一海域浮游甲藻的种类越来越多, 但新增加的种类大多数是有毒甲藻(图 12)。因此, 獐子岛海域浮游甲藻群落危害性越来越大。
| 多样性指标 | 冬季 | 春季 | 夏季 | 秋季 | 均值 | 变化区间 |
| 香农-威纳指数(H') | 1.835 | 2.180 | 2.846 | 3.569 | 2.607 | 1.436—3.964 |
| 均匀度指数(J) | 0.288 | 0.405 | 0.579 | 0.633 | 0.475 | 0.156—0.765 |
| 丰富度指数(d) | 1.822 | 2.434 | 3.344 | 3.750 | 2.800 | 0.979—5.748 |
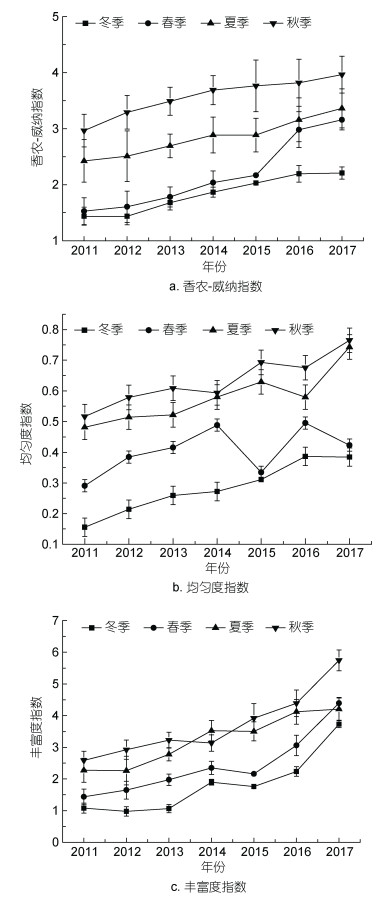 |
| 图 11 獐子岛海域浮游甲藻多样性指数年际变化 Fig. 11 Interannual variation of diversity index in planktonic dinoflagellates around the Zhangzi Island |
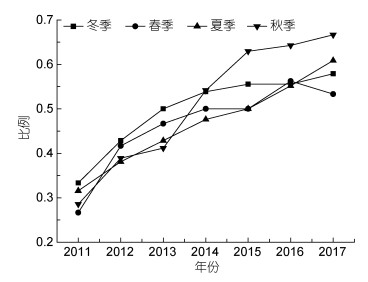 |
| 图 12 獐子岛海域浮游有毒甲藻所占比例的年际变化 Fig. 12 The interannual variation in proportion of toxic dinoflagellates around the Zhangzi Island |
综合分析獐子岛海域浮游甲藻种群变化趋势, 可看出甲藻种类呈逐年增多, 尤其是有毒甲藻种类明显增多; 甲藻生物量逐年减少; 甲藻与硅藻的比例逐年增高, 这表明獐子岛海域浮游生物群落甲藻化和有毒化趋势在加剧。实际上, 浮游生物种群演替可能是对海水营养盐比例失衡、海水酸化、洋流输入、过度海水养殖等的综合生态响应, 具有重要的生态学指示意义。
2.5.1 与海水营养盐比例失衡有关北黄海氮磷主要来源于鸭绿江和大洋河等陆源排海。位于北黄海外海的獐子岛海域, 海水中的氮磷营养盐含量均不高, 均符合一类海水水质标准, 但由于受生物活动、黄海冷水团、河流输入、温跃层和黄海暖流等的综合影响, 氮磷比例较大, 变化区间为18.2—175.6(姜珊等, 2017)或5.86—176.25(段丽琴等, 2015), 远大于最适宜浮游植物生长繁殖的Redfield比值(16︰1), 属于磷缺乏, 海水中的磷酸盐大幅度降低而形成了磷限制有利于毒藻的繁殖(Hadjadji et al, 2014), 甲藻的细胞丰度与活性磷酸盐呈负相关(黄海燕等, 2018)。在营养盐相对贫乏的水域(尤其是磷缺乏), 甲藻的生长、繁殖比硅藻更有优势(董婧等, 2002)。磷酸盐限制条件下, 氮磷比为80︰1时米氏凯伦藻的生长速率最大(孙军等, 2004), 微小亚历山大藻可以在低磷或无磷环境中生长(俞群娣等, 2018), 网状原角藻细胞个体大, 产毒素量明显增多(Röder et al, 2012), N、P限制均有利于网状原角藻YTX毒素的合成和累积(高春蕾等, 2017)。P限制可以促进链状裸甲藻细胞麻痹性贝类毒素的产生(胡蓉等, 2012), 塔玛亚历山大藻经过磷酸盐限制后, 单位藻细胞麻痹性贝类毒素含量约是对照组的6倍(周健等, 2011)。综上所述, 不同季节的氮磷比例或结构差异, 促进了獐子岛海域藻浮游生物种群的甲藻化及有毒化。
2.5.2 与海水酸化有关2006—2007年, 北黄海夏季和冬季pCO2受海水表面温度影响强烈, 春季和秋季受海洋生物活动过程影响显著。夏季水柱垂直交换与海底冷水团、冬季黄海暖流、沉积物再悬浮等也有一定相关性。温度作用大于生物过程的影响。北黄海海-气界面净交换为向大气释放CO2气体, 每年净交换量为0.63±0.10mol/cm2 (Xue et al, 2012)。由此可以看出, 北黄海海水中CO2含量丰富, 且受温度影响较大, 如果全球气温继续升高, 北黄海海水中的CO2含量可能进一步升高。CO2浓度升高能够加剧米氏凯伦藻分泌化感物质对盐生杜氏藻产生的抑制作用(胡顺鑫等, 2017)。网状原角藻在高二氧化碳分压情况下, 生长、光合作用和暗呼吸速率明显加快(Montechiaro et al, 2010)。二氧化碳分压、温度和磷酸盐限制组合试验结果表明, 三个因子的相互作用对链状亚历山大藻(A. catenella)产生麻痹性毒素组分影响较小, 但对其毒性影响很大。在高二氧化碳分压低温低磷酸盐情况下, 细胞毒性最高; 低二氧化碳分压高温高磷酸盐情况下, 细胞毒性较小(Tatters et al, 2013)。由此推断未来海洋酸化的加剧, 再与营养盐限制共同作用, 獐子岛海域甲藻化和有毒化会加重。
2.5.3 与北黄海冷水团有关春夏秋季北黄海冷水团表层水温高, 底层水温低, 尤其在夏季更为明显(姚志刚等, 2012)。底层海水温度一般不超过20℃, 非常适宜芬迪亚历山大藻等低温有毒甲藻的生长繁殖; 且低温海水中二氧化碳含量高, 更有利于甲藻的繁殖(Montechiaro et al, 2010; Tatters et al, 2013)。7—10月, 北黄海底层水二氧化碳分压从438±44μatm逐渐增加到630±84μatm; pH从8.02±0.04逐渐减少到7.88±0.06 (Zhai et al, 2014)。冬季北黄温跃层消失, 但黄海冷水团所能影响到的海域底层海水温度仍然较近岸海域高, 一般不会低于4℃, 非常有利于甲藻孢囊的生存与萌发。这可能是北黄海甲藻孢囊种类全、密度大(石雅君等, 2011)、毒素含量高的原因之一。
2.5.4 与双壳贝类大规模养殖有关双壳贝类以滤食海洋中颗粒有机物为主, 很多研究结果表明它们对食物没有选择性, 有毒甲藻营养细胞或孢囊同样可被双壳贝类以食物颗粒被摄食, 一部分可被消化吸收, 另一部分以甲粪的形式排出, 而排出的甲藻形成休眠孢囊。如美洲牡蛎(Crassostrea virginica)摄食芬迪亚历山大藻营养细胞, 72%可被消化吸收, 剩余28%通过牡蛎消化道后变成临时性休眠孢囊(Persson et al, 2006)。大规模海水养殖浮筏区, 局部海域易形成涡流, 在双壳贝类的摄食作用下, 可形成甲藻孢囊堆积在养殖区海底, 双壳贝类的粪便同时沉降在海底, 又可作为肥料促进孢囊再萌发形成营养细胞, 因而为甲藻的繁殖提供了持续的种源。长海县及獐子岛海域的双壳贝类浮筏养殖历史悠久, 且规模大, 十分有助于甲藻的繁殖。沉积物与水形成的海底边界层表层厚度1cm以上, 具有丰富的悬浮甲藻孢囊(Pilskaln et al, 2014)。再悬浮对甲藻赤潮发生具有重要作用(Butman et al, 2014); 在沉积物中10—15cm深度芬迪亚历山大藻孢囊密度最高, 至表层逐渐减少, 底栖动物扰动能将深埋在沉积物中的孢囊到表面而有利于其萌发(Shull et al, 2014)。底播养殖虾夷扇贝每三年达到养成期时以托耙式收获可使海底沉积物深耕, 可将沉积物深层孢囊翻到表层; 底播养殖的虾夷扇贝摄食与排泄、运动等, 都可能会有助于海底边界层中甲藻孢囊的再悬浮和萌发。獐子岛海域底播养殖虾夷扇贝已有约30年的时间, 形成了有利于甲藻孢囊萌发繁殖的沉积环境。作为浮游植物防御被摄食的功能, 在所有后生动物摄食芬迪亚历山大藻时, 它就通过增多分泌毒素量来防御被摄食。这些摄食者间接或直接诱导了有毒藻产生更多的毒素(Senft-Batoh et al, 2015)。獐子岛养殖的虾夷扇贝, 摄食海水中有毒微藻时, 同样会刺激有毒藻增加毒素分泌。
3 结论(1) 2011—2017年, 獐子岛海域共发现浮游甲藻19属47种, 其中原多甲藻属最多17种, 鳍藻属4种, 角藻属4种, 原甲藻属3种, 裸甲藻属3种, 膝沟藻属和环沟藻属2种, 原角藻属、夜光藻属、凯伦藻属等均为1种。浮游甲藻种类的季节变化是夏季和秋季最多, 春季次之, 冬季最少, 从2011年至2017年种类呈递增趋势。优势种数量夏季(17种) > 秋季(12种) > 春季(11种) > 冬季(5种), 三角角藻、梭角藻、亚历山大藻为四季优势种, 鳍藻属和夜光藻为夏季和秋季优势种, 网状原角藻为冬季和春季优势种, 有毒甲藻为优势种呈逐年增多趋势。
(2) 2011—2017年, 獐子岛海域浮游甲藻细胞密度范围为(2.376—339.323)×104/m3, 平均密度为65.479× 104/m3。浮游甲藻细胞密度秋季(125.879×104/m3) > 夏季(75.074×104/m3) > 春季(63.545×104/m3) > 冬季(5.151× 104/m3), 呈逐年递减趋势。
(3) 2011—2017年, 獐子岛海域浮游甲藻群落的香农-威纳指数、均匀度指数、丰富度指数均为秋季 > 夏季 > 春季 > 冬季, 呈逐年递增趋势。浮游生物种群甲藻化有毒化趋势明显, 可能与海水营养盐失衡、海水酸化、北黄海冷水团、双壳贝类大规模养殖等有关。
石雅君, 刘东艳, 邵红兵, 等. 2011. 北黄海表层沉积物中甲藻孢囊的分布特征. 海洋通报, 30(3): 320-327 DOI:10.3969/j.issn.1001-6392.2011.03.014 |
刘汉超, 2016.獐子岛海洋牧场海域夏季浮游植物群落研究.大连: 大连海洋大学硕士学位论文, 14 http://cdmd.cnki.com.cn/Article/CDMD-10158-1016757912.htm
|
孙军, 刘东艳, 陈宗涛, 等. 2004. 不同氮磷比率对青岛大扁藻、新月柱鞘藻和米氏凯伦藻生长影响及其生存策略研究. 应用生态学报, 15(11): 2122-2126 DOI:10.3321/j.issn:1001-9332.2004.11.027 |
杜秀宁, 刘光兴. 2009. 2006年冬季北黄海网采浮游植物群落结构. 海洋学报, 31(5): 132-147 |
李大志, 祝文君, 宋文斌, 等. 2002. 记忆缺失性贝类毒素的主要成分-软骨藻酸的毛细管电泳分析. 色谱, 20(2): 125-128 DOI:10.3321/j.issn:1000-8713.2002.02.007 |
张雪, 栾青杉, 孙坚强, 等. 2016. 獐子岛海域浮游植物群落周年变化及其与环境因子的关系. 大连海洋大学学报, 31(3): 315-323 |
张翠霞, 陈婷, 黄晓, 等. 2014. 2011年夏季北黄海浮游植物群落. 海洋湖沼通报, (1): 81-93 |
陈建华, 于仁成, 孔凡洲, 等. 2014. 北黄海海域虾夷扇贝体内脂溶性藻毒素分析. 海洋与湖沼, 45(4): 855-863 |
罗璇, 于仁成, 周名江. 2014. 应用LC-MS联用方法分析青岛近海渐尖鳍藻(Dinophysis acuminata)细胞中的毒素成分. 海洋环境科学, 33(5): 781-787 |
周健, 高春蕾, 李艳, 等. 2011. 磷酸盐不同补充方式对塔玛亚历山大藻生长和产毒影响. 海洋科学进展, 29(4): 487-497 DOI:10.3969/j.issn.1671-6647.2011.04.008 |
胡蓉, 徐艳红, 张文, 等. 2012. N、P、Mn和Fe对链状裸甲藻生长和产毒的影响. 海洋环境科学, 31(2): 167-172 DOI:10.3969/j.issn.1007-6336.2012.02.004 |
胡顺鑫, 杨丁, 唐学玺, 等. 2017. 海水酸化对米氏凯伦藻和盐生杜氏藻种群增长和种间竞争的影响. 海洋与湖沼, 48(4): 777-785 |
段丽琴, 宋金明, 袁华茂, 等. 2015. 北黄海獐子岛养殖海域营养水平与虾夷扇贝增殖渔获量评估. 生态学报, 35(4): 1004-1013 |
俞群娣, 王亚军, 余新威, 等. 2018. 微小亚历山大藻(Alexandrium minutum)的氮磷吸收、生长、产毒动态变化. 海洋与湖沼, 49(2): 346-351 |
姜珊, 陈燕珍, 曹戈然, 等. 2017. 大连獐子岛赤潮监控区浮游植物群落. 海洋湖沼通报, (5): 63-68 |
姚志刚, 鲍献文, 李娜, 等. 2012. 北黄海冷水团季节变化特征分析. 中国海洋大学学报, 42(6): 9-15 |
徐铭, 朱志祥, 徐步峰, 等. 1994. 长海县核大砣子海珍品自然保护区海域的浮游植物. 水产科学, 13(3): 10-13 |
栾青杉, 孙坚强, 乔芮, 等. 2018. 北黄海獐子岛海域浮游植物沉降通量的周年变化. 渔业科学进展, 39(4): 1-8 |
高春蕾, 孙萍, 贾智慧, 等. 2017. 温度和营养盐限制对网状原角藻生长与产毒的影响. 生态学报, 37(12): 4217-4226 |
郭术津, 孙军, 张辉, 等. 2013. 2011年秋季北黄海浮游植物群落. 天津科技大学学报, 28(1): 23-29 |
黄海燕, 王秋璐, 许艳, 等. 2018. 2004-2016年夏季长江口网采浮游植物及其影响因素. 海洋与湖沼, 49(2): 319-330 |
崔伟民, 杨维东, 刘洁生, 等. 2009. 米氏凯伦藻溶血毒素的溶血反应特征. 热带亚热带植物学报, 17(3): 237-241 DOI:10.3969/j.issn.1005-3395.2009.03.005 |
董婧, 刘海映, 毕博远, 等. 2002. 黄海北部近岸的浮游甲藻生态. 海洋水产研究, 23(4): 46-50 |
董婧, 李培军, 刘悦, 等. 1999. 黄海北部近岸浮游植物生态特征分析. 水产科学, 18(5): 12-15 |
韩华, 周春, 于光磊, 等. 2011. 大窑湾海域虾夷扇贝体内麻痹性贝毒的周年变化. 海洋环境科学, 31(3): 436-438 |
鲍献文, 李娜, 姚志刚, 等. 2009. 北黄海温盐分布季节变化特征分析. 中国海洋大学学报, 39(4): 553-562 |
Bravo I, Fernández M L, Ramilo I et al, 2001. Toxin composition of the toxic dinoflagellate Prorocentrum lima isolated from different locations along the Galician coast (NW Spain). Toxicon, 39(10): 1537-1545 DOI:10.1016/S0041-0101(01)00126-X |
Butman B, Aretxabaleta A L, Dickhudt P J et al, 2014. Investigating the importance of sediment resuspension in Alexandrium fundyense cyst population dynamics in the Gulf of Maine. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 103: 79-95 DOI:10.1016/j.dsr2.2013.10.011 |
Chen J H, Yu R C, Yan G et al, 2013. Tracing the origin of paralytic shellfish toxins in scallop Patinopecten yessoensis in the northern Yellow Sea. Food Additives & Contaminants: Part A, 30(11): 1933-1945 |
Díaz P A, Ruiz-Villarreal M, Pazos Y et al, 2016. Climate variability and Dinophysis acuta blooms in an upwelling system. Harmful Algae, 53: 145-159 DOI:10.1016/j.hal.2015.11.007 |
Gao H, An X L, Liu L et al, 2017. Characterization of Dinophysis acuminata from the Yellow Sea, China, and its response to different temperatures and Mesodinium prey. Oceanological and Hydrobiological Studies, 46(4): 439-450 |
Gao Y, Yu R C, Chen J H et al, 2015. Distribution of Alexandrium fundyense and A pacificum (Dinophyceae) in the Yellow Sea and Bohai Sea. Marine Pollution Bulletin, 96(1-2): 210-219 DOI:10.1016/j.marpolbul.2015.05.025 |
Gu H F, Liu T T, Vale P et al, 2013a. Morphology, phylogeny and toxin profiles of Gymnodinium inusitatum sp.nov., Gymnodinium catenatum and Gymnodinium microreticulatum (Dinophyceae) from the Yellow Sea, China. Harmful Algae, 28: 97-107 DOI:10.1016/j.hal.2013.06.001 |
Gu H F, Ni Z, Liu T T et al, 2013b. Morphology, toxicity, and phylogeny of Alexandrium (Dinophyceae) species along the coast of China. Harmful Algae, 27: 68-81 DOI:10.1016/j.hal.2013.05.008 |
Hadjadji I, Frehi H, Ayada L et al, 2014. A comparative analysis of Alexandrium catenella/tamarense blooms in Annaba Bay (Algeria) and Thau lagoon (France); phosphorus limitation as a trigger. Comptes Rendus Biologies, 337(2): 117-122 DOI:10.1016/j.crvi.2013.11.006 |
Li Y, Chun X H, Guo S X et al, 2017. Pseudo-nitzschia simulans sp.nov. (Bacillariophyceae), the first domoic acid producer from Chinese waters. Harmful Algae, 67: 119-130 DOI:10.1016/j.hal.2017.06.008 |
Liu L, Wei N, Gou Y X et al, 2017. Seasonal variability of Protoceratium reticulatum and yessotoxins in Japanese scallop Patinopecten yessoensis in northern Yellow Sea of China. Toxicon, 139: 31-40 DOI:10.1016/j.toxicon.2017.09.015 |
Margalef R D, 1958. Information theory in ecology. International Journal of General Systems, 3: 36-71 |
Montechiaro F, Giordano M, 2010. Compositional homeostasis of the dinoflagellate Protoceratium reticulatum grown at three different pCO2. Journal of Plant Physiology, 167(2): 110-113 DOI:10.1016/j.jplph.2009.07.013 |
Moore S K, Johnstone J A, Banas N S et al, 2015. Present-day and future climate pathways affecting Alexandrium blooms in Puget Sound, WA, USA. Harmful Algae, 48: 1-11 DOI:10.1016/j.hal.2015.06.008 |
Persson A, Smith B C, Wikfors G H et al, 2006. Grazing on toxic Alexandrium fundyense resting cysts and vegetative cells by the eastern oyster (Crassostrea virginica). Harmful Algae, 5(6): 678-684 DOI:10.1016/j.hal.2006.02.004 |
Pielou E C, 1969. An Introduction to Mathematical Ecology. New York: Wiley-Interscience, 1-286
|
Rhodes L, McNabb P, De Salas M et al, 2006. Yessotoxin production by Gonyaulax spinifera. Harmful Algae, 5(2): 148-155 DOI:10.1016/j.hal.2005.06.008 |
Riccardi M, Guerrini F, Roncarati F et al, 2009. Gonyaulax spinifera from the Adriatic Sea: toxin production and phylogenetic analysis. Harmful Algae, 8(2): 279-290 DOI:10.1016/j.hal.2008.06.008 |
Röder K, Hantzsche F M, Gebühr C et al, 2012. Effects of salinity, temperature and nutrients on growth, cellular characteristics and yessotoxin production of Protoceratium reticulatum. Harmful Algae, 15: 59-70 DOI:10.1016/j.hal.2011.11.006 |
Senft-Batoh C D, Dam H, Shumway S E et al, 2015. A multi-phylum study of grazer-induced paralytic shellfish toxin production in the dinoflagellate Alexandrium fundyense: A new perspective on control of algal toxicity. Harmful Algae, 44: 20-31 DOI:10.1016/j.hal.2015.02.008 |
Shannon C E, Weaver W, 1949. The Mathematical Theory of Communication. Urbana, Chicago, USA: University of Illinois Press, 1-125
|
Shull D H, Kremp A, Mayer L, 2014. Bioturbation, germination and deposition of Alexandrium fundyense cysts in the Gulf of Maine. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 103: 66-78 DOI:10.1016/j.dsr2.2013.09.027 |
Simpson E H, 1949. Measurement of diversity. Nature, 163(4148): 688 DOI:10.1038/163688a0 |
Suikkanen S, Kremp A, Hautala H et al, 2013. Paralytic shellfish toxins or spirolides? The role of environmental and genetic factors in toxin production of the Alexandrium ostenfeldii complex. Harmful Algae, 26: 52-59 DOI:10.1016/j.hal.2013.04.001 |
Tatters A O, Flewelling L J, Fu F X et al, 2013. High CO2 promotes the production of paralytic shellfish poisoning toxins by Alexandrium catenella from Southern California waters. Harmful Algae, 30: 37-43 DOI:10.1016/j.hal.2013.08.007 |
Xue L, Xue M, Zhang L J et al, 2012. Surface partial pressure of CO2 and air-sea exchange in the northern Yellow Sea. Journal of Marine Systems, 105-108: 194-206 DOI:10.1016/j.jmarsys.2012.08.006 |
Zhai W D, Zheng N, Huo C et al, 2014. Subsurface pH and carbonate saturation state of aragonite on the Chinese side of the North Yellow Sea: seasonal variations and controls. Biogeosciences, 11(4): 1103-1123 DOI:10.5194/bg-11-1103-2014 |
 2019, Vol. 50
2019, Vol. 50


