中国海洋湖沼学会主办。
文章信息
- 张培培, 宋秀贤, 李靖, 俞志明. 2019.
- ZHANG Pei-Pei, SONG Xiu-Xian, Li Jing, YU Zhi-Ming. 2019.
- 改性粘土絮凝法对大西洋鲑(Salmo salar)存活及生理生化的影响初探
- EFFECTS OF MODIFIED CLAY ON ATLANTIC SALMON (SALMO SALAR)
- 海洋与湖沼, 50(3): 684-691
- Oceanologia et Limnologia Sinica, 50(3): 684-691.
- http://dx.doi.org/10.11693/hyhz20180800205
文章历史
-
收稿日期:2018-08-23
收修改稿日期:2018-10-10
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266071;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory of Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
近年来, 有害藻华在世界沿海国家频繁发生, 且影响范围、规模和物种复杂性呈上升趋势(Anderson, 2014), 对海洋食物网中的鱼类、哺乳类、鸟类等生物造成严重威胁(Anderson, 1997), 也对沿海旅游业、养殖业等产生直接或间接的危害, 造成巨大的经济损失。针对有害藻华, 研究人员提出了多种控制方法, 大致可分为化学法、物理法、生物法和矿物絮凝法, 但大部分方法因受生态效应、成本、现场操作性等局限, 仅停留在实验室研究阶段。改性粘土絮凝法因其安全高效、成本低、现场可操作性强等优点, 成为少数能应用于有害藻华现场治理的方法(Yu et al, 2017)。大量实验证明, 改性粘土不仅可以有效去除水体中的有害藻(Sengco et al, 2004; Liu et al, 2016a; 邱丽霞等, 2017; Li et al, 2017), 还能在一定程度上改善水质, 吸附水体中的营养物质, 有效降低水体的富营养化程度(Pierce et al, 2004; Lu et al, 2015)。研究表明, 适宜浓度的粘土或改性粘土对硬壳蛤(Mercenaria mercenaria)、虾夷扇贝(Patinopecten yessoensis)、太平洋牡蛎(Crassostrea gigas)、中国对虾(Penaeus chinensis)等多种生物无负面影响(Lewis et al, 2003; Archambault et al, 2004; 王志富等, 2014)。
大西洋鲑(Salmo salar), 俗称三文鱼, 属于鲑形目(Salmoniformes)、鲑科(Salmonidae)、鲑属(Salmo), 冷水鱼, 最适生长水温在12—16℃, pH适宜范围7—8, 是一种遗传性状比较稳定的世界性养殖鱼类。海水养殖大西洋鲑一般为洄游型, 其在淡水中完成育苗、银化之后可在深水网箱中养殖(Jensen et al, 2013), 当养殖海域暴发有害藻华时会对深水网箱中的大西洋鲑等生物造成巨大的影响。智利作为全球第二大三文鱼出口国, 近年来受到有害藻华暴发的影响, 养殖业遭受了巨大的经济损失。其中, 2002年链状亚历山大藻(Alexandrium catenella)藻华造成1800吨大西洋鲑死亡, 2009年链状亚历山大藻藻华造成了超过一千万美元的经济损失(Mardones et al, 2015), 2016年Pseudochattonella cf. verruculosa藻华暴发, 造成了约12%的智利三文鱼死亡, 经济损失近10亿美元(León-Muñoz et al, 2018)。将改性粘土应用于大西洋鲑养殖海域的有害藻华治理, 研究其对大西洋鲑的影响, 确定其安全性显得尤为重要。
本文以大西洋鲑为实验对象, 探究添加改性粘土后一定时间内, 大西洋鲑鱼鳃、消化道组织的形态学变化, 并以超氧化物歧化酶(Superoxide dismutase, SOD)、过氧化氢酶(Catalase, CAT)活性及丙二醛(Malondialdehyde, MDA)含量对其鳃、肝脏、消化道组织的氧化应激反应进行表征, 旨在从组织学观察和生理生化角度, 综合探讨改性粘土絮凝法对大西洋鲑的影响, 为改性粘土治理有害藻华技术在国内外养殖海域的应用提供科学依据。
1 材料与方法 1.1 实验材料实验对象为大西洋鲑, 取自山东东方海洋科技股份有限公司开发区分公司大西洋鲑循环水养殖车间, 属同一批次、同一车间。实验鱼体重为(388.00± 41.11)g, 体长为(31.82±1.24)cm, 暂养48h死亡率为4%, 可用于实验。
实验所用海水初始pH值为7.9, 盐度为32±1, 水温维持在(13±1)℃, 水体溶解氧通过持续充气保持在(13.72±0.16)mg/L。实验容器为底面积0.5m2、高0.9m的圆柱形塑料缸, 实验水体体积为250L。
实验所使用的粘土为高岭土, 产自广西兖矿北海高岭土有限公司, 所使用的改性剂为无机改性剂硫酸铝(aluminum sulfate, AS), 改性粘土依据相关文献制备(Liu et al, 2016b)。
1.2 实验方法大西洋鲑经暂养后, 随机分为4组移入实验容器中, 每组随机分配7条大西洋鲑进行实验, 观察添加改性粘土后60h内改性粘土对大西洋鲑的影响, 实验过程中不换水。喷洒制备好的改性粘土悬浮液, 使体系改性粘土浓度分别为0(对照组)、10、50、100g/m2, 采用少量多次的喷洒方法(Yu et al, 2004)。
分别在添加改性粘土后0、0.5、1、3、6、12、24、36、48h时测定pH, 并采集未过滤海水用于总有机碳(TOC)的测定, 采集过滤海水用于营养盐的测定; 添加改性粘土后36h取新鲜鳃丝用体视镜观察改性粘土对鳃组织有无机械损伤, 60h取鳃组织、消化道、肝脏, 一部分用4%多聚甲醛固定, 用于石蜡切片的制作, 另一部分-80℃冻存用于酶活的测定。
1.3 实验参数测定 1.3.1 水质参数的测定利用pH计(S400 SevenExcellence, Mettler Toledo, Zurich, Switzerland)测定水体的pH, 精确度为±0.002。借助营养盐自动分析仪(Skalar-1000, SA 3000/5000 chemistry unit, Netherland)测定样品中各项营养盐浓度, 对硝酸盐、磷酸盐、亚硝酸盐、铵盐、硅酸盐的检出限分别为0.05、0.03、0.05、0.07、0.03μmol/L。TOC样品采用高温催化氧化法, 利用总有机碳分析仪(Multi N/C 2100S, Analytik jena, Germany)测定。溶解氧和浊度等参数采用YSI水质分析仪进行连续观测, 透光率利用分光光度计(Unico2100可见分光光度计, 上海, 中国)测定660nm处的吸光度值进行计算。
1.3.2 组织学观察取新鲜鳃组织用体视显微镜(Olympus SZX16, Japan)观察并拍照。将固定的鱼鳃、消化道组织经过脱水、透蜡、染色、封片等步骤制成石蜡切片, 用倒置显微镜(Olympus IX71, Japan)观察并拍照。
1.3.3 酶活的测定准确称取鱼鳃、消化道、肝脏组织, 加入生理盐水, 用超声波破碎仪(JY92-11DN, 新芝, 中国)破碎, 制成匀浆, 离心收集上清液, 低温保存。总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)和丙二醛(MDA)采用南京建成生物工程研究所的相应试剂盒测定。蛋白浓度采用BCA试剂盒进行测定。
1.3.4 实验数据处理采用单因子方差分析(ANOVA)数据, 显著性差异P < 0.05, 使用Origin进行绘图。
2 结果与讨论 2.1 改性粘土对大西洋鲑养殖水体水质的影响添加改性粘土后, 养殖水体pH略有下降, 随添加改性粘土浓度的升高pH下降幅度增大, pH最大变化范围为7.3—7.9, 仍在适宜大西洋鲑生活的pH范围内(图 1)。3h左右pH明显回升, 12h后与对照组之间没有显著差异(P > 0.05), pH维持在7.4±0.1。测定养殖水体硝酸盐、硅酸盐、亚硝酸盐、铵盐、磷酸盐浓度随时间的变化, 与对照组相比, 添加改性粘土的实验组, 硝酸盐和硅酸盐的浓度没有显著差异(P > 0.05), 磷酸盐以及作为养殖水质重要参数的铵盐、亚硝酸盐浓度明显降低(P < 0.05)。TOC的测定结果表明, 实验组TOC浓度明显降低。
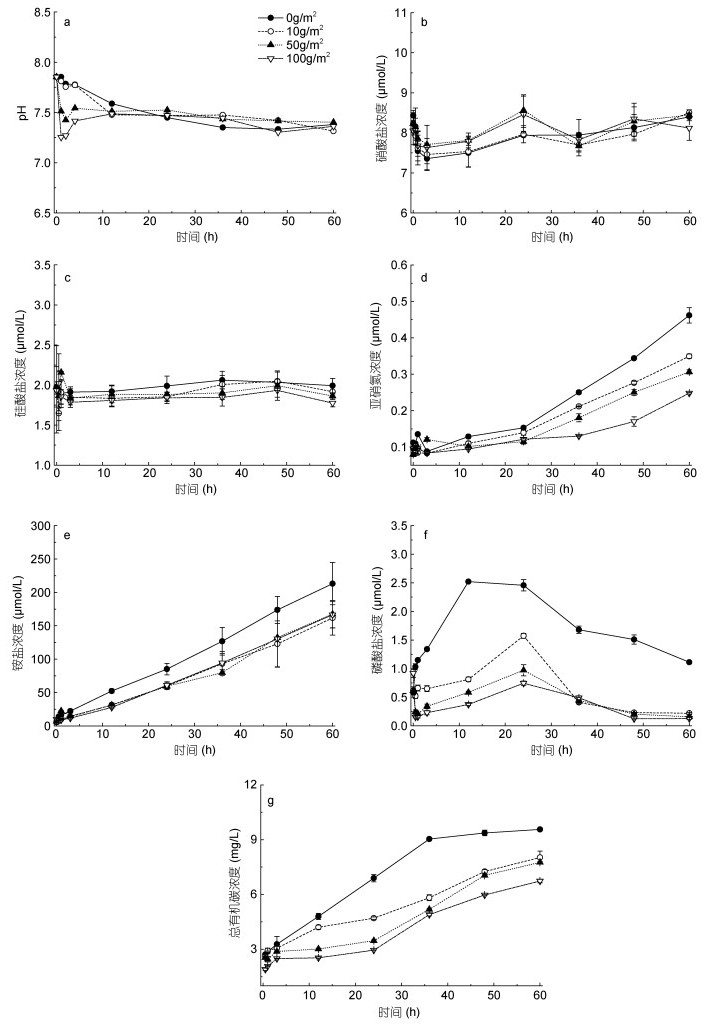 |
| 图 1 添加改性粘土后养殖水体水质参数的变化 Fig. 1 Changes of water quality parameters in cultured water after adding modified clay 注: a.添加改性粘土后养殖水体pH的变化; b—f.添加改性粘土后养殖水体营养盐浓度随时间的变化(依次为硝酸盐、硅酸盐、亚硝酸盐、铵盐、磷酸盐); g.添加改性粘土后养殖水体总有机碳浓度变化 |
实验过程中水体未更换, 大西洋鲑呼吸代谢过程使得水体中各营养盐含量升高。大西洋鲑排泄物中含有较多的铵氮, 虽然实验过程中充气使溶解氧保持较高水平, 但随着时间的延长和铵氮的积累, 水体中的硝化作用减弱, 使得水体中铵氮和亚硝氮的浓度明显上升。以往研究表明, 改性粘土对海水中的营养盐有一定的吸附作用, 能有效改善水质。硝酸盐属于惰性电解质, 性质不活泼, 改性粘土对其吸附-解吸作用不明显, 对照组与实验组的硝酸盐浓度都有缓慢升高的趋势, 但各组间差异不明显。无机改性粘土对磷酸盐的吸附能力强, 吸附量随水中磷酸盐浓度的升高而增加(俞志明等, 1995), 所以与对照组相比, 实验组磷酸盐的浓度显著低于对照组(图 1f)。
除pH、营养盐、TOC等参数外, 悬浮物也是养殖水体的重要指标之一, 因此本实验通过测定添加改性粘土后水体透光率和浊度的变化, 反映大西洋鲑养殖水体中悬浮物的含量和状态。通过50g/m2实验组的透光率与浊度对比(图 2), 可以发现两者有较好的对应关系。喷洒改性粘土后, 水体浊度有一定程度的上升, 透光率下降, 随喷洒粘土浓度增加透光率下降幅度增大, 但随着改性粘土絮凝沉降, 水体很快变澄清。0.5h水体即开始有澄清的趋势, 至12h恢复到添加粘土之前的水平。
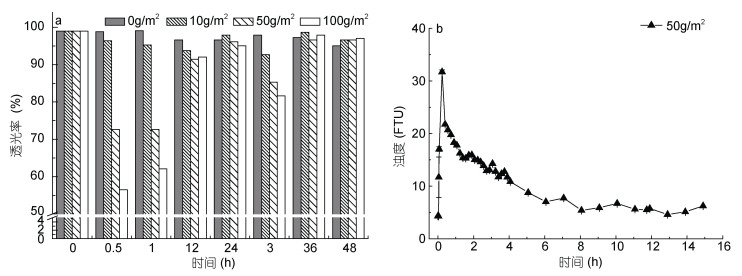 |
| 图 2 添加改性粘土后养殖水体透光率和浊度的变化 Fig. 2 Changes of transmittance and turbidity in cultured water after adding modified clay 注: a.添加改性粘土后养殖水体透光率变化; b.添加改性粘土后养殖水体浊度的变化 |
在实验进行的60h过程中, 0 (对照组)、10、50、100g/m2实验组均未出现大西洋鲑死亡, 且在连续观察中, 与对照组相比, 实验组大西洋鲑未出现行为异常。
从36h新鲜鳃丝的观察(图 3)中可以看出, 最高浓度粘土组与对照组相比没有明显差异, 鳃弓完整, 鳃丝表面呈毛绒状, 颜色正常, 鳃小片排列整齐、间距稳定无黏连、没有充血等症状出现。60h石蜡切片观察结果(图 4)也表明:鳃组织结构完整, 鳃丝排列规则, 鳃丝两侧伸出半圆形扁平囊状的鳃小片, 鳃小片独立无黏连; 消化道内壁褶皱多, 排列紧密, 绒毛丰富, 呈毛发状伸向管腔, 对照组与100g/m2改性粘土相比没有明显差异。在解剖制作新鲜组织切片和石蜡切片的过程中, 没有发现絮凝颗粒附着在鱼鳃表面和消化道内的现象。
 |
| 图 3 添加改性粘土36h大西洋鲑新鲜鳃组织观察 Fig. 3 Observation on fresh gill tissue of the Atlantic salmon before and after adding modified clay 注: a1—a3.未添加改性粘土组大西洋鲑新鲜鳃组织; b1—b3. 100g/m2改性粘土组大西洋鲑新鲜鳃组织 |
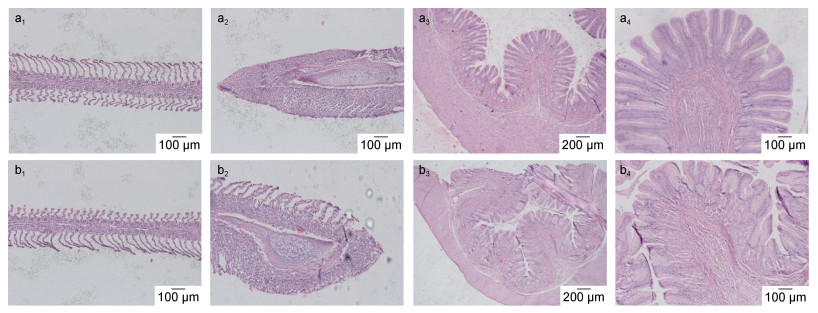 |
| 图 4 添加改性粘土60h大西洋鲑鳃组织石蜡切片观察 Fig. 4 Observation on fresh gill tissue of the Atlantic salmon before and after adding modified clay 注: a1, a2:未添加改性粘土组鳃组织石蜡切片; a3, a4:未添加改性粘土组消化道组织石蜡切片; b1, b2: 100g/m2改性粘土组鳃组织石蜡切片; b3, b4: 100g/m2改性粘土组消化道组织石蜡切片 |
鳃是硬骨鱼类的呼吸器官和气体交换的主要场所, 由于鳃组织与外界环境的密切接触以及其脆弱的结构, 特别容易受到外界环境的伤害, 比如在高悬浮物的环境中, 鳃会对悬浮物有一定的过滤作用, 颗粒较大的悬浮物还可能对鳃组织造成阻塞和损伤。
本研究中, 即使添加100g/m2(远高于现场用量4—10g/m2)的改性粘土也未造成鱼鳃和消化道损伤, 这与改性粘土性质和大西洋鲑的自身耐受性有关。改性粘土经过研磨处理后颗粒极细, 中值粒径为(9.99±0.73)μm, 形成的絮体较蓬松柔软, 且絮凝沉降速度快, 3h基本沉降完全, 沉降完全后若无剧烈扰动不会重新悬浮, 所以进入鱼鳃造成二次伤害的可能性较小。分别在添加改性粘土36和60h后, 解剖鱼鳃和消化道过程中未发现粘土絮体附着, 后续实验将增加取样时间点或利用其他技术手段研究改性粘土的附着情况。高咏卉等(2007)通过透射电镜对添加改性粘土后的太平洋牡蛎稚贝(Crassostrea gigas)鳃组织和消化腺的超微结构进行了观察, 与本实验结果相似, 改性粘土未对稚贝组织造成机械损伤。
2.3 改性粘土对大西洋鲑MDA含量、CAT和SOD活性的影响从60h三个氧化应激指标的测定结果(图 5)可以看出, 不同组织应对氧化损伤的能力存在差异, MDA含量和SOD、CAT活性在鱼鳃、肝脏和消化道中的差别明显。但不同剂量改性粘土作用下, 相同组织的MDA含量、CAT和SOD酶活与对照组没有显著差异(P > 0.05)。
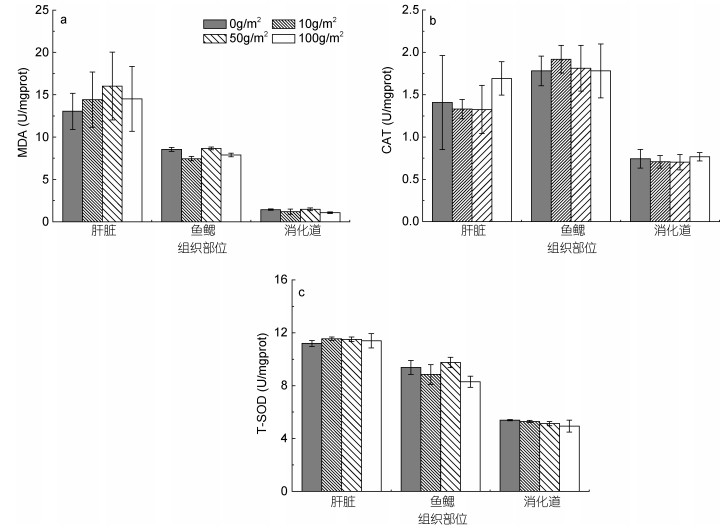 |
| 图 5 大西洋鲑不同组织中MDA含量(a)、CAT(b)和T-SOD(c)活性 Fig. 5 The content of MDA, activity of CAT and T-SOD in different tissues of the Atlantic salmon 注: MDA:活性及丙二醛; CAT:过氧化氢酶; T-SOD:总超氧化物歧化酶 |
鱼类在受到环境胁迫时会产生氧化应激反应, MDA是多不饱和脂肪酸过氧化的主要产物, 可以作为脂质过氧化的指标(Del et al, 2005), 其在机体内的含量高低间接反映了机体细胞受到自由基攻击的程度。超氧化物歧化酶(SOD)是对抗活性氧和超氧阴离子自由基的抗氧化酶防御系统的第一个也是最重要的防线(Zelko et al, 2002)。SOD对机体的氧化与抗氧化平衡起着至关重要的作用, 此酶能清除超氧阴离子自由基, 保护细胞免受损伤。其酶活的高低反映了机体清除自由基的能力。CAT与H2O2具有较高的亲和力, 能够清除脂肪酸氧化、光呼吸、线粒体电子传递中产生的H2O2, 是H2O2的主要清除剂(陈金峰等, 2008)。
已有学者研究悬浮物对菲律宾蛤仔(Ruditapes philippinarum)、杂色鲍(Haliotis divericolor)、褶牡蛎(Ostrea plicatula)等生物抗氧化酶系统的影响(沈盎绿等, 2007; 王广军等, 2007; 张雪等, 2013), 在菲律宾蛤仔受到悬浮物胁迫时, 鳃丝和内脏团超氧化物歧化酶不能及时充分地清除大量的自由基, 为了避免机体受损, 超氧化物歧化酶活力急剧升高。实验后期, 菲律宾蛤仔适应悬浮物环境后产生一定耐受能力, 其鳃丝超氧化物歧化酶活力恢复到正常水平, 说明菲律宾蛤仔鳃丝对悬浮物胁迫产生了一定的适应性。而杂色鲍和褶牡蛎在应对悬浮物胁迫时, 其抗氧化酶系统活性会被显著抑制, 说明不同生物在应对悬浮物的适应性不同。本研究测定添加改性粘土60h后大西洋鲑各组织氧化应激指标与对照组相比无显著差异, 说明添加改性粘土后一定时间(60h)内大西洋鲑并未产生异于对照组的氧化损伤, 可能因为改性粘土对大西洋鲑造成的刺激是暂时的、可逆的, 60h时大西洋鲑经过自身调节, 氧化应激水平已恢复至对照组水平; 或因实验水体未进行更换, 铵盐、亚硝酸盐累积造成的氧化应激损伤远大于改性粘土的刺激, 使对照组与实验组间不存在显著差异。后续实验拟增加取样时间点, 尤其是增加改性粘土未完全沉降过程中的取样点, 并利用电镜等手段, 观测鱼各组织中有无光镜难以分辨的微小颗粒附着, 增加除氧化应激之外的其他指标, 进一步研究改性粘土对大西洋鲑的影响。
3 结论(1) 在本实验过程中, 对照组与10、50、100g/m2实验组均未出现大西洋鲑死亡; 与对照组相比, 实验组大西洋鲑没有出现行为异常。添加改性粘土后, 大西洋鲑养殖水体水质有一定程度的改善。
(2) 显微镜观察发现, 添加改性粘土后大西洋鲑的鱼鳃、消化道组织形态正常; 实验组的SOD、CAT活性和MDA含量与对照组相比没有出现显著差异(P > 0.05), 改性粘土没有对大西洋鲑造成明显的氧化胁迫。
综上, 改性粘土絮凝法在适宜浓度下对本实验选用的大西洋鲑不会产生不良影响。
王广军, 谢骏, 余德光, 等. 2007. 杂色鲍对底泥悬浮物胁迫的生理响应. 大连水产学院学报, 22(5): 352-356 DOI:10.3969/j.issn.1000-9957.2007.05.007 |
王志富, 俞志明, 宋秀贤, 等. 2014. 有害藻华治理过程中改性粘土对仿刺参(Apostichopus japonicas Selenka)稚参的影响. 海洋与湖沼, 45(2): 233-238 |
邱丽霞, 俞志明, 曹西华, 等. 2017. 改性粘土对球形棕囊藻(Phaeocystis globosa)和东海原甲藻(Prorocentrum donghaiense)的去除作用. 海洋与湖沼, 48(5): 982-989 |
沈盎绿, 马胜伟, 陈亚瞿. 2007. 褶牡蛎对悬沙胁迫的生理响应研究. 上海环境科学, 26(1): 27-30 |
张雪, 宋伦, 杨国军, 等. 2013. 悬浮物对菲律宾蛤仔超氧化物歧化酶活力的影响. 水产科学, 32(6): 328-332 DOI:10.3969/j.issn.1003-1111.2013.06.004 |
陈金峰, 王宫南, 程素满. 2008. 过氧化氢酶在植物胁迫响应中的功能研究进展. 西北植物学报, 28(1): 188-193 DOI:10.3321/j.issn:1000-4025.2008.01.033 |
俞志明, 马锡年, 谢阳. 1995. 粘土矿物对海水中主要营养盐的吸附研究. 海洋与湖沼, 26(2): 208-214 DOI:10.3321/j.issn:0029-814X.1995.02.014 |
高咏卉, 俞志明, 宋秀贤, 等. 2007. 改性粘土絮凝法对太平洋牡蛎(Crassostrea gigas)稚贝的影响. 海洋通报, 26(3): 53-60 DOI:10.3969/j.issn.1001-6392.2007.03.008 |
Anderson D M, 1997. Turning back the harmful red tide. Nature, 388(6642): 513-514 DOI:10.1038/41415 |
Anderson D M, 2014. HABs in a changing world: a perspective on harmful algal blooms, their impacts, and research and management in a dynamic era of climactic and environmental change. Harmful Algae: 3-17 |
Archambault M C, Bricelj V M, Grant J et al, 2004. Effects of suspended and sedimented clays on juvenile hard clams, Mercenaria mercenaria, within the context of harmful algal bloom mitigation. Marine Biology, 144(3): 553-565 DOI:10.1007/s00227-003-1222-5 |
Del R D, Stewart A J, Pellegrini N, 2005. A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress. Nutrition, Metabolism and Cardiovascular Diseases, 15(4): 316-328 DOI:10.1016/j.numecd.2005.05.003 |
Jensen A J, Karlsson S, Fiske P et al, 2013. Escaped farmed Atlantic salmon grow, migrate and disperse throughout the Arctic Ocean like wild salmon. Aquaculture Environment Interactions, 3(3): 223-229 DOI:10.3354/aei00064 |
León-Muñoz J, Urbina M A, Garreaud R et al, 2018. Hydroclimatic conditions trigger record harmful algal bloom in western Patagonia (summer 2016). Scientific Reports, 8: 1330 DOI:10.1038/s41598-018-19461-4 |
Lewis M A, Dantin D D, Walker C C et al, 2003. Toxicity of clay flocculation of the toxic dinoflagellate, Karenia brevis, to estuarine invertebrates and fish. Harmful Algae, 2(4): 235-246 DOI:10.1016/S1568-9883(03)00041-6 |
Li J, Song X X, Zhang Y et al, 2017. An investigation of the space distribution of Ulva microscopic propagules and ship-based experiment of mitigation using modified clay. Marine Pollution Bulletin, 117(1-2): 247-254 DOI:10.1016/j.marpolbul.2017.01.063 |
Liu Y, Cao X H, Yu Z M et al, 2016a. Controlling harmful algae blooms using aluminum-modified clay. Marine Pollution Bulletin, 103(1-2): 211-219 DOI:10.1016/j.marpolbul.2015.12.017 |
Liu Y, Cao X H, Yu Z M et al, 2016b. Flocculation of harmful algal cells using modified clay: effects of the properties of the clay suspension. Journal of Applied Phycology, 28(3): 1623-1633 DOI:10.1007/s10811-015-0735-x |
Lu G Y, Song X X, Yu Z M et al, 2015. Environmental effects of modified clay flocculation on Alexandrium tamarense and paralytic shellfish poisoning toxins (PSTs). Chemosphere, 127: 188-194 DOI:10.1016/j.chemosphere.2015.01.039 |
Mardones J I, Dorantes-Aranda J J, Nichols P D et al, 2015. Fish gill damage by the dinoflagellate Alexandrium catenella from Chilean fjords: Synergistic action of ROS and PUFA. Harmful Algae, 49: 40-49 DOI:10.1016/j.hal.2015.09.001 |
Pierce R H, Henry M S, Higham C J et al, 2004. Removal of harmful algal cells (Karenia brevis) and toxins from seawater culture by clay flocculation. Harmful Algae, 3(2): 141-148 DOI:10.1016/j.hal.2003.09.003 |
Sengco M R, Anderson D M, 2004. Controlling harmful algal blooms through clay flocculation. Journal of Eukaryotic Microbiology, 51(2): 169-172 DOI:10.1111/jeu.2004.51.issue-2 |
Yu Z M, Sengco M R, Anderson D M, 2004. Flocculation and removal of the brown tide organism, Aureococcus anophagefferens (Chrysophyceae), using clays. Journal of Applied Phycology, 16(2): 101-110 DOI:10.1023/B:JAPH.0000044775.33548.38 |
Yu Z M, Song X X, Cao X H et al, 2017. Mitigation of harmful algal blooms using modified clays: Theory, mechanisms, and applications. Harmful Algae, 69: 48-64 DOI:10.1016/j.hal.2017.09.004 |
Zelko I N, Mariani T J, Folz R J, 2002. Superoxide dismutase multigene family: a comparison of the CuZn-SOD (SOD1), Mn-SOD (SOD2), and EC-SOD (SOD3) gene structures, evolution, and expression. Free Radical Biology and Medicine, 33(3): 337-349 DOI:10.1016/S0891-5849(02)00905-X |
 2019, Vol. 50
2019, Vol. 50


