中国海洋湖沼学会主办。
文章信息
- 韩菲尔, 赵中华, 李大鹏, 张路. 2019.
- HAN Fei-Er, ZHAO Zhong-Hua, LI Da-Peng, ZHANG Lu. 2019.
- 利用稳定同位素(15N)示踪技术研究浮游藻类氮素吸收速率特征
- THE USE OF 15N TO MEASURE NITROGEN UPTAKE OF PHYTOPLANKTON
- 海洋与湖沼, 50(4): 811-821
- Oceanologia et Limnologia Sinica, 50(4): 811-821.
- http://dx.doi.org/10.11693/hyhz20181200289
文章历史
-
收稿日期:2018-12-08
收修改稿日期:2019-02-22
2. 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室 南京 210008
2. State Key Laboratory of Lake Science and Environment Research, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, China
近年来, 全球湖泊、海洋水环境氮污染已经成为一个极其严峻的问题。研究人员普遍认为农业生产过程中大量含氮农药的使用以及污水处理厂着重于除磷而忽略氮的行为(Wang et al, 2009)是导致自然水体氮含量升高的主要原因。水体中过高的氮负荷导致水质不断恶化, 进而引起水体富营养化、水华等环境问题, 严重危害了水生生物多样性和生态系统健康(Dodds et al, 2016; Schindle et al, 2016)。水体中各种形态氮之间的固氮、氨化、硝化、反硝化等作用均是氮循环系统中的重要环节, 而通过浮游藻类吸收转化溶解态氮, 是形成湖泊中有机氮的关键环节。浮游藻类氮吸收过程分为两个步骤:第一步为吸收, 其中, 铵氮(NH4+-N)、硝氮(NO3--N)、尿素氮(Urea-N)分别通过铵根转运蛋白(ammonium transporters, AMTs)、硝酸根转运蛋白(nitrate transporters, NRTs)、尿素转运蛋白(urea transporters, URTs)进入细胞中; 第二步为同化, 同化的过程较吸收而言更为复杂。进入浮游藻类细胞内的NO3--N在硝酸还原酶的作用下还原为亚硝氮(NO2--N), NO2--N又在硝酸还原酶的作用下进一步还原为NH4+-N(Glibert et al, 2006)。Urea-N的同化有两种途径, 一是通过脲酶作用将Urea-N转化为NH4+-N和无机碳, 二是通过腺嘌呤核苷三磷酸(ATP):尿素氨基水解酶将Urea-N转化为NH4+-N和无机碳(Solomon et al, 2010)。细胞直接吸收和NO3--N、Urea-N转化而来的NH4+-N在谷氨酰氨合成酶和谷氨酸合成酶的一系列反应下最终合成氨基酸进而合成蛋白质被细胞所利用。由于不同浮游藻类细胞内氮素转运蛋白及同化酶活性不同, 因此具有不同的氮素吸收特征。过去的研究主要集中于单一藻类对不同形态氮素的吸收代谢过程研究, 缺乏对不同藻类氮素吸收代谢的对比研究(Cochlan et al, 2008; Mulholland et al, 2018)。
目前对氮素吸收过程的研究主要集中于吸收动力学, 其中温度、光照强度、pH以及底物浓度被认为是影响氮素吸收过程的主要因素(Weisse et al, 2016; Mactavish et al, 2017; Paparazzo et al, 2017)。Paparazzo等(2017)在San Jorge海湾的研究发现光照、营养物(硝酸盐、亚硝酸盐、氨氮、磷酸、硅酸)、温度会改变细胞内色素, 叶绿素与硝氮吸收正相关。现有研究表明铵态氮、尿素态氮、氨基酸等还原态氮在浮游藻类生长过程中起到非常重要的作用, 但大部分研究仍然集中于对无机氮的研究, 仅有少部分研究对浮游藻类尿素吸收进行了探讨(Paparazzo et al, 2017; Tank et al, 2018; Tripathy et al, 2018)。虽然尿素在水生生态系统中的浓度非常低, 但它对浮游藻类氮吸收的贡献却超过了50%(Kang et al, 2017), 同时也是再生氮的主要来源, 是浮游藻类营养的主要基质。由于受农药使用以及水产养殖等的影响, 尿素在水体中的浓度逐渐增高, 越来越多的有害藻华被认为与尿素的人为富集有关(Glibert et al, 2016)。
人类活动会改变水体的营养负荷, 进而改变水体中氮素营养盐的主要形态。已有研究表明, 当水环境中氮元素以铵态氮、尿素态氮、氨基酸等还原态氮形式存在时, 蓝藻和绿藻易于生长成为淡水和海洋生态系统中的优势种; 而当水体氮素主要以硝态氮形式存在时, 硅藻则表现出较高的生长能力, 成为优势藻种(Donald et al, 2013; Glibert et al, 2014b)。因此, 氮素形态化学计量学变化即不同形态氮素含量组成特征对浮游藻类群落组成和结构具有重要的影响, 在水华优势种形成和维持过程中发挥关键作用, 开展水体浮游藻类氮素吸收的研究对于探讨水体氮循环和富营养化发生机制具有重要的环境意义。
近年来稳定氮同位素示踪技术在氮素吸收速率研究中是一种被普遍使用的有力方法, 逐渐取代了凯氏定氮法、通过测定环境氮素浓度变化或测定叶绿素变化等常用的间接方法。该方法由Dugdale等(1967)于1967年首次建立用于测定浮游藻类对新氮源和再生氮源的吸收率, 目前该方法在无机氮、尿素以及氨基酸吸收方面发展较为成熟, 可用于原位测定浮游藻类氮素吸收速率, 且测定结果相较于间接方法更为准确。稳定氮同位素法通过向体系中添加15N同位素, 通过对15N的示踪, 测定浮游藻类吸收后颗粒氮中15N丰度, 进而计算氮素吸收速率。
硅藻海链藻(Thalassiosira sp.)、绿藻卡德藻(Tetraselmis sp.)、鞭毛藻剧毒卡尔藻(Karlodinium veneficum)、隐藻盐水隐藻(Rhodomonas salina)以及蓝藻铜绿微囊藻(Microcystis aeruginosa)均是海洋赤潮优势藻种(Semcheski et al, 2016), 同时, 铜绿微囊藻也是淡水水华优势藻种(Adolf et al, 2008)。研究显示, 剧毒卡尔藻与铜绿微囊藻是湾口富营养化主要的有毒藻类(Lin et al, 2018)。剧毒卡尔藻由于其对鱼类毒性而受到广泛关注, Chesapeake Bay海湾鱼死亡以及牡蛎等的产卵水平下降被证实与剧毒卡尔藻的毒性有关(Deeds et al, 2006; Glibert et al, 2007), 报道显示在南非、欧洲、澳大利亚西部以及美国东部沿海地区的河口系统中曾暴发过剧毒卡尔藻水华(Adolf et al, 2009; Place et al, 2012)。剧毒卡尔藻是一种兼性营养藻, 能够通过吞噬作用利用盐水隐藻作为营养源(Glibert et al, 2014a), 同时盐水隐藻的存在会使得绿藻生长更为快速。铜绿微囊藻由于其会产生微胱氨酸及其他毒素(Wang et al, 2013), 大量耗氧从而导致鱼类死亡。同时, 铜绿微囊藻已是湖泊、水库等淡水生态系统水华主要优势种(de Figueiredo et al, 2004; Paerl et al, 2013), 会严重危害湖泊、水库生态系统健康和安全。
不同湖泊、海洋水体氮素营养盐化学计量学不同, 不同藻种对不同形态氮的偏好性也不同。当环境中营养盐化学计量学发生改变, 浮游藻类群落结构也会随之发生变化。目前化学计量学研究的重点多集中于氮磷比对浮游植物生长及优势种形成的影响(Vrede et al, 2009), 然而氮素污染的加重以及氮素形态变化对浮游植物的生长效应影响研究表明, 氮素形态变化以及氮素内循环作用在浮游植物生长竞争和优势种形成方面同样存在重要作用(Mousseau et al, 2001; Heil et al, 2007)。所以, 通过分析对不同浮游藻类氮素吸收速率差异性可以有效探究浮游藻类对氮素营养盐化学计量学变化的响应。针对这一目的, 本研究选择海链藻、卡德藻、剧毒卡尔藻、盐水隐藻以及铜绿微囊藻为研究对象, 通过室内培养, 通过稳定同位素(15N)示踪技术探究不同浮游藻类氮素吸收特征, 丰富水体氮素循环和富营养化发生理论机制。
1 材料与方法 1.1 化学试剂稳定氮同位素(15NH4Cl、Na15NO3、15Urea)由美国马里兰大学环境科学中心(University of Maryland Center for Environmental Science, UMCES) Horn Point Laboratory实验室提供。
1.2 生物材料海链藻、卡德藻、剧毒卡尔藻以及盐水隐藻由UMCES Horn Point Laboratory实验室藻种培育库提供, 铜绿微囊藻由中国科学院淡水藻种库提供。
1.3 氮吸收实验稳定同位素添加实验如图 1所示。海链藻、卡德藻、剧毒卡尔藻以及盐水隐藻采用f/2培养基、铜绿微囊藻采用BG-11培养基于实验室纯化培养, 设置光照强度为430μmol/(m·s), 光照周期为12h︰12h, 温度为25℃。培养后海链藻、卡德藻、剧毒卡尔藻、盐水隐藻接种至美国马里兰州Choptank River过滤后的按照f/2培养液进行营养加富的淡海水(调节培养液盐度为12)中进行室内培养, 铜绿微囊藻接种至按照BG-11培养基进行营养加富的淡海水中进行室内培养, 分别于培养1d和4d时进行氮素吸收实验。氮素吸收实验操作如下:分别取培养1d和4d时的藻悬液10mL于27根15mL离心管中, 添加相应的氮底物15N稳定同位素使离心管中15N浓度为25μmol/L, 添加每种形态氮的离心管为9根, 设置3组吸收时间为1h, 3组为6h, 3组为24h, 维持原培养条件, 吸收结束后立即将藻悬液过GF/F膜终止反应并严格记录添加稳定同位素与终止反应时间。收集滤膜冷冻保存, 滤膜经40℃烘箱干燥后, 送样用于同位素质谱仪进行稳定氮同位素比值测定。吸收实验前取20mL藻悬液过GF/F膜, 滤膜经40℃烘箱干燥, 送样用于碳氮(C/N)元素分析仪进行颗粒态氮测定, 收集滤液冷冻保存用于NH4+-N、NO3--N、Urea-N营养盐含量指标测定。颗粒态氮含量以及氮同位素的分析测定均在美国马里兰大学环境科学中心分析测试中心完成。NH4+-N测定采用纳氏分光光度法, NO3--N测定采用酒石酸钾钠分光光度法, Urea-N测定采用二乙酰一肟分光光度法。
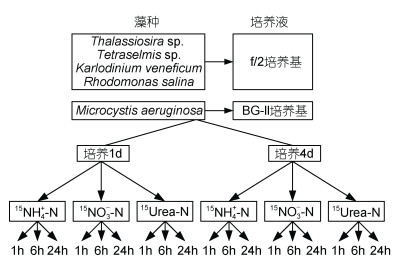 |
| 图 1 稳定同位素示踪实验示意图 Fig. 1 The schematic map of the enrichment experiment |
氮素吸收率的计算参照Dugdale等(1967)以及Glibert等(1982)修正的公式:
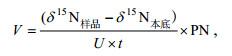 (1)
(1)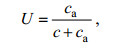 (2)
(2)式中, V为氮素吸收速率[μmol/(L·h)]; δ15N样品为GF/F膜上颗粒态样品的15N丰度; δ15N本底为15N的天然丰度(0.366%); PN为GF/F膜上颗粒态氮含量(μmol/L); ca为培养体系中添加的15N浓度; c为培养体系中溶解态氮浓度; t为培养时间(h)。
其中, 稳定氮同位素由MAT-251型同位素质谱仪分析完成。测定结果以δ15N丰度表示:
 (3)
(3)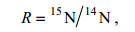 (4)
(4)式中, 15N/14N是样品和标准品(大气中的氮气)的氮同位素比率, 也即样品和标准品所产生N2中30/28的绝对同位素比。
相对偏好系数(RPI)根据下式计算:
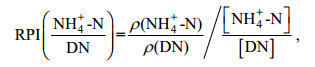 (5)
(5)式中, ρ(NH4+-N)为浮游藻类群落对NH4+-N的绝对吸收速率, ρ(DN)为浮游藻类群落对NH4+-N、NO3--N、Urea-N绝对吸收速率之和。[NH4+-N]为培养介质中NH4+-N的浓度, [DN]为培养介质中NH4+-N、NO3--N、Urea-N浓度之和。RPI(NO3--N/DN)、RPI(Urea-N/DN)计算公式与RPI(NH4+-N/DN)类似。
2 结果与讨论 2.1 氮素吸收速率随时间变化特征如图 2所示, 浮游藻类氮吸收速率随吸收时间变化表现出明显差异。培养时间为1d和4d的两组实验中, 吸收1h时NH4+-N的吸收速率均值最高[1d/4d, 均值±标准偏差: (8.90±6.31)/(9.09±8.52)μmol/(L·h)], 吸收24h时最低[(0.73±0.40)/(0.79±0.45)μmol/(L·h)], NH4+-N的吸收速率随吸收时间变化表现为1h>6h>24h。培养时间为1d和4d时, NO3--N的吸收速率均值同样在吸收1h时最高[(1.65±0.86)/ (2.14±1.18)μmol/(L·h)]; 培养1d时, 吸收24h的吸收速率均值最低[(0.21±0.08)μmol/(L·h)], 表现为1h>6h>24h;培养4d时, 吸收时间为6h NO3--N的吸收速率均值最低[(0.32±0.20)μmol/(L·h)], 表现为1h>24h>6h。培养时间为1d和4d的两组实验中, Urea-N的吸收速率均值也在吸收1h时最高[(1.64±0.69)/(1.78±1.82)μmol/(L·h)], 吸收24h时最低[(0.41±0.20)/(0.38±0.35)μmol/(L·h)], 吸收速率随吸收时间的变化也表现为1h>6h>24h。
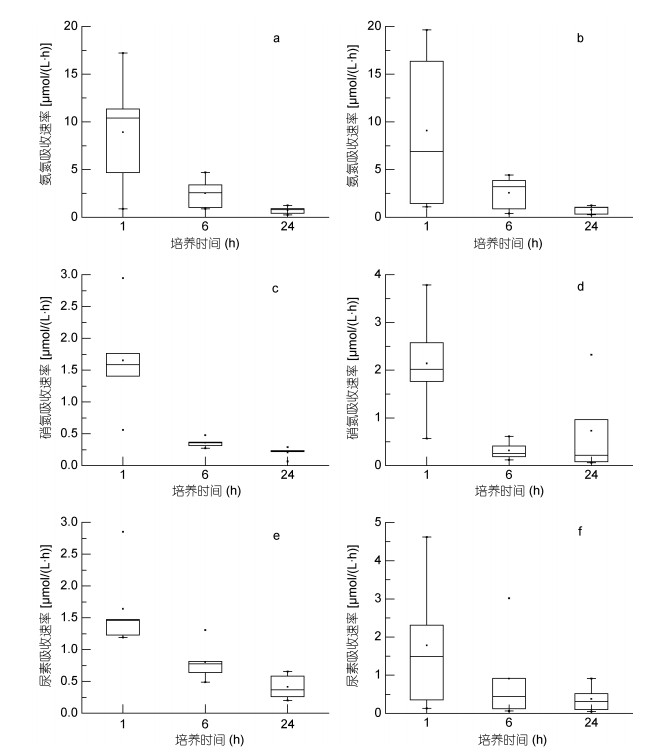 |
| 图 2 不同吸收时间浮游藻类氮吸收速率 Fig. 2 The nitrogen uptake rate of phytoplankton at different times 注: a、c、e为海链藻、卡德藻、剧毒卡尔藻、盐水隐藻以及铜绿微囊藻五种藻分别纯培养1d后测定不同吸收时间时的吸收速率; b、d、f为五种藻分别纯培养4d后测定不同吸收时间时的吸收速率 |
经过1d和4d的培养后, 浮游藻类对三种形态氮的吸收速率表现出相同的趋势, 吸收速率随着时间的延长逐渐减小并趋于平缓。吸收1h的吸收速率显著高于吸收6h (P<0.01)和吸收24h (P<0.01), 吸收6h与吸收24h之间不存在显著差异(P>0.05)。
吸收时间为1h时, 培养介质中营养盐充足, 三种形态氮的吸收速率均处于较高水平。浮游藻类快速吸收各形态氮, 培养介质中的氮浓度快速下降, 当吸收到达6h时, 由于培养介质中基质浓度处于低水平, 氮吸收速率相对于1h有明显的下降, 且由于6h之后营养盐浓度始终处于较低水平, 24h与6h的平均吸收速率相差不大。培养4d时, NO3--N吸收24h的吸收速率高于6h, 这可能是由于NH4+-N的大量减少, 降低了其对NO3--N吸收的抑制作用, 另外, 由于NH4+-N与Urea-N的吸收速率均处于较低水平, 为满足浮游藻类生长所需, 也有可能使NO3--N吸收速率有所增加。
根据图 2结果可认为浮游藻类氮素吸收是一个快速吸收的过程, 这与已有的文献研究结果相同。Glibert等(1981)在美国马萨诸塞州对海洋藻的实验表明, 前2h为快速吸收, 2h后吸收达到稳定。同样地, Kanda等(1985)对太平洋自然藻种群落的氮吸收研究显示, 当吸收超过3h, 吸收过程不受基质影响变为线性吸收, 即吸收达到平衡。浮游藻类氮素吸收无论藻种、基质差异均为快速吸收, 根据文献及相关实验可以认为吸收时间为2h时, 吸收达到稳定。因此, 在后续的氮素吸收实验中可选择2h为吸收时间, 一定程度上减短实验时间并保证吸收速率的准确性。
2.2 不同形态氮的吸收特征不同形态氮的吸收速率如图 3所示。当培养时间为1d和4d时, NH4+-N的吸收速率均值均为最高, 分别为4.05和4.15μmol/(L·h)。NO3--N与Urea-N的平均吸收速率均值大致相同, 培养1d时分别为0.74和0.95μmol/(L·h), 培养4d时分别为1.06和1.02μmol/(L·h)。NH4+-N的吸收速率显著高于另外两种形态的氮(P<0.01), NO3--N与Urea-N吸收速率无明显差异(P>0.05)。
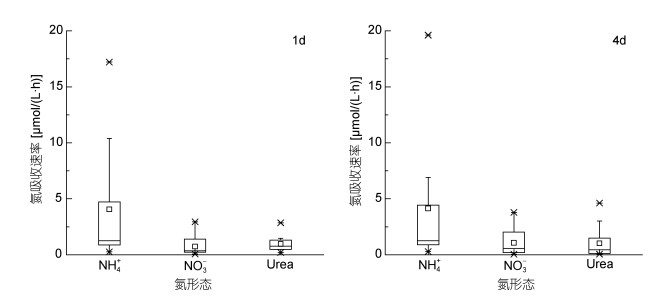 |
| 图 3 不同吸收时间浮游藻类氮吸收速率 Fig. 3 The uptake rate of nitrogen in different forms |
有研究发现, 相对偏好系数(RPI)可以表征浮游藻类对不同形态氮底物的偏好性(McCarthy et al, 1977)。当RPI值>1时表明浮游藻类对该种氮源具有特定偏好性, 反之则表明其对该种氮源偏好性较低。
不同藻种的RPI值如图 4所示, 5种藻对Urea-N的偏好系数都远高于另外两种形态的氮, 最高的是铜绿微囊藻, 为713.42, 最低的是剧毒卡尔藻, 为25.18。对NH4+-N的相对偏好系数虽然比Urea-N的小, 但仍大于1, 最高的是铜绿微囊藻, 为18.92, 最低的是盐水隐藻, 为1.10, 而对NO3--N的相对偏好系数最高的是盐水隐藻, 为0.27, 最低的是卡德藻, 为0.13。浮游藻类对Urea-N和NH4+-N的RPI值均大于1, 则说明浮游藻类对Urea-N和NH4+-N具有特定偏好性, 而RPI(NO3--N/DN)<1, 浮游藻类对NO3--N这种氮源的偏好性较低。
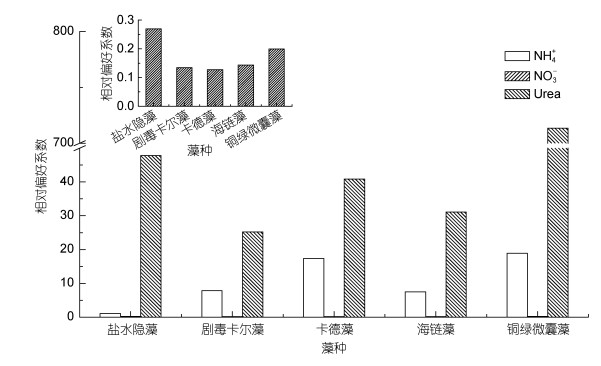 |
| 图 4 不同藻种的氮吸收相对偏好系数 Fig. 4 The relative preference index of different phytoplankton for different nitrogen forms |
从浮游藻类的氮吸收速率来看, NH4+-N的吸收速率远高于其他两种形态, Urea-N的吸收速率与NO3--N无明显差异。而从相对偏好系数来看, 浮游藻类对Urea-N的相对偏好系数最高, 其次为NH4+-N和NO3--N。相对偏好系数与实际吸收速率结果产生差异的主要原因是培养介质中Urea-N的浓度为0.05— 0.32μmol/L, 远小于培养介质中NH4+-N的浓度(2.63— 34.08μmol/L)与NO3--N的浓度(6.82—203.85μmol/L)。Urea-N的低浓度抑制了浮游藻类对其的吸收, 从而导致了Urea-N相对偏好系数与吸收速率不对等的情况。由图 2和图 3可知, 相对于氧化态氮, 浮游藻类优先利用还原态氮, 这可能是由于浮游藻类细胞吸收与同化NH4+-N首先需要通过铵根转运蛋白将其转运进入细胞中, 然后在谷氨酰氨合成酶的转氮作用下将铵根转化为氨基酸进而合成蛋白质。而NO3--N通过硝酸转运蛋白进入细胞后还需通过硝酸还原酶以及亚硝酸还原酶还原为铵根后才可进行后续的反应。而将NO3--N还原为NH4+-N需要消耗8个电子(Glibert et al, 2016)。此外, 由于环境中Urea-N的含量较低, 因此Urea-N主要通过主动运输的方式进入浮游藻类细胞中。在浮游藻类细胞内, 在脲酶的作用下, Urea-N被转化为NH4+-N和无机碳。脲酶是一种胞浆酶, 催化Urea-N水解成NH4+-N和氨基甲酸盐。氨基甲酸盐自发分解产生NH4+-N和H2CO3。Urea-N的另一种降解方式是通过ATP:尿素氨基水解酶的作用, 这一过程可以是尿素羧化酶和脲基甲酸水解酶的各自作用也可以是共同作用, 尿素羧化酶降解尿素这一过程仅需要1个ATP。浮游藻类吸收Urea-N和所需要的能量非常少(Solomon et al, 2010)。因此, 浮游藻类优先吸收还原态的NH4+-N、Urea-N等氮源。此外, Bronk等(2014)的实验结果均表现出浮游藻类对还原态氮的偏好性[34]。
有研究表明, 某些有毒、有害浮游藻类对尿素的利用率远远大于NO3--N等无机形态的氮(Baer et al, 2015)。另外, 当水体中检测到高浓度的尿素后, 许多有害浮游藻类如微小原甲藻(Prorocentrum minimum)细胞数目出现快速增长。因此, 有害藻类暴发次数增加与人为源尿素的增加存在一定关联(Glibert et al, 2006)。之前普遍认为富营养化湖泊主要为无机氮限制或磷限制, 而浮游藻类对尿素的高偏好性则表明, 湖泊富营养化可能受尿素限制。水体中尿素来源主要分为人为富集与自然富集。人为源主要包括农业地表径流和淋溶地下水、生活污水和工业废水排放、大气沉降。1828年弗里德里希·维勒通过氰酸银与铵反应生成尿素, 这一发现导致工业生产的尿素达到7000万吨/年, 过去40年尿素使用量已增长为原来的100倍, 大量使用尿素导致水体中尿素含量大量升高。同时, 有研究表明, 氮素的迁移转化过程、释放分解过程也对水体尿素水平有很大的影响(韩晓霞等, 2014), 普遍认为水体内源尿素的主要来源有沉积物或水体中有机物的缺氧或厌氧降解产生、细菌分解有机物过程中释放、浮游动物和鱼等直接排泄以及紫外光分解有机物等(Siuda et al, 2006; Solomon et al, 2010; Bogard et al, 2012)水体缺氧或低氧环境会导致水体大量内源尿素的累积。Mulholland等(2018)在Chesapeake Bay的研究表明, 尽管Urea-N的浓度很低且在整个培养过程中不稳定, 但Urea-N对总氮吸收的贡献率依然很高, 甚至有时超过50%。当环境中尿素含量不断增加, Urea-N对总氮吸收的贡献率将显著提高, 浮游藻类水华发生将更加频繁。因此, 如何有效控制水环境中Urea-N浓度将成为控制浮游藻类水华发生的关键环节。
2.3 不同藻种氮吸收特征 2.3.1 不同藻种对相同形态氮的吸收速率差异如图 5所示, 不同藻种对各形态氮的吸收速率(按藻密度归一化后的吸收速率)表现出显著的差异。总氮(TN)吸收速率即NH4+-N、NO3--N以及Urea-N吸收速率之和表现为剧毒卡尔藻的吸收速率均值最高[(11.36±12.55)×10-8μmol/(cell·h)], 铜绿微囊藻最低[(0.06±0.10)×10-8μmol/(cell·h)], 整体表现为剧毒卡尔藻>盐水隐藻>卡德藻>海链藻>铜绿微囊藻, 五种藻之间均不存在显著差异。剧毒卡尔藻的NH4+-N吸收速率均值最高[(8.96±9.91)×10-8μmol/(cell·h)], 铜绿微囊藻的NH4+-N吸收速率均值最低[(0.04±0.06)×10-8μmol/(cell·h)], NH4+-N吸收情况表现为剧毒卡尔藻>卡德藻>盐水隐藻>海链藻>铜绿微囊藻, 其中盐水隐藻与铜绿微囊藻之间NH4+-N吸收速率有显著差异(P<0.05), 而其他藻种之间不存在显著差异。剧毒卡尔藻的NH4+-N吸收速率均值仍为最高[(1.40±1.59)×10-8μmol/(cell·h)], 铜绿微囊藻的NO3--N吸收速率均值仍为最低[(0.13±0.19) ×10-7μmol/(cell·h)], NO3--N吸收情况同样表现为剧毒卡尔藻>盐水隐藻>卡德藻>海链藻>铜绿微囊藻, 五种藻之间仍不存在显著差异。剧毒卡尔藻与盐水隐藻的Urea-N吸收速率均值相当, 分别为(0.99±1.17) ×10-8和(0.94±0.68)×10-8μmol/(cell·h), 而铜绿微囊藻的最低[(0.13±0.17)×10-7μmol/(cell·h)], Urea-N吸收速率表现为剧毒卡尔藻>盐水隐藻>卡德藻>海链藻>铜绿微囊藻, 五种藻之间依然不存在显著差异(P>0.05)。海链藻与铜绿微囊藻对于各种形态氮的吸收速率都低于其他几种藻, 剧毒卡尔藻对于NH4+-N和NO3--N的吸收速率都远高于其他几种藻。
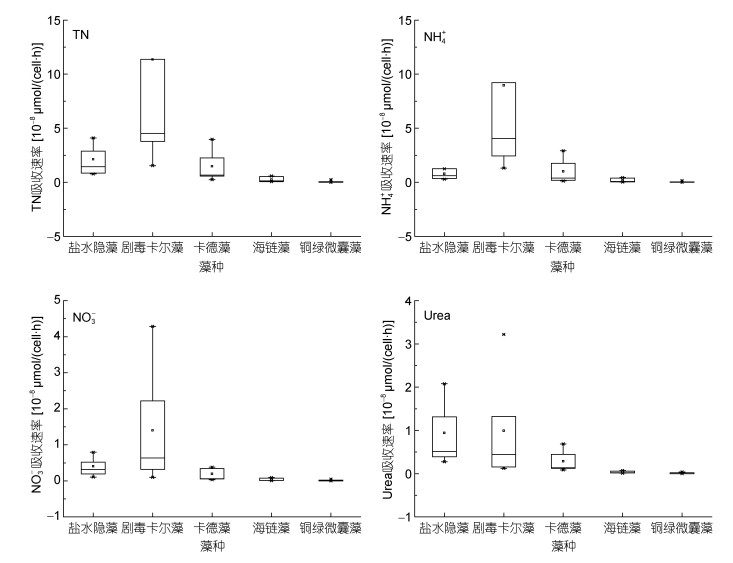 |
| 图 5 不同形态氮各藻种间差异 Fig. 5 Differences in the relationship between nitrogen form and algae species 注: TN:总氮=铵氮+硝氮+尿素氮 |
浮游藻类对氮源的吸收大都具有选择性。在氧化态氮源(如NO3--N和NO2--N)充足的情况下, 浮游藻类仍然偏向利用还原态的氮源(NH4+-N和Urea-N)(Bronk et al, 2014), 这与本文的结论相一致。然而不同藻种对氮源的吸收也存在差异性, 虽然绝大多数浮游藻类能够利用NH4+-N和Urea-N, 但有研究表明部分硅藻在Urea-N作为唯一氮源时不能继续生长, 更偏向于使用NO3--N(Kang et al, 2017), 从而导致硅藻的NO3--N吸收速率高于其Urea-N吸收速率, 这与本文海链藻的吸收特征相似。然而鞭毛类(包括甲藻)浮游藻类以及蓝藻等相比其他氮源更喜欢利用还原形态的NH4+-N(Donald et al, 2013; Glibert et al, 2014b), 这可能与浮游藻类细胞的个体差异有关。
2.3.2 同一藻种不同培养时间氮素吸收速率差异将浮游藻类氮素吸收速率按藻密度归一化后由图 6可知, 培养时间为1d时, 盐水隐藻以Urea-N吸收为主, 其他4种藻均以NH4+-N吸收为主, 培养时间为4d时, 铜绿微囊藻由以NH4+-N吸收为主逐渐转变为以NO3--N吸收为主, 而其他藻种不变。当培养时间分别为1d和4d时, 铜绿微囊藻氮素吸收速率显著下降, Urea-N吸收速率几乎为0。海链藻NH4+-N和Urea-N吸收速率下降, NO3--N吸收速率却有所升高。盐水隐藻三种形态氮素吸收速率均明显下降, 但仍以Urea-N吸收为主。培养时间为4d时, 卡德藻三种形态氮吸收速率均相较于培养时间为1d时升高。剧毒卡尔藻与盐水隐藻三种形态氮的吸收速率表现出与铜绿微囊藻相似规律, 均随培养时间增长而降低。
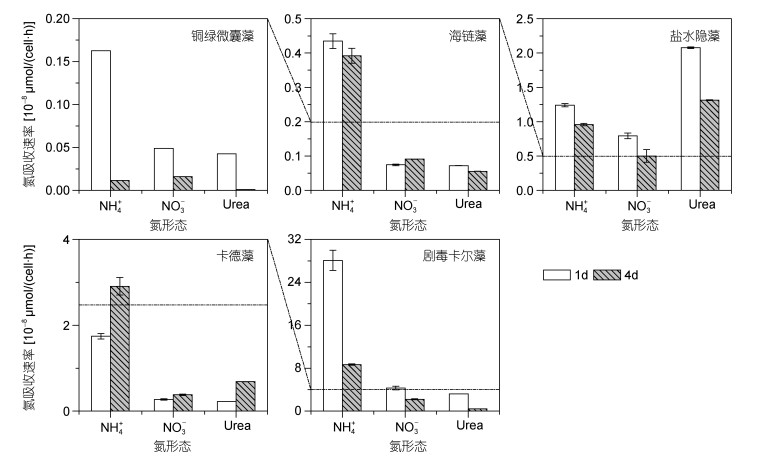 |
| 图 6 不同藻种的氮吸收特性 Fig. 6 Characteristics of nitrogen uptake of different algae species |
浮游藻类生长周期是造成其氮吸收生长速率变化的一个关键因素。当浮游藻类处于对数生长期时, 其生长速率最快, 生长所需能量最多, 其氮吸收速率也会达到最高。刘金鑫等(2017)将蓝藻(Microcystis aeruginosa)的生长期划分为0—3d为延缓期, 4d进入指数生长期, 4d生长速率应高于1d, 其生长所需的营养物质更多, 氮吸收速率则应更快, 这与我们所得的结论有所偏差, 考虑是由于铜绿微囊藻培养前期消耗了大量的营养盐, 4d时营养盐浓度较低, 限制了其对氮素的吸收。海链藻在1—4d处于指数生长期, 维持在一个较高的生长速率水平, 而4d后进入稳定期, 生长基本停止(魏鹏骥等, 2018), 因此, 其1d与4d时的氮吸收速率变化并不明显。当浮游藻类处于指数生长期时, 对于营养盐的高需求导致其对氮素吸收速率处于较高水平, 可以通过控制营养盐的输入, 使得浮游藻类对氮素的利用最小化。
天然水体中, 由于人类活动例如农业、工业活动很大程度上改变了水体中营养盐化学计量学, 因此导致暴发不同种类的水华。N:P化学计量变化会对浮游藻类生长和水华优势种形成造成影响, 当水环境中N:P降低, 浮游藻类优势种会转变为固氮蓝藻(Vrede et al, 2009)。同时氮素形态的变化也会影响浮游藻类生长和水华优势种形成, 当NO3--N浓度较高的水体, 硅藻为优势藻种, 而NH4+-N含量较高的水体中, 鞭毛藻以及蓝藻成为了优势藻种(Mousseau et al, 2001; Heil et al, 2007)。本论文研究也同样发现对于海洋或者湖泊等水体, 氮素形态变化及不同形态氮素化学计量比例对于赤潮或者水华优势种的形成具有一定的影响, 通过氮素吸收速率变化以及后续的代谢过程差异影响浮游植物的生长和竞争, 最后作用于水生态系统浮游植物群落结构。因此, 开展生态化学计量学研究尤其是氮素形态化学计量特征研究, 明确水体营养盐化学计量特征对水华优势种形成的影响效应, 是开展水域生态系统富营养化发生机制探讨和污染防治的重要理论基础。
3 结论(1) 浮游藻类对氮的吸收在1h左右吸收速率最快, 为快速吸收, 当吸收时间延长, 氮吸收速率会随浓度下降而减小。
(2) 浮游藻类以NH4+-N吸收为主, 相对偏好系数表明浮游藻类对Urea-N偏好性最高, 对NO3--N偏好性最低。
(3) 不同浮游藻类的氮素吸收速率差异明显。剧毒卡尔藻对三种形态氮的吸收速率均为最高, 铜绿微囊藻对三种形态氮素的吸收速率均最低。
刘金鑫, 谢邵文, 杨芬, 等. 2017. 不同生长期和磷浓度下砷酸盐对铜绿微囊藻生长及砷吸收的影响. 环境科学学报, 37(6): 2061-2068 |
韩晓霞, 朱广伟, 许海, 等. 2014. 太湖夏季水体中尿素的来源探析. 环境科学, 35(7): 2547-2556 |
魏鹏骥, 姜玥璐. 2018. Cd2+、Cu2+与Zn2+对威氏海链藻生长生理和油脂积累的影响. 中国海洋大学学报, 48(7): 47-54 |
Adolf J E, Bachvaroff T, Place A R, 2008. Can cryptophyte abundance trigger toxic Karlodinium veneficum blooms in eutrophic estuaries?. Harmful Algae, 8(1): 119-128 DOI:10.1016/j.hal.2008.08.003 |
Adolf J E, Bachvaroff T R, Place A R, 2009. Environmental modulation of karlotoxin levels in strains of the cosmopolitan dinoflagellate, Karlodinium veneficum (Dinophyceae). Journal of Phycology, 45(1): 176-192 DOI:10.1111/jpy.2009.45.issue-1 |
Baer S E, Connelly T L, Bronk D A, 2015. Nitrogen uptake dynamics in landfast sea ice of the Chukchi Sea. Polar Biology, 38(6): 781-797 DOI:10.1007/s00300-014-1639-y |
Bogard M J, Donald D B, Finlay K et al, 2012. Distribution and regulation of urea in lakes of central North America. Freshwater Biology, 57(6): 1277-1292 DOI:10.1111/fwb.2012.57.issue-6 |
Bronk D A, Killberg-Thoreson L, Sipler R E et al, 2014. Nitrogen uptake and regeneration (ammonium regeneration, nitrification and photoproduction) in waters of the West Florida Shelf prone to blooms of Karenia brevis. Harmful Algae, 38: 50-62 DOI:10.1016/j.hal.2014.04.007 |
Cochlan W P, Herndon J, Kudela R M, 2008. Inorganic and organic nitrogen uptake by the toxigenic diatom Pseudo-nitzschia australis (Bacillariophyceae). Harmful Algae, 8(1): 111-118 DOI:10.1016/j.hal.2008.08.008 |
de Figueiredo D R, Azeiteiro U M, Esteves S M et al, 2004. Microcystin-producing blooms-a serious global public health issue. Ecotoxicology and Environmental Safety, 59(2): 151-163 DOI:10.1016/j.ecoenv.2004.04.006 |
Deeds J R, Reimschuessel R, Place A R, 2006. Histopathological effects in fish exposed to the toxins from Karlodinium micrum. Journal of Aquatic Animal Health, 18(2): 136-148 DOI:10.1577/H05-027.1 |
Dodds W K, Smith V H, 2016. Nitrogen, phosphorus, and eutrophication in streams. Inland Waters, 6(2): 155-164 DOI:10.5268/IW |
Donald D B, Bogard M J, Finlay K et al, 2013. Phytoplankton-specific response to enrichment of phosphorus-rich surface waters with ammonium, nitrate, and urea. PLoS One, 8(1): e53277 DOI:10.1371/journal.pone.0053277 |
Dugdale R C, Goering J J, 1967. Uptake of new and regenerated forms of nitrogen in primary productivity. Limnology and Oceanography, 12(2): 196-206 DOI:10.4319/lo.1967.12.2.0196 |
Glibert P M, Alexander J, Meritt D W et al, 2007. Harmful algae pose additional challenges for oyster restoration:impacts of the harmful algae Karlodinium veneficum and Prorocentrum minimum on early life stages of the oysters Crassostrea virginica and Crassostrea ariakensis. Journal of Shellfish Research, 26(4): 919-925 DOI:10.2983/0730-8000(2007)26[919:HAPACF]2.0.CO;2 |
Glibert P M, Goldman J C, 1981. Rapid ammonium uptake by marine phytoplankton. Marine Biology Letters, 2: 25-31 |
Glibert P M, Harrison J, Heil C et al, 2006. Escalating worldwide use of urea - a global change contributing to coastal eutrophication. Biogeochemistry, 77(3): 441-463 DOI:10.1007/s10533-005-3070-5 |
Glibert P M, Hinkle D C, Sturgis B et al, 2014a. Eutrophication of a maryland/virginia coastal lagoon:a tipping point, ecosystem changes, and potential causes. Estuaries and Coasts, 37(S1): 128-146 DOI:10.1007/s12237-013-9630-3 |
Glibert P M, Lipschultz F, McCarthy J J et al, 1982. Isotope dilution models of uptake and remineralization of ammonium by marine plankton. Limnology and Oceanography, 27(4): 639-650 DOI:10.4319/lo.1982.27.4.0639 |
Glibert P M, Wilkerson F P, Dugdale R C et al, 2014b. Phytoplankton communities from San Francisco Bay Delta respond differently to oxidized and reduced nitrogen substrates-even under conditions that would otherwise suggest nitrogen sufficiency. Frontiers in Marine Science, 1: 17 |
Glibert P M, Wilkerson F P, Dugdale R C et al, 2016. Pluses and minuses of ammonium and nitrate uptake and assimilation by phytoplankton and implications for productivity and community composition, with emphasis on nitrogen-enriched conditions. Limnology and Oceanography, 61(1): 165-197 DOI:10.1002/lno.10203 |
Heil C A, Revilla M, Glibert P M et al, 2007. Nutrient quality drives differential phytoplankton community composition on the southwest Florida Shelf. Limnology and Oceanography, 52(3): 1067-1078 DOI:10.4319/lo.2007.52.3.1067 |
Kanda J, Saino T, Hattori A, 1985. Nitrogen uptake by natural populations of phytoplankton and primary production in the Pacific Ocean:regional variability of uptake capacity. Limnology and Oceanography, 30(5): 987-999 DOI:10.4319/lo.1985.30.5.0987 |
Kang Y, Kudela R M, Gobler C J, 2017. Quantifying nitrogen assimilation rates of individual phytoplankton species and plankton groups during harmful algal blooms via sorting flow cytometry. Limnology and Oceanography:Methods, 15(8): 706-721 DOI:10.1002/lom3.10193 |
Lin C H, Lyubchich V, Glibert P M, 2018. Time series models of decadal trends in the harmful algal species Karlodinium veneficum in Chesapeake Bay. Harmful Algae, 73: 110-118 DOI:10.1016/j.hal.2018.02.002 |
MacTavish R M, Cohen R A, 2017. Water column ammonium concentration and salinity influence nitrogen uptake and growth of Spartina alterniflora. Journal of Experimental Marine Biology and Ecology, 488: 52-59 DOI:10.1016/j.jembe.2016.12.009 |
McCarthy J J, Taylor W R, Taft J L, 1977. Nitrogenous nutrition of the plankton in the Chesapeake Bay. 1. Nutrient availability and phytoplankton preferences. Limnology and Oceanography, 22(6): 996-1011 |
Mousseau L, Klein B, Legendre L et al, 2001. Assessing the trophic pathways that dominate planktonic food webs:an approach based on simple ecological ratios. Journal of Plankton Research, 23(8): 765-777 DOI:10.1093/plankt/23.8.765 |
Mulholland M R, Morse R, Egerton T et al, 2018. Blooms of dinoflagellate mixotrophs in a lower Chesapeake Bay tributary:carbon and nitrogen uptake over diurnal, seasonal, and interannual timescales. Estuaries and Coasts, 41(6): 1744-1765 DOI:10.1007/s12237-018-0388-5 |
Paerl H W, Otten T G, 2013. Harmful cyanobacterial blooms:causes, consequences, and controls. Microbial Ecology, 65(4): 995-1010 DOI:10.1007/s00248-012-0159-y |
Paparazzo F E, Williams G N, Pisoni J P et al, 2017. Linking phytoplankton nitrogen uptake, macronutrients and chlorophyll-a in SW Atlantic waters:the case of the Gulf of San Jorge, Argentina. Journal of Marine Systems, 172: 43-50 DOI:10.1016/j.jmarsys.2017.02.007 |
Place A R, Bowers H A, Bachvaroff T R et al, 2012. Karlodinium veneficum-the little dinoflagellate with a big bite. Harmful Algae, 14: 179-195 DOI:10.1016/j.hal.2011.10.021 |
Schindler D W, Carpenter S R, Chapra S C et al, 2016. Reducing phosphorus to curb lake eutrophication is a success. Environmental Science & Technology, 50(17): 8923-8929 |
Semcheski M R, Egerton T A, Marshall H G, 2016. Composition and diversity of intertidal microphytobenthos and phytoplankton in Chesapeake Bay. Wetlands, 36(3): 483-496 DOI:10.1007/s13157-016-0756-5 |
Siuda W, Chróst R J, 2006. Urea and ureolytic activity in lakes of different trophic status. Polish Journal of Microbiology, 55(3): 221-225 |
Solomon C M, Collier J L, Berg G M et al, 2010. Role of urea in microbial metabolism in aquatic systems:a biochemical and molecular review. Aquatic Microbial Ecology, 59(1): 67-88 |
Tank J L, Martí E, Riis T et al, 2018. Partitioning assimilatory nitrogen uptake in streams:an analysis of stable isotope tracer additions across continents. Ecological Monographs, 88(1): 120-138 DOI:10.1002/ecm.1280 |
Tripathy S C, Patra S, Vardhan K V et al, 2018. Nitrogen uptake by phytoplankton in surface waters of the Indian sector of Southern Ocean during austral summer. Frontiers of earth science, 12(1): 52-62 DOI:10.1007/s11707-017-0649-9 |
Vrede T, Ballantyne A, Mille-Lindblom C et al, 2009. Effects of N:P loading ratios on phytoplankton community composition, primary production and N fixation in a eutrophic lake. Freshwater Biology, 54(2): 331-344 DOI:10.1111/fwb.2009.54.issue-2 |
Wang H J, Wang H Z, 2009. Mitigation of lake eutrophication:loosen nitrogen control and focus on phosphorus abatement. Progress in Natural Science, 19(10): 1445-1451 DOI:10.1016/j.pnsc.2009.03.009 |
Wang X Y, Sun M J, Xie M J et al, 2013. Differences in microcystin production and genotype composition among Microcystis colonies of different sizes in Lake Taihu. Water Research, 47(15): 5659-5669 DOI:10.1016/j.watres.2013.06.040 |
Weisse T, Gr schl B, Bergkemper V, 2016. Phytoplankton response to short-term temperature and nutrient changes. Limnologica, 59: 78-89 DOI:10.1016/j.limno.2016.05.002 |
 2019, Vol. 50
2019, Vol. 50


