
中国海洋湖沼学会主办。
文章信息
- 崔莹, 吴旭干, 赵峰, 李嘉尧, 连一霖, 王福强. 2019.
- CUI Ying, WU Xu-Gan, ZHAO Feng, LI Jia-Yao, LIAN Yi-Lin, WANG Fu-Qiang. 2019.
- 基于碳、氮稳定同位素分析中华绒螯蟹(Eriocheir sinensis)幼蟹溯河洄游期食物来源变化
- DIET SOURCES OF JUVENILE CHINESE MITTEN CRAB (ERIOCHEIR SINENSIS) DURING UPSTREAM MIGRATION INDICATED BY THE CARBON AND NITROGEN STABLE ISOTOPES
- 海洋与湖沼, 50(4): 822-829
- Oceanologia et Limnologia Sinica, 50(4): 822-829.
- http://dx.doi.org/10.11693/hyhz20181100261
文章历史
-
收稿日期:2018-11-01
收修改稿日期:2019-02-22
2. 上海海洋大学 水产与生命学院 上海 201306;
3. 中国水产科学研究院东海水产研究所 上海 200090
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. East China Sea Fishery Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China
中华绒螯蟹(Eriocheir sinensis)简称河蟹, 甲壳纲、十足目、方蟹科、绒螯蟹属, 是我国重要的渔业捕捞对象和水产养殖品种, 具有较高的经济价值。长江口水域是中华绒螯蟹适宜的产卵场和育幼场, 野生成蟹及蟹苗资源捕捞一度成为长江中下游地区的重要产业(李长松等, 1997; 徐东坡等, 2015)。80年代后期, 由于人类过度捕捞以及栖息地环境变化等因素导致野生中华绒螯蟹资源急剧下降, 且年度变化较大(俞连福等, 1999; 谷孝鸿等, 2001)。另一方面, 由于对幼体阶段的营养需求了解尚有限, 目前河蟹养殖产业仍缺乏适宜的幼体阶段的饲料配方(成永旭等, 2000)。对野生中华绒螯蟹幼体的食物组成进行详细研究, 可为研究幼体阶段的营养需求以及野生资源变动的控制因素提供依据, 对中华绒螯蟹野生资源的保护和修复管理, 以及养殖业的健康发展至关重要, 具有很强的现实意义。
中华绒螯蟹的生活史较为复杂, 成熟的个体在河口区咸淡水中繁殖, 幼体孵化, 发育至大眼幼体后集群, 上溯至淡水中继续生长发育, 直至成体(王武等, 2007)。每年10—12月是亲蟹向长江口产卵洄游时期, 5—6月长江口出现大眼幼体汛期, 12—1月又形成幼蟹溯河洄游的汛期(施炜纲等, 2002)。食物来源作为中华绒螯蟹的营养支撑, 是影响其野生资源品质及存活量的重要因素(成永旭等, 2000)。然而, 关于幼蟹溯河生态学的研究较少, 有关河蟹摄食生态的报道均采用传统的胃含物观察法(谈奇坤等, 1984; 金刚等, 2003)。无脊椎动物的胃含物分析较为困难, 仔蟹、幼蟹的胃含物中常含有较多难以分辨的食团混合物, 胃内食物形态也会发生巨大改变, 且不同食物之间的消化能力不同, 较难消化的组分留在胃内的机率较大, 这些因素均会导致食物组成的误判(金刚等, 2003)。因此, 单从出现频次不能准确判断某一食物对河蟹的贡献, 需要更为精确的手段对难分辨的食源进行识别。稳定同位素是近几年发展较为成熟的技术手段, 可用以追踪食物网碳的来源及传递信息, 反映的是摄食者较长时间尺度的食源信息(Peterson et al, 1987; Peterson, 1999; de Abreu et al, 2017), 可以弥补传统胃含物分析方法的不足。诸多研究表明, 生境对稳定同位素的影响远大于生物种类以及个体大小对其的影响(Ciancio et al, 2008)。如果栖息地之间同位素有显著差异, 且洄游动物在栖息地生活的时间足够长, 就可用稳定同位素识别洄游过程中食源的变化(Fry, 1981; Bardonnet et al, 2005; Hoffman, 2016)。中华绒螯蟹幼体从河口咸淡水交汇处上溯至上游淡水河段, 栖息地的碳、氮稳定同位素特征存在一定变化。但中华绒螯蟹属于杂食性无脊椎动物, 摄食有很高的随机性, 食源繁杂(金刚等, 2003), 碳、氮稳定同位素呈现的是综合各种碳源的特征, 加之洄游过程耦合季节、水文等条件的变化, 都可能对同位素的示踪引起干扰。因此, 利用碳、氮稳定同位素识别中华绒螯蟹溯河洄游过程中食物来源的变化具有可行性, 但仍存在挑战。
本文拟利用碳、氮稳定同位素对长江野生中华绒螯蟹溯河洄游期的食物来源进行识别, 研究结果对了解野生中华绒螯蟹溯河洄游过程中的营养生态学具有重要意义, 可为中华绒螯蟹野生资源的保护利用以及人工养殖过程中的饵料选择提供科学依据。
1 材料与方法 1.1 样品采集根据中华绒螯蟹的生活史及历史调查资料, 在幼体溯河洄游的路线上, 设置3个采样区域(长江口水域、长江靖江段水域、长江镇江段水域), 见图 1。长江口水域面积较大, 水文变化复杂, 细分3个站位(S-E1、S-E2、S-E3)采集潜在食源样品。根据当年苗汛时间, 确定各发育时期幼体样品的采集时间。于2017年5月在长江口水域采用定置张网的方式采集中华绒螯蟹大眼幼体、早期仔蟹样品, 2017年8月长江口S-E1站(太仓段)附近采用地笼网的方式采集幼蟹样品, 2018年3月、4月分别于长江靖江段(S-JJ)和镇江段(S-ZJ)水域采用走航底拖网和地笼网的方式采集幼蟹样品。依据文献中河蟹胃含物的分析结果(谈奇坤等, 1984; 金刚等, 2003), 初步确定中华绒螯蟹的潜在食源(如悬浮颗粒物、浮游动物、底栖藻类、底栖动物、大型植物等), 在采集河蟹样品时一并采集。悬浮颗粒物样品的采集, 用桶打表层水, 先过100μm的筛网, 去掉浮游动物之后, 过滤至预先灼烧(500℃, 5h)的GFF膜(0.7μm, 47mm)上。浮游动物采集用13号浮游动物网, 收集多次垂直拖网的滤液, 去掉大的垃圾和泥沙, 将相对较纯的浮游动物过滤至预先灼烧过的GFF膜上。用刮刀刮取沉积物表层附着的底栖藻类。挖取沉积物至40目网筛, 不断清洗, 镊子收集纯的底栖动物, 分类保存。手工采集大型植物样品, 洗去浮泥, 分类保存。
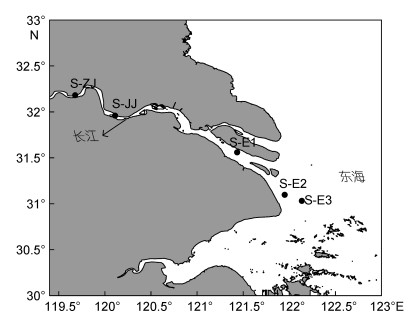 |
| 图 1 样品采集站位分布图 Fig. 1 Sampling stations |
各发育时期中华绒螯蟹幼体样品的信息见表 1。随机挑选部分幼蟹样品进行胃含物定性分析(显微观察)。靖江、镇江采集的浮游动物样品, 进行浮游动物种类鉴定。
| 样品名称 | 采集时间(年/月) | 体重(mg) | 壳宽(mm) | 样品数量(个) |
| 大眼幼体 | 2017/05 | 3.12—4.85 | 1.0—1.5 | 50 |
| 早期仔蟹 | 2017/05 | 2.81—7.61 | 2.0—3.1 | 50 |
| 长江口幼蟹 | 2017/08 | 220—380 | 5.0—9.0 | 30 |
| 靖江幼蟹 | 2018/03 | 1320—17010 | 17.0—33.0 | 195 |
| 镇江幼蟹 | 2018/04 | 640—25520 | 10.0—37.0 | 180 |
大眼幼体和早期仔蟹取全样, 幼蟹样品解剖刮取肌肉组织。大眼幼体和早期仔蟹样品个体较小, 采用多个体混合样本, 小规格的幼蟹(< 1g)也采用多个体混合样品。贝类、螺类等样品去掉硬壳, 刮取肌肉, 多毛类取全样, 大型植物取茎叶。处理完毕的样品经冷冻干燥后研磨, 过80目筛, 备用。碳、氮稳定同位素(δ13C、δ15N)的测定采用稳定同位素质谱计(EA-IR-MS, 美国, 赛默飞公司), 所用标准物质分别为美洲拟箭石(PDB)和纯化大气N2。动物肌肉、植物样品无须处理, 直接包样测试δ13C, 其他样品均预先去除无机碳后(悬浮颗粒物样品:酸熏; 沉积物、大眼幼体、仔蟹、浮游动物:滴加稀盐酸), 再包样测试。所有样品均直接包样测试δ15N。碳、氮稳定同位素的测试精密度均为±0.1‰。
不同站位的幼蟹样品δ13C、δ15N值的差异性分析(One-way ANOVA)以及相同站位不同规格的幼蟹样品δ13C、δ15N值的差异性分析(One-way ANOVA), 均通过IBM SPSS Statistic 23完成。
2 结果与分析 2.1 中华绒螯蟹洄游栖息地食源样品的碳、氮稳定同位素特征三个采样区域食源样品的碳、氮稳定同位素总体分布特征见图 2。δ13C的范围在-30.7‰— -18.6‰, 呈现陆源和海源的明显差异。δ15N的范围在1.1‰— 9.6‰, 表层沉积物最低, 底栖动物较高(11.3‰— 14.3‰)。不同区域之间各食源样品的碳、氮稳定同位素变化见图 3。长江口南支由上游向下游三个站位的悬浮颗粒物样品, δ13C值由-26.3‰增加至-24.5‰, δ15N值由5.6‰增至6.6‰。靖江悬浮颗粒物的δ13C值为-27.4‰±0.1‰, δ15N值为7.6‰± 1.2‰。镇江悬浮颗粒物的δ13C值与靖江接近, δ15N较低(图 3a)。浮游动物的δ13C值以靖江为最低(-29.7‰±0.1‰), 镇江次之。长江口上游站位(S-E1)采集的浮游动物δ13C值相对较低(-27.9‰±0.7‰), 位于近海端的S-E3站位的δ13C值较高(-22.0‰± 0.5‰)(图 3b)。
 |
| 图 2 中华绒螯蟹洄游期间食物来源的碳、氮稳定同位素特征 Fig. 2 Stable carbon and nitrogen isotope patterns of the diet sources of Chinese mitten crab during its migration 注: JJ-PH:靖江悬浮颗粒物; JJ-Z:靖江浮游动物; JJ-S:靖江表层沉积物; ZJ-PH:镇江悬浮颗粒物; ZJ-Z:镇江浮游动物; ZJ-SB:镇江底栖微藻; ZJ-W:镇江多毛类(沙蚕); ZJ-SN:镇江螺; ZJ-PL1:镇江禾本科植物(虉草); ZJ-PL2:苜蓿属植物; ZJ-S1:镇江江滩沉积物; ZJ-S2:表层沉积物; CJK-PH:长江口悬浮颗粒物; CJK-BI:长江口双壳类(河蜆); CJK-W:长江口寡毛类; CJK-S:长江口沉积物; CJK-Z1:长江口S-E1站浮游动物; CJK-Z2:长江口S-E3站浮游动物; CJK-SH:长江口安氏白虾; CJK-PL1:长江口金鱼藻; CJK-PL2:长江口菹草 |
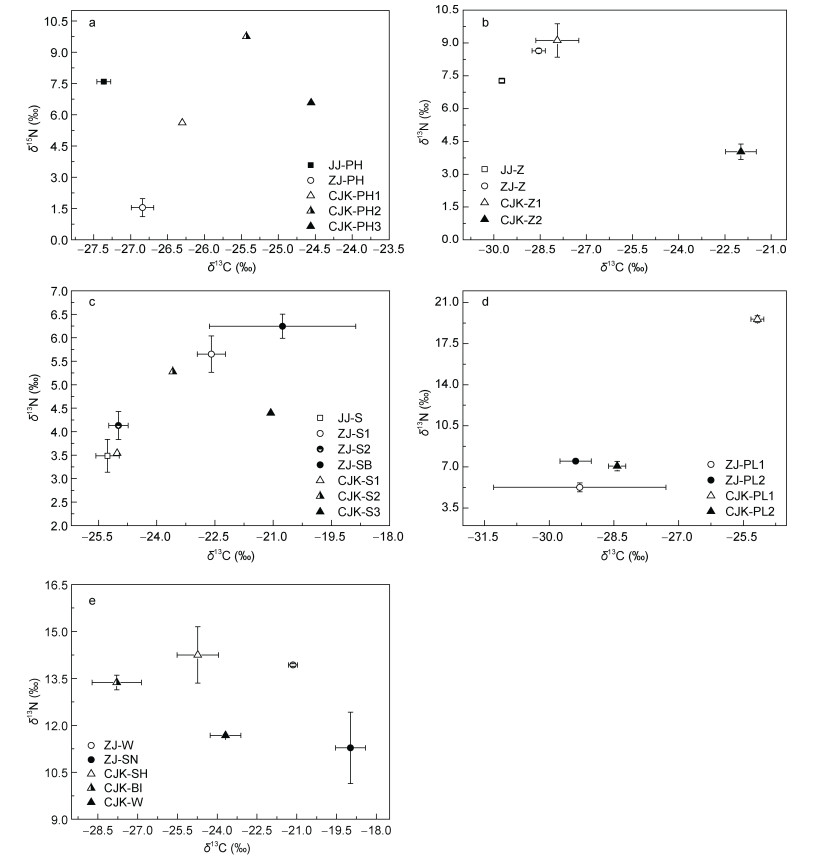 |
| 图 3 不同采样区域各食源样品的碳、氮稳定同位素变化 Fig. 3 Changes in the stable carbon and nitrogen isotopes of diet sources in the sampling stations 注: JJ-PH:靖江悬浮颗粒物; ZJ-PH:镇江悬浮颗粒物; CJK-PH1:长江口S-E1站悬浮颗粒物; CJK-PH2:长江口S-E2站悬浮颗粒物; CJK-PH3:长江口S-E3站悬浮颗粒物; JJ-Z:靖江浮游动物; ZJ-Z:镇江浮游动物; CJK-Z1:长江口S-E1站浮游动物; CJK-Z2:长江口S-E3站浮游动物; JJ-S:靖江表层沉积物; ZJ-S1:镇江江滩沉积物; ZJ-S2:镇江表层沉积物; ZJ-SB:镇江底栖微藻; CJK-S1:长江口S-E1站沉积物; CJK-S2:长江口S-E2站沉积物; CJK-S3:长江口S-E3站沉积物; ZJ-PL1:镇江禾本科植物(虉草); ZJ-PL2:镇江苜蓿属植物; CJK-PL1:长江口金鱼藻; CJK-PL2:长江口菹草; ZJ-W:镇江多毛类(沙蚕); ZJ-SN:镇江螺; CJK-SH:长江口安氏白虾; CJK-BI:长江口双壳类(河蜆); CJK-W:长江口寡毛类 |
表层沉积物的δ13C值仍以靖江为最负(-25.3‰±0.3‰), 镇江站潮滩底栖微藻的δ13C值(-20.8‰±1.9‰)较高, 潮滩沉积物的δ13C值相对较正(-22.6‰±0.4‰), 水下表层沉积物偏负(-25.0‰± 0.3‰)。靖江和镇江表层沉积物的δ15N值在3.5‰— 5.7‰。长江口南支三个沿江站点, 从上游至下游, 表层沉积物的δ13C值逐渐偏正, 由-25.0‰增至-20.9‰, δ15N的由3.5‰±0.4‰增至5.7‰±0.4‰(图 3c), 这一变化规律与悬浮颗粒物相似。
镇江站禾本科植物(虉草Phalaris arundinacea) δ13C值(-29.3‰±2.0‰)较低, 呈现典型的C3植物特征, 另一种苜蓿属(Medicago)植物δ13C与之相近。长江口两种大型植物差异相对较大, 金鱼藻(Ceratophyllum demersum)的δ13C为-25.2‰±0.2‰, δ15N高至9.6‰±0.3‰, 菹草(Potamogeton crispus) δ13C为-28.4‰±0.2‰, δ15N为7.1‰±0.4‰(图 3d)。于镇江江段和长江口水域采集5种底栖动物, 分别为多毛类(疣吻沙蚕Tylorrhynchus heterochaetus)、中华拟蟹守螺(Cerithidea sinensis)、双壳类(河蜆Corbicula fluminea)、寡毛类(苏式尾鳃蚓Branchiura sowerbyi)以及安氏白虾(Exopalaemon annandalei)。底栖动物的δ13C呈现明显差异, 镇江的多毛类和螺δ13C较高, 分别为-21.1‰±0.2‰和-19.0‰±0.6‰。长江口采集的河蜆δ13C最低, 为-27.8‰±0.9‰, 安氏白虾稍高, 为-24.7‰±0.8‰, 寡毛类最高(-23.7‰±0.6‰)(图 3e)。
2.2 中华绒螯蟹溯河洄游期碳、氮稳定同位素变化特征中华绒螯蟹幼体溯河洄游期的稳定同位素变化见图 4。大眼幼体的δ13C、δ15N值分别为-20.6‰± 0.09‰、3.0‰±0.2‰, 早期仔蟹的δ13C值与大眼幼体相近(-20.7‰±0.4‰), δ15N值稍有升高(3.5‰±0.1‰)。随着幼体的沿江而上, 至太仓段(S-E1站), 幼蟹(< 1g)的δ13C值降至-22.4‰±0.4‰, δ15N值增加至6.7‰± 0.2‰。至靖江江段, 幼蟹群体的δ13C值降至-24.7‰± 0.8‰、δ15N值增至11.5‰±2.1‰。镇江江段的幼蟹群体δ13C值已降至-25.2‰±0.9‰, δ15N值增至11.8‰±2.3‰。总体来看, 从长江口的大眼幼体, 至镇江江段的幼蟹, δ13C均值由-20.6‰降至-25.7‰, δ15N均值则由3.0‰增至11.8‰。统计分析表明, 不同生长时期的群体δ13C和δ15N值均有显著差异(单向方差分析, P < 0.05)。两两比较来看, 早期仔蟹与大眼幼体的δ13C和δ15N均值无显著差异(P > 0.05), 靖江和镇江江段群体的δ13C值有显著差异(T检验, t=2.247, P=0.029), δ15N值无显著差异(T检验, t= -0.419, P=0.677)。同一站位样品无论规格大小δ13C、δ15N值均无显著差异(单向方差分析, P > 0.05), 且体重与δ13C、δ15N值均无显著相关关系(双变量相关分析, P > 0.05)。
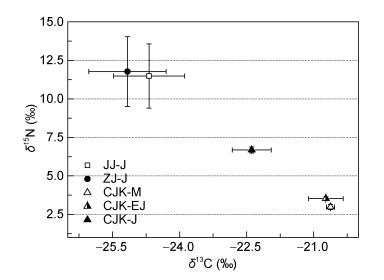 |
| 图 4 中华绒螯蟹溯河洄游期碳、氮稳定同位素变化 Fig. 4 Stable carbon and nitrogen isotope patterns of Chinses mitten crab during its upstream migration 注: CJK-M:长江口大眼幼体; CJK-EJ:长江口早期仔蟹; CJK-J:长江口(太仓段)幼蟹; JJ-J:靖江幼蟹; ZJ-J:镇江幼蟹 |
浮游动物样品种类鉴定结果表明, 靖江和镇江江段的浮游动物中桡足类占绝对优势, 以剑水蚤和哲水蚤为主, 含少量枝角类。幼蟹胃含物的显微观察发现, 胃内含物主要有草屑、白色粒状物及黏液团。多数个体胃内以绿色或者黑色草屑为主, 少数含有大量白色有机碎屑。
3 讨论 3.1 中华绒螯蟹沿江栖息地同位素分布特征中华绒螯蟹的幼体在长江口咸淡水交汇的水域孵化, 蚤状幼体在口外的海水中索饵, 发育至大眼幼体时开始集群, 往上游淡水江段迁徙。长江口水域盐度梯度明显, S-E3站涨潮时表层水盐度达10.41, S-E2站为3.01。S-E1站盐度只有0.14, 已呈现淡水特征。靖江段和镇江段表层水盐度均呈现淡水特征, 分别为0.18和0.14。温带海洋浮游植物δ13C一般在-24‰— -18‰范围, 均值-23.2‰ (Fry, 1981; 蔡德陵等, 1999), 陆地C3植物δ13C在-20‰— -35‰, 均值为-27‰(崔莹, 2012), 而陆地大型植物是河流陆源物质的重要来源(Allan et al, 2017)。因此, 普遍来讲, 海源碳δ13C值相对较正, 陆源碳δ13C值相对较负(Bardonnet et al, 2005)。河流悬浮颗粒物组成复杂, 既有内源的浮游生物及碎屑物, 又有外源的大型植物碎屑以及河岸冲刷侵蚀形成的泥沙等, 其δ13C值受到水体浮游植物生长与陆源输入变化的影响, 呈现一定的变化规律, 陆源输入比例较高时, δ13C值较低, 浮游生物繁盛时, δ13C值升高(吴莹等, 2002)。本研究中, 悬浮颗粒物、浮游动物以及表层沉积物的δ13C值均呈现上游低, 下游高的趋势。长江口水域口门附近由于潮汐的作用, 有一定的海源物质汇入, δ13C值相对偏正, 至太仓段受淡水影响增大, 陆源输入物质的特征已经有所表现, δ13C值降低, 至镇江、靖江江段, 则完全以陆源输入为主, δ13C值最负。浮游动物作为初级消费者, δ13C值呈现与悬浮颗粒物相似的特征。表层沉积物多为悬浮颗粒物的沉积, 两者受区域大背景环境控制, 局部环境碳源(红树林、潮滩植物和底栖微藻)的影响也不容忽视(France, 1998; 余婕等, 2008)。例如, 红树林表层沉积物δ13C值呈现与红树林相似的特征, δ13C值较负(崔莹, 2012)。底栖微藻通常具有较高的δ13C值(蔡德陵等, 1999; Kang et al, 2006), 受之影响的悬浮颗粒物和表层沉积物的δ13C值也会相应增高(Kang et al, 2006)。因此, 在底栖微藻繁盛的镇江江滩, 潮滩表层沉积物的δ13C值比水体表层沉积物δ13C值高。
悬浮颗粒物的δ15N值未呈现较明显的分布规律, 长江口和靖江站相差不大, 镇江较低。δ15N保守性差, 除了陆源、海源混合影响之外, 还易受到生物地球化学过程的改造(吴莹等, 2002; 于海燕等, 2014)。长江受人类活动影响严重, 沿江排放的废水组成复杂, 不同来源的废水δ15N值差异明显, 如含有人畜排泄物的污水常具有较高的δ15N值(10‰—22‰), 而含高浓度农业化肥的污水则δ15N较低(-3‰—3‰)(Kendall et al, 2007)。镇江站位岸边有较多的农业生产活动, 农业化肥的使用会显著降低河流水体的δ15N值(Peterson, 1999), 镇江悬浮颗粒物的低δ15N值很可能受到岸边农业废水的影响。因此, 在复杂的水文条件下, 长江悬浮颗粒物的δ15N值受水体环境、生物地球化学过程及人类活动等多种因素影响, 变化较为复杂。
底栖动物的δ13C、δ15N值与其他文献报道的结果相似(俞雅文等, 2017), 均未呈现规律性的区域变化趋势。长江口双壳类(河蜆)的δ13C值最低, 与悬浮颗粒物的δ13C值相近, 体现了双壳类的滤食性。镇江段中心江滩采集的螺和多毛类的δ13C值则较高, 与底栖微藻的δ13C值相近, 体现了底栖微藻的贡献。长江口S-E1站采集的安氏白虾、寡毛类与该站表层沉积物的δ13C值相近, 与它们的底栖食性特征一致。由此可见, 底栖动物的δ13C值呈现了不同物种间食物来源的差异。
长江口、镇江采集的三种大型植物(虉草、菹草、苜蓿属植物)的δ13C、δ15N值相近, 均呈现典型的C3植物特征, 与文献报道的靖江段的各类大型植物的碳氮稳定同位素特征相似(俞雅文等, 2017)。富营养化与初级生产者的高δ15N值密切相关(Zambrano et al, 2010)。因此, 长江口采集的金鱼藻极高的δ15N值很可能源自其栖息环境中较高的营养盐富集。
3.2 中华绒螯蟹溯河洄游期食物来源变化的总体特征中华绒螯蟹的洄游过程伴随季节、区域以及个体发育的变化, 季节和区域变化的影响可由栖息地悬浮颗粒物的δ13C值变化特征体现。随着个体的生长, 重同位素会在生物体内累积, 这种由于生物生长代谢引起的同位素的累积会使得生物在食源不变的情况下δ13C、δ15N随着体长的增加而增加(Gu et al, 1996), 这一现象在生命周期较长的动物中比较明显。按一般规律, 从大眼幼体到幼蟹, 历时10个月, 体重增加了几千倍, 体内稳定同位素应呈现累积变正的趋势。然而, 中华绒螯蟹的大眼幼体到幼蟹的δ13C值变化却呈现逐渐变轻的趋势, 与生长代谢累积规律相反, 而与水体环境的同位素变化特征一致。镇江段采集的幼蟹体重从小至大相差十几倍, 靖江段采集的幼蟹体重差异更在几十倍, 但同一站位的个体间δ13C值均未呈现显著差异, 并没有随着体重增加而呈现累积的趋势。由此可见, 个体发育对溯河洄游期的中华绒螯蟹的δ13C值影响不大, 幼体的δ13C值体现了当地食物来源的δ13C特征。从大眼幼体到镇江幼蟹, δ15N值增加至4倍, 而镇江悬浮颗粒物的δ15N与长江口水域并没有显著差异。因此, 溯河洄游期中华绒螯蟹幼体δ15N的累积应为个体发育和食性转变、营养级增加的结果。同一站位不同规格样品之间的δ15N虽有差异, 但不显著, 可见生长代谢累积引起的δ15N增加并不高。食性转变和营养级增加才是镇江、靖江幼蟹δ15N显著高于其他站位的原因。
由此, 中华绒螯蟹幼体碳同位素变化总体特征表明大眼幼体和早期仔蟹的同位素特征仍表现为海源特征, 随着幼蟹的不断上溯, 食物来源不断多样化, 河流陆源碳的贡献逐渐增大, 食物来源由海洋源向陆地源转变。期间, 个体不断增大, 食物组成亦发生转换, 营养级显著提高。
3.3 中华绒螯蟹溯河洄游过程中的食物组成中华绒螯蟹大眼幼体的δ13C值与S-E3站采集的浮游动物的δ13C值非常接近, 呈现的仍是海洋食源的特征, 这表明大眼幼体仍以浮游动物为食。早期仔蟹由大眼幼体刚变态为蟹的形态, 其δ13C和δ15N值和大眼幼体无显著差异, 但δ13C值的变化范围较大眼幼体宽, 表明其食源较大眼幼体多样化。而δ13C、δ15N值与大眼幼体没有显著差异, 则可能由于从食源变化到自身同位素特征发生改变存在滞后时间(Maruyama et al, 2001), 如果间隔时间尚短, 新食源的同位素特征还未能体现。至太仓段, 幼蟹(< 1g)已营底栖生活, 其δ13C值则与表层沉积物的δ13C值接近, 位于大型植物和底栖微藻之间。表层沉积物的碳源组成复杂, 动植物残体碎屑、底栖微藻等都是沉积物中有机碳的来源。诸多研究表明蟹类作为大型底栖无脊椎动物, 食物来源与表层沉积物有紧密联系。例如红树林栖息的相手蟹以红树林表层沉积物中的有机成分为主要食物来源(Mazumder et al, 2010)。栖息于潮滩的招潮蟹则以底栖微藻为主要食源(France, 1998)。太仓段幼蟹群体的δ13C群内变化近1‰, 表明碳源较为多样化, 除了底栖微藻、碎屑之外, 还有底栖动物的贡献; δ15N值位于底栖动物和表层沉积物之间, 群内变化不大, 说明同一规格的个体营养级相近。镇江和靖江段的幼蟹, δ13C值与表层沉积物也很接近, 位于大型植物和底栖动物之间。胃含物分析发现幼蟹个体胃内含有大量植物碎屑, 表明在洄游过程中大型植物是其重要食源, 这与以往研究结果一致(谈奇坤等, 1984; 金刚等, 2003)。由于δ15N值较前期的幼体有较明显的增加, 说明营养级有显著提高, 动物性食源的贡献增大。以往的胃含物分析结果发现随着幼蟹个体的增大, 胃内小型虾类、鱼类和水生昆虫出现的频次逐渐增高(谈奇坤等, 1984)。因此, 至靖江、镇江段, 幼蟹的δ13C值可能是底栖藻类、大型植物和底栖动物的同位素特征混合的结果。
碳、氮稳定同位素虽可示踪大致的食源变化, 但如能结合其他标志物(如脂肪酸组成及其单体碳同位素)来进一步的分析, 对每个洄游期的食物来源的识别将更加精细。在此基础上, 利用碳、氮稳定同位素进行定量分析将更加准确。
4 结论中华绒螯蟹洄游过程中δ13C值受个体生长代谢的影响不大, 主要体现的是食物来源的区域性和特异性; δ15N受多种因素影响, 无区域性变化规律, 但仍可分辨营养级的高低。在生境多样化, 食物来源较复杂的河流生态系统中, 碳、氮稳定同位素可以识别中华绒螯蟹洄游过程中的食源变化。中华绒螯蟹大眼幼体仍以海源性浮游动物为食, 随着幼蟹不断上溯, 陆源底栖性食物的贡献逐渐增加, 营养级逐渐升高, 至靖江江段以上, 以大型植物、底栖藻类以及底栖动物为食。
致谢 感谢上海海洋大学季高华老师帮助胃含物分析和浮游动物种类鉴定; 感谢中国水产科学研究院东海水产研究所的赵峰、杨刚、耿智等研究员及多位研究生在采样过程中的协助。
于海燕, 俞志明, 宋秀贤, 等. 2014. 长江口海域悬浮颗粒有机物的稳定氮同位素季节分布与关键生物地球化学过程. 海洋学报, 36(2): 16-22 DOI:10.3969/j.issn.0253-4193.2014.02.002 |
王武, 成永旭, 李应森. 2007. 河蟹的生物学. 水产科技情报, 34(1): 25-28, 50 DOI:10.3969/j.issn.1001-1994.2007.01.010 |
成永旭, 王武, 吴嘉敏, 等. 2000. 虾蟹类幼体的脂类需求及脂类与发育的关系. 中国水产科学, 7(4): 104-107 DOI:10.3321/j.issn:1005-8737.2000.04.024 |
李长松, 俞连福, 戴国梁, 等. 1997. 长江口及其邻近水域中华绒螯蟹大眼幼体和其它蟹类大眼幼体的调查研究. 水产学报, 21(S1): 111-114 |
吴莹, 张经, 张再峰, 等. 2002. 长江悬浮颗粒物中稳定碳、氮同位素的季节分布. 海洋与湖沼, 33(5): 546-552 DOI:10.3321/j.issn:0029-814X.2002.05.012 |
余婕, 刘敏, 许世远, 等. 2008. 长江口潮滩有机质稳定碳同位素时空分布与来源分析. 地理研究, 27(4): 847-854 DOI:10.3321/j.issn:1000-0585.2008.04.013 |
谷孝鸿, 赵福顺. 2001. 长江中华绒螯蟹的资源与养殖现状及其种质保护. 湖泊科学, 13(3): 267-271 DOI:10.3321/j.issn:1003-5427.2001.03.011 |
金刚, 谢平, 李钟杰. 2003. 湖泊放流二龄河蟹的食性. 水生生物学报, 27(2): 140-146 DOI:10.3321/j.issn:1000-3207.2003.02.007 |
俞连福, 李长松, 陈卫忠, 等. 1999. 长江口中华绒螯蟹蟹苗数量分布及其资源保护对策. 水产学报, 23(S1): 34-38 |
俞雅文, 徐东坡, 王媛, 等. 2017. 长江靖江段近岸小型渔业生物碳氮稳定同位素特征分析. 长江流域资源与环境, 26(12): 2091-2098 |
施炜纲, 周昕, 杜晓燕. 2002. 长江中下游中华绒螯蟹亲体资源动态研究. 水生生物学报, 26(6): 641-647 DOI:10.3321/j.issn:1000-3207.2002.06.011 |
徐东坡, 刘凯, 段金荣, 等. 2015. 长江下游中华绒螯蟹成蟹资源现状(2007~2011年). 长江流域资源与环境, 24(1): 39-44 DOI:10.11870/cjlyzyyhj201501006 |
谈奇坤, 董秀英, 温耀群, 等. 1984. 河蟹幼蟹溯江生态的研究. 动物学杂志, 19(6): 19-22 |
崔莹, 2012.基于稳定同位素和脂肪酸组成的中国近海生态系统物质流动研究.上海: 华东师范大学博士学位论文, 15 http://cdmd.cnki.com.cn/Article/CDMD-10269-1012435513.htm
|
蔡德陵, 毛兴华, 韩贻兵. 1999. 13C/12C比值在海洋生态系统营养关系研究中的应用——海洋植物的同位素组成及其影响因素的初步探讨. 海洋与湖沼, 30(3): 306-314 DOI:10.3321/j.issn:0029-814X.1999.03.014 |
Allan J D, Castillo M M编著, 黄钰铃, 纪道斌, 惠二青等译, 2017.河流生态学.北京: 中国水利水电出版社, 71-74
|
Bardonnet A, Riera P, 2005. Feeding of glass eels (Anguilla anguilla) in the course of their estuarine migration:new insights from stable isotope analysis. Estuarine, Coastal and Shelf Science, 63(1-2): 201-209 DOI:10.1016/j.ecss.2004.11.009 |
Ciancio J E, Pascual M A, Botto F et al, 2008. Stable isotope profiles of partially migratory salmonid populations in Atlantic rivers of Patagonia. Journal of Fish Biology, 72(7): 1708-1719 DOI:10.1111/j.1095-8649.2008.01846.x |
de Abreu D C, Paula J, Macia A, 2017. Tropical seascapes as feeding grounds for juvenile penaeid shrimps in southern Mozambique revealed using stable isotopes. Estuarine, Coastal and Shelf Science, 198: 21-28 DOI:10.1016/j.ecss.2017.08.040 |
France R, 1998. Estimating the assimilation of mangrove detritus by fiddler crabs in Laguna Joyuda, Puerto Rico, using dual stable isotopes. Journal of Tropical Ecology, 14(4): 413-425 DOI:10.1017/S0266467498000315 |
Fry B, 1981. Natural stable carbon isotope tag traces Texas shrimp migration. Fishery Bulletin, 79(2): 337-345 |
Gu B, Schelske C L, Hoyer M V, 1996. Stable isotopes of carbon and nitrogen as indicators of diet and trophic structure of the fish community in a shallow hypereutrophic lake. Journal of Fish Biology, 49(6): 1233-1243 DOI:10.1111/jfb.1996.49.issue-6 |
Hoffman J, 2016. Tracing the origins, migrations, and other movements of fishes using stable isotopes. In: Morais P, Daverat F eds. An Introduction to Fish Migration. Boca Raton, FL, USA: CRC Press, 169-196
|
Kang C K, Lee Y W, Choy E J et al, 2006. Microphytobenthos seasonality determines growth and reproduction in intertidal bivalves. Marine Ecology Progress Series, 315: 113-127 DOI:10.3354/meps315113 |
Kendall C, Elliott E M, Wankel S D, 2007. Tracing anthropogenic inputs of nitrogen to ecosystemsIn:Michener R, Lajtha K eds. Stable Isotopes in Ecology and Environmental Science. 2nd ed. Oxford, UK: Blackwell Publishing, 375-449
|
Maruyama A, Yamada Y, Rusuwa B et al, 2001. Change in stable nitrogen isotope ratio in the muscle tissue of a migratory goby, Rhinogobius sp. , in a natural setting. Canadian Journal of Fisheries and Aquatic Science, 58(11): 2125-2128 DOI:10.1139/f01-147 |
Mazumder D, Saintilan N, 2010. Mangrove leaves are not an important source of dietary carbon and nitrogen for crabs in temperate Australian mangroves. Wetlands, 30(2): 375-380 DOI:10.1007/s13157-010-0021-2 |
Peterson B J, 1999. Stable isotopes as tracers of organic matter input and transfer in benthic food webs:a review. Acta Oecologica, 20(4): 479-487 DOI:10.1016/S1146-609X(99)00120-4 |
Peterson B J, Fry B, 1987. Stable isotopes in ecosystem studies. Annual Review of Ecology and Systematics, 18: 293-320 DOI:10.1146/annurev.es.18.110187.001453 |
Zambrano L, Valiente E, Vander Zanden M J, 2010. Stable isotope variation of a highly heterogeneous shallow freshwater system. Hydrobiologia, 646(1): 327-336 DOI:10.1007/s10750-010-0182-2 |
 2019, Vol. 50
2019, Vol. 50

