
中国海洋湖沼学会主办。
文章信息
- 赵永芳, 郑珊, 孙晓霞. 2019.
- ZHAO Yong-Fang, ZHENG Shan, SUN Xiao-Xia. 2019.
- 2014年冬季热带西太平洋雅浦Y3海山光合色素分布及其对浮游植物群落的指示作用
- DISTRIBUTION OF PHOTOSYNTHETIC PIGMENTS AND ITS INDICATION TO PHYTOPLANKTON COMMUNITY IN YARP Y3 SEAMOUNT IN THE TROPICAL WEST PACIFIC IN WINTER 2014
- 海洋与湖沼, 50(4): 830-837
- Oceanologia et Limnologia Sinica, 50(4): 830-837.
- http://dx.doi.org/10.11693/hyhz20181100265
文章历史
-
收稿日期:2018-11-07
收修改稿日期:2019-02-01
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266071;
3. 中国科学院海洋研究所 海洋生态与环境科学重点实验室 青岛 266071;
4. 中国科学院大学 北京 100049;
5. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071, China;
3. CAS Key Laboratory of Marine Ecology and Environmental Science, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China;
5. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
海山(seamount)为深海大洋生态系统中位于海平面以下, 高度大于1000m的隆起地形(Rogers, 1994)。洋流系统受海山的影响形成很多物理过程, 包括洋流加速、等温线变形、涡的形成、底部增强为泰勒柱(Taylor column)、内波等, 这些物理过程导致局部环流和形成独特水团(Genin et al, 1985; Dower et al, 1992, 1996; Chivers et al, 2013)改变营养来源、栖息地、沉积物等因素, 形成独特的海山生物区系, 有着较高的物种多样性和生物量(Rogers, 1994)。因此, 海山生态系统受到国际和国内研究者的广泛关注(汪品先, 2013; 张武昌等, 2014)。
西赤道太平洋暖池区是全球海山的集中分布地, 关于热带西太平洋浮游植物群落的相关研究已有一些报道。一些研究表明原绿球藻在群落中占据优势地位(Blanchot et al, 2001; Mackey et al, 2002), 有调查认为原绿球藻的贡献与蓝细菌及定鞭金藻的相当(Higgins et al, 2000; 庄燕培等, 2012), 目前针对该海域海山光合色素及浮游植物群落的研究还未见报道。热带西太平洋雅浦Y3海山区叶绿素最大层均在100m以浅(张文静等, 2016), 本文重点分析100m以内海山区浮游植物光合色素的特征并通过矩阵因子化程序CHEMTAX (Mackey et al, 1996)来分析海山区浮游植物类群结构特征, 以期为海山区海洋初级生产过程、水色遥感和碳循环研究提供基础数据。
1 材料与方法 1.1 调查站位2014年12月3日至2015年1月7日在热带西太平洋雅浦Y3海山(8.76°—9.02°N, 137.62°— 137.95°E)海域调查取样9个站位(图 1), 其中Y3-0站位于Y3海山(水深约300m)山顶。Y3海山位于热带西太平洋暖池区(0°—16°N, 125°—145°E), 属于雅浦岛弧, 其东南紧邻雅浦海沟, 沟弧间距短, 岛弧与海沟走向均为NNE向(张正一等, 2017)。
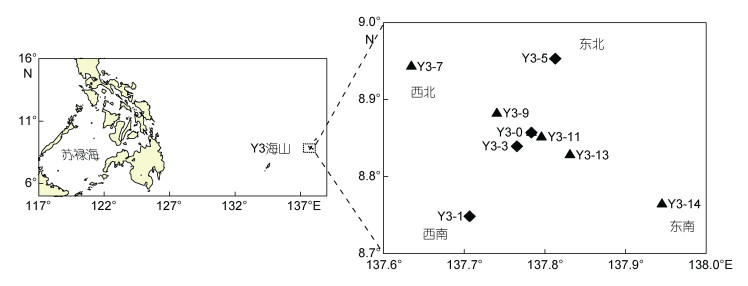 |
| 图 1 雅浦Y3海山区采样站位图 Fig. 1 Sampling stations in the seamount Y3 |
采用Niskin采水器(KC-Denmark公司, 丹麦)在各站分4层(0, 30, 75, 100m)采集水样, 水样立即用Whatman GF/F滤膜(47mm, 0.7μm)过滤(负压<0.030MPa), 过滤体积为2L, 滤膜对折后用铝铂纸包好放入冻存管中, 存放于液氮或-80℃冰箱中保存至实验室分析。室内分析时将冻存管取出并开盖, 在黑暗条件下冷冻干燥36h(-20℃), 展开铝铂纸, 用不锈钢剪刀将滤膜剪成细条, 全部转移至棕色样品瓶(2.0mL)中。加入1400μL 95%甲醇和100μL内标母液, 将浸有滤膜的提取液置于冰水浴中超声5min (Zapata et al, 2000)。用玻璃注射器吸取上清液, 通过Pall GHP针头式有机相滤头(0.2μm, 13mm)过滤。准确吸取500 μL滤液与100μL超纯水混合均匀后立即上机分析。
色素分析按照Zapata等(2000)建立的方法, HPLC系统为Waters ACQUITY H-Class系统, 采用Waters Symmetry C8色谱柱(3.5μm, 4.6mm×150mm), 二元梯度洗脱, 流动相A为V甲醇︰V乙腈︰V吡啶水溶液(2%, pH为5.0) =50︰25︰25, 流动相B为V甲醇︰V乙腈︰V丙酮=20︰60︰20。设定流速1mL/min, 柱温27℃, 梯度洗脱参数设定见表 1。进样前用100%甲醇洗针, 进样量为50μL, 样品室温度保持在4℃。
| 时间(min) | 流动相A(%) | 流动相B(%) |
| 0 | 100 | 0 |
| 22 | 50 | 50 |
| 28 | 20 | 80 |
| 40 | 5 | 95 |
| 43 | 5 | 95 |
| 43.1 | 100 | 0 |
采用PDA检测器进行记录和鉴别, 波长440nm, 分辨率为1.2nm, 同时扫描并记录350—750nm的光谱信息。根据色素标准品的色素峰保留时间和吸收光谱图, 确定色素成分, 定量采用内标工作曲线定量法进行。
分析中所用的甲醇、乙腈、丙酮均为Merck公司生产的HPLC级, 超纯水来自ELGA PURELAB Ultra实验室超纯水机(18Ω), 26种色素标准品均购自丹麦DHI公司, 包括叶绿素c3 (chlorophyll c3, chl c3)、叶绿素c2 (chlorophyll c2, chl c2)、多甲藻黄素(peridinin, Peri)、19′-丁酰氧基岩藻黄素(19′-butanoyloxyfucoxanthin, 19'BF)、岩藻黄素(fucoxanthin, Fuco)、新黄素(neoxanthin, Neox)、青绿素(prasinoxanthin, Pras)、紫黄素(violaxanthin, Viol)、19′-已酰氧基岩藻黄素(19′-hexanoyloxyfucoxanthin, 19'HF)、硅甲藻黄素(diadinoxanthin, Diad)、硅藻黄素(diatoxanthin, Diat)、别黄素(alloxanthin, Allo)、玉米黄素(zeaxanthin, Zeax)、叶黄素(lutein, Lute)、叶绿素b (chlorophyll b, chl b)、叶绿素a (chlorophyll a, chl a)、二乙烯基叶绿素a (divinyl chlorophyll a, Dvchl a)、Mg-2, 4-二乙烯基脱镁卟啉a5单甲基酯(Mg-2, 4-divinyl pheoporphyrin a5 monomethylester, MGDVP)、环氧玉米黄质(antheraxanthin, Anth)、虾青素(astaxanthin, Asta)、海胆酮(echinenone, Echi)、脱镁叶绿素a (pheophytin a, Phtin a)、脱镁叶绿素盐a(pheophorbide a, Phbide a)、陀螺叶黄素-二酯(gyroxanthin diester, Gyro)、α-胡萝卜素(α-carotene, α-caro)、β-胡萝卜素(β- carotene, β-caro)。色素内标8′-阿朴-β, ψ-胡萝卜醛(8′- apo-beta-carotenal)购自Sigma公司。
1.3 计算浮游植物类群对叶绿素a的贡献依据11种光合色素浓度[其中DDX(硅甲藻黄素+硅藻黄素)= Diad+ Diat], 按CHEMTAX程序因子分析方法计算浮游植物类群对叶绿素a的贡献率, 具体计算方法参见Mackey等(1996)。初始色素比值采用Miki等(2008)在同纬度苏禄海研究输出的色素比值。海山区未检出定鞭金藻和隐藻的特征色素19′HF、Allo, 但周围大洋区检出19′HF并且含量与19′BF相当(未发表数据), 据之前报道周围附件海区均存在定鞭金藻, 但西赤道太平洋4°N以北的地区隐藻含量极低(Higgins et al, 2000), 参与计算的类群包括定鞭金藻不包含隐藻, 本文分析的浮游植物类群为绿藻、金藻、蓝细菌、硅藻、甲藻、青绿藻、原绿球藻7种。根据水深分为0—30m, 75—100m两组, 大洋区数据参与运算, 结果不展示。
1.4 数据分析分析结果用Surfer11.0及R语言ggplot2包绘图, 用R语言中的vegan包对研究区类群组成与环境因子进行Pearson相关性分析, 对环境因子分层进行Wicoxon-Matt-Whitney差异性检验。
2 结果 2.1 光合色素特征调查海区检测到的主要色素浓度范围统计见箱式图 2, Neox, Viol, Pras, chl c3, Diat, β-caro, Anth, Lute, chl b检测浓度平均值较低(<1.50ng/L), 未检出的色素有19′HF, Asta, Echi, Phtin a, Phbide a, Gyro, Allo。蓝细菌的特征色素Zeax是水柱中浓度最高的光合色素, 浓度范围为22.64—84.31ng/L, 均值为(57±15)ng/L, 站位间差异不明显, 指示了蓝细菌在大洋寡营养海区浮游植物群落中的优势地位。chl a浓度在水柱中均值为(37±34)ng/L, 变化范围为2.78— 140.71ng/L, 浓度存在空间差异。指示金藻的19′BF均值为(31±30)ng/L, 主要分布在75—100m层。原绿球藻的特征色素Dvchl a在水柱中均值为(27±22)ng/L, 水层间浓度变化范围大(0—100.75ng/L), 水柱积分占到总叶绿素(Tchl a=chl a + Dvchl a)的21%—65%。指示硅藻和甲藻的Fuco与Peri浓度较低, 其均值分别为(8±6)及(4±2)ng/L。绿藻及青绿藻的特征色素Neox、Lute、chl b、Pras平均水柱含量极低<1.00ng/L, 多存在75m水层。定鞭金藻的特征色素19'HF在Y3海山区未检出。
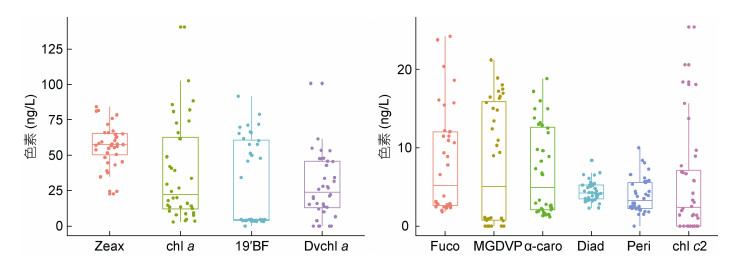 |
| 图 2 海山区色素浓度变化范围 Fig. 2 The range of pigments concentration 注: Zeax:玉米黄素; chl a:叶绿素a; 19′BF: 19′-丁酰氧基岩藻黄素; Dvchl a:二乙烯基叶绿素a; Fuco:岩藻黄素; MGDVP: Mg-2, 4-二乙烯基脱镁卟啉a5单甲基酯; α-caro: α-胡萝卜素; Diad:硅甲藻黄素, Peri:多甲藻黄素; chl c2:叶绿素c2。 |
CHEMTAX分析的初始及输出色素比值如表 2, 多数特征色素与chl a的比值在75—100m层大于0—30m层, 或者略有增加。原绿球藻虽然参与了程序计算, 由于其不含chl a, 由Dvchl a表示其贡献, 文中所指贡献率均转化为类群对Tchl a的贡献。
| Peri | 19′BF | Fuco | Neox | Pras | 19′HF | DDX | Zeax | chl b | |
| 初始值 | |||||||||
| 绿藻 | 0 | 0 | 0 | 0.040 | 0 | 0 | 0 | 0.010 | 0.260 |
| 金藻 | 0 | 0.760 | 0.350 | 0 | 0 | 0 | 0.190 | 0 | 0 |
| 蓝细菌 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1.800 | 0 |
| 硅藻 | 0 | 0 | 0.750 | 0 | 0 | 0 | 0.050 | 0 | 0 |
| 甲藻 | 1.100 | 0 | 0 | 0 | 0 | 0 | 0.240 | 0 | 0 |
| 青绿藻 | 0 | 0 | 0 | 0 | 0.250 | 0 | 0 | 0 | 1.200 |
| 原绿球藻 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.320 | 0.420 |
| 定鞭金藻 | 0 | 0 | 0 | 0 | 0 | 1.700 | 0.100 | 0 | 0 |
| 0—30m水层(输出) | |||||||||
| 绿藻 | 0 | 0 | 0 | 0.036 | 0 | 0 | 0 | 0.010 | 0.107 |
| 金藻 | 0 | 1.270 | 0.034 | 0 | 0 | 0 | 0.072 | 0 | 0 |
| 蓝细菌 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.705 | 0 |
| 硅藻 | 0 | 0 | 0.815 | 0 | 0 | 0 | 0.074 | 0 | 0 |
| 甲藻 | 1.097 | 0 | 0 | 0 | 0 | 0 | 0.277 | 0 | 0 |
| 青绿藻 | 0 | 0 | 0 | 0 | 0.288 | 0 | 0 | 0 | 0.793 |
| 原绿球藻 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1.756 | 0.112 |
| 定鞭金藻 | 0 | 0 | 0 | 0 | 0 | 1.866 | 0.131 | 0 | 0 |
| 75—100m水层(输出) | |||||||||
| 绿藻 | 0 | 0 | 0 | 0.039 | 0 | 0 | 0 | 0.012 | 0.147 |
| 金藻 | 0 | 1.676 | 0.040 | 0 | 0 | 0 | 0.089 | 0 | 0 |
| 蓝细菌 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.499 | 0 |
| 硅藻 | 0 | 0 | 0.992 | 0 | 0 | 0 | 0.095 | 0 | 0 |
| 甲藻 | 1.188 | 0 | 0 | 0 | 0 | 0 | 0.266 | 0 | 0 |
| 青绿藻 | 0 | 0 | 0 | 0 | 0.274 | 0 | 0 | 0 | 0.765 |
| 原绿球藻 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1.473 | 0.110 |
| 定鞭金藻 | 0 | 0 | 0 | 0 | 0 | 2.007 | 0.138 | 0 | 0 |
| 注: Peri:多甲藻黄素; 19′BF: 19′-丁酰氧基岩藻黄素; Fuco:岩藻黄素Neox:新黄素Pras:青绿素; 19′HF: 19′-已酰氧基岩藻黄素; DDX:硅甲藻黄素+硅藻黄素; Zeax:玉米黄素; chl b:叶绿素b。 | |||||||||
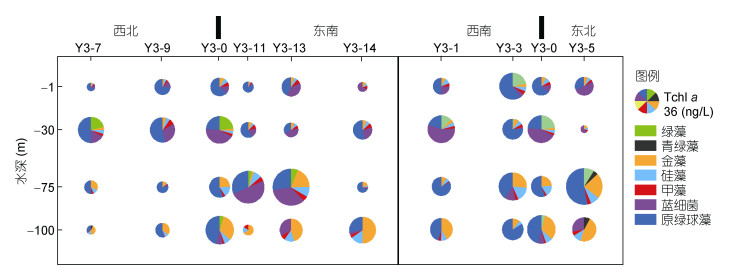 |
| 图 3 浮游植物类群组成垂直分布 Fig. 3 Vertical distribution of phytoplankton groups |
调查区浮游植物总量在垂向分布上海山顶附近差异性要小于周边, 海山西北和西南侧总量高值出现在30m层, 东南和东北侧高值出现在75—100m。100m以浅西北东南向Tchl a浓度空间分布差异大于西南东北向。Y3海山区浮游植物群落以原绿球藻为优势藻, 其次主要为蓝细菌和金藻。0和30m层, 蓝细菌和原绿球藻两者分布具有此消彼长的特点, 蓝细菌贡献率高值区分布在海山东南东北侧。75和100m层, 除Y3-11和Y3-13站外, 原绿球藻和金藻为主要的贡献类群, 金藻贡献率高值区主要分布在100m层。原绿球藻、蓝细菌及金藻三者对Tchl a的相对贡献率之和大于60%, 水柱平均分别为45%、19%、18%。硅藻、甲藻、绿藻、青绿藻对Tchl a的贡献均低于10%。
2.3 浮游植物群落贡献率与环境因子的关系将浮游植物群落贡献率与温度、盐度和各种营养盐进行相关性分析(表 3)。结果表明金藻、蓝细菌和硅藻的贡献率与环境因子显著相关。金藻与温度呈负相关, 与其他环境因子呈正相关, 蓝细菌与温度呈正相关, 与其他环境因子呈负相关, 原绿球藻贡献率与各环境因子不具有相关性。
| 温度 | 盐度 | 水深 | 磷酸盐 | 硝酸盐 | 亚硝酸盐 | 硅酸盐 | |
| 绿藻 | 0.28* | -0.29* | -0.22 | -0.16 | -0.12 | -0.16 | -0.17 |
| 金藻 | -0.79** | 0.56** | 0.65** | 0.80** | 0.67** | 0.67** | 0.80** |
| 蓝细菌 | 0.43** | -0.48** | -0.35** | -0.35** | -0.20 | -0.32* | -0.32* |
| 硅藻 | -0.54** | 0.32* | 0.35** | 0.53** | 0.39** | 0.32* | 0.54** |
| 甲藻 | 0.20 | -0.27* | -0.22 | -0.05 | 0.13 | -0.15 | -0.04 |
| 青绿藻 | -0.24 | 0.25 | 0.32* | 0.32* | 0.21 | 0.31* | 0.40** |
| 原绿球藻 | 0.09 | 0.08 | -0.09 | -0.16 | -0.21 | -0.07 | -0.17 |
| 注: *表示相关显著(P<0.05), **表示相关极显著(P<0.01) | |||||||
西太平洋暖池区年均表层水温不低于28℃ (张启龙等, 1997), Y3海山为中层海山(垂直尺度山顶距海面300m), 张文静等(2016)和赵丽等(2017)对海山区温盐及营养盐环境因子进行了分析。海山山顶及周围区域存在温度抬升, 50m存在明显盐跃层, 50m以浅水体混合均匀, 50m以深分层明显, 盐度高值在75—100m水层(张文静等, 2016)。营养盐浓度垂直分布(200m以浅)海山NO3-在75m以浅基本耗尽, 100m以深逐渐升高且分层明显, NO2-在30m以浅基本耗尽, 高值多分布在75—100m水层, PO43-在75m以浅区域浓度基本小于5μg/L并且分布均匀, 75m以深逐渐升高, 存在分层现象(赵丽等, 2017)。
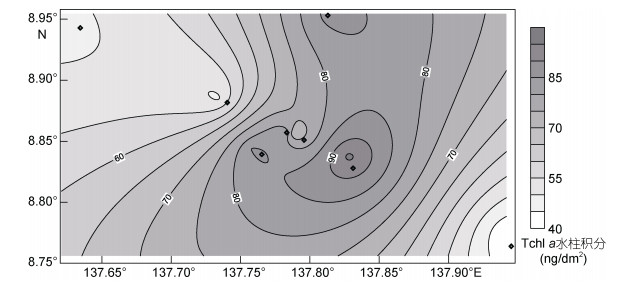 |
| 图 4 Tchl a水柱积分分布 Fig. 4 Distribution of Tchl a in water column 注:总叶绿素Tchl a=chl a + Dvchl a |
Zeax是水柱中浓度最高的光合色素, 100m以浅垂向分布均一, 这与西太平洋暖池区特征相一致。Tchl a代表着海区的初级生产力, 根据张文静等(2016)研究表明Y3海山区叶绿素a浓度水平与大洋区并无显著差异, 经典假说在本海山并不适用(张文静等, 2016), HPLC测定的Tchl a浓度(7.81— 194.14ng/L)也在西太平洋暖池区范围(<200ng/L) (Blanchot et al, 2001)之内, 具有贫营养海区的特征。Y3海山区Tchl a水柱积分与站位水深水平分布具有相似的趋势, 沿着东北—西南走向浅水区存在高值区, 与雅浦岛弧走向一致, 向两侧海沟逐渐减小, 表现出海山地形对水柱生产力水平有一定的影响, 但未达到显著水平。海山区未检测到反映捕食作用强弱的降解叶绿素(pheophytin a、pheophorbide a), 暗示调查区多数有机物通过微生物食物网被消耗和再矿化而不是向高营养级输送(Wright et al, 2010)。
Y3海山区浮游植物群落以原绿球藻为优势藻, 0和30m层以原绿球藻和蓝细菌为主, 75和100m层以原绿球藻和以金藻为代表的微型光合真核生物占优势, 与Blanchot等(Blanchot et al, 2001; 赵丽等, 2017)的研究相一致, 原绿球藻的整体贡献率(45%)要小于暖池大洋区(57%)(Blanchot et al, 2001), 蓝细菌和金藻整体贡献率相当。原绿球藻除海山东南和东北侧部分水层外, 贡献率均大于20%, 多数水层贡献率大于40%, 研究区各环境因子对其贡献率不具有限制性。蓝细菌在海山东南和东北区域0和30m层贡献率高(>38%), 在盐跃层(50m)之上, 水体具有高温低盐的特征, 这与之前的研究(赵丽等, 2017)相一致, 此外在Y3-11、Y3-13站75m和Y3-1站30m层也占绝对优势, 水层中硝酸盐和亚硝酸盐均消耗殆尽, 可能是在低氮环境下, 有利于蓝细菌的生长(Moore et al, 2002)。金藻贡献率随水深增加而增大, 高值区分布在75和100m水层, 也是研究区高盐低温高营养盐水层, 在本环境下金藻等真核生物具有更强的聚氮能力(Moore et al, 2002)。
西太平洋暖池区高温表层水的主要浮游植物类群为微微型原核浮游植物, 低温高营养盐的次表层水以微微型真核浮游植物类群为主(Blanchot et al, 2001; Chen et al, 2017), Y3海山区浮游植物类群组成在盐跃层之上和之下存在差异, 盐跃层之上(0和30m)以原绿球藻和蓝细菌为主, 盐跃层之下(75和100m)以金藻和原绿球藻为主, 盐跃层之上和之下的水环境因子均差异显著(Wicoxon-Matt-Whitney, P<0.01)。海山盐跃层之上西北和西南侧原绿球藻贡献率大于50%, 类群结构与暖池大洋区表层相近, 东北和东南蓝细菌贡献率增加, 平均贡献率达到50%, 对这两个区0m和30m层环境因子对比显示两者不具有显著差异(Wicoxon-Matt-Whitney, P>0.1)。盐跃层之下75m层以原绿球藻为主, 并在近海山站(Y3-9, Y3-0, Y3-3)下嵌到100m层, 其他站位100m水层为金藻贡献率高值区(>40%)。Y3海山存在等温线抬升现象, 北侧为北赤道流区域, 南侧为北赤道逆流(张文静等, 2016; Chen et al, 2017), 研究区浮游植物类群结构可能受到西向高温低盐水、低温高营养盐上升流以及周围海山地形的共同影响。西太平洋海山区有着复杂的洋流系统, 建议以后的研究需增加断面数量和加密采样水层。
4 结论(1) 玉米黄素(Zeax)是水柱中浓度最高的光合色素, 浓度为22.64—84.31ng/L, 水层间差异不明显, 叶绿素a浓度在水柱中均值为(37±34)ng/L, 具有贫营养海区的特征, 100m以浅水柱积分高值区与海山走向一致, 二乙烯叶绿素a和19′-丁酰氧岩藻黄素也是调查海区较高浓度的色素, 在水柱中均值分别为(27±22)及(31±30)ng/L, 水层间存在差异。其他色素Neox、Lute、chl b、Pras平均水柱含量极低(<1.00ng/L), 19′HF未检出。
(2) 调查区浮游植物群落以原绿球藻为优势藻, 除海山东南和东北侧部分水层外, 贡献率均大于20%, 多数水层贡献率大于40%, 贡献率与环境因子不具有相关性。其次主要为蓝细菌和金藻, 蓝细菌贡献率高值区分布在海山东南和东北侧0和30m水层, 金藻贡献率高值区在75和100m水层, 贡献率均与环境因子显著相关。
(3) 海山地形对水柱Tchl a水柱积分水平有一定的影响, Y3海山区浮游植物类群组成在盐跃层之上和之下存在差异, 盐跃层之上(0和30m)以原绿球藻和蓝细菌为主, 盐跃层之下(75和100m)以金藻和原绿球藻为主。
致谢 本研究中温盐数据由中国科学院海洋研究所海洋专项办公室提供, 营养盐数据由李学刚老师和李宁老师提供。样品采集工作由陈芸燕博士、李俊磊博士和张文静硕士共同完成, 海上调查得到了“科学号”考察船全体工作人员的支持, 谨致谢忱。
汪品先. 2013. 从海洋内部研究海洋. 地球科学进展, 28(5): 517-520 |
庄燕培, 金海燕, 陈建芳, 等. 2012. 西赤道太平洋暖池区光合色素分布及其对浮游植物群落的指示作用. 海洋学报, 34(2): 143-152 |
张文静, 孙晓霞, 陈芸燕, 等. 2016. 2014年冬季热带西太平洋雅浦Y3海山浮游植物叶绿素a浓度及粒级结构. 海洋与湖沼, 47(4): 739-747 |
张正一, 董冬冬, 张广旭, 等. 2017. 板块俯冲侵蚀雅浦岛弧的地形制约. 海洋地质与第四纪地质, (1): 41-50 |
张启龙, 翁学传. 1997. 热带西太平洋暖池的某些海洋学特征分析. 海洋科学集刊, (1): 31-38 |
张武昌, 于莹, 李超伦, 等. 2014. 海山区浮游生态学研究. 海洋与湖沼, 45(5): 973-978 |
赵丽, 赵燕楚, 王超锋, 等. 2017. 热带西太平洋Y3和M2海山微食物网主要类群生态分布与比较. 海洋与湖沼, 48(6): 1446-1455 |
Blanchot J, André J M, Navarette C et al, 2001. Picophytoplankton in the equatorial pacific:vertical distributions in the warm pool and in the high nutrient low chlorophyll conditions. Deep Sea Research PartⅠ:Oceanographic Research Papers, 48(1): 297-314 DOI:10.1016/S0967-0637(00)00063-7 |
Chen Y Y, Sun X X, Zhu M L et al, 2017. Spatial variability of phytoplankton in the Pacific western boundary currents during summer 2014. Marine and Freshwater Research, 68(10): 1887-1900 DOI:10.1071/MF16297 |
Chivers A J, Narayanaswamy B E, Lamont P A et al, 2013. Changes in polychaete standing stock and diversity on the northern side of Senghor seamount (NE Atlantic). Biogeosciences, 10(6): 3535-3546 DOI:10.5194/bg-10-3535-2013 |
Dower J, Freeland H, Juniper K, 1992. A strong biological response to oceanic flow past cobb seamount. Deep Sea Research Part A. Oceanographic Research Papers, 39(7-8): 1139-1145 DOI:10.1016/0198-0149(92)90061-W |
Dower J F, Mackas D L, 1996. "Seamount effects" in the zooplankton community near cobb seamount. Deep Sea Research PartⅠ:Oceanographic Research Papers, 43(6): 837-858 DOI:10.1016/0967-0637(96)00040-4 |
Genin A, Boehlert G W, 1985. Dynamics of temperature and chlorophyll structures above a seamount:an oceanic experiment. Journal of Marine Research, 43(4): 907-924 DOI:10.1357/002224085788453868 |
Higgins H W, Mackey D J, 2000. Algal class abundances, estimated from chlorophyll and carotenoid pigments, in the western equatorial pacific under El Ni o and non-El Ni o conditions. Deep Sea Research PartⅠ:Oceanographic Research Papers, 47(8): 1461-1483 DOI:10.1016/S0967-0637(99)00114-4 |
Mackey D J, Blanchot J, Higgins H W et al, 2002. Phytoplankton abundances and community structure in the equatorial pacific. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 49(13-14): 2561-2582 DOI:10.1016/S0967-0645(02)00048-6 |
Mackey M D, Mackey D J, Higgins H W et al, 1996. CHEMTAX - a program for estimating class abundances from chemical markers:application to HPLC measurements of phytoplankton. Marine Ecology Progress Series, 144: 265-283 DOI:10.3354/meps144265 |
Miki M, Ramaiah N, Takeda S et al, 2008. Phytoplankton dynamics associated with the monsoon in the Sulu Sea as revealed by pigment signature. Journal of Oceanography, 64(5): 663-673 DOI:10.1007/s10872-008-0056-7 |
Moore L R, Post A F, Rocap G et al, 2002. Utilization of different nitrogen sources by the marine cyanobacteria Prochlorococcus and Synechococcus. Limnology and Oceanography, 47(4): 989-996 DOI:10.4319/lo.2002.47.4.0989 |
Rogers A D, 1994. The biology of seamounts. Advances in Marine Biology, 30: 305-350 DOI:10.1016/S0065-2881(08)60065-6 |
Wright S W, van den Enden R L, Pearce I et al, 2010. Phytoplankton community structure and stocks in the southern ocean (30-80°E) determined by CHEMTAX analysis of HPLC pigment signatures. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 57(9-10): 758-778 DOI:10.1016/j.dsr2.2009.06.015 |
Zapata M, Rodríguez F, Garrido J L, 2000. Separation of chlorophylls and carotenoids from marine phytoplankton:a new HPLC method using a reversed phase C8 column and pyridine-containing mobile phases. Marine Ecology Progress Series, 195: 29-45 DOI:10.3354/meps195029 |
 2019, Vol. 50
2019, Vol. 50


