中国海洋湖沼学会主办。
文章信息
- 赵越, 于仁成, 孔凡洲, 张清春, 耿慧霞, 代丽, 王锦秀, 周名江. 2019.
- ZHAO Yue, YU Ren-Cheng, KONG Fan-Zhou, ZHANG Qing-Chun, GENG Hui-Xia, DAI Li, WANG Jin-Xiu, ZHOU Ming-Jiang. 2019.
- 黄、东海夏季浮游植物群落特征及其影响因素分析
- FEATURES OF PHYTOPLANKTON COMMUNITIES AND THEIR CONTROLLING FACTORS IN THE YELLOW SEA AND THE EAST CHINA SEA IN SUMMER TIME
- 海洋与湖沼, 50(4): 838-850
- Oceanologia et Limnologia Sinica, 50(4): 838-850.
- http://dx.doi.org/10.11693/hyhz20181100268
文章历史
-
收稿日期:2018-11-08
收修改稿日期:2019-02-21
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266071;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
黄海和东海是西北太平洋重要的边缘海(Chen, 2009), 海域环境状况不仅受到陆源物质输入影响, 也与邻近大洋的水交换过程密切相关。东海外接太平洋, 位于外侧深槽区的黑潮、陆架区的台湾暖流以及近岸海域的沿岸流构成了东海的基本环流系统(Guan, 1994; Chen, 2009), 同时, 长江径流将大量淡水输送至东海, 形成的长江冲淡水对海域环境也有重要影响(图 1)。黄海是半封闭的陆架浅海, 位于黄海中部的黄海暖流和两侧的沿岸流是黄海海域的主要环流, 夏季黄海中部会出现季节性的冷水团(Guan, 1994; 张启龙等, 1996)。复杂的海洋环流和丰富的陆源物质输入共同影响着黄、东海域的环境状况和生态系统(刘瑞玉等, 1963; Zhou et al, 2008; Chen, 2009; 中国科学技术协会, 2015)。
浮游植物是海洋生态系统中的主要初级生产者, 支撑着海域初级生产力和渔业资源, 对碳、氮元素生物地球化学过程和气候变化也具有重要调控作用。同时, 有部分浮游植物能够形成有害藻华, 危害海洋生态系统健康(Zhou et al, 2008)。因此, 浮游植物的种类组成和分布状况直接影响着海洋生态系统的结构和功能。在针对浮游植物的研究中, 常常采用走航调查, 结合形态学观察、流式细胞分析、浮游植物色素分析和DNA/RNA序列测定等方法(陈纪新等, 2006; 宋书群, 2010; Zhang et al, 2012; Zhao et al, 2013), 对浮游植物的种类组成和分布情况进行研究。海洋中的小型浮游植物(20—200μm)和微型浮游植物(2—20μm)主要分布于近岸海域, 具有明显的形态学特征, 可以通过形态学观察进行鉴别和计数。而微微型浮游植物(<2μm), 包括微微型真核藻类及聚球藻(Synechococcus)和原绿球藻(Prochlorococcus)等蓝细菌, 是寡营养盐大洋中的常见优势类群(Campbell et al, 1994; Moore et al, 1995; Flombaum et al, 2013), 在一些海域可以贡献超过50%的初级生产力(Agawin et al, 2000)。由于细胞微小, 形态特征不明显, 通常采用流式细胞仪对微微型浮游植物进行分析。
目前, 国内外学者围绕黄、东海海域的浮游植物开展了大量研究工作, 涵盖浮游植物分类学、粒级结构、区系分布、环境适应性和有害藻华等诸多方面(黄文祥等, 1984; Lu et al, 2001; Zhou et al, 2008; 宋书群, 2010; 郭术津等, 2011; 孙晓霞等, 2012; 吕末晓等, 2016)。大量研究表明, 黄、东海浮游植物的种类组成和分布状况在很大程度上受控于海域环境条件和海洋学过程, 如黄海冷水团的形成、长江冲淡水分布, 以及黑潮向东海陆架区的入侵等(黄邦钦, 2009; 吕末晓等, 2016; 岑竞仪等, 2017)。但是, 相关研究在时、空覆盖度上仍存在一定的局限性(孙晓霞等, 2012; Zhang et al, 2016; 岑竞仪等, 2017)。本研究基于2015年夏季(8—9月)在黄海和东海开展的大面调查, 采用显微镜观察和流式细胞分析等手段, 研究了黄、东海海域浮游植物种类组成与分布状况, 探讨了影响浮游植物群落的主要因素, 为进一步分析邻近大洋和陆源物质输入对我国近海生态系统的影响提供基础数据。
1 材料与方法 1.1 调查海域于2015年8月27日至9月14日期间, 参加黄、东海海域的大面调查航次, 其中黄海海域搭载“北斗号”科学考察船, 东海海域搭载“科学三号”科学考察船。调查海域范围为120.0—125.5°E, 25.5—38.8°N。共设置18条断面, 85个调查站位, 具体如图 1所示。
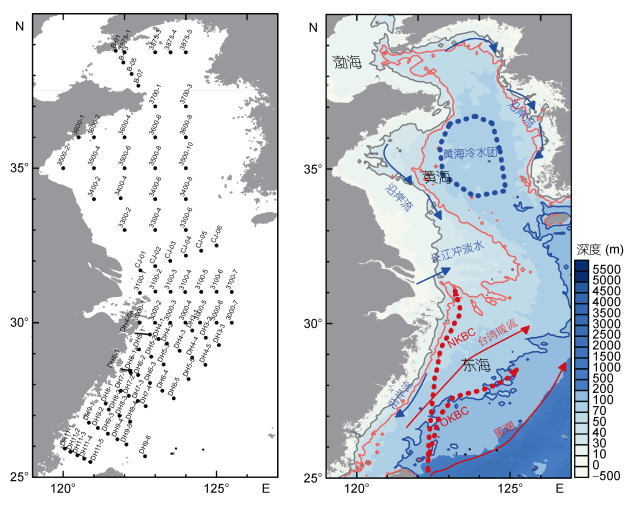 |
| 图 1 2015年夏季黄、东海航次站位图及调查海域环流示意图(改绘自Ichikawa et al, 2002; Yang et al, 2012) Fig. 1 The sampling sites during the cruises in the Yellow Sea and the East China Sea in summer 2015 and the schematic diagram of the circulation system (modified from Ichikawa et al, 2002; Yang et al, 2012) |
采用CTD (SBE911, Sea-bird Scientific, 美国)现场采集记录各站位海水温度和盐度数据。用CTD配载的5L Niskin采水器采集不同水层(表层、10m、30m等)的海水样品, 处理后用于叶绿素 a 和浮游植物种类分析。
取500mL海水, 经200μm筛绢过滤去除浮游动物后, 以玻璃纤维滤膜(GF/F, 25mm, Whatman, 英国)过滤收集浮游植物, 用于高效液相色谱法分析叶绿素 a 。过滤后的滤膜用锡纸包裹, 置于液氮中保存, 运回实验室后保存在-80℃冰箱中直至分析。
取4mL海水, 经20μm筛绢过滤后, 加入400μL 10%的多聚甲醛溶液(终浓度1%)固定, 用于流式细胞仪分析。样品在室温下固定10—15min后, 在液氮中速冻保存, 运回实验室后保存在-80℃冰箱中直至分析。
取500—1000mL海水, 经200μm筛绢过滤去除浮游动物后, 置于塑料瓶内, 加入鲁哥氏剂(终浓度1%—1.5%)固定, 室温保存直至显微镜观察分析。
1.3 样品检测方法 1.3.1 叶绿素 a 含量分析应用高效液相色谱法分析叶绿素 a 含量, 具体过程参见相关文献(Zapata et al, 2000; Kong et al, 2012)。高效液相色谱仪(e2695, Waters corporation, 新加坡)配备高压梯度泵、自动进样器和光电二极管阵列检测器(2998, Waters corporation, 新加坡)。采用C8色谱柱(Symmetry, 4.6mm×150mm, 3.5μm, Waters corporation, 美国)对浮游植物色素进行分离。将滤膜解冻、剪碎后, 加入甲醇提取浮游植物色素, 以8′-apo -β, ψ- Apocarotenal (Apo)(500μg /L, 溶解于90%丙酮, Sigma)作为内标。样品室温度4 ℃, 进样体积100μL, 通过相对响应因子、过滤海水体积及叶绿素 a 和内标的峰面积计算样品中叶绿素 a 含量。
1.3.2 微型及微微型浮游植物类群分析采用流式细胞仪对不同类群的微型和微微型浮游植物丰度进行测定。水样在20 ℃下解冻后, 用BD Accuri C6流式细胞仪(Accuri C6, Becton, Dickinson and Company, 美国)分析微型真核藻类(nanoeukaryotes, nanoeuk)、微微型真核藻类(picoeukaryotes, picoeuk)、聚球藻(Synechococcus, Syn)和原绿球藻(Prochlorococcus, Pro)的丰度, 具体过程参见相关文献(Jiang et al, 2017; Delpy et al, 2018; Zhao et al, 2019)。
1.3.3 浮游植物种类鉴定与计数通过显微镜镜检, 对浮游植物样品进行种类鉴定, 并计数其丰度。将鲁哥氏剂固定过的浮游植物水样摇匀后, 取25mL水样在浮游植物沉降器(Hydro-bios, 德国)中沉降24h (Lund et al, 1958; Utermöhl, 1958), 沉降后的样品用倒置显微镜(Olympus CKX41, 日本或者Zeiss AXIO Vert, 德国)在200倍或400倍放大倍数下进行种类鉴定和计数。
1.4 数据统计与分析采用EMPOWER2软件处理和分析高效液相色谱法测定的叶绿素 a 含量, 用CFlow Plus和Flow Jo V10软件对流式细胞仪获取的浮游植物各类群丰度进行分析和计算。浮游植物优势度指数(Yi) (McNaughton, 1967)以如下方法计算:
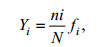
其中N是浮游植物总丰度; ni是第i种物种或类群的丰度; fi是第i种物种或类群在所有样品中出现的频率。
采用t-test进行差异显著性检验。基于流式细胞仪和显微观察结果, 选取优势度大于1‰的浮游植物种类, 根据浮游植物种类组成和丰度情况对采集的样品进行聚类分析(Kong et al, 2016)。由于不同种类浮游植物丰度数据差别很大, 采用四次方根方法对数据进行标准化处理, 以平衡常见种与稀有种的丰度差异。采用Bray-Curtis方法构建相似性矩阵, 通过层次聚类(Hierarchical Clustering)方法进行聚类分析并作树状图。通过NMDS分析检验结果的可信度, 当胁迫系数(Stress Coefficient)小于0.02时认为聚类结果良好(Clarke et al, 2001)。通过ANOSIM方法检验浮游植物样品之间的相似性。选取上述23类浮游植物作为指标, 对主要聚类群落进行主成分分析, 以Bartlett球形检验概率P<0.05, 表明数据均适合进行主成分分析。以特征值≥1为标准, 提取各浮游植物群落中的主成分进行分析。样品差异显著性分析及主成分分析采用SPSS软件分析, 用Primer软件对数据进行聚类分析。
2 结果与分析 2.1 海水温度、盐度和叶绿素 a 分布状况调查海域夏季海水温度、盐度及叶绿素 a 情况见表 1。表层海水中各要素的平面分布状况及四个重点断面分布情况如图 2所示。选择的四个重点断面分别为:渤海海峡口附近的B断面, 黄海中部的3500断面, 长江口附近的3100断面, 以及东海DH6断面。
| 海域 | 平均值(最小值—最大值) | ||
| 温度(℃) | 盐度 | 叶绿素 a (μg/L) | |
| 调查海域总体 | 23.2(6.9—28.1) | 32.7(24.0—34.7) | 0.75(0—6.55) |
| 东海 | 25.0(15.23—28.1) | 33.4(24.0—34.7) | 0.69(0—6.55) |
| 黄海 | 20.1(6.9—27.6) | 31.5(28.8—33.2) | 0.85(0.12—3.23) |
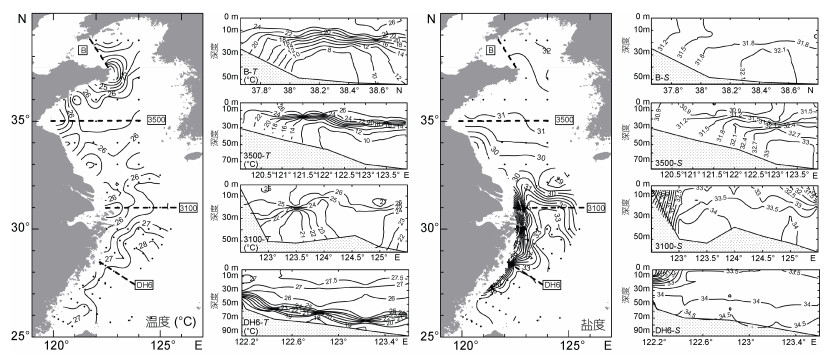 |
| 图 2 2015年夏季调查期间黄、东海表层及典型断面海水温度和盐度情况 Fig. 2 Temperature and salinity at the surface and four transects in the Yellow Sea and the East China Sea during the cruises in summer 2015 |
夏季黄、东海表层水温较高, 但表层与底层之间往往存在温度跃层, 垂向温度变化剧烈, 这一现象在黄海更为突出。调查期间, 黄海表层水温可达25℃以上, 在3500断面和B断面均可观察到底层黄海冷水团, 水温在9—13℃之间。与表层海水相比, 底部冷水团海水的盐度也较高。北黄海冷水团的水温和盐度均低于南黄海冷水团。长江口邻近海域是东海盐度最低的海域, 夏季调查期间, 长江冲淡水主体自河口向东北部延伸。在东海近岸海域, 低盐水团可向南影响至27°N附近海域。在长江口外侧, 台湾暖流向北切入长江冲淡水水舌, 其影响可延伸到32°N以北。
调查期间黄、东海海水中叶绿素 a 含量分布状况如图 3所示。整体来看, 黄海海域叶绿素 a 平均含量为0.85μg/L, 略高于东海, 高值区位于长江口北侧近岸海域和山东半岛周边海域, 黄海中部叶绿素 a 含量较低。从断面分布上可以看出, 黄海中层海水中叶绿素 a 含量高于表层。东海叶绿素 a 平均含量为0.69μg/L, 高值区出现在长江口及其邻近海域表层海水中, 最高含量可达6.55μg/L。
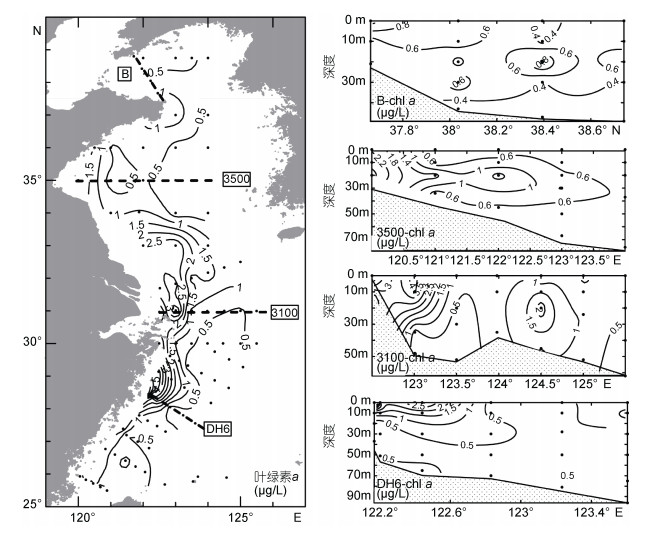 |
| 图 3 2015年夏季调查期间黄、东海表层及典型断面叶绿素 a 含量分布情况 Fig. 3 Distribution of chlorophyll a at the surface and four transects in the Yellow Sea and the East China Sea during the cruises in summer 2015 |
应用流式细胞仪分析的四类浮游植物丰度情况见表 2。调查期间四类浮游植物在黄、东海海域的丰度与分布状况如图 4、5所示。黄海微型真核藻类丰度值显著高于东海(P<0.05), 在山东半岛南侧南黄海中部海域(122 E, 35 N)丰度最高。在东海海域, 高丰度的微型真核藻类主要出现在长江口邻近海域及浙闽沿海一带。黄海微微型真核藻类丰度显著低于东海(P<0.05), 主要分布在山东半岛和江苏近岸海域, 在黄海中部较少, 与微型真核藻类的分布情况恰好相反。东海的微微型真核藻类高值区集中在近岸海域, 但在离岸较远的表、中层海水中也有高丰度的微微型真核藻类分布。
| 海域 | 平均值(最小值—最大值) | |||
| 微型真核藻类 (×103cells/mL) |
微微型真核藻类 (×103cells/mL) |
聚球藻 (×104cells/mL) |
原绿球藻 (×103cells/mL) |
|
| 调查海域总体 | 4.56(0.10—55.42) | 2.57(0.02—28.14) | 6.15(0.03—46.39) | 3.27(0—69.48) |
| 东海 | 3.74(0.10—55.42) | 2.97(0.072—28.14) | 6.09(0.03—46.39) | 3.62(0—69.48) |
| 黄海 | 5.90(0.48—32.24) | 1.93(0.02—12.21) | 6.25(0.11—40.25) | 0.15(0—3.79) |
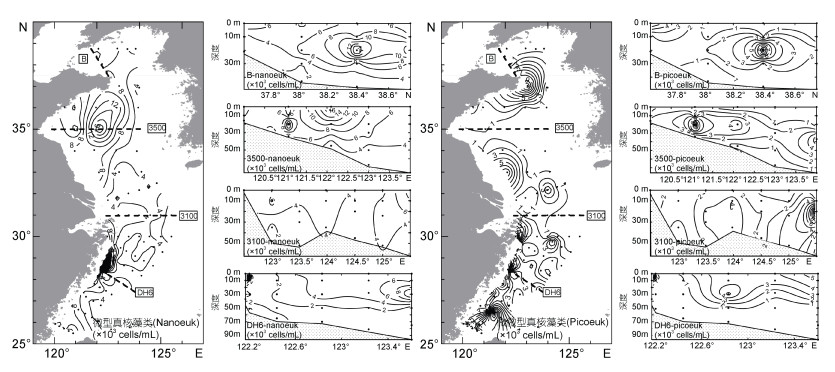 |
| 图 4 2015年夏季调查期间黄、东海表层及典型断面微型真核藻类和微微型真核藻类分布情况 Fig. 4 Distributions of nanoeukaryotes and picoeukaryotes at the surface and four transects in the Yellow Sea and the East China Sea during the cruises in summer 2015 |
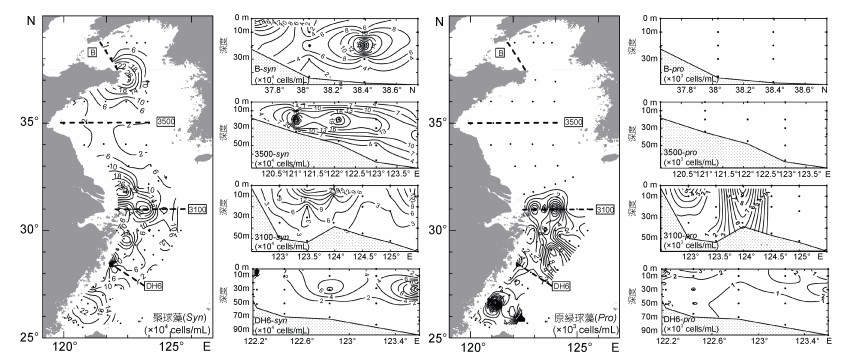 |
| 图 5 2015年夏季调查期间黄、东海表层及典型断面聚球藻和原绿球藻分布情况 Fig. 5 Distributions of Synechococcus and Prochlorococcus at surface and four transects in the Yellow Sea and the East China Sea during the cruises in summer 2015 |
调查期间黄、东海海域的聚球藻丰度没有显著差异, 高丰度的聚球藻主要出现在山东半岛周边和长江口邻近海域。黄海海域中层海水中聚球藻丰度往往高于表层。原绿球藻主要分布在东海海域。从表层分布状况来看, 除在DH9断面近岸有高值区外, 高丰度的原绿球藻主要分布在向长江口邻近海域入侵的高盐水舌中。在次表层至底层, 原绿球藻基本上分布在受底层黑潮水入侵影响的海域。
通过对浮游植物样品的显微镜镜检分析, 夏季黄、东海浮游植物总丰度平均值为4.38×104cells/L, 主要优势种为硅藻类的海链藻(Thalassiosira spp.)、新月柱鞘藻(Cylindrotheca closterium)、长菱形藻(Nitzschia longissima)、菱形藻(Nitzschia spp.)和角毛藻(Chaetoceros spp.)等。甲藻优势度不高, 且丰度普遍低于硅藻。甲藻中优势度较高的藻种有螺旋环沟藻(Gyrodinium spirale)、亚历山大藻(Alexandrium spp.)和东海原甲藻(Prorocentrum donghaiense)等。浮游植物总丰度在浙闽近海最高, 可达1.20×106cells/L, 其中新月柱鞘藻占有绝对优势, 丰度为6.57× 105cells/L。浮游植物优势种海链藻、新月柱鞘藻和螺旋环沟藻丰度情况见表 3。结合叶绿素 a 含量数据可以看出, 长江口邻近海域硅藻丰度和生物量已达到赤潮水平。
| 海域 | 平均值(最小值—最大值) | ||
| 海链藻 (×103cells/L) |
新月柱鞘藻 (×103cells/L) |
螺旋环沟藻 (×102 cells/L) |
|
| 调查海域总体 | 1.633(0—197.280) | 2.870(0—656.640) | 1.92 (0—57.60) |
| 东海 | 2.470(0—197.280) | 4.601(0—656.640) | 2.98(0—57.60) |
| 黄海 | 0.250(0—3.394) | 0(0—0.080) | 0.150(0—7.34) |
调查期间表层海水中海链藻、新月柱鞘藻和螺旋环沟藻的分布情况见图 6, 三种微藻分布特征相似, 高值区均出现长江口南部浙闽近海。相比之下, 螺旋环沟藻丰度明显低于两种硅藻, 最高丰度为5.76×103cells/L, 且在东海近岸和外海均有分布, 但近岸丰度更高。几种浮游植物均以表层丰度最高, 中层和底层分布趋势与表层相似, 但丰度明显降低。
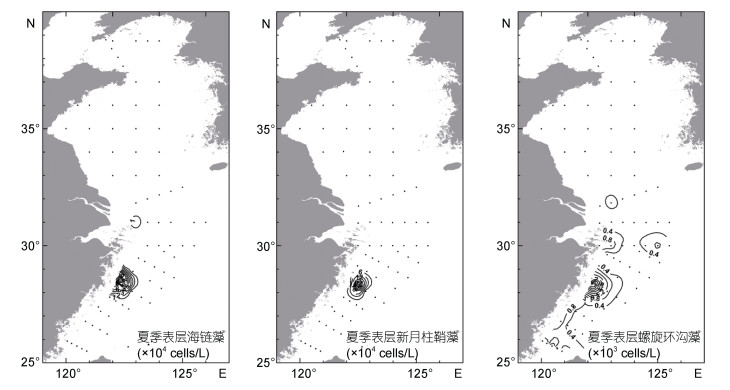 |
| 图 6 2015年夏季调查期间黄、东海表层海水中海链藻、新月柱鞘藻和螺旋环沟藻的分布情况 Fig. 6 Distributions of diatoms Thalassiosira spp. and Cylindrotheca closterium and dinoflagellate Gyrodinium spirale at the surface of the Yellow Sea and the East China Sea during the cruises in summer 2015 |
基于流式细胞仪和显微镜检获得的浮游植物种类组成和丰度结果, 对浮游植物样品进行聚类分析, 结果如图 7所示。在68%相似度下, 除少数样品外, 大部分样品聚成两簇, 分别代表黄海(YS)和东海(ECS)两个浮游植物群落。在75%相似度下, 群落ECS又可以再分为ECS-Ⅰ、ECS-Ⅱ及ECS-Ⅲ三簇, 其中ECS-Ⅱ可在78%相似度下可以进一步划分为ECS-ⅰ和ECS-ⅱ两簇。群落YS内各样品相似度较高, 在90%相似度下形成的两簇YS-Ⅰ和YS-Ⅱ包含了大多数样品。以上结果NMDS检验胁迫反映聚类结果良好。应用ANOSIM检验表明各聚类群落间差异极显著(相似性均为0.1%), 聚类结果良好。
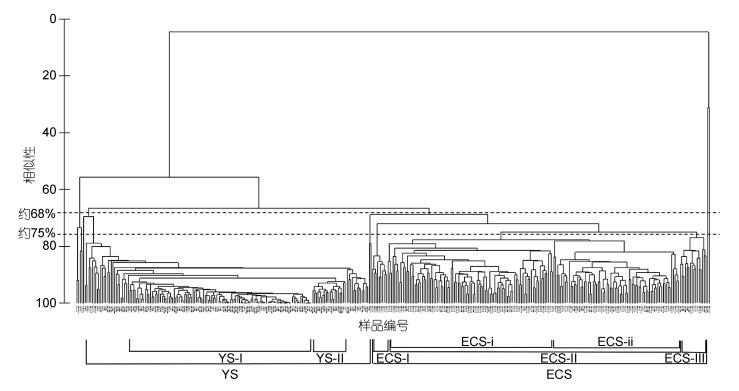 |
| 图 7 2015年夏季调查期间黄、东海海域采集浮游植物样品的Bray-Curtis聚类图 Fig. 7 Bray-Curtis clustering dendrogram of phytoplankton samples collected from the Yellow Sea and the East China Sea during the cruises in summer 2015 |
聚类分析的各浮游植物群落在黄、东海的分布情况如图 8所示。其中群落YS与ECS分别代表黄海和东海的浮游植物群落, 两者大致以31°N为分界线。对主要群落ECS-Ⅰ、ECS-Ⅱ、ECS-Ⅲ、YS-Ⅰ和YS-Ⅱ进行主成分分析, 排名前两位的主成分载荷图见图 9。黄海海域的两个主要浮游植物群落中, YS-Ⅰ远离海岸, 位于黄海中部海域。主成分分析结果表明, 该群落的特征藻种包括原多甲藻(Protoperidinium spp.)、海链藻和角毛藻等。YS-Ⅱ主要存在于山东半岛周边海域, 该群落的特征藻种包括裸甲藻(Gymnodinium sp.)和聚球藻等种类。
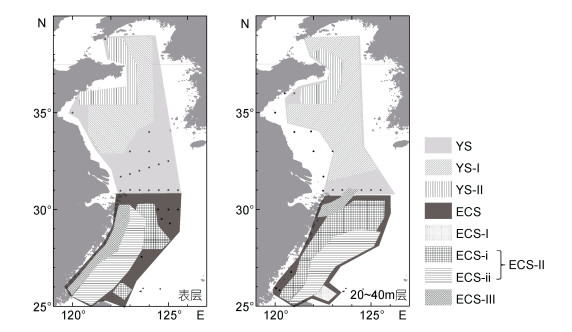 |
| 图 8 2015年夏季调查期间黄、东海海域表层和中层(20—40m)浮游植物群落分布示意图 Fig. 8 Distributions of different phytoplankton clustering groups at the surface and middle layer of the Yellow Sea and the East China Sea in summer 2015 |
 |
| 图 9 2015年夏季黄、东海浮游植物群落主成分载荷图 Fig. 9 Diagram of the loading of clustering phytoplankton groups in the Yellow Sea and the East China Sea in summer 2015 |
东海浮游植物群落ECS-Ⅰ靠近黑潮主干区, 主成分分析表明菱形藻、角毛藻、原绿球藻、东海原甲藻和螺旋环沟藻等为该群落的特征藻种。ECS-Ⅱ主要分布在东海陆架区, 菱形藻、新月柱鞘藻、几内亚藻(Guinardia spp.)和根管藻(Rhizosolenia spp.)等硅藻, 以及亚历山大藻、聚球藻等为该群落的特征藻种。ECS-Ⅲ主要分布在长江口近岸海域, 该群落的特征藻种有细柱藻(Leptocylindrus spp.)、米氏凯伦藻(Karenia mikimotoi)和新月柱鞘藻等。
3 讨论 3.1 黄、东海夏季浮游植物分布差异对2015年夏季采集浮游植物样品的聚类分析结果显示, 调查海域浮游植物可以明显划分为黄海(YS)和东海(ECS)两个相对独立的群落。群落YS的总体丰度较低, 以海链藻和小等刺硅鞭藻等为主要优势种。而群落ECS丰度相对较高, 多样性丰富, 原绿球藻、角毛藻、新月柱鞘藻和东海原甲藻等藻种与YS群落有显著差异。类似现象在以往对黄、东海浮游植物种类组成、区系分布和功能群研究中也有报道(邓春梅等, 2008; 宋书群, 2010; Zhang et al, 2016; 岑竞仪等, 2017)。高岩等(Gao et al, 2015)在对典型赤潮藻种塔玛亚历山大藻复合种的研究中也发现, 黄海海域塔玛亚历山大藻复合种以Alexandrium fundyense为主, 而东海长江口邻近海域则以A. pacificum为主。除浮游植物外, 底栖动物、游泳动物和浮游动物等在黄、东海海域也存在不同的区系(刘瑞玉等, 1963; 中国科学技术协会, 2015)。黄、东海海域浮游植物群落的差别与其环境特征差异有关。黄海属半封闭陆架浅海, 而东海海域外接太平洋, 与邻近大洋的联系更加密切。夏季出现的黄海冷水团(赫崇本等, 1959), 在一定程度上阻隔了黄、东海之间的水交换过程; 同时, 夏季长江冲淡水主体转向济州岛方向, 强盛的低盐水对黄、东海之间的水交换也形成了一定的阻隔作用。黄、东海海域相对独立的海洋环境特征决定了浮游植物群落的显著差异。
在黄海海域, 不同区域和水层的浮游植物样品之间相似性较高, 浮游植物组成和丰度差异较小。YS-Ⅰ和YS-Ⅱ两簇包含了大多数浮游植物样品。其中, YS-Ⅰ群落主要分布在离岸较远的黄海中部海域, 与夏季黄海冷水团及其周边的锋面和上升流区密切相关(Lü et al, 2010; Wei et al, 2016a, b)。YS-Ⅱ群落主要分布在山东半岛周边海域, 群落多样性较高, 可能与陆源输入至近岸海域的丰富营养物质有关。
东海浮游植物群落多样性明显高于黄海, 在75%相似度下, 浮游植物群落ECS可以再分为ECS-Ⅰ、ECS-Ⅱ及ECS-Ⅲ三个群落。其中, ECS-Ⅲ群落主要分布在长江口和闽浙沿岸海域, 与长江冲淡水和陆源污染密切相关。该群落以生长较快的小型硅藻和甲藻为特征藻种, 其中不乏米氏凯伦藻等我国近海典型赤潮藻种。东海陆架区主要受台湾暖流影响, 夏季台湾暖流表层水主要源自台湾海峡, 而底层水主要来自台湾东北部黑潮次表层(Su et al, 1987; Yang et al, 2011, 2012)。复杂的水文环境导致陆架区浮游植物群落的多样化。群落ECS-Ⅱ主要分布在陆架区, 该群落可以再进一步划分为ECS-ⅰ与ECS-ⅱ两个群落。其中ECS- i主要分布在调查海域底层, 表层分布区明显缩小, 且靠近外海。该群落中原绿球藻丰度更高, 角毛藻等硅藻占据优势, 东海原甲藻丰度也较高, 主要反映了黑潮分支的影响(Jiao et al, 2002; 林更铭等, 2012; 谭激扬等, 2013; Dai et al, 2013; Zhao et al, 2019)。群落ECS-ⅱ主要分布在调查区表层的近岸海域, 但在底层的分布区靠近外海, 在地理分布上与台湾海峡水的影响范围相似。ECS-ⅱ与ECS- i不同, 该群落中原绿球藻丰度较低, 硅藻中海链藻是优势类群, 甲藻多样性丰富且优势度高, 螺旋环沟藻和米氏凯伦藻占有优势。浮游植物群落ECS-Ⅰ主要分布在台湾东北部黑潮主干区附近, 该群落中有高丰度的原绿球藻, 反映了黑潮主干区浮游植物群落的特点(Jiao et al, 2002; 谭激扬等, 2013)。
3.2 黄、东海浮游植物群落的主要影响因素夏季黄、东海海域浮游植物的组成和分布特点突出反映了黄海冷水团、长江冲淡水和台湾暖流的影响(赫崇本等, 1959; 王凯敏等, 2012; 杨德周等, 2017)。
对黄海海域的浮游植物调查表明, 夏季黄海表层水中微微型真核藻类主要分布在近岸海域, 而微型真核藻类却分布在离岸较远的南黄海中部海域。这与海水中微型和微微型真核藻类的一般分布规律并不一致。通常海水中粒径较大的小型和微型浮游植物分布在近岸海域, 而粒径更小的微微型真核藻类一般在外海丰度更高(Wang et al, 1997; 刘子琳等, 1998)。夏季黄海海域两类浮游植物的异常分布现象可能与黄海冷水团的影响有关。随着夏季水温上升和营养盐的快速消耗, 近岸水体中会出现营养盐失衡现象, 从而导致部分营养盐的限制。现场添加实验表明, 微型真核藻类更适应于营养盐充足的环境, 而磷酸盐等营养盐的限制有利于微微型真核藻类的生长(方涛等, 2006)。在黄海中部冷水团边缘锋面区, 上升流能够向表层海水中补充营养盐, 从而促进微型真核藻类的生长, 导致叶绿素 a 含量增加。同样, 在黄海冷水团锋面区, 浮游动物、鳀鱼等生物量也比较高(Lü et al, 2010; 吕末晓等, 2016; Wei et al, 2016a, b; Zhang et al, 2016)。
调查期间, 东海长江口和浙闽近海部分海域叶绿素 a 含量已达到赤潮水平, 浮游植物优势种主要是海链藻和新月柱鞘藻等硅藻。长江口邻近海域常在春、夏交接时发生大规模赤潮, 主要优势种为东海原甲藻、米氏凯伦藻和亚历山大藻等, 对海水养殖、水产品食品安全和生态系统健康构成直接威胁(周名江等, 2003; Zhou et al, 2008; 于仁成等, 2016; Li et al, 2017)。以往研究认为, 东海赤潮的形成与长江输入的营养盐密切相关(周名江等, 2003; Zhou et al, 2008), 其中硅藻赤潮与陆源输入的营养盐关系更加密切, 而甲藻赤潮的发生还会受到黑潮分支输入磷酸盐等营养盐调控(Zhou et al, 2017)。此次夏季观察到的硅藻赤潮现象在规模和范围上均明显小于春季甲藻赤潮, 应当与甲藻赤潮之后陆源输入的营养盐补充有关。
原绿球藻是东海浮游植物群落中最突出的微藻类群, 调查期间黄海海域基本上未检测到原绿球藻。通常认为原绿球藻是寡营养盐大洋中的优势种(Campbell et al, 1994; Moore et al, 1995; Flombaum et al, 2013), 此次调查中, 原绿球藻高值区也主要位于台湾东北部黑潮主干区。原绿球藻是一类高温广盐种(Olson et al, 1990; Moore et al, 1995; 冯宪栋等, 2007), 在近岸海域也能存活。目前已发现原绿球藻存在多种生态型, 但在中国近海尚未发现不同生态型(Ma et al, 2004; Jiao et al, 2005), 推测东海陆架区的原绿球藻应当来自黑潮分支输入, 其分布区和黑潮水向陆架区的输入有关, 与夏季黑潮东海近岸分支路径基本吻合。
4 结论基于2015年夏季在黄、东海海域的大面调查, 本研究应用流式细胞仪对调查海域微型真核藻类、微微型真核藻类、聚球藻和原绿球藻等4类浮游植物类群的丰度和分布状况进行了分析, 并通过显微镜镜检手段分析了主要浮游植物优势种的丰度和分布状况, 探讨了影响黄、东海浮游植物群落的主要因素, 得到以下结论:
(1) 夏季黄海和东海浮游植物群落存在明显差别, 黄海海域微型浮游植物丰度高于东海, 而微微型浮游植物丰度低于东海, 原绿球藻主要分布在东海海域, 这与以往对黄、东海生物区系分布特征的认识基本一致。
(2) 黄、东海浮游植物群落的组成与分布特征与海域环境特征紧密相关。夏季黄海海域相对封闭, 主要受到黄海冷水团控制, 表层海水中高丰度的微型真核藻类主要出现在冷水团西侧边缘锋面区。东海海域受到长江冲淡水和黑潮水向岸入侵的强烈影响, 在长江口邻近海域出现硅藻赤潮, 而原绿球藻呈现出自外海向近岸输送的分布态势。
本文研究结果为进一步了解陆源物质输入和邻近大洋对我国近海生态系统的影响效应和机理提供依据。
于仁成, 刘东艳. 2016. 我国近海藻华灾害现状、演变趋势与应对策略. 中国科学院院刊, 31(10): 1167-1174 |
王凯敏, 熊学军, 郭炳火, 等. 2012. 2006-2007年长江冲淡水的扩展形态及季节变化. 海岸工程, 31(1): 46-54 DOI:10.3969/j.issn.1002-3682.2012.01.007 |
中国科学技术协会. 2015. 中国海洋学学科史. 北京: 中国科学技术出版社, 137
|
方涛, 李道季, 余立华, 等. 2006. 光照和营养盐磷对微型及微微型浮游植物生长的影响. 生态学报, 26(9): 2783-2790 DOI:10.3321/j.issn:1000-0933.2006.09.002 |
邓春梅, 于志刚, 姚鹏, 等. 2008. 东海、南黄海浮游植物粒级结构及环境影响因素分析. 中国海洋大学学报, 38(5): 791-798, 756 |
冯宪栋, 蒋霞敏, 符方尧. 2007. 理化因子对原绿球藻生长及其色素含量的影响. 水产科学, 26(12): 643-647 DOI:10.3969/j.issn.1003-1111.2007.12.001 |
吕末晓, 栾青杉, 彭亮, 等. 2016. 2014年夏黄海浮游植物群集及其对物理过程的响应. 海洋科学进展, 34(1): 70-84 DOI:10.3969/j.issn.1671-6647.2016.01.007 |
刘子琳, 蔡昱明, 宁修仁. 1998. 象山港中、西部秋季浮游植物粒径分级、叶绿素 a 和初级生产力. 东海海洋, 16(3): 18-23 |
刘瑞玉, 徐凤山. 1963. 黄、东海底栖动物区系的特点. 海洋与湖沼, 5(4): 306-321 |
孙晓霞, 任琳琳, 郑珊, 等. 2012. 2011年春夏季黄、东海浮游植物粒级结构. 海洋与湖沼, 43(3): 419-428 |
杨德周, 尹宝树, 侯一筠, 等. 2017. 黑潮入侵东海陆架途径及其影响研究进展. 海洋与湖沼, 48(6): 1196-1207 |
岑竞仪, 欧林坚, 李思, 等. 2017. 2014年春季黑潮与邻近海域甲藻组成及其对水团的指示作用. 海洋与湖沼, 48(5): 1022-1029 |
宋书群, 2010.黄、东海浮游植物功能群研究.青岛: 中国科学院研究生院(海洋研究所)博士学位论文, 113-116 http://cdmd.cnki.com.cn/Article/CDMD-80068-2010147131.htm
|
张启龙, 翁学传, 杨玉玲. 1996. 南黄海春季水团分析. 海洋与湖沼, 27(4): 421-428 DOI:10.3321/j.issn:0029-814X.1996.04.013 |
陈纪新, 黄邦钦, 刘媛, 等. 2006. 应用特征光合色素研究东海和南海北部浮游植物的群落结构. 地球科学进展, 21(7): 738-746 DOI:10.3321/j.issn:1001-8166.2006.07.012 |
林更铭, 杨清良, 王雨, 等. 2012. 福建北部海域浙闽沿岸流消亡期浮游植物的种类组成与分布特征. 应用与环境生物学报, 18(3): 411-420 |
周名江, 颜天, 邹景忠. 2003. 长江口邻近海域赤潮发生区基本特征初探. 应用生态学报, 14(7): 1031-1038 DOI:10.3321/j.issn:1001-9332.2003.07.001 |
郭术津, 田伟, 戴民汉, 等. 2011. 2009年夏季东海浮游植物群集. 海洋科学进展, 29(4): 474-486 DOI:10.3969/j.issn.1671-6647.2011.04.007 |
黄文祥, 沈亮夫, 朱琳. 1984. 黄海的浮游植物. 海洋环境科学, 3(3): 19-28 |
黄邦钦, 2009.中国海典型海区浮游植物群落结构及其对中尺度物理过程的响应.见: 庆祝中国藻类学会成立30周年暨第十五次学术讨论会摘要集.珠海: 中国海洋湖沼学会藻类学分会, 2 http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGHI200911001152.htm
|
赫崇本, 汪圆祥, 雷宗友, 等. 1959. 黄海冷水团的形成及其性质的初步探讨. 海洋与湖沼, 2(1): 11-15 |
谭激扬, 黄良民, 谭烨辉, 等. 2013. 水团对吕宋海峡浮游植物群落结构的影响. 海洋学报, 35(6): 178-190 DOI:10.3969/j.issn.0253-4193.2013.06.019 |
Agawin N S R, Duarte C M, Agustí S, 2000. Nutrient and temperature control of the contribution of picoplankton to phytoplankton biomass and production. Limnology and Oceanography, 45(3): 591-600 DOI:10.4319/lo.2000.45.3.0591 |
Campbell L, Nolla H A, Vaulot D, 1994. The importance of Prochlorococcus to community structure in the central North Pacific Ocean. Limnology and Oceanography, 39(4): 954-961 DOI:10.4319/lo.1994.39.4.0954 |
Chen C T A, 2009. Chemical and physical fronts in the Bohai, Yellow and East China seas. Journal of Marine Systems, 78(3): 394-410 DOI:10.1016/j.jmarsys.2008.11.016 |
Clarke K R, Warwick R M, 2001. A further biodiversity index applicable to species lists:variation in taxonomic distinctness. Marine Ecology Progress Series, 216: 265-278 DOI:10.3354/meps216265 |
Dai X F, Lu D D, Guan W B et al, 2013. The correlation between Prorocentrum donghaiense blooms and the Taiwan Warm Current in the East China Sea - evidence for the "Pelagic Seed Bank" hypothesis. PLoS One, 8(5): e64188 DOI:10.1371/journal.pone.0064188 |
Delpy F, Serranito B, Jamet J L et al, 2018. Pico- and nanophytoplankton dynamics in two coupled but contrasting coastal bays in the NW Mediterranean Sea (France). Estuaries and Coasts, 41(7): 2039-2055 DOI:10.1007/s12237-018-0412-9 |
Flombaum P, Gallegos J L, Gordillo R A et al, 2013. Present and future global distributions of the marine Cyanobacteria Prochlorococcus and Synechococcus. Proceedings of the National Academy of Sciences of the United States of America, 110(24): 9824-9829 DOI:10.1073/pnas.1307701110 |
Gao Y, Yu R C, Chen J H et al, 2015. Distribution of Alexandrium fundyense and A. pacificum (Dinophyceae) in the Yellow Sea and Bohai Sea. Marine Pollution Bulletin, 96(1-2): 210-219 |
Guan B X, 1994. Patterns and structures of the currents in Bohai, Huanghai and East China Seas. In: Di Z, Liang Y B, Zeng C K eds. Oceanology of China Seas. London: Kluwer Academic Publishers
|
Ichikawa H, Beardsley R C, 2002. The current system in the Yellow and East China Seas. Journal of Oceanography, 58(1): 77-92 DOI:10.1023/A:1015876701363 |
Jiang X, Li J J, Ke Z X et al, 2017. Characteristics of picoplankton abundances during a Thalassiosira diporocyclus bloom in the Taiwan Bank in late winter. Marine Pollution Bulletin, 117(1-2): 66-74 DOI:10.1016/j.marpolbul.2017.01.042 |
Jiao N Z, Yang Y H, 2002. Ecological studies on Prochlorococcus in China seas. Chinese Science Bulletin, 47(15): 1243-1250 DOI:10.1360/02tb9276 |
Jiao N Z, Yang Y H, Hong N et al, 2005. Dynamics of autotrophic picoplankton and heterotrophic bacteria in the East China Sea. Continental Shelf Research, 25(10): 1265-1279 DOI:10.1016/j.csr.2005.01.002 |
Kong F Z, Yu R C, Zhang Q C et al, 2012. Pigment characterization for the 2011 bloom in Qinhuangdao implicated "brown tide" events in China. Chinese Journal of Oceanology and Limnology, 30(3): 361-370 DOI:10.1007/s00343-012-1239-z |
Kong F Z, Xu Z J, Yu R C et al, 2016. Distribution patterns of phytoplankton in the Changjiang River estuary and adjacent waters in spring 2009. Chinese Journal of Oceanology and Limnology, 34(5): 902-914 DOI:10.1007/s00343-016-4202-6 |
Li X D, Yan T, Lin J N et al, 2017. Detrimental impacts of the dinoflagellate Karenia mikimotoi in Fujian coastal waters on typical marine organisms. Harmful Algae, 61: 1-12 DOI:10.1016/j.hal.2016.11.011 |
Lu D D, Goebel J, 2001. Five red tide species in genus Prorocentrum including the description of Prorocentrum donghaiense Lu sp. nov. from the East China Sea. Chinese Journal of Oceanology and Limnology, 19(4): 337-344 DOI:10.1007/BF02850738 |
Lü X G, Qiao F L, Xia C S et al, 2010. Upwelling and surface cold patches in the Yellow Sea in summer:effects of tidal mixing on the vertical circulation. Continental Shelf Research, 30(6): 620-632 DOI:10.1016/j.csr.2009.09.002 |
Lund J W G, Kipling C, Le Cren E D, 1958. The inverted microscope method of estimating algal numbers and the statistical basis of estimations by counting. Hydrobiologia, 11(2): 143-170 DOI:10.1007/BF00007865 |
Ma Y, Jiao N Z, Zeng Y H, 2004. Natural community structure of cyanobacteria in the South China Sea as revealed by rpoC1 gene sequence analysis. Letters in Applied Microbiology, 39(4): 353-358 DOI:10.1111/lam.2004.39.issue-4 |
McNaughton S J, 1967. Relationships among functional properties of Californian grassland. Nature, 216(5111): 168-169 |
Moore L R, Goericke R, Chisholm S W, 1995. Comparative physiology of Synechococcus and Prochlorococcus:influence of light and temperature on growth, pigments, fluorescence and absorptive properties. Marine Ecology Progress Series, 116(1-3): 259-275 |
Olson R J, Chisholm S W, Zettler E R et al, 1990. Spatial and temporal distributions of prochlorophyte picoplankton in the north Atlantic Ocean. Deep Sea Research Part A. Oceanographic Research Papers, 37(6): 1033-1051 DOI:10.1016/0198-0149(90)90109-9 |
Su J L, Pan Y Q, 1987. On the shelf circulation north of Taiwan. Acta Oceanologica Sinica, 6(S1): 1-20 |
Utermöhl H, 1958. Zur Vervolkommung der quantitativen Phytoplankton-Methodik. Mitteilung Internationale Vereinigung Fuer Theoretische unde Amgewandte Limnologie, 9: 1-38 |
Wang H L, Huang B Q, Hong H S, 1997. Size-fractionated productivity and nutrient dynamics of phytoplankton in subtropical coastal environments. Hydrobiologia, 352(1-3): 97-106 |
Wei Q S, Li X S, Wang B D et al, 2016a. Seasonally chemical hydrology and ecological responses in frontal zone of the central southern Yellow Sea. Journal of Sea Research, 112: 1-12 DOI:10.1016/j.seares.2016.02.004 |
Wei Q S, Yu Z G, Wang B D et al, 2016b. Coupling of the spatial-temporal distributions of nutrients and physical conditions in the southern Yellow Sea. Journal of Marine Systems, 156: 30-45 DOI:10.1016/j.jmarsys.2015.12.001 |
Yang D Z, Yin B S, Liu Z L et al, 2011. Numerical study of the ocean circulation on the East China Sea shelf and a Kuroshio bottom branch northeast of Taiwan in summer. Journal of Geophysical Research:Oceans, 116(C5): C05015 |
Yang D Z, Yin B S, Liu Z L et al, 2012. Numerical study on the pattern and origins of Kuroshio branches in the bottom water of southern East China Sea in summer. Journal of Geophysical Research:Oceans, 117(C2): C02014 |
Zapata M, Rodriguez F, Garrido J L, 2000. Separation of chlorophylls and carotenoids from marine phytoplankton:a new HPLC method using a reversed phase C8 column and pyridine-containing mobile phases. Marine Ecology Progress Series, 195: 29-45 DOI:10.3354/meps195029 |
Zhang Q C, Qiu L M, Yu R C et al, 2012. Emergence of brown tides caused by Aureococcus anophagefferens Hargraves et Sieburth in China. Harmful Algae, 19: 117-124 DOI:10.1016/j.hal.2012.06.007 |
Zhang S, Leng X Y, Feng Y Y et al, 2016. Ecological provinces of spring phytoplankton in the Yellow Sea:species composition. Acta Oceanologica Sinica, 35(8): 114-125 DOI:10.1007/s13131-016-0872-3 |
Zhao L, Zhao Y, Zhang W C et al, 2013. Picoplankton distribution in different water masses of the East China Sea in autumn and winter. Chinese Journal of Oceanology and Limnology, 31(2): 247-266 DOI:10.1007/s00343-013-2085-3 |
Zhao Y, Yu R C, Kong F Z et al, 2019. Distribution patterns of picosized and nanosized phytoplankton assemblages in the East China Sea and the Yellow Sea:Implications on the impacts of Kuroshio intrusion. Journal of Geophysical Research:Oceans, 124(2): 1262-1276 DOI:10.1029/2018JC014681 |
Zhou M J, Shen Z L, Yu R C, 2008. Responses of a coastal phytoplankton community to increased nutrient input from the Changjiang (Yangtze) River. Continental Shelf Research, 28(12): 1483-1489 DOI:10.1016/j.csr.2007.02.009 |
Zhou Z X, Yu RC, Zhou M J, 2017. Seasonal succession of microalgal blooms from diatoms to dinoflagellates in the East China Sea:a numerical simulation study. Ecological Modelling, 360: 150-162 DOI:10.1016/j.ecolmodel.2017.06.027 |
 2019, Vol. 50
2019, Vol. 50


