中国海洋湖沼学会主办。
文章信息
- 王蕊, 黄文雯, 吴佳俊, 陈荔, 王江涛. 2019.
- WANG Rui, HUANG Wen-Wen, WU Jia-Jun, CHAN Lai-Leo, WANG Jiang-Tao. 2019.
- 剧毒卡尔藻与东海原甲藻间的化感作用研究
- ALLELOPATHIC INTERACTION OF TWO DINOFLAGELLATES: KARLODINIUM VENEFICUM AND PROROCENTRUM DONGHAIENSE
- 海洋与湖沼, 50(4): 858-863
- Oceanologia et Limnologia Sinica, 50(4): 858-863.
- http://dx.doi.org/10.11693/hyhz20181200299
文章历史
-
收稿日期:2018-12-19
收修改稿日期:2019-03-25
2. 香港城市大学 海洋污染国家重点实验室 香港 999077;
3. 中国海洋大学 化学化工学院 青岛 266100
2. The State Key Laboratory of Marine Pollution, City University of Hong Kong, Hong Kong SAR 999077, China;
3. College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China
微藻间的竞争关系直接影响了浮游群落的生物多样性及稳定性, 研究微藻间的竞争关系有利于更全面了解赤潮形成及演替机制等。化感作用作为重要的竞争方式之一, 通过向环境释放化学物质对其他植物产生促进或抑制作用, 对赤潮的发生、维持以及优势种群的演替具有重要的意义(周成旭等, 2008Rice, 1984; Vardi et al, 2002; Legrand et al, 2003; Roy et al, 2006; Yang et al, 2014)。
东海原甲藻是2001年新命名的一种原甲藻。近二十年来, 在我国东海海域频繁发生赤潮, 且涉及范围广、持续时间长。虽然东海原甲藻本身无毒, 但其大量繁殖对养殖业及环境仍带来严重的影响(周伟华等, 2006)。剧毒卡尔藻分布广泛, 是沿岸水域中常见的浮游微藻。首次报道于南非(Braarud, 1957; Pieterse et al, 1967), 后来在欧洲(BjØrnland et al, 1979; Nielsen, 1996)、澳大利亚(Cosgrove et al, 2000; Ajani et al, 2001)、北美(Li et al, 2000; Terlizzi et al, 2000)都有发现。作为潜在新型赤潮毒素的藻种, 在我国东海海域也相继被发现(王红霞等, 2011; Dai et al, 2014)。
研究者不仅在东海暴发的大规模米氏凯伦藻和东海原甲藻混种赤潮水样中检测到过剧毒卡尔藻, 在东海原甲藻单种赤潮水样中也检测到过该藻, 另有调查发现剧毒卡尔藻可在东海原甲藻赤潮减弱后继续暴发形成一定密度的赤潮(周成旭等, 2008; Dai et al, 2014)。剧毒卡尔藻除了具有强烈的毒性作用外, 是否还参与了藻种间的竞争, 通过抑制其他竞争生物(如微藻)的生长繁殖而获得生长优势仍不清楚。因此研究剧毒卡尔藻与东海原甲藻之间的化感效应, 对于了解甲藻间的竞争机制具有重要的意义。
1 材料与方法 1.1 微藻培养东海原甲藻由中国海洋大学海洋污染生态化学实验室藻种室提供, 剧毒卡尔藻由国家海洋局第二海洋研究所藻种室提供。微藻培养在光照培养箱中进行, 两种藻的培养条件相同: f/2-Si培养基, 白色冷光源, 光强度: 4000lx, 光暗比: 12h︰12h, 培养温度: (20±1)℃, 盐度: 30, 培养过程中定时摇晃培养瓶并随机摆放。
1.2 剧毒卡尔藻与东海原甲藻的竞争关系 1.2.1 剧毒卡尔藻与东海原甲藻混合培养的相互影响混合培养实验分为三组: (1)剧毒卡尔藻单独培养实验(对照组), 初始藻密度为1.0×104cells/mL; (2)东海原甲藻单独培养实验(对照组), 初始藻密度为1.0×104cells/mL; (3)剧毒卡尔藻与东海原甲藻混合培养(实验组), 在混合培养的过程中两种微藻的初始藻密度均为1.0×104cells/mL, 即接种比例为1︰1。每组设置三个平行样, 每两天进行一次取样并用显微镜计数。
1.2.2 剧毒卡尔藻滤液对东海原甲藻生长的影响将剧毒卡尔藻培养至指数生长末期, 藻密度约为8.0×104cells/mL。培养液经0.22μm微孔滤膜过滤, 得无藻细胞滤液并测定其营养盐浓度(祝陈坚, 2006)。剧毒卡尔藻无藻细胞滤液和灭菌海水均加富至f/2培养基浓度, 滤液培养为实验组, 海水培养为对照组, 东海原甲藻初始藻密度约为1.0×104cells/mL。
1.2.3 东海原甲藻滤液对剧毒卡尔藻生长的影响将东海原甲藻培养至指数生长末期, 藻密度约为10.0×104cells/mL。获得无藻细胞滤液, 并测定其营养盐浓度, 然后将东海原甲藻无藻细胞滤液和灭菌海水均加富至f/2培养基。剧毒卡尔藻初始藻密度为1.0×104cells/mL。
1.3 剧毒卡尔藻滤液不同洗脱组分对东海原甲藻生长的影响SPE C18小柱经100%甲醇、60%甲醇、水活化后, 取1L 1.2.2中剧毒卡尔藻的生长滤液, 置于SPE C18小柱吸附、不同比例的甲醇溶液(20%, 40%, 60%, 80%, 100%)依次洗脱, 将洗脱的各部分经旋转蒸发仪蒸干或氮吹吹干, 分别用1mL DMSO (二甲亚砜, Dimethyl sulfoxide)溶解。经证实: DMSO在一定的浓度范围内对藻类生长没有影响(张议文等, 2014; Wang et al, 2016)。分别添加上述100μL不同洗脱部分的DMSO溶液到100mL东海原甲藻培养基中培养。经体积换算, 加入的化感物质浓度即为剧毒卡尔藻指数生长末期化感物质的最大浓度。
1.4 数据处理 1.4.1 相对抑制率(IR)采用下列公式计算相对抑制率(Lu et al, 2008):
式中, IR:相对抑制率; T:实验组的细胞生长密度; C:对照组的细胞生长密度。
1.4.2 显著性差异平均值±标准差的形式表示(n=3)实验结果, 各组间显著性差异用one-way ANOVA分析, 以P < 0.05作为显著性差异的标准。
2 结果 2.1 剧毒卡尔藻与东海原甲藻之间的竞争关系 2.1.1 剧毒卡尔藻与东海原甲藻混合培养的相互影响剧毒卡尔藻在单独培养组中和与东海原甲藻混合培养组中生长状况都良好, 且生长期同步, 两组的生长曲线没有明显的差异(图 1, P > 0.05)。而东海原甲藻在混合培养实验中藻密度从第2天开始下降, 与单独培养的对照组相比, 具有显著的差异(图 2, P < 0.05)。在混合培养体系中, 剧毒卡尔藻的生长没有受到影响, 而东海原甲藻的生长受到了明显的抑制, 当培养到第12天时, 东海原甲藻藻密度已低于初始藻密度。
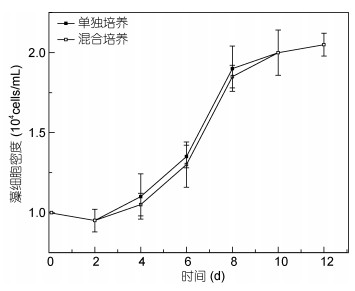 |
| 图 1 剧毒卡尔藻单独培养与混合培养的生长 Fig. 1 The growth curve of K. veneficum in mono-culture and bi-algal culture |
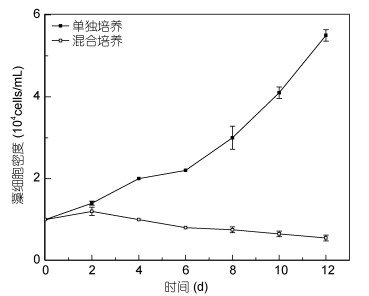 |
| 图 2 东海原甲藻单独培养与混合培养的生长 Fig. 2 The growth curve of P. donghaiense in mono-culture and bi-algal culture |
与混合培养相似, 剧毒卡尔藻在东海原甲藻无藻细胞滤液中没有受到影响, 生长状况良好(图 3, P > 0.05)。东海原甲藻在剧毒卡尔藻滤液中的生长则受到了明显抑制, 接种2天后藻密度开始低于对照组(P < 0.05), 培养至12天时, 东海原甲藻的密度接近于初始藻密度(图 4)。
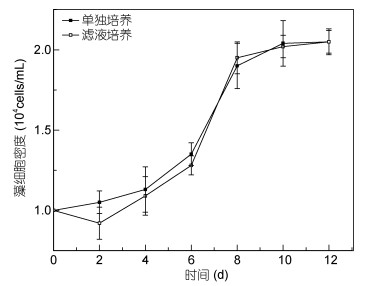 |
| 图 3 剧毒卡尔藻在东海原甲藻滤液中的生长 Fig. 3 The growth curve of K. veneficum in P. donghaiense filtrate |
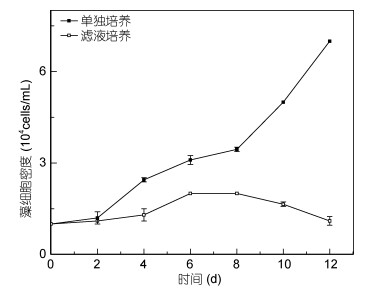 |
| 图 4 东海原甲藻在剧毒卡尔藻滤液中的生长 Fig. 4 The growth curve of P. donghaiense in K. veneficum filtrate |
将剧毒卡尔藻滤液置于SPE C18小柱, 经吸附、解析后, 通过添加不同比例甲醇洗脱的组分考察对东海原甲藻生长的影响。结果表明, 除了20%甲醇洗脱组分对东海原甲藻的生长没有影响以外, 其余各部分都不同程度地抑制了东海原甲藻的生长, 其中80%的洗脱部分抑制效果最为明显, 在整个培养实验过程中, 东海原甲藻的细胞存活率保持在60%左右(图 5)。
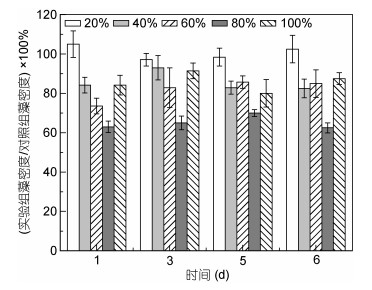 |
| 图 5 不同比例的甲醇溶液洗脱组分对东海原甲藻的生长影响 Fig. 5 Influence on growth of P. donghaiense cells by K. veneficum filtrate with different methanol elution |
进入21世纪后, 我国近海赤潮灾害越发严重, 甲藻等有毒有害赤潮所占比例越来越高, 无毒赤潮向有毒赤潮演替的趋势越来越显著, 关于微藻之间的化感作用也受到了越来越多的重视。化感藻种可以通过释放化感物质到环境中而影响其它藻类的生长, 从而获得竞争优势(Granéli et al, 2008; Żak et al, 2016), Hattenrath-Lehmann等(2011)发现甲藻亚历山大藻属Alexandrium fundyense通过化感作用抑制隐藻Rhodomonas salina、硅藻Thalassiosira pseudonana和Thalassiosira weissflogii的生长而引起浮游植物群落发生改变。本研究选取了两种赤潮肇事甲藻, 一种为新发现的有毒甲藻-剧毒卡尔藻, 该藻种在我国近海海域(香港海域、山东半岛、东海海域等)已发生过大面积的赤潮, 导致鱼虾大量死亡(Wang et al, 2011; 徐娜等, 2012)。另一种为常见的无毒甲藻-东海原甲藻, 这两种藻不仅在我国东海有经常被同时发现的记录, 剧毒卡尔藻甚至可在东海原甲藻赤潮减弱后暴发一定密度的赤潮而发生竞争演替(周成旭等, 2008; Dai et al, 2014), 因此有必要研究这两种微藻间的竞争关系。
为研究这两种微藻间的竞争关系, 首先采用了混合培养的方法, 在混合培养体系中, 剧毒卡尔藻的生长没有受到影响, 而东海原甲藻的生长受到了明显的抑制。在此基础上, 又采用了滤液交叉培养的方法, 与单独培养对照组相比, 剧毒卡尔藻的生长并没有发生变化, 而东海原甲藻的生长在剧毒卡尔藻滤液中受到了明显的抑制, 剧毒卡尔藻通过产生与释放化感物质到周围水体环境中直接影响了东海原甲藻的生长而获得竞争优势。通过对比东海原甲藻在混合培养和滤液培养中的生长抑制率发现(表 1), 在整个培养过程中, 混合培养组的抑制率都略高于滤液培养组, 因此在混合培养体系中, 除了化感作用这一重要影响因素外, 营养盐、生存空间、细胞接触等因素也可能影响了剧毒卡尔藻与东海原甲藻种间竞争关系。另外Zhou等(2015)发现东海原甲藻与剧毒卡尔藻之间的竞争也可能与剧毒卡尔藻对东海原甲藻的摄食有关。
| 时间(天) | 混合培养抑制率 | 滤液培养抑制率 |
| 0—2 | 0.14 | 0.08 |
| 3—4 | 0.50 | 0.47 |
| 5—6 | 0.64 | 0.35 |
| 7—8 | 0.75 | 0.42 |
| 9—10 | 0.84 | 0.67 |
| 11—12 | 0.90 | 0.84 |
在我国东海海域, 东海原甲藻作为重要的赤潮肇事藻种之一, 近些年来频繁暴发赤潮, 且经常为大规模赤潮。从本文的研究结果可以看出, 在实验室条件下, 剧毒卡尔藻通过化感作用明显抑制东海原甲藻的生长而获得竞争优势。在实际海洋环境中, 有毒甲藻也可能会通过化感作用这一种间竞争方式抑制东海原甲藻的增值, 从而影响东海原甲藻赤潮暴发的规模。如果海洋环境沿着这一方向发生进一步的变化, 当东海原甲藻规模减弱到一定程度时, 东海海域赤潮优势藻种则有可能从无毒东海原甲藻向有毒甲藻转变, 从而发生优势藻种的演替。
因此, 对于有毒甲藻的研究除了关注毒素及毒性作用外, 研究者也应关注藻种自身同其他藻种之间的竞争关系。已有研究表明米氏凯伦藻毒素提取物可作为化感物质对硅藻、鞭毛藻等一些赤潮藻种的生长有一定的抑制作用(Chang, 2011)。Yang等(2011)将米氏凯伦藻分别与东海原甲藻、塔码亚历山大藻混合培养后发现, 微藻共存增强了米氏凯伦藻溶血毒素的合成, 并认为溶血毒素极有可能作为米氏凯伦藻释放的化感物质参与了藻种间的竞争, 然而对于这些有毒甲藻的具体竞争机制仍不清楚(陈宝红等, 2015)。
剧毒卡尔藻作为典型的鱼毒性甲藻, 产生的藻毒素主要包括溶血性毒素、鱼毒素及细胞毒素等(Adolf et al, 2015)。目前剧毒卡尔藻毒素除KmTx1、KmTx2被分离鉴定外, 4, 5-dihydro-KmTx 2, 4, 5-dihydro-dechloro-KmTx 2也相继被发现, 这些藻毒素主要来源于剧毒卡尔藻滤液经C18柱吸附后80%的甲醇洗脱部分(Cai et al, 2016)。本研究在证明了剧毒卡尔藻可以通过释放化感物质明显抑制东海原甲藻生长的基础上, 将剧毒卡尔藻指数生长末期的滤液置于SPE C18小柱, 经吸附、不同比例的甲醇溶液洗脱后发现, 80%的甲醇洗脱部分表现的抑制效果最为明显。我们证实了80%的甲醇洗脱部分除了对东海原甲藻具有明显的化感作用外, 对兔细胞还具有很强的溶血作用(未发表)。因此剧毒卡尔藻产生的生物毒素除了对海洋生物具有毒性外, 还可能参与了藻种间的竞争, 并在种间竞争中占据优势。研究结果不仅为了解剧毒卡尔藻的竞争机制提供了科学依据, 对评估生物毒素作为化感物质在剧毒卡尔藻赤潮优势种形成过程中的作用以及对天然产物的开发都提供了新的思路。
4 结论(1) 滤液交叉培养实验表明剧毒卡尔藻通过化感作用明显抑制了东海原甲藻的生长, 然而抑制程度稍低于在混合培养中的抑制程度。剧毒卡尔藻与东海原甲藻之间的竞争除了化感作用这一重要的影响因素外, 细胞接触、摄食、营养盐等因素也可能影响了这两种微藻之间的竞争关系, 研究结果对于了解有毒甲藻的竞争机制具有重要的意义。东海原甲藻对剧毒卡尔藻则没有抑制作用。
(2) 将剧毒卡尔藻滤液经SPE C18小柱吸附、洗脱, 验证化感效应, 结果发现80%的甲醇洗脱部分较其他洗脱部分对东海原甲藻的生长具有更明显的抑制效果。
王红霞, 陆斗定, 黄海燕, 等. 2011. 东海剧毒卡尔藻的形态特征及其系统进化分析. 植物学报, 46(2): 179-188 |
张议文, 王江涛, 谭丽菊. 2014. 旋链角毛藻对中肋骨条藻化感作用的影响因素及化感物质性质初探. 海洋学报, 36(2): 123-129 DOI:10.3969/j.issn.0253-4193.2014.02.014 |
陈宝红, 谢尔艺, 高亚辉, 等. 2015. 米氏凯伦藻对海洋生物致毒作用的研究进展. 福建水产, 37(3): 241-249 |
周成旭, 孙雪, 冯婧, 等. 2008. 源于中国东海的有毒裸甲藻Karlodinium micrum的显微观察和分子鉴定. 海洋通报, 27(3): 32-37 DOI:10.3969/j.issn.1001-6392.2008.03.006 |
周伟华, 殷克东, 朱德第. 2006. 舟山海域春季浮游植物生物量及东海原甲藻赤潮频发机制初探. 应用生态学报, 17(5): 887-893 DOI:10.3321/j.issn:1001-9332.2006.05.026 |
祝陈坚. 2006. 海水分析化学实验. 青岛: 中国海洋大学出版社
|
徐娜, 逄少军, 刘峰. 2012. 一株桑沟湾赤潮藻的分子鉴定. 海洋科学, 36(4): 13-18 |
Adolf J E, Bachvaroff T R, Deeds J R et al, 2015. Ichthyotoxic Karlodinium veneficum (Ballantine) J Larsen in the upper swan river estuary (Western Australia):ecological conditions leading to a fish kill. Harmful Algae, 48: 83-93 DOI:10.1016/j.hal.2015.07.006 |
Ajani P, Hallegraeff G, Pritchard T, 2001. Historic overview of algal blooms in marine and estuarine waters of New South Wales, Australia. Proceedings of the Linnean Society of New South Wales, 123: 1-22 |
Bjrnland T, Tangen K, 1979. Pigmentation and morphology of a marine Gyrodinium (Dinophyceae) with a major carotenoid different from peridinin and fucoxanthin. Journal of Phycology, 15(4): 457-463 DOI:10.1111/jpy.1979.15.issue-4 |
Braarud T, 1957. A red water organism from Walvis Bay (Gymnodinium galatheanum). Galathea Report 1, pp. 137-138
|
Cai P J, He S, Zhou C X et al, 2016. Two new karlotoxins found in Karlodinium veneficum (strain GM2) from the East China Sea. Harmful Algae, 58: 66-73 DOI:10.1016/j.hal.2016.08.001 |
Chang F H, 2011. Toxic effects of three closely-related dinoflagellates, Karenia concordia, K. brevisulcata and K. mikimotoi (Gymnodiniales, Dinophyceae) on other microalgal species. Harmful Algae, 10(2): 181-187 |
Cosgrove J, Grigo S, Hosja W et al, 2000. The investigation of a dinoflagellate associated with a fish kill event in the Murray River/estuary, Western Australia. In: Proceedings of the 9th International Conference on Harmful Algal Bloom. Australia: UNESCO, 518
|
Dai X F, Lu D D, Guan W B et al, 2014. Newly recorded Karlodinium veneficum dinoflagellate blooms in stratified water of the East China Sea. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 101: 237-243 DOI:10.1016/j.dsr2.2013.01.015 |
Granéli E, Weberg M, Salomon P S, 2008. Harmful algal blooms of allelopathic microalgal species:the role of eutrophication. Harmful Algae, 8(1): 94-102 DOI:10.1016/j.hal.2008.08.011 |
Hattenrath-Lehmann T K, Gobler C J, 2011. Allelopathic inhibition of competing phytoplankton by North American strains of the toxic dinoflagellate, Alexandrium fundyense:evidence from field experiments, laboratory experiments, and bloom events. Harmful Algae, 11: 106-116 DOI:10.1016/j.hal.2011.08.005 |
Legrand C, Rengefors K, Fistarol G O et al, 2003. Allelopathy in phytoplankton-biochemical, ecological and evolutionary aspects. Phycologia, 42(4): 406-419 DOI:10.2216/i0031-8884-42-4-406.1 |
Li A S, Stoecker D K, Coats D W, 2000. Mixotrophy in Gyrodinium galatheanum (DINOPHYCEAE):grazing responses to light intensity and inorganic nutrients. Journal of Phycology, 36(1): 33-45 DOI:10.1046/j.1529-8817.2000.98076.x |
Lu H M, Liao X J, Yang Y F et al, 2008. Effects of extracts from Gracilaria lemaneiform on microalgae. Ecological Science, 27(5): 424-426 |
Nielsen M V, 1996. Growth and chemical composition of the toxic dinoflagellate Gymnodinium galatheanum in relation to irradiance, temperature and salinity. Marine Ecology Progress Series, 136: 205-211 DOI:10.3354/meps136205 |
Pieterse F, Van Der Post D C, 1967. The pilchard of South West Africa (Sardinops ocellata): oceanographical conditions associated with red-tides and fish mortalities in the Walvis Bay Region. Administration of South West Africa, Marine Research Laboratory, p. 14
|
Rice E L, 1984. Allelopathy. 2nd ed. New York, USA: Academic Press, 422
|
Roy S, Alam S, Chattopadhyay J, 2006. Competing effects of toxin-producing phytoplankton on overall plankton populations in the Bay of Bengal. Bulletin of Mathematical Biology, 68(8): 2303-2320 DOI:10.1007/s11538-006-9109-5 |
Terlizzi D E, Stoecker D K, Glibert P M, 2000. Gyrodinium galatheanum: a threat to estuarine aquaculture. In: Flos R, Creswell L eds. Abstracts of Contributions Presented at the International Conference AQUA 2000, Nice, France. Oostende, Belgium: European Aquaculture Society Special Publication, 700
|
Vardi A, Schatz D, Beeri K et al, 2002. Dinoflagellate- cyanobacterium communication may determine the composition of phytoplankton assemblage in a mesotrophic lake. Current Biology, 12(20): 1767-1772 DOI:10.1016/S0960-9822(02)01217-4 |
Wang H X, Lu D D, Huang H Y et al, 2011. First observation of Karlodinium veneficum from the East China Sea and the coastal waters of Germany. Acta Oceanologica Sinica, 30(6): 112-121 DOI:10.1007/s13131-011-0168-6 |
Wang R, Wang J T, Xue Q N et al, 2016. Preliminary analysis of allelochemicals produced by the diatom Phaeodactylum tricornutum. Chemosphere, 165: 298-303 DOI:10.1016/j.chemosphere.2016.09.005 |
Yang J, Deng X R, Xian Q M et al, 2014. Allelopathic effect of Microcystis aeruginosa on Microcystis wesenbergii:microcystin-LR as a potential allelochemical. Hydrobiologia, 727(1): 65-73 DOI:10.1007/s10750-013-1787-z |
Yang W D, Zhang N S, Cui W M et al, 2011. Effects of co-existing microalgae and grazers on the production of hemolytic toxins in Karenia mikimotoi. Chinese Journal of Oceanology and Limnology, 29(6): 1155-1163 DOI:10.1007/s00343-011-0274-5 |
Żak A, Kosakowska A, 2016. Cyanobacterial and microalgal bioactive compounds-the role of secondary metabolites in allelopathic interactions. Oceanological and Hydrobiological Studies, 45(1) DOI:10.1515/ohs-2016-0013 |
Zhou C X, Place A R, Yan X J et al, 2015. Interactions between Karlodinium veneficum and Prorocentrum donghaiense from the East China Sea. Harmful Algae, 49: 50-57 DOI:10.1016/j.hal.2015.08.004 |
 2019, Vol. 50
2019, Vol. 50


