
中国海洋湖沼学会主办。
文章信息
- 苏倡, 刘艳, 蒋鑫, 苏秀榕. 2019.
- SU Chang, LIU Yan, JIANG Xin, SU Xiu-Rong. 2019.
- 基于FT-IR、GC及核磁共振的仿刺参(Apostichopus japonicus)消化道多糖结构解析研究
- PREPARATION AND STRUCTURE ANALYSIS OF APOSTICHOPUS JAPONICUS DIGESTIVE TRACT
- 海洋与湖沼, 50(4): 886-893
- Oceanologia et Limnologia Sinica, 50(4): 886-893.
- http://dx.doi.org/10.11693/hyhz20190300063
文章历史
-
收稿日期:2019-03-31
收修改稿日期:2019-04-29
2. 宁波大学海洋学院 宁波 315211
2. School of Marine Science, Ningbo University, Ningbo 315211, China
仿刺参(Apostichopus japonicus)属于棘皮动物门(Echinodermata)、海参纲(Holothroidea), 作为一种传统的保健食品其食用历史悠久, 已成为国内外常见的、具有较高经济价值的海产品(李妍妍等, 2015)。由于仿刺参营养高并富含多种生物活性成分, 具有重要的经济价值, 已成为我国沿海渔业经济的支柱产业。作为高附加值水产养殖物种, 目前已由传统的小规模养殖逐渐转变为区域性和国际化的产业格局。现代药理研究表明:仿刺参(Apostichopus japonicus)体壁结缔组织、体腔及内脏均含有生物活性物质如粘多糖, 具有丰富的药理活性, 包括抗凝血、抗血栓、抗肿瘤、免疫调节等作用(蒋鑫, 2012; Pangestuti et al, 2018)。仿刺参多糖主要存在于体壁, 也有部分存在于废弃内脏及性腺中(陈涛等, 2010; 张红玲等, 2017)。多糖的功能一是作用于相类似的对应分子, 作为非特异治疗剂调节各种生理功能或干预病理过程; 二是进入机体, 作为信息分子发挥补充调节或抑制作用。随着糖功能基因的发现, 其特异性治疗将不断涌现(Wang et al, 2016)。研究表明, 仿刺参体壁多糖主要分两种:一种为仿刺参糖胺聚糖(holothuria glycosaminoglycan, HG)或粘多糖, 由D-葡萄糖醛酸、D-N-乙酰氨基半乳糖和L-岩藻糖组成的分支杂多糖, 相对分子量为4—5万Da; 另一种为仿刺参岩藻多糖(holothurian fucan, HF), 是由L-岩藻糖构成的直链匀多糖, 相对分子质量在8—10万Da (Albano et al, 1986; 闫冰等, 2004)。两者组成的糖基虽然不同, 但它们的糖链上都有部分基团发生了硫酸酯化, 硫酸酯基质量分数均在30%左右, 为仿刺参所特有(张健等, 2018)。仿刺参体壁多糖前人已有研究成果, 但针对仿刺参消化道多糖的提取工艺却鲜有报道。本文采用酶解法提取仿刺参消化道多糖, 优化了仿刺参多糖的提取工艺, 利用DEAE-Sepharose Fast Flow对仿刺参消化道多糖进行分离纯化, 同时测定其理化性质, 通过FT-IR、GC、NMR对其初级结构进行了探索, 为仿刺参的综合加工、提高仿刺参人工养殖的经济效益提供基础性资料, 更好地推动海参水产养殖业和渔业的发展。
1 材料与方法 1.1 材料复合蛋白酶(3×105U/g)购自广西南宁庞博酶制剂有限公司, DEAE-Sepharose Fast Flow (Amersham公司)和标准单糖购于Sigma公司。
1.2 方法 1.2.1 多糖的制备取仿刺参消化道20g, 匀浆, 加入复合蛋白酶至(1×104U/g), 选取酶解温度、酶解时间、加酶量、pH值作单因素试验, 以多糖得率为判断指标。根据单因素实验的结果设计L9(34)正交试验, 通过统计分析最终确定消化道多糖的最佳提取工艺。采用蒽酮-硫酸法检测多糖含量, 三氯乙酸沉淀法和Sevage法脱蛋白(刘文等, 2013; 李雪珍等, 2017), 考马斯亮蓝法测定蛋白含量, 活性碳脱色法、双氧水脱色法和大孔吸附树脂法脱色(于晓红等, 2017), 利用DEAE-sepharose Fast Flow层析柱纯化, pH为7.5的PBS为洗脱液, 流速为lmL/min。
1.2.2 多糖的理化性质采用葡聚糖凝胶Sephadex G-200柱层析(ϕ2.0×40cm)检测多糖纯度, 以蒸馏水为洗脱液, 洗脱体积150mL, 流速为0.3mL/min, 3mL管, 蒽酮-硫酸法检测。将多糖样品配成0.5mg/mL的溶液, 紫外—分光光度计在190—400nm范围内进行扫描。通过样品是否在260nm和280nm出现吸收峰判断其是否含有其他核酸和蛋白质等杂质。糖醛酸采用咔唑显色、硫酸基采用氯化钡-明胶比浊法(Dodgonson, 1961)测定。
1.2.3 多糖的结构解析取分离后的消化道多糖20mg, 加入2mol/L的三氟乙酸(TFA)20mL, 在105℃下封口水解12h。水解完毕后冷却, 于40℃减压浓缩至干, 加甲醇重复4-5次蒸干, 以除尽TFA。将水解后的多糖样品中按标注单糖衍生化方法进行即可。
气相色谱分析:色谱柱类型为DB-1701(30m× 0.25mm×0.25μm), 载气类型为N2, 进样口温度250℃, 升温程序: 170℃, 2min, 170—250℃, 10℃/min, 250℃保持20min, 色谱柱温250℃, FID检测器, 300℃分流比1︰20。
红外光谱分析:取干燥的多糖样品3.0mg与干燥的KBr在玛瑙研钵中研磨均匀后压片, 使用FT-IR在4000—400cm–1, 范围内进行扫描。
核磁共振测定:称取多糖样品30mg于核磁管中, 用D2O溶解配制成质量分数为4.0%的多糖溶液, 在Bruker-AVANCE 400核磁共振仪进行核磁共振分析。
2 结果与分析 2.1 仿刺参消化道多糖的提取条件 2.1.1 单因素酶解条件不同酶解时间、酶解温度条件下仿刺参消化道多糖得率如图 1所示。当水解时间从开始到4h, 多糖含量随时间延长显著增加, 4h后随着时间的延长, 多糖提取量增加明显变缓(图 1a)。在较低的温度(< 55℃)时, 随着温度的升高, 酶促反应速度随温度上升而加快, 大于55℃以上时, 随着温度升高酶开始变性, 温度的升高能加速酶的变性而使酶失活, 酶活性有减弱的趋势, 多糖得率下降(图 1b)。
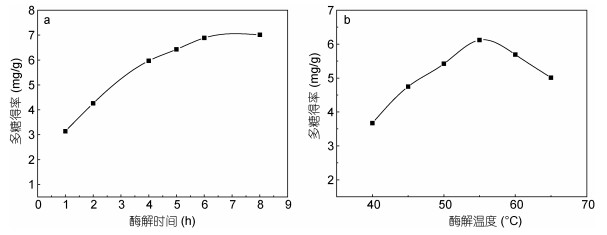 |
| 图 1 提取时间和温度对多糖得率的影响 Fig. 1 Effect of hydrolysis time and temperature on the extraction rate of polysaccharides |
酶加入量、pH条件下仿刺参消化道多糖得率如图 2所示。多糖得率随酶加入量的增大而变大, 当酶加入量大于1.2×104U/g时, 提取多糖含量随酶量增加趋势变小, 说明多糖在此附近基本提取完全(图 2a)。复合蛋白酶含有中性蛋白酶、木瓜蛋白酶、胰蛋白酶等酶类, 各类酶的最适合pH不同, 由图 2b可知pH=6.5时各酶类的降解蛋白功能最好, 多糖得以最大程度释放。因此, 复合蛋白酶最适pH为6.5。
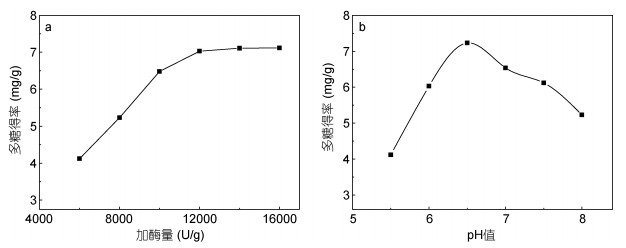 |
| 图 2 加酶量和pH对多糖得率的影响 Fig. 2 Effect of enzyme amount and pH on the extraction rate of polysaccharides |
采用L9(34)正交试验进行水平试验, 实验因素表如表 1所示。正交试验的实验结果显示酶解温度和酶解时间的影响显著, 而酶浓度和pH值影响不大。从正交实验表及结果表中(表 2, 表 3)选择平均数大的水平A3、B2、C1、D3组合成最优水平组合A3B2C1D3, 即在pH=7, 加酶量1.0×104U/g, 60℃下酶解4h。
| 水平 | 因素 | |||
| A 酶解温度(℃) |
B 酶解时间(h) |
C 加酶量(U/g) |
D pH |
|
| 1 | 50 | 2 | 10000 | 6.0 |
| 2 | 55 | 4 | 12000 | 6.5 |
| 3 | 60 | 6 | 14000 | 7.0 |
| 序号 | 酶解温度 | 酶解时间 | 加酶量 | 酶解pH | 多糖得率(mg/g) |
| 1 | 1 | 1 | 1 | 1 | 4.78 |
| 2 | 1 | 2 | 2 | 2 | 6.12 |
| 3 | 1 | 3 | 3 | 3 | 6.43 |
| 4 | 2 | 1 | 2 | 3 | 6.61 |
| 5 | 2 | 2 | 3 | 1 | 7.28 |
| 6 | 2 | 3 | 1 | 2 | 7.29 |
| 7 | 3 | 1 | 3 | 2 | 6.51 |
| 8 | 3 | 2 | 1 | 3 | 7.98 |
| 9 | 3 | 3 | 2 | 1 | 7.79 |
| 均值1 | 5.777 | 5.967 | 6.683 | 6.617 | |
| 均值2 | 7.060 | 7.127 | 6.840 | 6.640 | |
| 均值3 | 7.427 | 7.170 | 6.740 | 7.007 | |
| 极差 | 1.650 | 1.203 | 0.157 | 0.390 | |
| 因素 | 偏差平方和 | 自由度 | F比 | F临界值 |
| 酶解温度* | 4.504 | 2 | 118.526 | 19.00 |
| 酶解时间* | 2.795 | 2 | 73.553 | 19.00 |
| 加酶量 | 0.038 | 2 | 1.000 | 19.00 |
| 酶解pH | 0.287 | 2 | 7.553 | 19.00 |
| 误差 | 0.04 | 2 | ||
| 注: *表示正交因素对多糖提取的影响显著 | ||||
分别采用Sevage法和三氯乙酸法脱除仿刺参消化道多糖提取液中的蛋白。结果显示: Sevage法的蛋白去除率为81.25%, 多糖的损失率20.36%。三氯乙酸法的蛋白去除率为78.83%, 多糖的损失率30.21%。
2.2.2 脱色过透光度的变化研究了利用双氧水、活性碳和D-101型大孔树脂三种脱色。结果显示:双氧水对仿刺参消化道多糖脱色效果明显优于另外两种, D-101大孔树脂脱色后透明度为0.577, 活性炭脱色透明度为0.481, H2O2脱色透明度为0.339。
2.2.3 纯化粗多糖经DEAE-sepharose Fast Flow柱分离收集洗脱液, 洗脱液经过蒽酮-硫酸法测定多糖含量绘制洗脱峰(如图 3), 仿刺参消化道多糖洗脱出两个峰SJAP-Ⅰ和SJAP-Ⅱ。同时发现第二个洗脱峰明显大于第一个峰, 说明仿刺参消化道多糖主要为第二组分SJAP-Ⅱ。
 |
| 图 3 DEAE-sepharose Fast Flow柱分离多糖洗脱峰 Fig. 3 The elution curve of polysaccharide by DEAE-sepharose Fast Flow |
凝胶层析:采用Sephadex G-200柱层析纯化后的SJAP-Ⅱ(如图 4), 得到一对称单一峰。表明其为单一组分, 冻干待用。紫外光谱分析发现SJAP-Ⅱ在260nm和280nm未出现吸收峰, 说明了其不含有核酸和蛋白质等杂质成分。
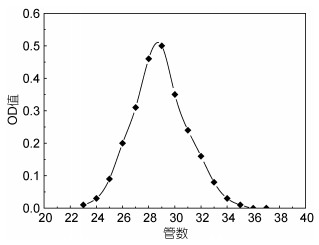 |
| 图 4 Sephadex G-200柱多糖洗脱峰 Fig. 4 The elution curve of polysaccharide by Sephadex G-200 |
采用咔唑法测得糖醛酸浓度-吸光度标准曲线, 回归方程为y = 0.003x + 0.0161, R2= 0.9882, 通过计算, 仿刺参消化道多糖中葡萄糖醛酸的含量为11.8%。氯化钡-明胶比浊法测多糖中硫酸基含量, 得线性回归方程y = 0.2981x– 0.0298, R2= 0.9916, 计算得仿刺参消化道多糖硫酸基含量为20.6%。
2.3.3 多糖的红外光谱图多糖SJAP在3403.85cm–1附近处的吸收波数为O-H伸缩振动, 2932.95cm–1为C-H伸缩振动, 说明此氢键为分子内缔合氢键, 此两处的峰为糖的特征吸收峰, 由此可以判断为多糖类物质。3700—3100cm–1为O-H和N-H的伸缩振动, 1070—1010cm–1为O-H变角振动; 2923cm–1、2851cm–1为-CH2-的C-H伸缩振动; 1660—1550cm–1为二级氨基N-H变角振动和羧基C=O非对称伸缩振动, 1402cm–1为羧基C=O对称伸缩振动。1251cm–1为S=O伸缩振动; 1000—1200cm–1间比较大的吸收峰是由两种C-O伸缩振动所引起的, 其中一种是属于C-O-H的, 另一种是糖环的C-O-C(图 5)。
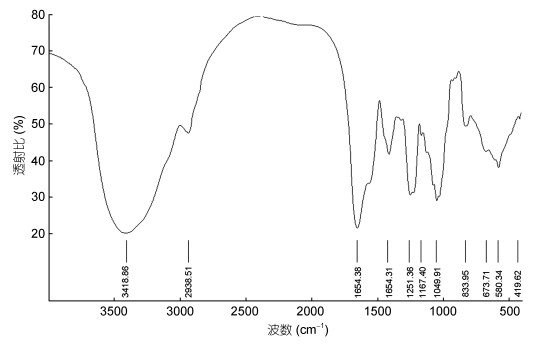 |
| 图 5 多糖红外光谱图 Fig. 5 FT-IR spectrum of polysaccharide |
GC分析表明SJAP-Ⅱ是杂多糖, 它由鼠李糖、岩藻糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖六种单糖组成, 其摩尔比为1︰32.86︰14.56︰1.66︰0.78︰10.43 (图 6)。
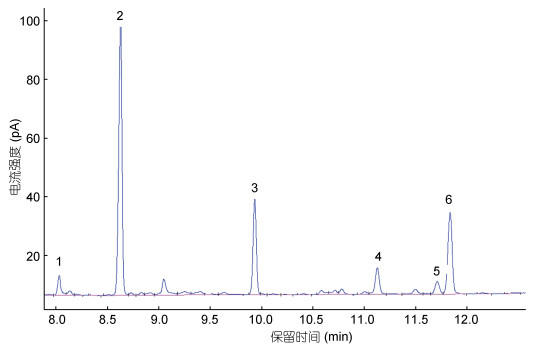 |
| 图 6 SJAP-Ⅱ多糖气相色谱图 Fig. 6 The gas chromatogram spectrum of SJAP-Ⅱ 注: 1.鼠李糖, 2.岩藻糖, 3.阿拉伯糖, 4.甘露糖, 5.半乳糖, 10.葡萄糖 |
从图 7中1H-NMR核磁共振图可知, 仿刺参消化道多糖样品具有糖类的特征信号, 即化学位移在4.072、4.189、4.798ppm有较强的信号出现。化学位移4.798ppm小于4.95ppm, 表明为β型毗喃已糖的C1质子。
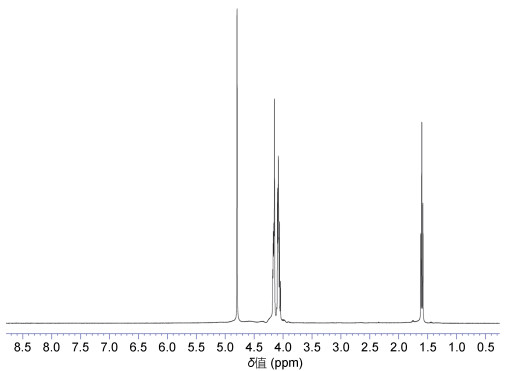 |
| 图 7 多糖核磁共振1H谱 Fig. 7 The 1H-NMR spectrum of polysaccharide |
13C-NMR谱有较大的化学位移范围, 自旋-自旋耦合的相对简单, 分辨率好, 与溶剂峰重叠很少。如图 8多糖13C-NMR核磁共振图可知, 105.12、104.34、103.96、103.87ppm为异头碳的化学位移, 表明至少可能存在四个单糖。同时该信号表示为β型葡萄糖毗喃糖苷的端基碳信号, 与1H-NMR谱分析结果一致。59.63ppm、62.7lppm为未发生取代的C6的化学位移, 非端基碳(C2, C3, C4及C5)信号在70.54—76.28ppm之间, 取代质子信号78.91ppm的峰表示样品为l, 4-糖苷键连接。
 |
| 图 8 多糖核磁共振13C谱 Fig. 8 The 13C-NMR spectrum of polysaccharide |
多糖提取的关键问题是不仅要降解蛋白聚糖整体分子中的核心蛋白链, 更重要的是同时要破坏多糖链与蛋白质的共价结合, 从而释放出多糖链。提取多糖的常用方法有热水浸提法、稀酸浸提法、稀碱浸提法、酶解法和超声法等(李妍妍等, 2015; 丁卫军等, 2016; Kumar et al, 2016; Ben Romdhane et al, 2017)。热水浸提法提取效率不高; 稀酸浸提法, 要求时间短、温度低, 条件控制不好易使多糖发生降解; 稀碱提取, 虽然可以提高多糖得率, 但对多糖的生物活性有很大影响。本实验选用酶法提取仿刺参消化道中的多糖, 该多糖属于动物性多糖, 选用对肽键断裂作用专一性低的蛋白酶, 复合蛋白酶作为水解酶。复合蛋白酶酶解时, pH接近中性, 与胃蛋白酶或胰蛋白酶相比, 酶解条件相对温和, 避免多糖在酶解过程中发生降解作用, 充分保持多糖的生物活性。在确定单因素酶解温度、水解时间、酶浓度实验基础上, 通过正交实验对提取工艺进行优化, 确定了仿刺参消化道多糖的最佳提取工艺。
多糖结构复杂, 组成单糖的种类较多, 又因为单糖的连接顺序、连接位置以及糖苷键构型的不同使其结构鉴定困难, 只有充分结合多种分析方法, 才有可能判断出多糖的一级结构(Ustyuzhanina et al, 2017; 刘贺等, 2018)。Kariya等(2004)研究日本刺参的单糖组成时发现, 该多糖的主要单糖构成为岩藻糖, 主链为类硫酸软骨素结构, 葡萄糖醛酸(GlcUA)、氨基半乳糖(GalN)和岩藻糖(Fuc)的摩尔比为1︰1︰2。樊绘曾(1983)对玉足刺参酸性粘多糖(SVⅠ)和刺参粘多糖(SJAMP)的组成进行研究, 发现二者均由GlcUA、GalN和Fuc组成, 其分子比值分别为1︰1.21︰1.29和1︰1.11︰1.20, 说明仿刺参多糖中Fuc含量最高, Fuc含量在很大程度上决定其抗凝血和抗血栓活性。仿刺参消化道多糖由鼠李糖、岩藻糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖六种单糖组成, 其摩尔比为1︰29.86︰14.56︰1.66︰0.78︰10.43, 其中岩藻糖的含量最高。测得多糖糖醛酸和硫酸基的含量分别为11.8%和20.6%, 其中硫酸基含量较高, 这为海参多糖所特有, 而海参消化道多糖也同样具有较高的功能活性。在核磁分析中, 由于不同糖残基中非异头质子的亚甲基和次甲基的化学位移非常接近, 使得1H-NMR谱图中的大多数质子共振峰集中在3.0—4.5ppm, 1H-NMR谱峰严重重叠。非端基碳C2—C6上质子的信号堆集在3.0—4.8ppm范围内, 难以解析。异头碳C1上质子的信号分布在4.8—5.5ppm, 解析相对容易。一般情况下, α型吡喃糖1H质子化学位移大于4.95ppm, C1化学位移97—101ppm, β型吡喃糖1H质子化学位移小于4.95ppm, C1化学位移103—105ppm, 借此可以判断糖环的构型(Holmbeck et al, 1994; Whittaker et al, 1994; Zhang et al, 2017), 同时根据信号的线宽和积分可用来确定糖单元的种类及其相对含量。综合分析1H-NMR和13C-NMR谱图结果, 证实仿刺参消化道多糖含有β型毗喃已糖, 且主要是以l, 4-糖苷键连接。
4 结论在pH 7, 加酶量1.2×104U/g, 酶解温度60℃, 酶解时间6h的条件下, 采用Sevage法脱蛋白, H2O2法脱色, 可获得高产量的仿刺参消化道多糖。该多糖由6种单糖组成, 其中岩藻糖含量最高, 硫酸基含量20.6%, 含有β型毗喃已糖, 主要以l, 4-糖苷键连接。仿刺参消化道多糖具有多种重要的生理功能, 是具有深入利用前景的优质海洋资源。
丁卫军, 楚占营. 2016. 天然产物中活性多糖提取纯化技术进展. 生命科学仪器, 14(S2): 20-24 |
于晓红, 吴宪玲, 付薇, 等. 2017. 西洋参多糖脱色脱蛋白方法研究. 中国食品学报, 17(11): 145-149 |
刘文, 张悦容, 李晔, 等. 2013. 牡蛎体液主要呈味物质的测定及脂类成分分析. 核农学报, 27(10): 1518-1524 DOI:10.11869/hnxb.2013.10.1518 |
刘贺, 张红运, 杨立娜, 等. 2018. 多糖化学结构解析研究进展. 渤海大学学报(自然科学版), 39(2): 97-106 DOI:10.3969/j.issn.1673-0569.2018.02.002 |
闫冰, 李玲, 易扬华. 2004. 海参多糖的生物活性研究概况. 药学实践杂志, 22(2): 101-103 DOI:10.3969/j.issn.1006-0111.2004.02.013 |
李妍妍, 戴娟, 胡玲萍, 等. 2015. 仿刺参(Apostichopus japonicus)和海地瓜(Acaudina leucoprocta)体壁多肽的响应面法酶解和N末端测序. 海洋与湖沼, 46(3): 620-627 |
李雪珍, 郭家文. 2016. 蒽酮浓硫酸法测定多糖含量显色条件的研究. 中国糖料, 39(2): 15-17,20 |
张健, 刘芳, 张金浩, 等. 2018. 海参多糖制备、化学分析及生物活性研究进展. 食品安全质量检测学报, 9(8): 1370-1376 |
张红玲, 韦豪华, 李兴太. 2017. 海参多糖的提取分离与生物活性研究进展. 食品安全质量检测学报, 8(6): 2062-2067 DOI:10.3969/j.issn.2095-0381.2017.06.020 |
陈涛, 王茂剑, 张健, 等. 2010. 海参多糖研究进展. 食品工业科技, 31(7): 375-378 |
蒋鑫, 徐静, 苏秀榕, 等. 2012. 海参多糖对急性不完全性脑缺血的保护及抗凝作用的研究. 中国应用生理学杂志, 28(2): 170-172 |
樊绘曾, 陈菊娣, 吕培宏, 等. 1983. 玉足海参酸性多糖的研究. 药学学报, 3: 134-137 |
Albano R M, Mourao P A S, 1986. Isolation, fractionation, and preliminary characterization of a novel class of sulfated glycans from the tunic of Styela plicata (Chordata Tunicata). Biological Chemistry, 261(2): 758-765 |
Ben Romdhane M, Haddar A, Ghazala I et al, 2017. Optimization of polysaccharides extraction from watermelon rinds:structure, functional and biological activities. Food Chemistry, 216: 355-364 DOI:10.1016/j.foodchem.2016.08.056 |
Dodgson K S, 1961. Determination of inorganic sulphate in studies on the enzymic and non-enzymic hydrolysis of carbohydrate and other sulphate esters. Biological Chemistry, 78(2): 312-319 |
Holmbeck S M A, Petillo P A, Lerner L E, 1994. The solution conformation of hyaluronan:A combined NMR and molecular dynamics study. Biochemistry, 33(47): 14246-14255 DOI:10.1021/bi00251a037 |
Kariya Y, Mulloy B, Imai K et al, 2004. Isolation and partial characterization of fucan sulfates from the body wall of sea cucumber Stichopus japonicus and their ability to inhibit osteoclastogenesis. Carbohydrate Research, 339(7): 1339-1346 DOI:10.1016/j.carres.2004.02.025 |
Kumar C S, Sivakumar M, Ruckmani K, 2016. Microwave- assisted extraction of polysaccharides from Cyphomandra betacea and its biological activities. International Journal of Biological Macromolecules, 92: 682-693 DOI:10.1016/j.ijbiomac.2016.07.062 |
Pangestuti R, Arifin Z, 2018. Medicinal and health benefit effects of functional sea cucumbers. Journal of Traditional and Complementary Medicine, 8(3): 341-351 |
Ustyuzhanina N E, Bilan M I, Dmitrenok A S et al, 2017. A highly regular fucosylated chondroitin sulfate from the sea cucumber Massinium magnum:Structure and effects on coagulation. Carbohydrate Polymers, 167: 20-26 DOI:10.1016/j.carbpol.2017.02.101 |
Wang J M, Ge B L, Li Z H et al, 2016. Structural analysis and immunoregulation activity comparison of five polysaccharides from Angelica sinensis. Carbohydrate Polymers, 140: 6-12 DOI:10.1016/j.carbpol.2015.12.050 |
Whittaker D V, Parolis L A S, Parolis H, 1994. Structural elucidation of the capsular polysaccharide expressed by Escherichia coli O20:K83:H26 by high resolution NMR spectroscopy. Carbohydrate Research, 253: 247-256 DOI:10.1016/0008-6215(94)80069-3 |
Zhang W H, Turney T, Meredith R et al, 2017. Conformational populations of β-(1→4) O-Glycosidic linkages using redundant NMR J-couplings and circular statistics. The Journal of Physical Chemistry B, 121(14): 3042-3058 DOI:10.1021/acs.jpcb.7b02252 |
 2019, Vol. 50
2019, Vol. 50


