
中国海洋湖沼学会主办。
文章信息
- 沈伟良, 钱宝英, 薛良义. 2019.
- SHEN Wei-Liang, QIAN Bao-Ying, XUE Liang-Yi. 2019.
- 饥饿和复投喂对大黄鱼(Larimichthys crocea)IGF-Ⅰ、mTOR、MyoD和MHC基因表达的影响
- EFFECTS OF STARVATION AND REFEEDING ON THE EXPRESSION OF IGF-Ⅰ, mTOR, MyoD, AND MHC IN LARGE YELLOW CROAKER LARIMICHTHYS CROCEA
- 海洋与湖沼, 50(4): 894-902
- Oceanologia et Limnologia Sinica, 50(4): 894-902.
- http://dx.doi.org/10.11693/hyhz20181200287
文章历史
-
收稿日期:2018-12-07
收修改稿日期:2019-03-02
2. 宁波市海洋与渔业研究院 宁波 315103;
3. 台州学院 浙江省植物进化 生态学与保护重点实验室 台州 317000
2. Ningbo Academy of Oceanology and Fishery, Ningbo 315103, China;
3. Zhejiang Province Key Laboratory of Plant Evolutionary Ecology and Conservation, Taizhou University, Taizhou 317000, China
大黄鱼(Larimichthys crocea)属鲈形目(Perciformes), 石首鱼科(Perciformes), 黄鱼属(Larimichthys), 为暖湿狭温性洄游鱼类, 喜集群, 主要分布在我国东部近海区域, 如南海、黄海南部和东海约80m以内的近大陆沿岸中底层水域, 是我国重要的海洋经济鱼类(段清源等, 2000; 刘家富等, 2011)。在自然水域或者人工养殖过程中, 鱼类会经常因自身原因或环境因素如季节更替、极端天气等而经受缺少食物或者不进食的情况。大部分鱼类都有一定时间的耐饥饿能力, 其往往是通过改变自身的基础代谢水平和消耗食物丰富时体内所储存的营养物质如糖类、脂肪、蛋白质等, 从生理生化、物质代谢等方面来应对饥饿胁迫对鱼体本身的影响(Menezes et al, 2015; Carmen et al, 2017; 夏媛香等, 2018)。由于大黄鱼进食与水体温度有关, 当水体温度高于30 C和低于14 C时摄食明显下降, 且低于10℃时大黄鱼基本停止进食(刘端炜等, 2002), 而浙江沿海冬季海水温度低于10℃, 因此网箱养殖大黄鱼每年都会禁食3个月左右。在此期间, 大黄鱼主要通过调整自身的各项生理代谢及消耗自身所储存的营养物质来应对饥饿。
在鱼类肌肉生长过程中, 其下丘脑—垂体—肝脏轴发挥着重要的生长调控作用, 通过胰岛素样生长因子基因IGF-Ⅰ (insulin-like growth fator-Ⅰ)介导雷帕霉素靶蛋白基因mTOR (mammalian target of rapamycin)、成肌分化抗原基因MyoD (myogenic differentiation antigen)和肌球蛋白重链基因MHC (myosin heavy chain)等基因的表达调控, 实现鱼类肌细胞的增殖、分化。已有研究表明, 肌肉生长过程中胰岛素样生长因子(IGF)—磷酸肌醇三磷酸(PI3K)—丝氨酸/苏氨酸激酶(PKB/Akt)—雷帕霉素靶蛋白(mTOR)代谢通路的激活能有效增加成肌细胞中的蛋白质合成, 其中IGF是一种在肝脏中合成并储存于血液中可促进细胞分裂增殖的多肽, 包括IGF-Ⅰ和IGF-Ⅱ, 与胰岛素的结构与功能相似, 主要与生物体的生长发育有关(Blundel et al, 1978; Rinderknecht et al, 1978; Vasilatos-Younken et al, 1991), 其中IGF-Ⅰ可正向调节肌肉的生长, 如促进肌细胞的增殖、分化并促进细胞中肌管的融合。代谢通路中mTOR为磷脂酰肌醇-3激酶(phosphatidylinositol kinase-related kinases, PIKKS)家族的主要成员之一, 是一种重要的丝氨酸/苏氨酸蛋白激酶(Brown et al, 1994)。在动物如鱼类遭受环境胁迫时, mTOR可将多种胞外信号如盐度压力、营养等整合, 并通过调节蛋白质的合成、能量代谢及控制相关基因的转录和翻译, 进一步调控细胞的生长、分化、增殖以及细胞凋亡, 从而调整生物体器官、组织的各项机能应对环境的变化(Fingar et al, 2004)。MyoD是肌肉生长调节因子MRFs家族(四种转录调节因子包括MyoD, Myf5, MyoG和MRF4等)的成员之一, 在肌肉细胞的形成和分化起正向调控作用(Naidu et al, 1995; Rescan, 2001; Francetic et al, 2011)。MyoD正常表达对鱼类骨骼肌细胞的分化有重要作用, 缺失可导致成肌细胞停止增殖和停止分化, 而过量表达则会抑制肌细胞的增殖, 并促使成肌细胞过早分化成成熟的肌纤维细胞(Rudnicki et al, 1993; Te Pas et al, 2000; Alves et al, 2003)。MHC是马达蛋白-肌球蛋白(Myosin)中的长肽链, 也是肌球蛋白的重要组分, MHC表达变化能引起肌球蛋白含量的改变, 进而引起肌原纤维蛋白含量的改变(Watabe et al, 1997)。
饥饿胁迫对鱼类的生理活动影响涉及多个方面, 而对肌肉生长代谢的影响尤为明显。目前对饥饿胁迫后大黄鱼肌肉生长相关基因表达变化的研究未见报道。本文分析了饥饿胁迫42d并恢复投喂14d期间大黄鱼IGF-Ⅰ、mTOR、MyoD和MHC等4个肌肉生长相关基因的时空表达量变化, 研究结果可为饥饿胁迫对大黄鱼生长影响及补偿生长的分子机制研究提供一定的基础数据。
1 材料与方法 1.1 材料与取样选取象山港湾水产苗种有限公司平均体重(60±2.27)g大黄鱼300尾为试验群体, 暂养于3m×3m×4m规格网箱中, 每箱150尾。经停食适应3d后, 每天早晚各以鱼糜饱食投喂一次, 正常养殖7d后随机分组开始实验。其中实验组停止投喂, 饥饿42d后恢复投喂鱼糜, 恢复投喂期为14d。对照组正常投喂, 不进行饥饿处理。
分别在饥饿胁迫处理0、7、14、21、28、35、42d和恢复投喂7、14d, 从对照组和实验组各取6尾大黄鱼, 经麻醉后取肝脏、脾脏、脑、心脏、肠、鳃、肌肉和肾组织, 样品储存于RNA保存液中, 带至实验室立即保存于–20℃冰箱中。
1.2 基因表达分析用高纯度总RNA抽提试剂盒(RP1201)(北京百泰克生物技术有限公司)进行总RNA的提取, 按照试剂盒说明书进行提取操作, 后用1%琼脂糖凝胶(上海生工生物工程技术服务有限公司)检测RNA的完整性, 并用NanoDrop2000超微量紫外分光光度计(美国托摩根科技有限公司)测定浓度和纯度, 提取的总RNA保存于–80℃超低温冰箱备用。cDNA合成使用PrimeScriptTM RT Reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒(TaKaRa, 大连), 并以说明书要求进行反转录操作。
根据本实验室转录组测序获得的大黄鱼MyoD、IGF-Ⅰ、mTOR、MHC基因cDNA序列, 以β列肌动蛋白(β-actin)为内参基因使用Primer premier 5.0设计β-actin、MyoD、IGF-Ⅰ、mTOR、MHC引物, 并送华大公司合成。引物名称及序列见表 1。
| 基因 | 正向引物或反向引物 | 引物序列(5′—3′) |
| β-actin | 正向(F) | GCTGTCCCTGTATGCCTCTG |
| 反向(R) | CTCGGCTGTGGTGGTGAAG | |
| MyoD | 正向(F) | CGGCTCAGTAAAGTCAACGA |
| 反向(R) | TGATGGCGTTGCGAAGGA | |
| MTOR | 正向(F) | GGGAATGTTTGCTGTGCT |
| 反向(R) | ATCAAGTCCCTGCCGTAA | |
| IGF-Ⅰ | 正向(F) | TTCAAGAGTGCGATGTGC |
| 反向(R) | GCCGTAGCCTGTTGGTTT | |
| MHC | 正向(F) | TTGTGGATGGTTGTCCGTAT |
| 反向(R) | AAAGCCAGCAATGTCCAG |
实时荧光定量PCR反应体系(20μL)为: 10μL FastStart Universal SYBR Green Master (Roche)、0.4μL正向引物(10μmol/L)、0.4μL反向引物(10μmol/L)、1μL cDNA模板、8.2μL无菌水。热循环反应条件包括: 95℃预变性10min; 95℃变性15s, 59℃退火40s, 40个循环, 72℃延伸20s。将cDNA模板以5为单位进行6个梯度的稀释, 用于制作目的基因和内参基因的标准曲线。目的基因的mRNA表达采用2–ΔΔCT方法来计算目的基因的表达倍数(Schmittgen et al, 2008), 然后用SPSS软件(版本21.0)进行单因素方差分析, 且P < 0.05表示存在显著差异。
2 结果 2.1 大黄鱼不同组织中四个基因的表达分析以大黄鱼肝脏组织中基因各自表达量为参照, 不同组织间四个基因的相对表达量均存在极显著差异(P < 0.01)(图 1)。其中MyoD基因除肝脏、心脏、鳃、肾组织的相对表达量无显著差异外, 脾脏、脑、肠、肌肉组织均显著高表达, 且脑中表达量最高。mTOR基因在脾脏、心脏组织中显著高表达, 而在脑、肠、鳃、肌肉和肾组织中相对表达量显著低于肝脏组织。IGF-Ⅰ基因在除肝脏组织显著高表达外, 其他组织中相对表达量均较低, 而MHC基因仅在肌肉组织中显著高表达, 其他组织相对表达量均不存在显著差异。
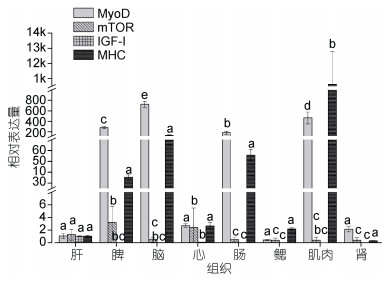 |
| 图 1 基因MyoD、mTOR、IGF-Ⅰ、MHC在大黄鱼不同组织中的qPCR分析 Fig. 1 qPCR analysis of MyoD, mTOR, IGF-Ⅰ, and MHC in the different tissues of the large yellow croaker |
对照组样品与实验组饥饿0d样品相比, 基因表达量无显著差异; 对照组同一组织的基因表达量在不同实验时间段之间无显著性差异。以正常投喂条件下MyoD基因在大黄鱼不同组织中的表达量作为参照, 饥饿处理后MyoD基因在不同组织中呈现不同的表达变化规律。其中脾、脑和肠组织在进行饥饿处理7d后表达显著下降至接近不表达(图 2)。肝脏中MyoD基因表达量在饥饿胁迫开始时出现显著表达上调后随胁迫时间降低, 至饥饿42d时几乎不表达; 恢复投喂14d后表达水平部分恢复, 但相比饥饿前对照时正常水平, 表达量仍显著下调。心脏中MyoD基因表达受饥饿胁迫表达与饥饿前对照相比显著下调, 在饥饿28d时表达量最低; 恢复投喂后表达相比饥饿期显著升高, 但与表达量与饥饿前仍显著降低。鳃中MyoD表达量变化趋势为先上升, 且差异极显著, 在饥饿28d时表达量最大, 后逐步降低, 不论饥饿还是恢复投喂期均显著高于饥饿前对照水平。肌肉中MyoD表达量变化呈现鳃中类似规律, 在饥饿初期至21d时显著上升, 饥饿21d时表达量最高, 随着饥饿时间的持续, 缓慢回落直至饥饿42d时恢复到饥饿前水平, 恢复投喂后表达量又急剧升高, 此后恢复至对照组水平。在肾脏组织MyoD表达量在饥饿14d时显著下调, 饥饿21d时表达量显著上升, 而后表达量均显著下降。
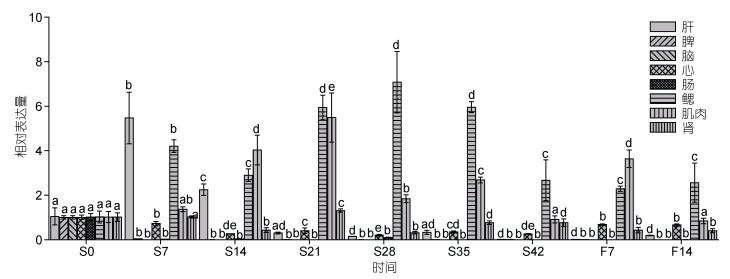 |
| 图 2 基因MyoD在大黄鱼组织中的qPCR分析 Fig. 2 qPCR analysis of MyoD in the tissues of the large yellow croaker 注: S代表饥饿, F代表恢复投喂。下同 |
以正常投喂条件下mTOR基因在大黄鱼不同组织中的表达量作为参照, 当受到饥饿胁迫时, mTOR表达量在不同时长胁迫处理后的大黄鱼不同组织中出现了不同的变化。在肝脏中(图 3), mTOR表达量在饥饿胁迫开始时表达显著上调后下调, 并在21d时出现二次升高后持续表达下调持续至42d, 恢复投喂后持续上调并在恢复投喂14d时相对饥饿前对照呈显著表达上调。在脾脏中, 无论是饥饿胁迫处理还是恢复投喂, mTOR表达量都呈下降趋势, 且差异极显著, 在饥饿14d时表达量最低。在脑中mTOR表达量总体趋势呈上升趋势并呈现出表达上调双峰形态, 且饥饿35d时表达量最大, 饥饿42d时仍显著高于对照水平; 恢复投喂7d时又小幅上升, 但与饥饿42d时差异不显著, 恢复投喂14d时恢复至正常对照水平。在心脏中, mTOR表达量在饥饿胁迫下均显著下调, 至饥饿28d时达到最低; 恢复投喂后则上调表达, 至复投喂7d时恢复至饥饿前水平, 在复投喂14d时表达极显著上调。在肠组织中, mTOR表达在饥饿7d时极显著上调, 在饥饿14时恢复至饥饿前水平, 21d至42d表达量显著下调; 恢复投喂后略有回升, 但相比对照组, 表达量仍显著下降。在鳃组织中, mTOR表达规律同心脏相似, 也呈现明显双峰形态, 在饥饿28d时表达量最大, 饥饿42d时恢复至饥饿前水平; 恢复投喂7d后表达显著上调, 至复投喂14d时表达量恢复至饥饿前水平。在肌肉中, mTOR表达量在整个实验过程中均显著上调, 且在饥饿21d、35d处呈现上调双峰, 总体趋势是先上升后慢慢回落再上升再回落的过程。在肾脏组织中, mTOR表达在整个饥饿胁迫期除14d外均下调状态, 且在饥饿35d时表达量最低; 在恢复投喂后表达量恢复至饥饿前对照水平, 并在恢复投喂14d时表达显著上调。
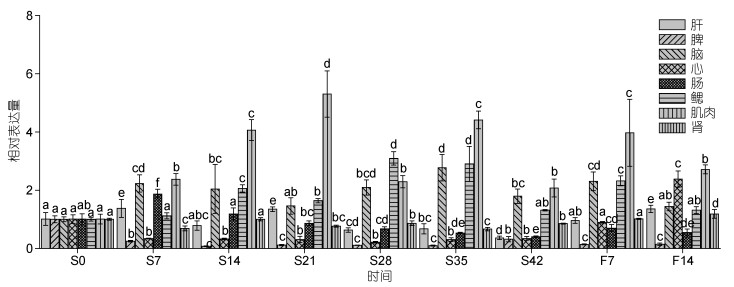 |
| 图 3 基因mTOR在大黄鱼组织中的qPCR分析 Fig. 3 qPCR analysis of mTOR in the tissues of the large yellow croaker |
以正常投喂条件下IGF-Ⅰ基因在大黄鱼不同组织中的表达量作为参照, 受饥饿胁迫后表达量变化明显。在肝脏组织中(图 4), IGF-Ⅰ基因受饥饿胁迫, 表达量显著下调, 在42d时表达量最低; 恢复投喂后表达量逐步上调, 复投喂7d时仍显著低于对照, 至复投喂14d时表达量显著高于对照组。在脾脏组织中IGF-Ⅰ表达量的总体变化趋势为升高-降低-恢复的规律, 在饥饿7d时表达量最大, 后逐步回落, 21d时恢复对照水平并保持至饥饿结束; 恢复投喂7d时表达量显著升高, 再恢复至饥饿起始对照水平。在脑组织中, 饥饿周期中的IGF-Ⅰ表达量变化也表现为升高-降低-升高-恢复的双峰趋势, 在饥饿7d、35d表达量上升极显著, 且在饥饿35d时表达量最大; 恢复投喂7d后IGF-Ⅰ表达量显著上升, 在复投喂14天时恢复至对照水平。在心脏中, 饥饿和恢复投喂期间, 基因IGF-Ⅰ表达量都呈显著降低, 且差异极显著, 在饥饿42d时表达量最低。在肠组织中, 饥饿14d时IGF-Ⅰ表达量远大于其他时间段的表达量, 并随饥饿胁迫呈升高-降低-升高的趋势, 仅复投14d时表达量与对照无显著变化。在鳃组织中, 饥饿期IGF-Ⅰ表达量总体变化趋势为饥饿胁迫7d和35d高表达的双峰形态, 除21d时表达水平与对照组无显著差异外, 均呈高表达状态; 恢复投喂后IGF-Ⅰ表达显著上调, 在复投喂14d后恢复至对照水平。在肌肉组织中, IGF-Ⅰ表达量的总体变化趋势为先升高后降低波浪趋势, 在饥饿7d时, 表达量无变化, 14d时表达量显著升高, 21d时恢复到饥饿前水平, 至饥饿28d时, 表达量显著降低, 35d时又恢复至饥饿前水平, 但饥饿42d时下降极显著; 恢复投喂7d时, 表达量突然升高, 差异显著, 而恢复投喂14d时又显著降低。在肾脏组织中, IGF-Ⅰ表达量变化呈现与肌肉相同的先升高后降低的波浪形态, 在饥饿14d时表达量显著上升, 然后下降, 在饥饿28d表达量再次显著上升后下降, 至35d后恢复至正常对照水平; 恢复投喂7d时显著提高IGF-Ⅰ在肾中的表达, 而后表达量下降至对照水平。
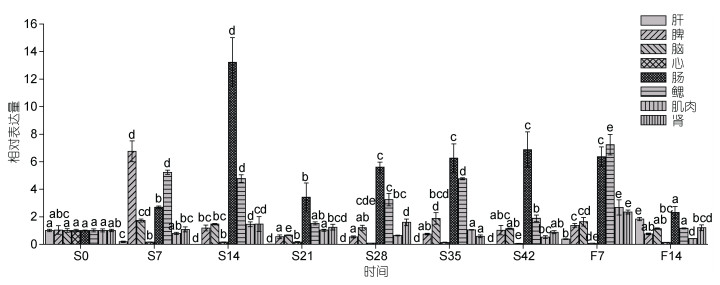 |
| 图 4 基因IGF-Ⅰ在大黄鱼组织中的qPCR分析 Fig. 4 qPCR analysis of IGF-Ⅰ in the tissues of the large yellow croaker |
与MyoD类似, 饥饿胁迫后MHC在脾、脑和肠(图 4)组织中几乎不表达。在肝脏组织中, MHC在饥饿14d、28d、42d和恢复投喂7d时几乎不表达, 饥饿7d、21d、35d、恢复投喂14d时微量表达, 与对照组相比表达量极显著下调。在心脏组织中, MHC表达量相比饥饿胁迫前呈先升高再降低后恢复的趋势, 且饥饿28d时达到最低。在鳃组织中, MHC表达量趋势为降低—升高—降低—升高—降低, 在饥饿7d时, 表达量显著下降, 饥饿14d至28d时, 表达量显著上调并趋于下降, 至饥饿35d和饥饿42d时, 表达量恢复到饥饿前水平; 恢复投喂期间表达量显著上升, 并随恢复投喂时间表达量趋于下降, 但均与对照水平差异显著。在肌肉组织中, MHC表达量呈上升-回复-上升的趋势, 在饥饿21d时, 表达量最大, 其次为饥饿35d;恢复投喂7d时表达量仍显著上升, 至恢复投喂14d时, 表达量恢复至对照水平。在肾组织中, MHC表达量与饥饿前相比, 都呈下降趋势, 且差异显著, 虽在饥饿14d至21d期间稍有回升, 但仍显著低于饥饿前对照水平。
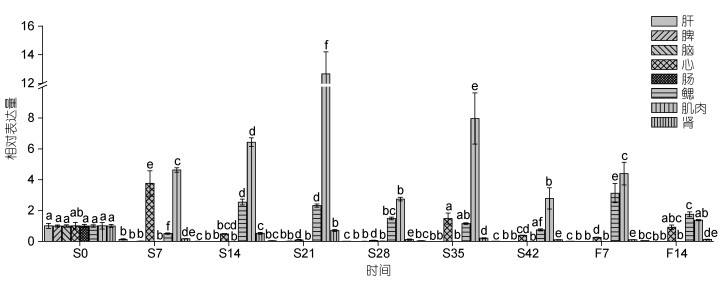 |
| 图 5 基因MHC在大黄鱼组织中的qPCR分析 Fig. 5 qPCR analysis of MHC in the tissues of the large yellow croaker |
张玉青(2008)对MyoD基因在牙鲆(Paralichthys olivaceus)成鱼不同组织中的表达情况进行研究后发现, MyoD表达量在肌肉组织中最高, 在其他组织如脾脏、肾脏、心脏、肠、胃、眼和鳃中的表达量都少于肌肉组织中的表达量。黄颡鱼不同组织的MyoD表达量也存在差异, 表现为肌肉中最高, 其次是肠组织和胃(梁宏伟等, 2012)。陈丽萍发现饥饿和恢复投喂对团头鲂(Megalobrama amblycephala)幼鱼MyoD基因在白肌中的表达有显著影响, 随着饥饿时间的持续, 其表达量呈升高趋势, 且在饥饿21d和恢复投喂7d时显著升高, 后随着恢复投喂时间的延长, 表达量逐渐降低(陈丽萍, 2013)。在本实验中, 饥饿胁迫和恢复投喂对MyoD基因在大黄鱼肝脏、鳃和肌肉组织中的表达影响较大, 其中在饥饿7d对大黄鱼MyoD基因在肝脏组织中表达的影响远胜于其他饥饿和恢复投喂时间, 而在肌肉中表达的变化趋势同陈丽萍的研究结果类似, 也是在饥饿21d和恢复投喂7d时显著升高, 而在恢复投喂14d时逐渐降低。这一结果预示MyoD基因作为肌肉细胞生长的重要基因在补偿生长中可能发挥着重要的调控作用。此外, 饥饿和恢复投喂显著影响了MyoD基因在鳃中的表达量, 其意义有待于进一步研究。
在本实验中, mTOR基因在大黄鱼饥饿及恢复投喂期间, 与对照组相比, 脾脏的表达量都极显著降低, 而在脑组织、鳃组织和肌肉组织中表达量都显著升高。Woods等(2008)发现, mTOR信号通路是下丘脑发挥作用的主要通路之一, 且对生物体体重变化和食物摄入等敏感。由于脑组织特别是下丘脑, 是整合协调营养如食物摄入、生存和生物节律等多种信号的主要区域, 大黄鱼在饥饿胁迫下, 营养物质摄入停止, 体重出现不同程度下降, 从而导致对营养等敏感的mTOR基因的表达量上升, 来维持自身内环境的稳定。同时mTOR基因对维持肌肉细胞、防止肌肉萎缩具有重要作用(曾凡星等, 2011), 本实验中肌肉组织mTOR基因的持续高表达可能与大黄鱼在饥饿胁迫下持续肌肉组织稳定并提供基础摄食、避险运动能力相关。此外, mTOR基因在鳃组织中表达量上升极显著, 特别是饥饿14—35d时, 表达量上升极显著, 这可能是鳃作为鱼类呼吸器官, 相比其他组织, 含氧量极丰富且富含毛细血管, 从而使与血管系统密切相关的mTOR基因表达量相应增加, 以维持机体的正常生理活动。
IGF-Ⅰ基因在肝脏中大量表达, 同时在其他组织中也有少量的表达, 如Otteson等(2002)在硬骨鱼的脑组织、胃组织、肾脏和胰脏等都有发现IGF-Ⅰ基因的表达。此外, IGF-Ⅰ基因的表达受鱼类营养贫瘠状况(如饥饿胁迫导致营养摄入不足)的影响。日本鳗鲡(Anguilla japonica)在饥饿14d后, IGF-Ⅰ基因在肝脏组织的表达量显著下降(Duan et al, 1992); IGF-Ⅰ基因在长时间饥饿胁迫的银大马哈鱼(Oncorhynchus kisutch)肝脏组织中表达量也显著下降, 研究结果与日本鳗鲡一致(Gray et al, 1992); 类似的结果同样在奥利亚罗非鱼(Oreochromis mossambicus) (Uchida et al, 2003; Fox et al, 2009)、斜带石斑鱼(Epinephelus coioides) (Pedroso et al, 2006)、斑点叉尾 
有研究发现MHC基因在鳜鱼中的表达在肌肉效应期之后, 且表达量在鱼苗和成鱼中较高, 在成体鳜鱼不同组织的MHC基因表达量分析发现, MHC基因在肌肉组织中的表达量最为丰富, 心脏组织中有少量的表达, 但其他组织如脑组织、肾脏和脾脏等几乎不表达(符贵红, 2007), 这与大黄鱼脑与脾组织中MHC基因的高表达模式存在差异。本实验在对大黄鱼进行饥饿胁迫和复投喂处理后, MHC基因在肌肉、鳃和心脏中均有表达, 如在肌肉组织中, MHC基因在饥饿胁迫和复投喂期间表达量都极显著上升, 且在饥饿21d时表达量最大。此外, 在鳃组织中, 饥饿期间MHC基因的表达量也呈显著上升, 而在心脏组织中, 只有饥饿起始阶段的高表达, 如在饥饿7d时MHC基因表达量显著上升, 随着饥饿时间的延长, 表达量都显著下降甚至不表达。在饥饿胁迫和恢复投喂期间MHC基因表达量显著升高的原因可能是大黄鱼肌肉组织对营养胁迫的一种应激反应。
大黄鱼肌肉的分化、生长和发育受饥饿胁迫的影响较大, 在分子水平上, 则表现为成肌纤维蛋白合成密切相关的基因IGF-Ⅰ、mTOR、MyoD和MHC等表达量的增加或减少来调节成肌纤维蛋白合成量, 实现鱼体生长的调节。其中IGF-Ⅰ和mTOR同属正向调控通路, 在增加成肌细胞中蛋白质合成等个体生长正调控方面有着重要作用。IGF-Ⅰ通过与其受体结合后可促进代谢通路中下游调节因子如mTOR的合成, 当受到饥饿胁迫时, 机体显著降低IGF-Ⅰ在肝脏的表达量, 并降低IGF-Ⅰ蛋白质合成, 而作为调节因子mTOR表达量也随之降低, 从而调节肌肉组织中成肌纤维蛋白的合成, 降低肌肉组织细胞的生长和增殖。本实验中, 饥饿期间IGF-Ⅰ在肝脏中表达量下降极显著, 调节饥饿期细胞生长与增殖以适应饥饿胁迫, 提高机体生存能力。此外, MyoD作为肌肉生长调节因子, MyoD的过量表达可抑制肌细胞的增殖(Rudnicki et al, 1993; Te Pas et al, 2000; Alves et al, 2003), 在本实验饥饿胁迫期间, MyoD肌肉组织中表达量同对照组相比显著上升, 可能与大黄鱼在饥饿胁迫时采用MyoD过量表达策略, 实现减少肌细胞增殖以适应饥饿胁迫环境有关。同时本实验中, 在恢复投喂后IGF-Ⅰ、mTOR表达量恢复至对照组并显著上升, 该结果预示了饥饿后复投喂带来的补偿生长效应可能通过IGF-Ⅰ基因的高表达介导下游基因来实现肌肉细胞的生长与增殖。
4 结论本实验对不同时间饥饿胁迫下大黄鱼IGF-Ⅰ、mTOR、MyoD、MHC基因在脏、脾、心、鳃、肠、肾、肌肉和脑组织的表达量变化进行分析, 初步研究大黄鱼对饥饿条件适应的分子机制, 结果显示:上述基因的表达具有组织特异性, MyoD在大黄鱼脾、脑、肠和肌肉组织中高表达, mTOR在大黄鱼脾和心脏组织中高表达, IGF-Ⅰ基因在肝脏组织表达量最高, 而MHC基因在肌肉组织中高表达。大黄鱼机体感受饥饿胁迫后, 通过调节下丘脑—垂体—肝脏生长轴中肝脏IGF-Ⅰ基因的表达量, 介导MyoD、mTOR、和MHC基因在组织中的表达变化, 以减少细胞的生长分化与增殖, 实现对饥饿环境的适应; 而复投喂显著提高了IGF-Ⅰ的表达, 其生长正调控功能提示鱼类复投喂以后的补偿生长可能与IGF-Ⅰ基因表达量的显著升高存在相关性, 并通过MyoD、mTOR、和MHC基因的协同表达调控实现。
田娟, 涂玮, 曾令兵, 等. 2012. 饥饿和再投喂期间尼罗罗非鱼生长、血清生化指标和肝胰脏生长激素、类胰岛素生长因子-I和胰岛素mRNA表达丰度的变化. 水产学报, 36(6): 900-907 |
刘家富, 韩坤煌. 2011. 我国大黄鱼产业的发展现状与对策. 福建水产, 33(5): 4-8 |
刘端炜, 任全娜. 2002. 大黄鱼网箱养殖技术. 齐鲁渔业, 19(10): 12 |
张玉青, 2008.牙鲆肌肉发育调节基因的克隆、表达及功能分析.青岛: 中国科学院海洋研究所博士学位论文
|
陈丽萍, 2013.饥饿再投喂对团头鲂幼鱼生肌调节因子表达和肌肉特性的影响.武汉: 华中农业大学硕士学位论文
|
段青源, 钟惠英, 斯列钢, 等. 2000. 网箱养殖大黄鱼与天然大黄鱼营养成分的比较分析. 浙江海洋学院学报(自然科学版), 19(2): 125-128 DOI:10.3969/j.issn.1008-830X.2000.02.006 |
夏媛香, 邱汉勋, 闫玉莲. 2018. 饥饿对南方鮎和草鱼的生长及能量代谢的影响. 西南师范大学学报(自然科学版), 43(6): 102-109 |
符贵红, 2007.鳜鱼营养成分分析及肌球蛋白重链基因克隆与表达.长沙: 湖南农业大学硕士学位论文
|
梁宏伟, 李忠, 邹桂伟, 等. 2012. 黄颡鱼MyoD基因的克隆及其表达. 武汉大学学报(理学版), 58(4): 347-353 |
曾凡星, 朱晗, 赵华, 等. 2011. 外源性IGF-Ⅰ对大鼠运动骨骼肌mTOR及下游信号的影响. 北京体育大学学报, 34(4): 47-50 |
Alves H J, Alvares L E, Gabriel J E et al, 2003. Influence of the neural tube/notochord complex on MyoD expression and cellular proliferation in chicken embryos. Brazilian Journal of Medical and Biological Research, 36(2): 191-197 DOI:10.1590/S0100-879X2003000200005 |
Blundell T L, Bedarkar S, Rinderknecht E et al, 1978. Insulin- like growth factor:a model for tertiary structure accounting for immunoreactivity and receptor binding. Proceedings of the National Academy of Sciences of the United States of America, 75(1): 180-184 DOI:10.1073/pnas.75.1.180 |
Brown E J, Albers M W, Shin T B et al, 1994. A mammalian protein targeted by G1-arresting rapamycin-receptor complex. Nature, 369(6483): 756-758 DOI:10.1038/369756a0 |
Carmen M Hidalgo, Amalia E Morales, Marta Arizcun et al, 2017. Regional asymmetry of metabolic and antioxidant profile in the sciaenid fish shi drum (Umbrina cirrosa) white muscle. Response to starvation and refeeding. Redox Biology, 11: 682-687 |
Duan C, Hirano T, 1992. Effects of insulin-like growth factor-I and insulin on the in-vitro uptake of sulphate by eel branchial cartilage:evidence for the presence of independent hepatic and pancreatic sulphation factors. Journal of Endocrinology, 133(2): 211-219 DOI:10.1677/joe.0.1330211 |
Fingar D C, Blenis J, 2004. Target of rapamycin (TOR):an integrator of nutrient and growth factor signals and coordinator of cell growth and cell cycle progression. Oncogene, 23(18): 3151-3171 DOI:10.1038/sj.onc.1207542 |
Fox B K, Breves J P, Hirano T et al, 2009. Effects of short- and long-term fasting on plasma and stomach ghrelin, and the growth hormone/insulin-like growth factor I axis in the tilapia, Oreochromis mossambicus. Domestic Animal Endocrinology, 37(1): 1-11 DOI:10.1016/j.domaniend.2009.01.001 |
Francetic T, Li Q, 2011. Skeletal myogenesis and Myf5 activation. Transcription, 2(3): 109-114 DOI:10.4161/trns.2.3.15829 |
Frantzen M, Damsg rd B, Tveiten H et al, 2004. Effects of fasting on temporal changes in plasma concentrations of sex steroids, growth hormone and insulin-like growth factor I, and reproductive investment in Arctic charr. Journal of Fish Biology, 65(6): 1526-1542 DOI:10.1111/jfb.2004.65.issue-6 |
Gray E S, Kelley K M, Law S et al, 1992. Regulation of hepatic growth hormone receptors in coho salmon (Oncorhynchus kisutch). General and Comparative Endocrinology, 88(2): 243-252 DOI:10.1016/0016-6480(92)90256-J |
Menezes C, Ruiz-Jarabo I, Martos-Sitcha J et al, 2015. The influence of stocking density and food deprivation in silver catfish (Rhamdia quelen):a metabolic and endocrine approach. Aquaculture, 435: 257-264 DOI:10.1016/j.aquaculture.2014.09.044 |
Naidu P S, Ludolph D C, To R Q et al, 1995. Myogenin and MEF2 function synergistically to activate the MRF4 promoter during myogenesis. Molecular and Cellular Biology, 15(5): 2707-2718 DOI:10.1128/MCB.15.5.2707 |
Otteson D C, Cirenza P F, Hitchcock P F, 2002. Persistent neurogenesis in the teleost retina:evidence for regulation by the growth-hormone/insulin-like growth factor-I axis. Mechanisms of Development, 117(1-2): 137-149 DOI:10.1016/S0925-4773(02)00188-0 |
Pedroso F L, De Jesus-Ayson E G T, Cortado H H et al, 2006. Changes in mRNA expression of grouper (Epinephelus coioides) growth hormone and insulin-like growth factor I in response to nutritional status. General and Comparative Endocrinology, 145(3): 237-246 DOI:10.1016/j.ygcen.2005.09.001 |
Rescan P Y, 2001. Regulation and functions of myogenic regulatory factors in lower vertebrates. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 130(1): 1-12 DOI:10.1016/S1096-4959(01)00412-2 |
Rinderknecht E, Humbel R E, 1978. The amino acid sequence of human insulin-like growth factor I and its structural homology with proinsulin. Journal of Biological Chemistry, 253(8): 2769-2776 |
Rudnicki M A, Schnegelsberg P N J, Stead R H et al, 1993. MyoD or Myf-5 is required for the formation of skeletal muscle. Cell, 75(7): 1351-1359 DOI:10.1016/0092-8674(93)90621-V |
Schmittgen T D, Livak K J, 2008. Analyzing real-time PCR data by the comparative CT method. Nature Protocols, 3(6): 1101-1108 DOI:10.1038/nprot.2008.73 |
Small B C, Peterson B C, 2005. Establishment of a time-resolved fluoroimmunoassay for measuring plasma insulin-like growth factor Ⅰ (IGF-Ⅰ) in fish:effect of fasting on plasma concentrations and tissue mRNA expression of IGF-Ⅰ and growth hormone (GH) in channel catfish (Ictalurus punctatus). Domestic Animal Endocrinology, 28(2): 202-215 DOI:10.1016/j.domaniend.2004.09.002 |
Te Pas M F W, Verburg F J, Gerritsen C L M et al, 2000. Messenger ribonucleic acid expression of the MyoD gene family in muscle tissue at slaughter in relation to selection for porcine growth rate. Journal of Animal Science, 78(1): 69-77 DOI:10.2527/2000.78169x |
Uchida K, Kajimura S, Riley L G et al, 2003. Effects of fasting on growth hormone/insulin-like growth factor I axis in the tilapia, Oreochromis mossambicus. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 134(2): 429-439 |
Vasilatos-Younken R, Scanes C G, 1991. Growth hormone and insulin-like growth factors in poultry growth:required, optimal, or ineffective?. Poultry Science, 70(8): 1764-1780 DOI:10.3382/ps.0701764 |
Watabe S, Hirayama Y, Nakaya M et al, 1997. Carp expresses fast skeletal myosin isoforms with altered motor functions and structural stabilities to compensate for changes in environmental temperature. Journal of Thermal biology, 22(6): 375-390 DOI:10.1016/S0306-4565(97)00057-0 |
Woods S C, Seeley R J, Cota D, 2008. Regulation of food intake through hypothalamic signaling networks involving mTOR. Annual Review of Nutrition, 28: 295-311 DOI:10.1146/annurev.nutr.28.061807.155505 |
 2019, Vol. 50
2019, Vol. 50


