
中国海洋湖沼学会主办。
文章信息
- 袁雪梅, 潘晓艺, 郝贵杰, 刘莉, 吕孙建, 蔺凌云, 沈锦玉. 2019.
- YUAN Xue-Mei, PAN Xiao-Yi, HAO Gui-Jie, LIU Li, L Sun-Jian, LIN Ling-Yun, SHEN Jin-Yu. 2019.
- 一例异育银鲫(Carassius auratus gibelio)暴发性出血病病原分析
- ANALYSIS OF PATHOGEN IN AN EXPLOSIVE HEMORRHAGE DISEASE OF CARASSIUS AURATUS GIBELIO
- 海洋与湖沼, 50(4): 913-920
- Oceanologia et Limnologia Sinica, 50(4): 913-920.
- http://dx.doi.org/10.11693/hyhz20190100021
文章历史
-
收稿日期:2019-01-23
收修改稿日期:2019-04-07
鲤疱疹病毒Ⅱ型(Cyprinid herpesvirus 2, CyHV-2)是第2个分离自鲤科鱼的疱疹病毒, 因此国际上将其命名为鲤疱疹病毒Ⅱ型(Cyprinid herpesvirus 2, CyHV-2)。其对金鱼、鲫鱼及其变种具有很高的致病性。1992年秋和1993年春在日本的观赏金鱼中检出CyHV-2, 这是该病毒首次被发现报道(Jung et al, 1995)。第一次在银鲫体内被检出报道是在2011年的匈牙利(Doszpoly et al, 2011), 随后, 关于CyHV-2感染异育银鲫的报道逐渐增多(Daněk et al, 2012; Fichi et al, 2013; Luo et al, 2013; Ito et al, 2014; Wang et al, 2016)。Wang等于2012年首次报道了CyHV-2感染我国异育银鲫, 该病病程发展迅速, 死亡率高达90%—100%, 严重威胁我国鲫鱼养殖业(Wang et al, 2012; Xu et al, 2013)。本文针对出现在江苏省某养殖场异育银鲫的暴发性出血病, 通过细菌、病毒、寄生虫等检测方法, 阐明该病样的主要病原, 可为今后异育银鲫病害防控提供参考依据。
1 材料与方法 1.1 实验材料发病异育银鲫(Carassius auratus gibelio)采自江苏盐城某异育银鲫养殖场, 共40尾, 体长20—25cm。健康异育银鲫购自浙江湖州某异育银鲫养殖场, 体长12cm左右, 经检测为CyHV-2阴性。暂养于本实验室循环养殖系统, 水温控制在23—25℃。
鲫鱼囊胚细胞系(CGB)由国家水生动物病原库馈赠。M199培养基胰酶为Gibco公司产品, 胎牛血清购自杭州天杭生物科技有限公司。pMD-18T购于TaKaRa公司, 2.5%戊二醛购自Sigma公司, GoTaq® Master Mixes购自Promage公司, 质粒DNA少量抽提试剂盒购自axygen公司, SuperReal PreMix (Probe)试剂盒购置天根生化科技有限公司, 组织DNA提取试剂盒购自QIAGEN公司, 其他试剂为国产分析纯。
1.2 细菌的分离及寄生虫观察随机选取病鱼10尾, 在无菌条件下取病鱼的肝脏、脾脏、肾脏等病灶组织, 在TSA平板划线分离, 28℃培养24—48h, 观察有无细菌生长。对随机选取的20尾病鱼进行鳍条、鳃、体表黏液、肝、脾、肾等组织器官的肉眼检查和压片显微镜检, 血液制成涂片显微镜检, 观察有无寄生虫。
1.3 组织病理变化观察取病鱼的鳃、肾脏组织, 置于10%的中性福尔马林中固定, 石蜡包埋切片, H.E染色后中性树胶封片, 显微镜下观察并拍照。
1.4 透射电镜样本制备及电镜观察取病鱼脾脏组织切成小块, 体积不超过1mm×1mm×1mm, 将小组织块迅速投入2.5%戊二醛中固定, 经磷酸盐缓冲液冲洗后, 1%锇酸固定。酒精系列脱水, 苯二甲酸二丙烯酯包埋, 制备超薄切片, 在Tecnai G2 20 Twin透射电镜下观察和拍片。
1.5 病毒分离培养收集病鱼肝脏、脾脏、肾脏及脑等组织, 按照1︰10的体积比(V/W)加入含有双抗的无菌PBS (100μg/mL青霉素, 100μg/mL链霉素), 用玻璃匀浆器碾磨充分后, 置于4℃过夜处理, 4℃、12000r/min离心30min, 取上清, 用M199进行10倍、100倍稀释后, 分别取1mL加入长至单层的CGB细胞中, 24℃孵育1.5h, 弃上清, 再补加5mL细胞维持液(含有2%胎牛血清), 24℃静置培养, 每天观察细胞病变情况。
1.6 病毒人工感染试验无菌状态下取病鱼的脑、肝脏、脾脏、肾脏等内脏组织, 冰浴上用玻璃匀浆器充分匀浆, 随后按照1︰10的比例加入含有双抗(100μg/mL青霉素, 100μI/mL链霉素)的灭菌PBS缓冲液制成匀浆液, 4℃过夜后, 4℃、12000r/min离心30min, 取上清对健康异育银鲫进行攻毒, 每尾经腹腔注射0.5mL, 对照组注射相同剂量的无菌PBS, 每组20尾。实验期间水温控制在23—26℃。每日观察, 连续3周。
1.7 病毒PCR鉴定及序列分析分别提取自然发病鱼、人工感染鱼、健康鱼组织以及感染CGB细胞的DNA, 使用NanoDrop ND 2000测定DNA的浓度及纯度。CyHV-2的PCR检测方法参照文献(Goodwin et al, 2006a; Jeffery et al, 2007; Waltzek et al 2009; Sahoo et al, 2016)的方法进行, 根据世界动物卫生组织(OIE)上推荐引物(TK)用于检测CyHV-3, 引物信息见表 1。反应体系为50μL: DNA 1μL, 上下游引物(10μmol/L)各0.5μL, GoTaq® Master Mixes 25μL, 灭菌超纯水23μL。扩增反应热循环参数为: 95℃ 2min, 95℃ 30s, 退火30s(温度参照表 1), 72℃ 30s, 30个循环; 72℃延伸10min。取5μL PCR产物在1%的琼脂糖凝胶中电泳观察结果。选取编号1—3的引物阳性扩增产物送南京金斯瑞公司测序, 测序结果通过NCBI的Blast检索系统进行序列同源性分析。系统进化树依据DNA聚合酶基因部分氨基酸序列绘制, 将测得的聚合酶基因序列翻译为氨基酸序列, 并与GenBank数据库中其他疱疹病毒代表种的DNA聚合酶基因的氨基酸序列进行比较分析, 多重比对采用ClustalW软件, 用MEGA 7.0构建系统发育树。
| 编号 | 引物名称 | 序列(5′—3′) | 退火温度(℃) | 扩增片段(bp) |
| 1 | CyHVpol-F | CCCAGCAACATGTGCGACGG | 55 | PCR检测CyHV-2 |
| CyHVpol-R | CCGTARTGAGAGTTGGCGCA | |||
| 2 | CyHV-2Hel-F | GGACTTGCGAAGAGTTTGATTTCTAC | 60 | |
| CyHV-2Hel-R | CCATAGTCACCATCGTCTCATC | |||
| 3 | CyHV-2 GW-F | TCGGTTGGACTCGGTTTGTG | 58 | |
| CyHV-2 GW-R | CTCGGTCTTGATGCGTTTCTTG | |||
| 4 | CyHV-3Gray Sph-F | GACACCACATCTGCAAGGAG | 55 | PCR检测CyHV-3 |
| CyHV-3Gray Sph-R | GACACATGTTACAATGGTCGC | |||
| 5 | CyHV-2-F | TCGGTTGGACTCGGTTTGTG | 58 | 荧光定量PCR检测CyHV-2 |
| CyHV-2-R | CTCGGTCTTGATGCGTTTCTTG | |||
| CyHV-2-Prober | FAM-CCGCTTCCAGTCTGGGCCACTACC-BHQ1 |
CyHV-2 TaqMan荧光定量PCR检测方法参照文章(Goodwin et al, 2006b)进行, 引物及探针信息见表 1。反应体系包括:标准品或者检测样品的DNA 1μL, 2×SuperReal PreMix (Probe) 10μL, 上、下游引物(10μmol/L)各0.6μL, 探针(10μmol/L) 0.4μL, 50×ROX Reference Dye*3 0.2μL, 补充水至20μL。PCR反应参数如下: 95℃ 2min; 58℃ 45s、72℃ 45s、95℃ 30s, 共35个循环; 72℃延伸2min。每个待检样品及标准品稀释度做3个重复, 同时设立阴性对照。荧光定量PCR反应结束后, 根据标准品与Ct值的相关性, 绘制标准曲线, 用于未知样品中病毒拷贝数的换算。
1.9 不同组织中病毒含量的测定按1.6中的方法对健康异育银鲫进行攻毒, 取濒死鱼的肝脏、脾脏、肾脏、脑、鳃、心、肠道等组织, 提取各组织DNA, 应用建立的TaqMan荧光定量PCR方法检测各组织中CyHV-2的拷贝数。
2 结果与分析 2.1 临床症状和病原检测观察患病异育银鲫的主要临床症状为体表出血, 鱼下颌和腹部充血。解剖开来可见鳃丝出血, 肝脾肾肿胀, 并带有白色小结节, 鱼鳔出现点状出血(图 1)。病鱼的肝脏、脾脏及肾脏接种平板培养未见优势菌落。显微镜下观察发病鱼的鳍条、鳃、内脏及血液未见有寄生虫感染。
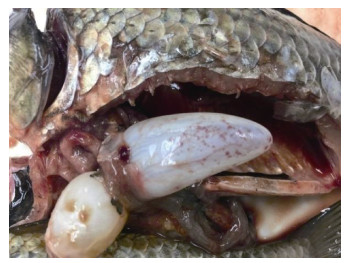 |
| 图 1 患病异育银鲫解剖症状 Fig. 1 The autopsy symptoms of diseased gibel carp |
组织病理切片观察患病鱼鳃丝充血肿胀(↙1), 鳃小片充血(↙2), 鳃小片上皮细胞脱落坏死(↙3)。肾脏周围间隙组织内出血(↙4), 肾小管上皮细胞结构紊乱, 细胞内长出新生核(↙5), 管腔变狭小, 有凝固性坏死现象(↙6)(图 2)。
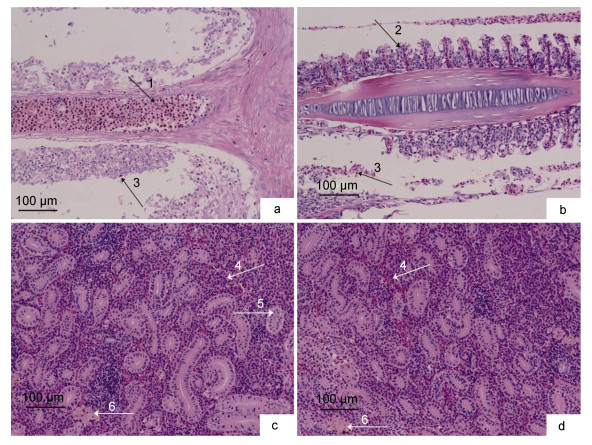 |
| 图 2 患病异育银鲫组织病理变化 Fig. 2 Histopathological changes of diseased crucian carp 注: a.患病鱼鳃丝腐烂; b.鳃丝肿胀; c、d.肾脏病变 |
制备患病鱼肾脏组织超薄切片, 电镜下可观测大量球形病毒颗粒(图 3)(白色箭头所示)。病毒为近似球形的具囊膜的病毒, 囊膜直径170—200nm, 病毒衣壳直径110—120nm, 核心直径约为60nm。
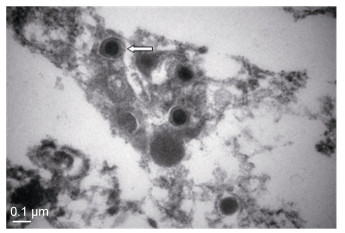 |
| 图 3 患病鱼脾脏组织中的病毒颗粒(标尺=100nm) Fig. 3 The virus in spleen tissues of diseased fish (bar=100nm) |
患病鱼组织浆接种CGB细胞系, 盲传2代即能产生明显的CPE。感染3d后细胞出现收缩, 6d后胞间连丝清晰可见, 部分细胞脱落, 细胞单层开始破裂, 第8天后可见细胞出现大面积脱落, 漂浮, 对照组细胞培养至20天, 未出现明显CPE(图 4)。当接种病毒的细胞CPE达到80%—90%时, 收集细胞冻于–80℃, 用于继续传代, 当传至第5代时, CPE消失。将分离的病毒株暂命名为CyHV-2-JS株。
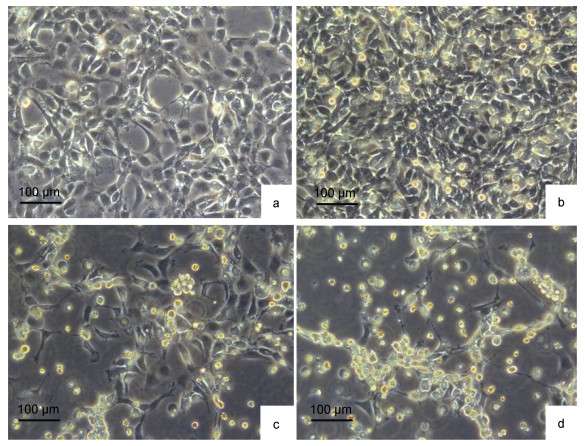 |
| 图 4 患病异育银鲫组织匀浆液接种CGB细胞单层引起的细胞病变效应 Fig. 4 Cytopathic effect of CGB cell monolayer inoculated with diseased fish tissue homogenate filtrate 注: a. CGB正常细胞单层; b.接种病毒3d的细胞单层; c.接种病毒6d的细胞单层; d.接种病毒8d的细胞单层 |
人工感染3天后, 异育银鲫开始发病, 发病症状与自然发病鱼相同, 呈现典型出血症状。第4天异育银鲫开始死亡, 第10天累计死亡率达到100%, 对照组鱼未见死亡。
2.6 病毒PCR鉴定及序列分析采用引物CyHV pol-F/CyHV pol-R, CyHV-2Hel- F/CyHV-2Hel-R, CyHV-2 GW-F/CyHV-2 GW-R对DNA模板进行了PCR检测, 结果显示发病鱼、人工感染鱼及病毒细胞培养物均能扩增出362、93和366bp的特异性条带, 结果为CyHV-2阳性, 健康鱼均为阴性(图 5)。PCR产物测序后经BLAST比对分析显示, 其与CyHV-2其他毒株的相应基因序列同源性达到100%。引物CyHV-3Gray Sph-F/CyHV-3Gray Sph-R扩增样本结果为阴性, 说明病鱼样本不携带CyHV-3。依据DNA聚合酶基因部分绘制系统进化树(图 6), 结果显示CyHV-2-JS株与其他CyHV-2病毒株属同一分支。
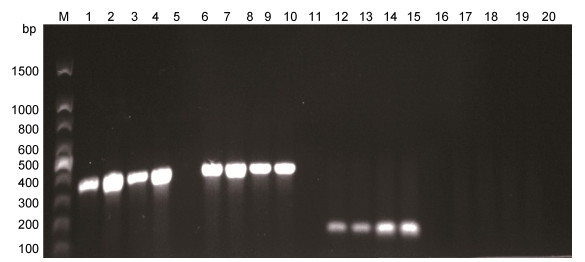 |
| 图 5 PCR检测结果 Fig. 5 Results of the PCR detection 注: M. DNA marker DL100; 1—2.引物CyHVpol-F/R的扩增自然发病鱼结果; 3.引物CyHVpol-F/R的扩增人工感染鱼结果; 4.引物CyHVpol-F/R的扩增病毒细胞培养物结果; 5.引物CyHVpol-F/R的扩增健康鱼鱼结果; 6—7.引物CyHV-2Hel-F/R扩增自然发病鱼结果; 8.引物CyHV-2Hel-F/R扩增人工感染鱼结果; 9.引物CyHV-2Hel-F/R扩增病毒细胞培养物结果; 10.引物CyHV-2Hel-F/R扩增健康鱼结果; 11—12.引物CyHV-2 GW-F/R的扩增自然发病鱼结果; 13.引物CyHV-2 GW-F/R的扩增人工感染鱼结果; 14.引物CyHV-2 GW-F/R的扩增细胞培养物结果; 15.引物CyHV-2 GW-F/R的扩增健康鱼结果; 16—17.引物CyHV-3Gray Sph-F/R的扩增自然发病鱼结果; 18.引物CyHV-3Gray Sph-F/R的扩增人工感染鱼结果; 19.引物CyHV-3Gray Sph-F/R的扩增细胞培养物结果; 20.引物CyHV-3Gray Sph-F/R的扩增健康鱼结果 |
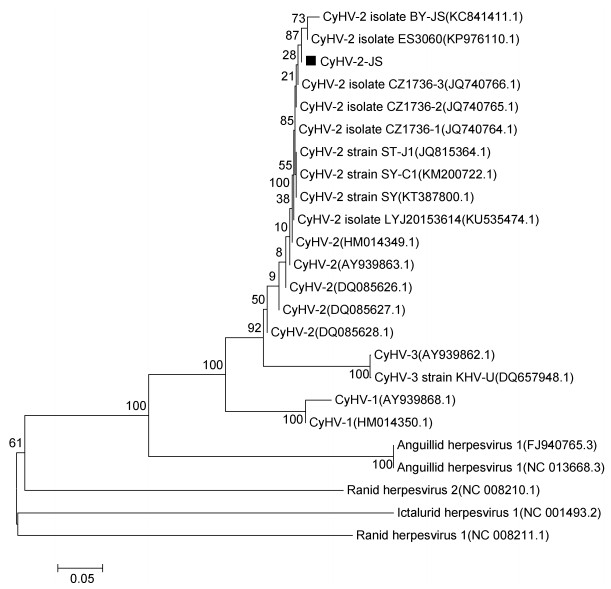 |
| 图 6 基于CyHV-2 DNA聚合酶基因部分序列同源性的系统进化分析 Fig. 6 Phylogenetic tree of CyHV-2 JS strain with other Cyprinivirus strains based on DNA polymerase gene partial sequence homologues |
用CyHV-2病毒感染异育银鲫, 取濒死鱼的肝脏、脾脏、肾脏、脑、鳃、心、肠道等组织, 进行Real-time PCR检测各组织中CyHV-2的含量。如图 7所示, 脾脏中病毒的含量最高, 为2×107.00个拷贝数, 其次是脑, 拷贝数为2×106.49。
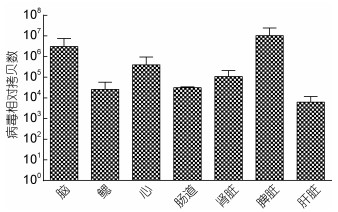 |
| 图 7 患病异育银鲫各组织中CyHV-2相对拷贝数 Fig. 7 The relative copies of CyHV-2 in different tissues of diseased crucian carp |
异育银鲫因其食性杂、抗逆性好、肉质鲜美、营养价值高等特点, 深受广大养殖者与消费者喜爱。据2018年渔业年鉴统计(农业农村部渔业渔政管理局等, 2018), 2017年我国养殖鲫产量达281多万吨, 其中江苏省养殖鲫产量超过62万吨, 为我国鲫鱼的主要养殖地区。然而, 自2009年以来, 在江苏省鲫主养区域连年发生养殖鲫暴发性死亡的出血性疾病, 造成重大经济损失。本次病例发生于江苏盐城一鲫鱼养殖厂, 在疾病暴发过程呈现出许多症状特点与之前国内外报道的金鱼、鲫鱼感染CyHV-2相似, 如体表呈典型性出血症状, 剖检见脾和肾肿大充血, 鱼鳔点状出血, 电镜下观察到患病鱼脾脏组织超薄切片存有病毒颗粒, 其大小、形状方面的特征与已报道的CyHV-2分离株一致(Goodwin et al, 2006a; Jeffery et al, 2007; Waltzek et al, 2009; Wang et al, 2012; 徐进等, 2013; Xu et al, 2013; 李茂等, 2015; Sahoo et al, 2016), 组织病理切片观察到患病鱼鳃小片上皮脱落坏死, 与Fichi等(2013)、姚卓凤(2015)的研究结果相似, 肾脏组织内出血及凝固性坏死现象与已有报道描述一致(Fichi et al, 2013; Lovy et al, 2014), PCR扩增分离病毒的DNA聚合酶基因, 产物测序结果经Blast同源性分析, 发现其与其他CyHV-2分离株同源性为100%, 表明该基因在遗传上具有保守性。该病毒人工感染鲫鱼, 死亡率达到100%, 说明其具有高致病性。学者们最初发现在患病金鱼的脾脏、体肾细胞中存有该病毒(Jung et al, 1995; Groff et al, 1998), 而后有报道在患病异育银鲫的体肾、脾脏、头肾、肝胰脏、肠道、鳃均检测到CyHV-2核酸(Xu et al, 2013), 林秀秀等(2016)用透射电镜观察到在患病异育银鲫的肾脏、脾脏、鳃中含有病毒粒子。本实验采用荧光定量PCR方法检测患病鱼各个组织中病毒含量, 结果显示脾脏组织中病毒含量最高, 为2×107.00个拷贝数, 其次是脑, 拷贝数为2×106.49, 这一结果说明这两个组织适合该病毒增殖, 可考虑用于该病毒易感细胞系的建立。
气单胞菌的一些成员单独(王利等, 2013; 耿昕颖等, 2016)或与CyHV-2混合感染(Fichi et al, 2013; 蒋新益, 2016; Sahoo et al, 2016)可引起银鲫发病。患病鱼鳍基部、腹部、下颌骨等部位出血, 呈现出与CyHV-2单独感染相似的体表症状, 给疾病的临床诊断带来困难。为确保病原分析的正确性, 本研究从寄生虫、细菌及病毒三个方面对病原进行排查, 显微镜下观察患病鳃、鳍及体表均无寄生虫, 取病鱼组织病灶接种TSA平板, 无优势菌落形成, 说明引起本次疾病的病原应为病毒而非寄生虫或细菌。根据已有报道, 在国内引起异育银鲫发病的病毒有两种, 一种为疱疹样病毒, 可引发异育银鲫上皮瘤病, 该病主要症状表现为在病鱼鳞片、鳍及鳃盖的表面出现上皮瘤, 死亡率低, 是一种低温季节发生的疾病(Lu et al, 2009), 另一种病毒即为引起异育银鲫患出血性疾病暴发性死亡的CyHV-2, 对照本病例患病银鲫高死亡率及体表不同程度出血等特征, 可排除病原为疱疹样病毒的可能, 而进一步的PCR检测证实引发该病的病原为CyHV-2。
CyHV-2作为疱疹病毒的成员, 具有潜伏感染这一重要特征(李祥敏等, 2001), 温度是影响该病毒复制的关键因素, 本研究在对异育银鲫进行CyHV-2人工感染时, 发现水温在22—24℃时, 被感染鱼死亡率最高, 达到100%, 超出这一温度范围, 死亡率下降。Wang等(2012)发现当水温低于15℃、高于26℃时, CyHV-2潜伏感染于鱼体内, 被感染鱼与正常鱼无明显差别, 当水温15—26℃之间时, 被感染鱼表现出临床正常, 且死亡率随着水温升高而急剧攀升。本实验室自2015年起参加农业部水产动物疫病监测项目, 负责浙江地区CyHV-2的监测, 在项目实施过程中也发现浙江地区养殖鲫鱼存在携带CyHV-2但不发病的情况。这些情况说明病毒监测及早期诊断的重要性, 并提示我们探索温度对CyHV-2复制的调控机制可为疾病防控提供一个突破口。
4 结论本文对江苏省某养殖场异育银鲫暴发性出血病进行病原分析, 证明引起该病暴发的原因为鲤疱疹病毒Ⅱ型病毒, 本研究结果可为鲫造血器官坏死症的诊断提供参考, 也为今后疫苗的研制及鲤疱疹病毒Ⅱ型病毒病防控奠定基础。
王利, 魏勇. 2013. 鲫鱼维氏气单胞菌的分离鉴定及耐药表型检测. 黑龙江畜牧兽医, (2): 101-103 |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会, 2018. 2018中国渔业统计年鉴.北京: 中国农业出版社
|
李茂, 肖丹, 刘天强, 等. 2015. 鲤科疱疹病毒Ⅱ型射阳株的分离与鉴定. 淡水渔业, 45(3): 93-96 DOI:10.3969/j.issn.1000-6907.2015.03.016 |
李祥敏, 金梅林, 陈焕春. 2001. 疱疹病毒潜伏感染与细胞凋亡关系的研究进展. 动物医学进展, 22(4): 32-35 DOI:10.3969/j.issn.1007-5038.2001.04.009 |
林秀秀, 叶元土, 吴萍, 等. 2016. 异育银鲫造血器官坏死症病鱼体内鲤疱疹病毒Ⅱ型的电镜观察与超微病理学特征. 水产学杂志, 29(1): 17-23 DOI:10.3969/j.issn.1005-3832.2016.01.004 |
姚卓凤, 2015.鲫感染鲤疱疹病毒Ⅱ的组织病理学研究.武汉: 华中农业大学硕士学位论文, 26-31
|
耿昕颖, 王家祯, 董文龙, 等. 2016. 异育银鲫嗜水气单胞菌的分离鉴定与病理组织学观察. 中国兽医杂志, 52(4): 109-112 DOI:10.3969/j.issn.0529-6005.2016.04.041 |
徐进, 曾令兵, 杨德国, 等. 2013. 鲤疱疹病毒2型武汉株的分离与鉴定. 中国水产科学, 20(6): 1303-1309 |
蒋新益, 2016.射阳地区异育银鲫大红鰓病与鲫造血器官坏死病病原研究.上海: 上海海洋大学硕士学位论文, 25-30
|
Daněk T, Kalous T, Veselý T et al, 2012. Massive mortality of Prussian carp Carassius gibelio in the upper Elbe basin associated with herpesviral hematopoietic necrosis (CyHV-2). Diseases of Aquatic Organisms, 102(2): 87-95 DOI:10.3354/dao02535 |
Doszpoly A, Benko M, Csaba G et al, 2011. Introduction of the family Alloherpesviridae:the first molecular detection of herpesviruses of cyprinid fish in Hungary. Magyar Allatorvosok Lapja, 133(3): 174-181 |
Fichi G, Cardeti G, Cocumelli C et al, 2013. Detection of Cyprinid herpesvirus 2 in association with an Aeromonas sobria infection of Carassius carassius (L. ) in Italy. Journal of Fish Diseases, 36(10): 823-830 |
Goodwin A E, Khoo L, Lapatra S E et al, 2006a. Goldfish hematopoietic necrosis herpesvirus (Cyprinid herpesvirus 2) in the USA:molecular confirmation of isolates from diseased fish. Journal of Aquatic Animal Health, 18(1): 11-18 DOI:10.1577/H05-007.1 |
Goodwin A E, Merry G E, Sadler J, 2006b. Detection of the herpesviral hematopoietic necrosis disease agent (Cyprinid herpesvirus 2) in moribund and healthy goldfish:validation of a quantitative PCR diagnostic method. Diseases of Aquatic Organisms, 69(2): 137-143 |
Groff J M, Lapatra S E, Munn R J et al, 1998. A viral epizootic in cultured populations of juvenile goldfish due to a putative herpesvirus etiology. Journal of Veterinary Diagnostic Investigation, 10(4): 375-378 DOI:10.1177/104063879801000415 |
Ito T, Maeno Y, 2014. Susceptibility of Japanese Cyprininae fish species to Cyprinid herpesvirus 2 (CyHV-2). Veterinary Microbiology, 169(3-4): 128-134 DOI:10.1016/j.vetmic.2014.01.002 |
Jeffery K R, Bateman K, Bayley A et al, 2007. Isolation of a Cyprinid herpesvirus 2 from goldfish, Carassius auratus (L. ), in the UK. Journal of Fish Diseases, 30(11): 649-656 DOI:10.1111/jfd.2007.30.issue-11 |
Jung S J, Miyazaki T, 1995. Herpesviral haematopoietic necrosis of goldfish, Carassius auratus (L. ). Journal of Fish Diseases, 18(3): 211-220 DOI:10.1111/jfd.1995.18.issue-3 |
Lovy J, Friend S E, 2014. Cyprinid herpesvirus-2 causing mass mortality in goldfish:applying electron microscopy to histological samples for diagnostic virology. Diseases of Aquatic Organisms, 108(1): 1-9 DOI:10.3354/dao02698 |
Lu H D, Zhu G L, Fan L P et al, 2009. Etiology and pathology of epidermal papillomas in allogynogenetic crucian carp Carassius auratus gibelio (♀)×Cyprinus carpio var. singuonensis (♂). Diseases of Aquatic Organisms, 83(1): 77-84 |
Luo Y, Lin L, Liu Y et al, 2013. Haematopoietic necrosis of cultured Prussian carp, Carassius gibelio (Bloch), associated with Cyprinid herpesvirus 2. Journal of Fish Diseases, 36(12): 1035-1039 DOI:10.1111/jfd.2013.36.issue-12 |
Sahoo P K, Swaminathan T R, Abraham T J et al, 2016. Detection of goldfish haematopoietic necrosis herpes virus (Cyprinid herpesvirus-2) with multi-drug resistant Aeromonas hydrophila infection in goldfish:First evidence of any viral disease outbreak in ornamental freshwater aquaculture farms in India. Acta Tropica, 161: 8-17 DOI:10.1016/j.actatropica.2016.05.004 |
Waltzek T B, Kurobe T, Goodwin A E et al, 2009. Development of a polymerase chain reaction assay to detect Cyprinid herpesvirus 2 in goldfish. Aquatic Animal Health, 21(1): 60-67 DOI:10.1577/H08-045.1 |
Wang H, Xu L J, Lu L Q, 2016. Detection of Cyprinid herpesvirus 2 in peripheral blood cells of silver crucian carp, Carassius auratus gibelio (Bloch), suggests its potential in viral diagnosis. Journal of Fish Diseases, 39(2): 155-162 DOI:10.1111/jfd.2016.39.issue-2 |
Wang L, He J G, Liang L et al, 2012. Mass mortality caused by Cyprinid Herpesvirus 2 (CyHV-2) in Prussian carp (Carassius gibelio) in China. Bulletin-European Association of Fish Pathologists, 32(5): 164-173 |
Xu J, Zeng L B, Zhang H et al, 2013. Cyprinid herpesvirus 2 infection emerged in cultured gibel carp, Carassius auratus gibelio in China. Veterinary Microbiology, 166(1-2): 138-144 DOI:10.1016/j.vetmic.2013.05.025 |
 2019, Vol. 50
2019, Vol. 50


