中国海洋湖沼学会主办。
文章信息
- 杜静雅, 苗亮, 李明云, 汤先念, 李双, 王昆. 2019.
- DU Jing-Ya, MIAO Liang, LI Ming-Yun, TANG Xian-Nian, LI Shuang, WANG Kun. 2019.
- 香鱼(Plecoglossus altivelis)JNK1基因克隆及其在成熟卵过熟进程中的表达变化
- CLONING AND EXPRESSION ANALYSIS OF SWEETFISH (PLECOGLOSSUS ALTIVELIS) JNK1 GENE DURING THE POST-OVULATORY AGEING OF EGGS
- 海洋与湖沼, 50(4): 921-929
- Oceanologia et Limnologia Sinica, 50(4): 921-929.
- http://dx.doi.org/10.11693/hyhz20190100024
文章历史
-
收稿日期:2019-01-25
收修改稿日期:2019-03-20
香鱼(Plecoglossus altivelis)为一年生小型洄游性鱼类, 分布在东亚的中国、朝鲜半岛、日本等地沿海溪流中, 是一种名贵经济鱼类(闫松松等, 2014)。卵的质量是影响鱼类繁殖和育苗生产的关键因素之一(Bobe et al, 2010), 香鱼为裸卵巢型, 其适当成熟卵排入到腹腔中, 过熟进程较慢, 具有较长时效的受精能力(李明云等, 2012), 在香鱼的人工繁育中正是利用这一特点大批量获取适当成熟卵(李明云等, 2009)。目前已有一些关于香鱼性腺发育和性别相关基因的研究(Wang et al, 2014a, b, c), 但在香鱼卵的凋亡和长时效受精能力机制方面研究较少。虹鳟(Oncorhynchus mykiss)是另一种卵具有长时效受精能力的鱼类, 其卵巢排出的成熟卵可以在体腔内保留5—7d而受精能力没有明显降低(Aegerter et al, 2004), Aegerter等(2005)认为虹鳟卵的过熟过程与细胞结构的保持、细胞分裂、细胞凋亡等相关的蛋白变化有关, 而这些蛋白的变化则是相关基因表达变化的结果。
c-Jun氨基端激酶(c-Jun N-terminal kinase, JNK)又被称为应激活化蛋白激酶(stress-activated protein kinase, SAPK), 是丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)蛋白超家族的重要成员之一, JNK信号通路可被多种细胞因子、某些G蛋白偶联受体及各种应激因素所激活, 参与细胞增殖与分化、细胞骨架构建、细胞凋亡、细胞迁徙等多种细胞活动(黎增辉, 2010)。在对大鼠嗜铬细胞瘤PC-12细胞的研究中首先发现了JNK具有促凋亡作用(Xie et al, 1995); 后来的研究显示通过活化NF-κB而抑制JNK的级联反应信号可以达到抑制凋亡的目的(Nakano et al, 2006);通过TNF-α诱导抑制了肾小管近端小管上皮细胞中NF-κB信号转导后, 引起JNK信号通路被激活并导致了细胞凋亡(Benedetti et al, 2013)。除参与细胞凋亡外, JNK在自噬、坏死等其他形式细胞死亡中也有着重要作用(Weston et al, 2007), 例如在大鼠中的研究显示JNK信号通路是肝脏、心脏缺血损伤中的主要调控因子, JNK抑制剂可减少缺血所致的肝细胞和心肌细胞死亡(Ferrandi et al, 2004; Uehara et al, 2005)。对3种JNK蛋白的研究表明, JNK1是促进细胞凋亡的主要因子之一, JNK2则对细胞凋亡起负向调控作用, JNK3具有组织特异性、只在脑高水平表达(Chang et al, 2001; Johnson et al, 2002; Santen et al, 2002)。现有研究显示JNK1基因与鱼类性别分化、性腺发育及生殖功能有关: Xiao等(2013)发现JNK1基因参与斑马鱼(Danio rerio)的胚胎发育和器官形成, 经JNK抑制剂SP600125处理后卵巢分化及性别决定进程均受到了抑制; 黄鳝(Monopterus albus)性逆转前卵巢中JNK1高表达, 而在逆转期间的兼性性腺及逆转后的精巢中其表达量显著降低(Xiao et al, 2010);在成熟卵具有长时效受精能力的虹鳟中发现未受精的成熟卵在随着时间的延长而出现卵质量下降、孵化率降低的过程中JNK1基因的表达量显著升高(Aegerter et al, 2005)。
为探究香鱼排入腹腔中成熟卵的受精、孵化能力随时间延长而逐渐降低过程中卵内的分子变化, 本研究克隆了香鱼JNK1基因cDNA序列, 并检测其在香鱼卵过熟中的表达变化以及与受精率、孵化率的关系, 以期为研究香鱼卵细胞凋亡和长时效受精机制提供参考资料, 并可为今后阐明香鱼中该基因的功能奠定基础。
1 材料与方法 1.1 实验动物实验用鱼为购自宁海凫溪清泉香鱼养殖专业合作社的“浙闽1号”香鱼。取健康成鱼雌、雄各3尾, 用丁香酚麻醉后立即冰上解剖, 取皮肤、心、肝、脾、肾、胃、肠、肌肉、鳃、脑、精巢、卵巢等组织, 用于JNK1基因克隆和组织表达检测。选取性腺发育程度基本一致的待排卵雌鱼25尾和雄鱼5尾带回实验室暂养于塑料箱中, 每天观察鱼腹部变化; 3天后共获得腹部膨大、轻压鱼腹有成熟卵自然流出且排卵时间基本一致的雌鱼16尾, 随机取9尾鱼并分为3组, 对每尾雌鱼均从排卵开始(记为0h)进行挤卵采样, 之后每隔24h挤卵一次、直到96h, 取样时轻压鱼腹收集流出的卵。将收集的卵分为2份: 1份用于提取总RNA后检测JNK1基因表达变化; 另1份用于检测受精率和孵化率以判定卵的过熟状态。
1.2 香鱼JNK1基因cDNA序列克隆根据GenBank中已发布的鱼类JNK1蛋白的保守区域, 用CodeHop在线引物设计软件(http://blocks.fhcrc.org/blocks/codehop.html)设计用于扩增香鱼JNK1基因cDNA部分序列的简并引物JNK1(+)\ JNK1(-)(表 1)。用Trizol试剂(生工生物工程(上海)股份有限公司)提取香鱼卵细胞总RNA, 反转录合成cDNA第一链作为模板, 用JNK1(+)\JNK1(-)引物扩增香鱼JNK1基因部分序列, 50μL扩增体系包括: 5U/μL的Ex Taq酶(TaKaRa公司)0.25μL, 10×Ex Taq Buffer (Mg2+ Plus) 5μL、dNTP Mixture (各2.5mmol/L) 4μL, 正、反向引物各0.5μL, cDNA模板1μL, ddH2O 38.75μL; PCR程序为: 94℃预变性5min, (94℃变性30s, 52℃退火30s, 72℃合成30s) × 30个循环, 72℃延伸10min。PCR产物经1.5%琼脂糖凝胶电泳后切取目的条带, 用Gel Extraction Kit (OMEGA公司)纯化回收后连接入pMD-19T载体, 转化入感受态大肠杆菌, 挑选阳性克隆菌落送至英潍捷基(上海)贸易有限公司测序。
| 用途 | 引物名称 | 引物序列(5′→3′) |
| 扩增香鱼JNK1核心序列 | JNK1(+) | CGAGACTGGTGCTGATGAARTGYGT |
| JNK1(-) | TGCTCGATCACCTTGTTCCATGRTC | |
| 用于5′RACE的基因特异性引物 | P.a.-JNK1-GSP1 | GCTTGGTAGCCCATACCGAGGATG |
| 用于3′RACE的基因特异性引物 | P.a.-JNK1-GSP2 | GCTGATGGATGCCAACTTGTGCC |
| 表达检测 | q-P.a.-JNK1-F | CTATAGCCTGGATGTCGGAG |
| q-P.a.-JNK1-R | TGGGTTTGGTTCTGGAAAGG | |
| 表达检测内参 | β-actin(+) | TCGTGCGTGACATCAAGGAG |
| β-actin(-) | CGCACTTCATGATGCTGTTG |
根据测得的香鱼JNK1基因部分序列设计引物, 用SMARTerTM RACE cDNA Amplification Kit (Clontech公司)进行3′RACE与5′RACE扩增。扩增体系及反应程序均按照说明书进行, 具体为: (1)使用试剂盒中的引物3′-CDS Primer A或5′-CDS Primer A将提取的香鱼卵细胞总RNA反转录合成用于3′RACE或5′RACE扩增的cDNA; (2)进行5′RACE (或3′RACE)的50μL反应体系包括: 2.5μL上一步制备的5′-RACE-Ready cDNA (或3′-RACE- Ready cDNA)、5μL 10×的UPM引物、1μL 10μmol/L的P.a.-JNK1- GSP1引物(或P.a.-JNK1-GSP2引物)、5μL 10×的Advantage 2 PCR Buffer、1μL dNTP Mix、1μL 50×的Advantage 2 Polymerase Mix、34.5μL PCR-Grade Water, 其中引物P.a.-JNK1-GSP1和P.a.-JNK1-GSP2为根据获取的香鱼JNK1基因部分序列自行设计(序列见表 1), 其余组分均为试剂盒提供; 反应程序为(94℃ 30s, 68℃ 30s, 72℃ 3min)×25个循环。PCR产物经1.5%琼脂糖凝胶电泳后切取目的条带, 纯化回收后连接入pMD-19T载体, 转化入感受态大肠杆菌, 挑选阳性克隆菌落测序。对测得序列用DNAStar Lasergene7软件进行分析和拼接, 获得的香鱼JNK1基因cDNA全长序列。
1.3 序列分析对获得的香鱼JNK1基因cDNA序列, 利用ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)检测开放阅读框(open reading frame, ORF)并翻译所编码的氨基酸序列; 对预测的编码蛋白用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP)进行信号肽预测, 用PredictProtein (http://www.cbs.dtu.dk/services/SignalP)、NCBI Conserved domains (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)和Prosite (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行酶活性位点、基序及功能域分析; 用Bioedit 7.0软件将香鱼JNK1氨基酸序列与GenBank中的其他物种的JNK1序列进行多重序列对比与同源性分析, 并用MEGA5.0软件构建系统进化树。所用序列信息见表 2。
| 物种 | 基因名 | 登录号 | ||
| 中文名 | 英文名 | 种名 | ||
| 香鱼 | ayu (sweetfish) | Plecoglossus altivelis | JNK1 | KC768782 |
| 黄鳝 | swamp eel | Monopterus albus | JNK1 | EF661977 |
| 斑马鱼 | zebrafish | Danio rerio | JNK1 | AB030900 |
| 金鱼 | goldfish | Carassius auratus | JNK1 | EU374209 |
| 鲤 | common carp | Cyprinus carpio | JNK1 | JN542470 |
| 人 | human | Homo sapiens | JNK1 | L26318 |
| 小鼠 | house mouse | Mus musculus | JNK1 | AB005663 |
| 鸡 | chicken | Gallus gallus | JNK2-α1 | AB000807 |
| 人 | human | Homo sapiens | JNK2 | L31951 |
| 金鱼 | goldfish | Carassius auratus | JNK3 | FJ183484 |
| 大鼠 | Norway rat | Rattus norvegicus | JNK3 | DQ377224 |
| 小鼠 | house mouse | Mus musculus | JNK3 | AB005665 |
| 玻璃海鞘 | vase tunicate | Ciona intestinalis | JNK | NM_001078282 |
通过半定量RT-PCR检测香鱼JNK1基因在成鱼各组织中的表达情况, 并以β-actin作为内参。20μL反应体系包括: cDNA模板为1μL, 10μmol/L的引物q-P.a.-JNK1-F和q-P.a.-JNK1-R各1μL, 2×Taq Master Mix(宁波博奥生物工程有限公司)10μL, ddH2O 3μL。反应程序为: 95 ℃预变性3min; (95 ℃变性20s, 56℃退火20s, 72℃延伸20s)×35个循环; 72℃延伸5min, 4℃保存。表达检测引物q-P.a.-JNK1-F、q-P.a.-JNK1-R及内参引物β-actin-F、β-actin-R的序列信息见表 1。PCR产物于含有4S Green Plus核酸染料(生工生物工程(上海)股份有限公司)的1.5%琼脂糖凝胶中电泳, 用GenoSens 1880型凝胶成像仪(上海勤翔科学仪器有限公司)获取图像, 分别测定各组织中JNK1条带与β-actin条带的光密度值, 以二者光密度的比值作为该组织中JNK1基因的表达量。
1.5 受精率、孵化率检测向收集的卵中加入过量精液, 经人工干法受精后将受精卵平铺于玻璃板上, 放入水中孵化, 孵化水温19±1℃。经常检测胚胎发育情况, 统计受精率和孵化率:
受精率=原肠期卵数/总卵数×100%
孵化率=出膜仔鱼数/受精卵数×100%
1.6 成熟卵母细胞过熟进程中JNK1表达变化的qRT-PCR检测通过实时荧光定量PCR (quantitative real-time PCR, qRT-PCR)技术检测香鱼成熟卵母细胞过熟进程中JNK1基因的表达变化, 反应在Mastercycler ep realplex型实时定量PCR仪(Eppendorf公司)上进行, 25μL反应体系包括: 2×SYBR® Premix Ex Taq (Tli RNaseH Plus) 12.5μL, 10μmol/L的引物q-P.a.-JNK1-F和q-P.a.-JNK1-R各1μL, cDNA模板2μL, ddH2O 8.5μL。反应程序为: 95℃预变性30s, (95℃变性5s, 56℃退火30s)×循环40次。以β-actin为内参基因, 根据目的基因和内参基因的Ct值, 用2–ΔΔCt法(Livak et al, 2001)计算各时间点JNK1基因的相对表达量。引物信息见表 1。
所得数据用SPSS 19.0软件进行统计分析, 对各个采样点的表达量进行单因素方差分析(One-way ANOVA), 以P < 0.05为具有显著性差异。
2 结果 2.1 香鱼JNK1基因cDNA序列特征经测序、拼接获得香鱼JNK1基因cDNA序列全长1670bp (GenBank登录号: KC768782), 包括45bp的5′非编码区、469bp的3′非编码区和1个长度1155bp的开放阅读框(ORF), 3′端非编码区含有一个多腺苷酸化信号序列(AATAAA), 预测编码384个氨基酸, 编码蛋白的分子量大小约为44.2kDa、理论等电点6.61, 分析显示该蛋白N端无信号肽、含有1个依赖cAMP/cGMP的蛋白激酶磷酸化位点“KKLS”、1个MAPK锚定位点“VKSDC”和1个双磷酸化位点的三肽基“TPY”(图 1)。
 |
| 图 1 香鱼JNK1基因cDNA核苷酸序列和预测的氨基酸序列 Fig. 1 Nucleotide sequences of JNK1 cDNA in P. altivelis and deduced amino acid sequence 注:阴影部分表示结构域和催化位点; 黑体序列表示起始和终止密码子; 下划线示末端多腺苷酸化信号序列 |
多重序列比对显示(图 2), JNK1氨基酸序列高度保守, 香鱼等几种鱼类和哺乳类(人(Homo sapiens)、小鼠(Mus musculus))JNK1序列相似性都在80%以上, 各物种JNK1中与该蛋白功能相关的3个位点(依赖cAMP/cGMP的蛋白激酶磷酸化位点“KKLS”、MAPK锚定位点“VKSDC”、双磷酸化位点的三肽基“TPY”)均完全保守; 香鱼、黄鳝(Monopterus albus)、斑马鱼(Danio rerio)、金鱼(Carassius auratus)、鲤(Cyprinus carpio)等硬骨鱼类之间JNK1的序列相似性均 > 90%, 其中香鱼与黄鳝JNK1序列相似性最高(97.6%)。
 |
| 图 2 香鱼及其他动物JNK1氨基酸序列比对 Fig. 2 Multiple alignment of JNK1 amino acid among P. altivelis and other vertebrates 注: ①:依赖cAMP/cGMP的蛋白激酶磷酸化位点“KKLS”; ②: MAPK锚定位点“VKSDC”; ③:双磷酸化位点的三肽基“TPY” |
构建的系统进化树(图 3)显示:各种脊椎动物的JNK1、JNK2、JNK3分别聚为一簇; 本研究获得的香鱼JNK1位于JNK1大簇中, 与其他鱼类JNK1相聚后再和人、小鼠等非鱼类脊椎动物相聚; 香鱼JNK1优先与黄鳝(M. albus)JNK1聚为一枝、表明二者的系统进化关系较近。
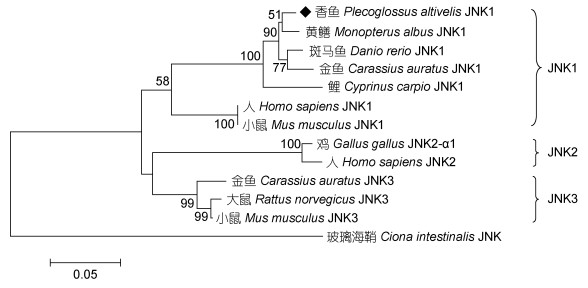 |
| 图 3 基于JNK1基酸序列构建的系统进化树(NJ法, bootstraps=1000) Fig. 3 The phylogenetic tree based on the amino acid sequence of JNK1 (neighbor-joining method, bootstraps=1000) |
RT-PCR检测结果(图 4a, b)显示, 雌、雄两性香鱼的皮肤、心、脾、肾、胃、肠、脑和性腺中均有JNK1基因表达, 雌鱼肌肉中JNK1基因微弱表达、雄鱼肌肉中则未检测到表达, 雌、雄鱼的肝和鳃中未检测到JNK1基因表达。雌、雄鱼均是脑中JNK1基因表达量最高、其次为性腺。半定量分析显示雌鱼皮肤、心、胃、肠、脑中JNK1基因表达量明显高于雄鱼, 雄鱼肾中JNK1基因表达量则明显高于雌鱼。
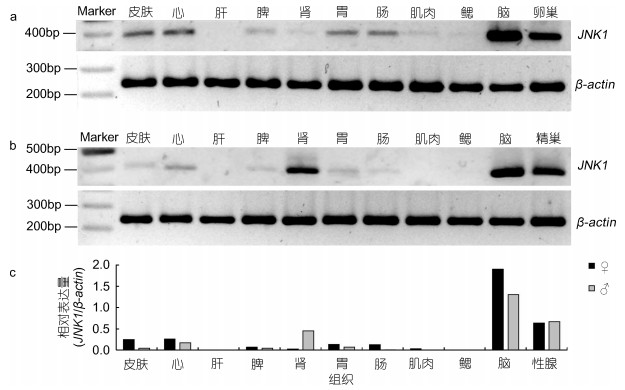 |
| 图 4 JNK1基因在香鱼各组织中的表达 Fig. 4 The expression of JNK1 gene in different tissues of P. altivelis 注: a.雌鱼各组织JNK1和β-actin基因PCR产物凝胶电泳图; b.雄鱼各组织JNK1和β-actin基因PCR产物凝胶电泳图; c.雌、雄鱼各组织JNK1基因相对表达量 |
qRT-PCR检测显示(图 5), 0—96h期间香鱼卵中JNK1基因的表达呈先升高后降低的变化: 24h时的表达量比0h时显著升高了1.49倍(P < 0.05); 48h时再次显著升高(P < 0.05)并达到峰值, 此时的表达量为0h时的2.55倍; 48—72h期间JNK1保持高表达水平; 96h时JNK1表达显著下调(P < 0.05), 表达量比72h时降低了34.05%, 但仍显著高于0h时的表达水平(P < 0.05)。香鱼排到腹腔中的成熟卵随着保存时间的延长(0—96h)受精率、孵化率不断降低(图 5), 表明卵逐渐过熟、衰老。但在0—48h期间变化相对较小, 48h时仍有88.99%的受精率和67.32%的孵化率。保存超过48h之后卵子质量急剧下降, 72h时受精率、孵化率分别为50.2%和25.54%, 保存96h时卵子则已基本失去发育能力(受精率、孵化率分别为10.83%和0.54%)。JNK1基因表达的高峰与卵受精、孵化能力的急剧降低在时间上有着一致性, 提示JNK1与卵的过熟、凋亡进程有关。
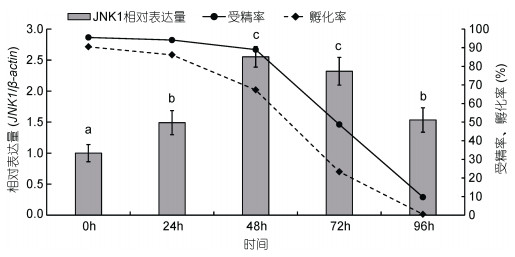 |
| 图 5 香鱼卵过熟过程中JNK1基因表达变化 Fig. 5 The expression changes of JNK1 mRNA in P. altivelis eggs during post-ovulatory ageing 注:小写字母不同表示具有显著性差异(P < 0.05) |
JNK与另外三种激酶——ERK、p38与ERK5共同组成了MAPK超家族, MAPK通路在细胞内信号转导中有着重要的作用, 参与多种细胞活动的调节。脊椎动物中, JNK基因家族共有3个成员——JNK1、JNK2和JNK3, 并且这3个基因编码蛋白都可形成多种异构体, 例如在人类中已经发现了6种JNK1蛋白异构体。本文克隆得到的香鱼JNK1基因cDNA序列全长1669bp、ORF编码384个氨基酸, 该基因的编码蛋白是否能形成多种异构体有待于进一步研究。在正常细胞中, JNK主要定位于细胞质, 当被刺激因素激活后, 一部分活化的JNK就转移到细胞核中, 通过磷酸化而激活多种核内转录因子, 从而促进相关靶基因的转录和新蛋白质的合成, 发挥相应的生物学效应(侯炳旭等, 2011)。对香鱼JNK1序列的分析显示其编码蛋白N端没有信号肽, 推测JNK1蛋白链不能进入内质网, 其成熟肽只会存在于细胞质内, 这与JNK参与胞内代谢调节的功能相符合。
MAPK超家族蛋白的特点之一是都含有一个双磷酸化功能区, 并且这一区域保守性很高。这一双磷酸化功能区由3个氨基酸组成, 称为“三肽基”, 可与其他氨基酸作用形成一个“活化唇”(activation lip)结构, 一般认为这个结构是决定包括MAPKs在内的多种蛋白激酶活性的关键结构(龚小卫等, 2003)。在MAPK超家族的不同成员中, 三肽基仅第2个氨基酸有所不同: ERK与ERK5为Thr-Glu-Tyr, p38为Thr-Gly-Tyr, 而JNK则为Thr-Pro-Tyr (Widmann et al, 1999)。香鱼JNK1中除包含三肽基“TPY”外, 还含有依赖cAMP/cGMP的蛋白激酶磷酸化位点“KKLS”、一个MAPK锚定位点“VKSDC”, 这与其他脊椎动物JNK1的结构特点相同, 推测香鱼中JNK1的功能也与其他脊椎动物中相似。
JNK蛋白由3个基因编码, 在人和小鼠中的研究显示JNK1、JNK2、JNK3三个基因分别位于不同的染色体上(Bogoyevitch, 2006); 笔者构建的系统进化树也显示各种脊椎动物的JNK1、JNK2、JNK3蛋白各自聚为一个大簇, 表明三者是分别独立进化的。本研究获取的香鱼JNK序列位于JNK1簇中, 并且包括香鱼在内的各种硬骨鱼类聚为一个紧密的簇, 序列比对显示序列相似性都在94%以上, 其中香鱼与黄鳝JNK1相似性最高(97.6%), 表明该蛋白序列在鱼类的系统进化中是比较保守的。
组织表达检测显示JNK1基因在香鱼脑和性腺中表达量较高, 这与鲫鱼中的情况一致(Xiao et al, 2014), 而斜带石斑鱼(Epinephelus coioides)脑中JNK1基因则为中等表达(Guo et al, 2016)。本研究在香鱼的肝和鳃中均未检测到JNK1基因的表达, Guo等(2016)则发现斜带石斑鱼各组织中JNK1基因表达量最高的是肝、鳃中也有一定表达。不同鱼类之间JNK1基因表达的组织差异可能是长期进化形成的功能差异所致, 也可能与各种鱼类生活的水环境不同有关。另外, 香鱼雄性肾中JNK1基因的表达量远高于雌鱼, 雌、雄两性在皮肤、心、肠、胃中的表达也有一定的差别, 但该基因在雌、雄鱼中的功能是否有差异有待于今后的进一步研究。
JNK是MAPK信号传导通路中的重要激酶之一, 有研究显示JNK1是促进细胞凋亡的主要分子之一, 如Kim等(2012)发现缺血/再灌注可显著增加肝细胞内JNK1的表达, 并引起肝细胞凋亡; 而Tien等(2010)通过药物降低JNK1活性后对LPS导致的心肌细胞凋亡起到了抑制作用。但目前在鱼类中JNK1功能的研究较少。我们之前的研究(李明云等, 2012)显示香鱼排至腹腔中的成熟卵随着保存时间的延长受精率、孵化率逐渐降低与卵内油球直径、SOD等酶活性及丙二醛含量变化有关, 其中24—48h是关键的时间段。本研究中成熟卵排出后48h既是香鱼卵受精、孵化能力急剧下降的时间拐点, 也是JNK1基因表达的高峰, 提示JNK1基因的表达与卵的过熟、衰老进程有关, 这也与Aegerter等(2005)发现虹鳟成熟卵母细胞随保存时间延长而发生的质量下降与JNK1等8种细胞因子表达上调有关的研究结果相一致。现有研究表明JNK1所参与的MAPK途径对细胞骨架的调节有着重要作用(孙瑜等, 2013), JNK通路激活后会引起细胞形态的改变以及微丝重排(Nakamichi et al, 2007); 敲除JNK1基因后会因微管相关蛋白无法正常磷酸化而影响微管的装配(Chang et al, 2003)。在之前的研究中我们发现香鱼成熟卵过熟过程中卵膜结构会逐渐退化, 成熟卵在腹腔中保存48h期间胶膜层逐渐退化、消失, 96h时放射膜逐渐退化、消失(汤先念等, 2013); 本研究中JNK1的最大表达量也是出现在48h时, 48—96h期间JNK1的表达量仍保持在较高水平。
4 结论综上, 可以推测香鱼成熟卵过熟过程中细胞膜骨架的逐渐崩溃、解体是由JNK1参与的MAPK信号传导通路所介导的。在哺乳动物中的研究显示JNK信号通路中存在多种上游激活物[如凋亡信号调节激酶(ASK)、MAPK激酶(MAPK kinase, MKK)、混合连接激酶(MLKs)]和下游作用分子(如AP-1蛋白、Elk-1、DPC4、NFAT4d等)(刘慧等, 2008), 而JNK1在香鱼成熟卵母细胞过熟过程中具体的生理功能和调控机制有待于今后进一步研究。
刘慧, 唐圣松. 2008. JNK活化机制的研究进展. 现代生物医学进展, 8(6): 1188-1190 |
闫松松, 苗亮, 李明云, 等. 2014. 香鱼(Plecoglossus altivelis)养殖群体遗传多样性的AFLP分析及性别特异性分子标记筛选. 海洋与湖沼, 45(2): 395-399 |
汤先念, 苗亮, 李明云, 等. 2013. 香鱼成熟卵母细胞过熟进程中卵膜结构变化的扫描电镜观察. 水生生物学报, 37(6): 1179-1183 |
孙瑜, 徐立红. 2013. MAPK信号通路对细胞骨架调控作用的研究进展. 癌变畸变突变, 25(3): 244-246 DOI:10.3969/j.issn.1004-616x.2013.03.019 |
李明云, 陈炯, 史雨红, 等. 2009. 香鱼优质受精卵和发眼卵的大量获取技术. 现代农业科技, (13): 309-314 DOI:10.3969/j.issn.1007-5739.2009.13.219 |
李明云, 苗亮, 安钦, 等. 2012. 香鱼(Plecoglossus altivelis)排卵后卵内油球、酶活、丙二醛及受精率、孵化率的变化. 海洋与湖沼, 43(2): 313-317 |
侯炳旭, 冯丽英. 2011. JNK信号通路介导的凋亡在疾病中的作用. 世界华人消化杂志, 19(17): 1819-1825 |
龚小卫, 姜勇. 2003. 丝裂原活化蛋白激酶(MAPK)生物学功能的结构基础. 中国生物化学与分子生物学报, 19(1): 5-11 DOI:10.3969/j.issn.1007-7626.2003.01.002 |
黎增辉. 2010. JNK信号通路. 国际病理科学与临床杂志, 30(3): 273-276 |
Aegerter S, Jalabert B, 2004. Effects of post-ovulatory oocyte ageing and temperature on egg quality and on the occurrence of triploid fry in rainbow trout, Oncorhynchus mykiss. Aquaculture, 231(1-4): 59-71 DOI:10.1016/j.aquaculture.2003.08.019 |
Aegerter S, Jalabert B, Bobe J, 2005. Large scale real-time PCR analysis of mRNA abundance in rainbow trout eggs in relationship with egg quality and post-ovulatory ageing. Molecular Reproduction and Development, 72(3): 377-385 DOI:10.1002/(ISSN)1098-2795 |
Benedetti G, Fredriksson L, Herpers B et al, 2013. TNF-a- mediated NF-kB survival signaling impairment by cisplatin enhances JNK activation allowing synergistic apoptosis of renal proximal tubular cells. Biochemical Pharmacology, 85(2): 274-286 |
Bobe J, Labbé C, 2010. Egg and sperm quality in fish. General and Comparative Endocrinology, 165(3): 535-548 DOI:10.1016/j.ygcen.2009.02.011 |
Bogoyevitch M A, 2006. The isoform-specific functions of the c-Jun N-terminal Kinases (JNKs):differences revealed by gene targeting. BioEssays, 28(9): 923-934 DOI:10.1002/(ISSN)1521-1878 |
Chang L F, Jones Y, Ellisman M H et al, 2003. JNK1 is required for maintenance of neuronal microtubules and controls phosphorylation of microtubule-associated proteins. Developmental Cell, 4(4): 521-533 DOI:10.1016/S1534-5807(03)00094-7 |
Chang L F, Karin M, 2001. Mammalian MAP kinase signalling cascades. Nature, 410(6824): 37-40 DOI:10.1038/35065000 |
Ferrandi C, Ballerio R, Gaillard P et al, 2004. Inhibition of c-Jun N-terminal kinase decreases cardiomyocyte apoptosis and infarct size after myocardial ischemia and reperfusion in anaesthetized rats. British Journal of Pharmacology, 142(6): 953-960 DOI:10.1038/sj.bjp.0705873 |
Guo M L, Wei J G, Huang X H et al, 2016. JNK1 derived from orange-spotted grouper, Epinephelus coioides, involving in the evasion and infection of Singapore grouper iridovirus (SGIV). Frontiers in Microbiology, 7: 121 |
Johnson G L, Lapadat R, 2002. Mitogen-activated protein kinase pathways mediated by ERK, JNK, and p38 protein kinases. Science, 298(5600): 1911-1912 DOI:10.1126/science.1072682 |
Kim H Y, Lee S M, 2012. Ferulic acid attenuates ischemia/reperfusion-induced hepatocyte apoptosis via inhibition of JNK activation. European Journal of Pharmaceutical Sciences, 45(5): 708-715 DOI:10.1016/j.ejps.2012.01.010 |
Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-DDCt method. Methods, 25(4): 402-408 DOI:10.1006/meth.2001.1262 |
Nakamichi K, Saiki M, Kitani H et al, 2007. Roles of NF-kB and MAPK signaling pathways in morphological and cytoskeletal responses of microglia to double-stranded RNA. Neuroscience Letters, 414(3): 222-227 DOI:10.1016/j.neulet.2006.12.058 |
Nakano H, Nakajima A, Sakon-Komazawa S et al, 2006. Reactive oxygen species mediate crosstalk between NF-κB and JNK. Cell Death and Differentiation, 13(5): 730-737 DOI:10.1038/sj.cdd.4401830 |
Santen R J, Song R X, McPherson R et al, 2002. The role of mitogen-activated protein (MAP) kinase in breast cancer. The Journal of Steroid Biochemistry and Molecular Biology, 80(2): 239-256 DOI:10.1016/S0960-0760(01)00189-3 |
Tien Y C, Lin J Y, Lai C H et al, 2010. Carthamus tinctorius L. prevents LPS-induced TNFα signaling activation and cell apoptosis through JNK1/2-NFκB pathway inhibition in H9c2 cardiomyoblast cells. Journal of Ethnopharmacology, 130(3): 505-513 |
Uehara T, Bennett B, Sakata S T et al, 2005. JNK mediates hepatic ischemia reperfusion injury. Journal of Hepatology, 42(6): 850-859 DOI:10.1016/j.jhep.2005.01.030 |
Wang C, Li M, Wang J et al, 2014a. Identification of a sex-linked SCAR marker for Plecoglossus altivelis and its application for identifying gender in cultivated and wild populations. Iranian Journal of Fisheries Sciences, 13(4): 895-906 |
Wang C Y, Wang J H, Li M Y et al, 2014b. The genomic structure and expression patterns of Cyp19a1a and Cyp19a1b genes in the ayu Plecoglossus altivelis. Turkish Journal of Fisheries and Aquatic Sciences, 14: 785-793 |
Wang J H, Miao L, Li M Y et al, 2014c. Cloning the Dmrt1 and DmrtA2 genes of ayu (Plecoglossus altivelis) and mapping their expression in adult, larval, and embryonic stages. Zoological Research, 35(2): 99-107 |
Weston C R, Davis R J, 2007. The JNK signal transduction pathway. Current Opinion in Cell Biology, 19(2): 142-149 DOI:10.1016/j.ceb.2007.02.001 |
Widmann C, Gibson S, Jarpe M B et al, 1999. Mitogen-activated protein kinase:conservation of a three-kinase module from yeast to human. Physiological Reviews, 79(1): 143-180 DOI:10.1152/physrev.1999.79.1.143 |
Xiao Y M, Chen L L, Liu J et al, 2010. Contrast expression patterns of jnk1 during sex reversal of the rice-field eel. Journal of Experimental Zoology. Part B, Molecular and Developmental Evolution, 314B(3): 242-256 |
Xiao Y M, Zhou Y H, Xiong Z et al, 2013. Involvement of JNK in the embryonic development and organogenesis in zebrafish. Marine Biotechnology, 15(6): 716-725 DOI:10.1007/s10126-013-9520-5 |
Xiao Y M, Jiang M G, Luo Z W et al, 2014. Identification and analysis of the jnk1 gene in polyploid hybrids of red crucian carp (Carassius auratus red var. ) and common carp (Cyprinus carpio L.). Genetics and Molecular Research, 13(1): 906-919 |
Xie Z G, Dickens M, Raingeaud J et al, 1995. Opposing effects of ERK and JNK-p38 MAP kinases on apoptosis. Science, 270(5240): 1326-1331 DOI:10.1126/science.270.5240.1326 |
 2019, Vol. 50
2019, Vol. 50


