中国海洋湖沼学会主办。
文章信息
- 乔腾生, 董训赞, 黄力, 余旭亚. 2019.
- QIAO Teng-Sheng, DONG Xun-Zan, HAUNG Li, YU Xu-Ya. 2019.
- Mg2+对糖蜜酒精废醪液培养单针藻(Monoraphidium sp.FXY-10)油脂合成的影响
- EFFECT OF MG2+ ON LIPID ACCMULATION BY MONORAPHIDIUM SP. FXY-10 IN MOLASSES WASTEWATER
- 海洋与湖沼, 50(5): 1043-1049
- Oceanologia et Limnologia Sinica, 50(5): 1043-1049.
- http://dx.doi.org/10.11693/hyhz20190300047
文章历史
-
收稿日期:2019-03-08
收修改稿日期:2019-04-28
2. 昆明冶金高等专科学校 昆明 650500
2. Institute of Chemical Industry, Kunming Metallurgy College, Kunming 650500, China
工业生产过程中会产生大量的废水, 这些废水含有大量的金属离子、氮、磷等, 排放到环境中污染土壤(余光辉等, 2015)。糖蜜酒精废醪液(molasses wastewater, MW)是糖蜜酒精生产过程中产生的无毒、有害、污染负荷高的酸性有机废水, 包含有蛋白质、氨基酸、维生素、Ca2+、Fe3+、Cu2+等大量的无机盐和有机质, 直接排放会破坏生态平衡(周祖光, 2005; 张跃彬等, 2009; Ma et al, 2017)。因此, 寻找一种经济、有效的处理方法是解决这一问题的关键和研究热点。
与其他原料相比, 以微藻油脂作为原料生产生物柴油具有诸多的优势(Carioca et al, 2008; Stephenson et al, 2011; 方正等, 2017), 利用废水培养微藻、积累油脂(Nayak et al, 2016; Fernández-Linares et al, 2017)是废水综合利用的又一策略。Mg2+作为微藻生长过程中必需的微量金属元素, 是叶绿素的重要组成成分, 其存在可促进光合作用及脂肪酸生成过程中关键限速酶乙酰辅酶A (acetyl CoA)的形成, 从而有利于微藻的生长和油脂的合成(Huang et al, 2014)。
本研究利用MW培养单针藻, 考察不同浓度Mg2+对微藻生长及油脂合成的影响, 以及微藻对MW中COD、总氮、总磷的移除效果, 并初步探讨了微藻残渣的利用途径, 以期为糖蜜酒精废水和微藻的综合利用提供一定的理论基础。
1 材料与方法 1.1 实验原料与方法 1.1.1 实验方法单针藻Monoraphidium sp. FXY-10, 本实验室筛选、保存, 被浓缩的MW(含水量: 28 %)由云南康丰糖业(集团)有限公司提供, 其成分如表 1所示。MW中N、P、K、Mg等含量较多, 同时含有Ca、Fe、Cu等诸多金属离子及微量的Hg、Pb、As等重金属离子, 其COD高达3016.00g/L。为了避免COD含量过高不利于微藻的生长, 因此, 将MW用蒸馏水稀释800倍作为对照组培养基(COD: 3770mg/L), 向对照组培养基中添加不同质量的MgSO4·7H2O, 使得最终培养基中Mg2+的浓度为400、800、1200、1600μmol/L作为实验组培养基, 调节pH在6.8—7.0之间, 分别装入500mL的三角瓶中(每瓶的装液量为300mL), 121℃灭菌20min。单针藻的初始接种量为0.1g/L。培养条件为:光照强度: 2.5×103lx;培养温度: (25±1)℃;摇床转速: 150r/min。每组设置3个平行。
| 成分 | 含量 | 成分 | 含量 | 成分 | 含量 |
| N (g/L) | 26.00 | B (mg/L) | 392.00 | As μg/L) | 184.00 |
| P (g/L) | 1.94 | Zn (mg/L) | 63.85 | Cd (mg/L) | 7.85 |
| K (g/L) | 47.70 | Mn (mg/L) | 112.00 | Hg (μg/L) | 44.80 |
| Mg (g/L) | 2.04 | Mo (mg/L) | 10.26 | Pb (mg/L) | 1.30 |
| Ca (mg/L) | 58.40 | Cu (mg/L) | 19.48 | COD (g/L) | 3016.00 |
| Fe (mg/L) | 296.00 | Cr (mg/L) | 3.85 | 水(%) | 28.00 |
三氯甲烷(分析纯):成都市克隆化学品有限公司;甲醇分析纯:天津市风船化学试剂科技有限公司。实验过程中主要仪器如表 2所示。
| 仪器名称 | 型号 | 生产厂家 |
| 恒温光照振荡摇床 | TS-2012GZ | 上海天呈实验仪器制造公司 |
| 高速低温离心机 | 5180R | 德国Eppendorf公司 |
| 显微镜 | XS-212-202 | 南京江南永新光学有限公司 |
| 气质联用仪 | GC7890 | 美国Agilent公司 |
| 紫外可见分光光度计 | UV-1700 | 日本SHIMADZU公司 |
| 冷冻干燥机 | FD5-12 | 美国SIM公司 |
| 超净工作台 | SW-CJ-1F | 苏州净化设备有限公司 |
| 分析天平 | BSA124S | 德国Sartorius公司 |
| 纯水仪 | Millipore | 美国BioGEN公司 |
| 灭菌锅 | LDZX-50KBS | 上海申安医疗器械厂 |
| 超低温冰箱 | Localized Performance | 美国Thermo fisher公司 |
| 水浴锅 | HHW-D6 | 金坛双捷 |
生物量:根据藻细胞干重与吸光度A750值(0.100—1.000)成线性关系, 得出微藻的生物量与A750值的关系:
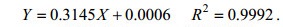 (1)
(1)Y:生物量(g/L); X :吸光度值
测定藻液的A750值(X), 代入公式(1), 得出微藻细胞干重。
油脂含量:将鲜藻液经8000×g离心5min, 去上清, 得到湿藻体, -80℃冷冻过夜后, 冷冻干燥。取干藻体(m1) 0.3—0.5g与2倍质量的石英砂混合, 充分研磨。用氯仿-甲醇溶液(2:1, v/v)清洗, 并将混合液转移至50mL的离心管中, 150r/min震荡20min后, 室温下8000×g离心5min, 收集上清液于另一个已干燥称重(m2)的离心管中。重复上述提取步骤两次, 合并3次上清液, 40℃烘干至恒重(m3), 微藻中油脂含量η的计算公式(2)如下:
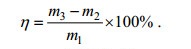 (2)
(2)η:油脂含量
1.3 CO2固定效率CO2固定效率依据下述公式(3)计算(Ketheesan et al, 2012):
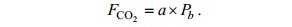 (3)
(3)FCO2: CO2固定效率[mgCO2/(L∙d)]
Pb:生物量产率[mg/(L∙d)]
a:单位生物量固定CO2的质量
1.4 脂肪酸组成检测向提取的油脂中加入2mL的3%的硫酸-甲醇(v/v)溶液, 70℃回流4h进行脂肪酸甲酯化, 加入2.0mL的正己烷震荡提取4h, 取正己烷相进行GC-MS分析(Zhao et al, 2016)。长链饱和因子(long chain saturated factor, LCSF)、冷凝点(cold filter plugging point, CFPP)和十六烷值(cetane number, CN)根据下述公式(4)计算(Francisco et al, 2009; Tong et al, 2011)。
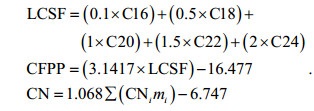 (4)
(4)m:脂肪酸的百分比
1.5 MW的COD、总氮及总磷检测MW中COD、总氮及总磷使用COD多参数光度计(HANNA-HI83399)检测, 具体检测方法如下:
COD检测方法:取出COD检测试剂HI93754B-0, 将消解管倾斜45°, 加入2.0mL的去离子水作为空白对照, 其余消解管中加入2.0mL的待测样品。拧紧盖子, 上下颠倒数次混匀。将上述消解瓶放入消解器中, 150℃, 消解2h。消解结束后趁热取出消解瓶颠倒数次混匀, 放在试管架上, 冷却至室温。将空白样品放入样品室中调零, 更换待测样品, 测定样品中COD的含量。
总氮检测方法:向HI93767B-B总氮检测试剂中, 加入过硫酸钾试剂(PERSULFATE/N)。将消解管倾斜45°, 加入0.5mL的去离子水作为空白对照, 其余消解管中加入0.5mL的待测样品。拧紧瓶盖, 用力上下震荡30s至粉末试剂完全溶解。将上述消解瓶放入消解器中, 105℃, 消解30min。消解结束后取出消解瓶放在试管架上, 冷却至室温。向上述冷却的各消解管中分别加入焦亚硫酸钠试剂(BISULFITE/N), 拧紧盖子轻摇15s混匀, 静待3min后, 各加入HI93767-0试剂, 轻摇15s混匀, 静待2min。将经过上述处理的消解管中的液体2.0mL, 加入到HI93767V试剂中, 颠倒10次混匀, 静待5min, 将空白样品放入样品室中调零, 更换待测样品, 测定样品中总氮含量。
总磷检测方法:取出HI93758V-0HR总磷检测试剂, 将消解管倾斜45°, 加入5.0mL的去离子水作为空白对照, 其余消解管中加入5.0mL的待测样品。向上述各消解瓶中分别加入PERFSULFATE/P试剂, 盖上盖子, 轻摇至粉末完全溶解, 105℃, 消解30min。消解结束后取出消解瓶放在试管架上, 冷却至室温。将消解管倾斜45°, 加入2.0mL的HI93758C-0试剂, 拧紧盖子, 颠倒数次混匀, 再向消解瓶中各加入0.5mL的HI93763B-0试剂拧紧盖子, 颠倒数次混匀。将空白样品放入样品室中调零, 更换待测样品, 测定样品中总氮含量。
1.6 统计分析本文全部试验均设置3组平行, 利用ANOVA (SPSS19.0)一步法分析实验数据。*P < 0.05表示差异显著, **P< 0.01表示差异极显著。
2 结果与讨论 2.1 不同浓度Mg2+对微藻生长、CO2固定效率及油脂含量的影响MW中添加不同浓度Mg2+对单针藻生长的影响如图 1a所示, 微藻的生物量随着Mg2+浓度的不断增加而增加, 当Mg2+浓度为800μmol/L, 生物量达到最高(0.91g/L), 是对照组的1.62倍。继续增加Mg2+浓度, 微藻的生长受到抑制。张森等(2014)也得到相似研究结果, 当海水BG11培养基中Mg2+浓度为0.09mmol/L时, 沙漠链带藻Desmodesmus sp. WC08的生物量达到最高, 是对照组的1.2倍, 过高或过低的Mg2+浓度均不利于微藻生长。在微藻的生长过程中, CO2作为唯一碳源, 其固定效率如图 1b所示, 当培养基中不额外添加Mg2+时, CO2的固定效率为45.55mg/(L·d), 当MW中的Mg2+含量增加至800μmol/L, CO2的固定效率逐渐增加至88.89mg/(L·d), 继续增加Mg2+含量, 微藻生物量降低, CO2的固定效率降低。作为叶绿素的中心原子, 适宜的Mg2+浓度, 在光能及酶促作用下参与光合作用(张森等, 2014), 促进微藻吸收CO2, 提高生物量。本实验结果表明, 向MW中添加适当浓度的Mg2+, 可促进MW中单针藻的生长及CO2的吸收。
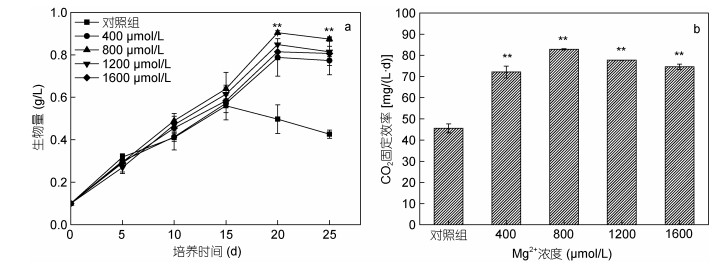 |
| 图 1 不同浓度Mg2+对单针藻Monoraphidium sp. FXY-10生物量(a)和CO2固定效率(b)的影响 Fig. 1 Effect of different concentrations of Mg2+ on the biomass(a) and CO2 fixation efficiency(b) of Monoraphidium sp. FXY-10 |
Mg不仅是植物叶绿素的组成成分, 在发酵和呼吸过程中会活化一些磷酸变位酶和磷酸激酶, 促进微藻中油脂的积累(李林等, 2012; Zhao et al, 2018)。由图 2可知, 当Mg2+浓度为800μmol/L, 油脂含量高达59.58%, 比对照组提高了25.99%, 同时生物量产率及油脂产率达到45.22和26.94mg/(L·d), 分别是对照组的1.62和2.03倍。有研究表明, 当培养基中Mg2+浓度从0增加至0.73g/L时, 栅藻Scenedesmus sp.中油脂含量逐渐增加(Ren et al, 2014)。虽然镁的浓度对链带藻Desmodesmus sp.WC08的油脂含量影响不显著, 但0.09mmol/L的镁作用下, 其油脂产率是对照组的1.2倍(张森等, 2014)。本实验中, 当MW中Mg2+浓度为800μmol/L时, 不仅可以提高单针藻的生物量, 还促进了油脂的积累。
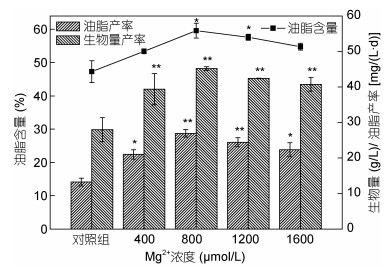 |
| 图 2 不同浓度Mg2+作用下单针藻Monoraphidium sp. FXY-10油脂含量及生物量、油脂产率的变化 Fig. 2 Changes of lipid content, biomass productivity and lipid productivity of Monoraphidium sp. FXY-10 under different concentrations of Mg2+ |
脂肪酸组成是衡量微藻油脂作为生物柴油原料的重要指标, 提高单不饱和脂肪酸甲酯的含量, 尤其是C18:1, 可以提高生物柴油的质量(王盛林等, 2017)。图 3显示不同Mg2+浓度作用下MW中单针藻脂肪酸组成变化。与对照组相比, 800μmol/L Mg2+作用下, 微藻中的C18:1含量增加至49.08%, 而C18:3的含量则下降12.67%, 分别为对照组的1.46和0.77倍;相同实验组中单不饱和脂肪酸含量上升至50.89%, 多不饱和脂肪酸下降至14.91%, 分别是对照组的1.45和0.73倍;实验组的不饱和度为80.72, 与对照组相比没有明显变化, 但均小于137, 可作为生产生物柴油的原料(Yu et al, 2012)。此外, MW中所培养微藻的脂肪酸LCSF、CFPP、CN值如表 3所示。CN值是衡量柴油抗爆性的指标, CN值低, 则燃料发火困难, 滞燃期长, 发动机工作时容易爆震, 欧洲柴油标准(EN 14214)指出, 生物柴油CN值的标准为不低于51 (Francisco et al, 2010)。LCSF是用来计算生物柴油的CFPP值的, CFPP值越低, 生物柴油的低温流动性能越好。由于各国所处的环境不同, 对CFPP值也有不同的规定, 而欧洲柴油标准并未对生物柴油的CFPP值提出具体的要求, 但我国(GB/T25199-2010)规定其值不高于-5℃到12℃。本实验结果表明, 以MW为培养基, 培养微藻得到的脂肪酸, 符合生产生物柴油的标准。
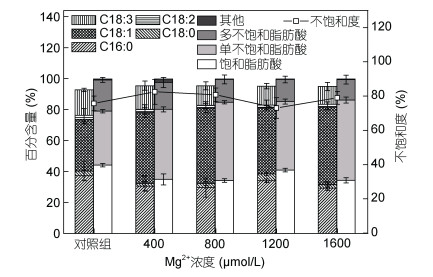 |
| 图 3 单针藻Monoraphidium sp. FXY-10中脂肪酸组成的变化 Fig. 3 Changes in fatty acid composition in Monoraphidium sp. FXY-10 |
| 脂肪酸 | Mg2+浓度(μmol/L) | ||||
| 0 | 400 | 800 | 1200 | 1600 | |
| LCSF (%) | 0.1070±0.012 | 0.0686±0.36 | 0.0551±0.021 | 0.0758±0.023 | 0.0712±0.17 |
| CFPP (℃) | –16.14±0.52 | –16.26±0.56 | –16.30±0.11 | –16.24±0.16 | –16.25±0.19 |
| CN | 56.82±0.16 | 55.25±0.34 | 55.33±0.28 | 56.92±0.22 | 56.54±0.92 |
糖蜜酒精废醪液中含有大量的氮、磷等无机盐和有机质等营养物质, 未经适当的处理直接排放, 会导致水体的富营养化, 引起环境污染。
微藻对MW中总氮的移除率如图 4所示, 外源添加Mg2+的实验组中, 当培养基中Mg2+浓度为800μmol/L时, MW中总氮去除效果最佳, 从16.25下降至1.89mg/L, 移除率达到88.37%, 相比对照组提高了15.96%。藻细胞对水体内总氮的去除, 主要依靠藻细胞的同化作用, 在细胞膜上将硝酸盐转化为亚硝酸盐, 再转化为铵盐, 然后被纳入自身物质的碳骨架中(甄茜等, 2017)。添加800μmol/L的Mg2+培养微藻, 随着其生物量的逐渐增加(图 1a), MW中总磷的含量逐渐下降至0.076mg/L, 移除率达到93.69% (图 4), 是对照组的1.35倍。磷是能量传递和核酸合成等细胞过程的重要元素, 微藻通过底物水平磷酸化、氧化磷酸化和光合磷酸化等三种磷酸化作用, 使磷进入细胞中的ATP中, 将废水中的磷去除(甄茜等, 2017)。废水COD值是衡量废水中有机物污染程度的综合指标。仅以MW培养微藻, 对照组COD值从3770下降至791mg/L, 而当MW中的Mg2+含量为800μmol/L时, COD值最终达到453mg/L, 相比对照组降低了42.73%, 同时COD移除率达到87.98% (图 4d), 是对照组的1.11倍。
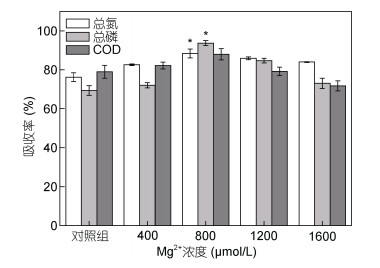 |
| 图 4 单针藻Monoraphidium sp. FXY-10对MW中总氮、总磷、COD的去除效果 Fig. 4 Effect of removal of total nitrogen, total phosphorus, and COD in MW by Monoraphidium sp. FXY-10 |
在本实验结果表明, Mg2+促进了MW中单针藻生长(图 1), 因此需要更多的氮(图 4)纳入自身的碳骨架, 以及更多的磷(图 4)形成ATP供给生命活动。已有研究表明, 利用光合细菌(PSB001)处理污水, COD的移除率最高可以达到87.5%, 但去除量仅有375.0mg/L (王冰等, 2018)。将1%的废水净化菌Lysinibacilus sp. S6菌株接种到糖蜜酒精废醪液中, COD的移除率最高, 可达到71.00%, 氨氮移除率为21.90%, 对总磷的去除效果不理想(郑先虎等, 2017)。本实验利用微藻处理MW废水, 其中总氮、总磷和COD的移除率可达到88.37%、93.69%和87.98%。此外, 魏鹏骥等(2018)的研究结果显示, 当受到氮饥饿等环境因素的胁迫时, 微藻会倾向于转变生理代谢途径, 合成较多的油脂(图 2)作为储能物质, 这样有利于其在不利的环境中存活。
2.4 微藻的资源化综合利用水和营养物质是微藻培养过程中不可缺少的成分, 而利用废水中的营养物质无疑可以降低微藻培养的成本, 同时还可以起到净化污水的目的。本实验利用MW作为微藻培养的基础培养基, 由图 5可知, 利用每千克的MW经稀释800倍后(800L培养基)可以培养得到单针藻728g的, 其中包含有433.74g的油脂和294.26g的微藻残渣。近期研究结果显示, 利用乳制品工业废水培养绿藻A. dimorphus, 其生物量仅为0.84g/L (Chokshi et al, 2016), 经计算, 728g的微藻最终可得到339.32g的生物柴油。微藻中含有丰富的蛋白质、多糖、维生素及矿物元素等多种营养物质, 将微藻作为幼体动物的饵料, 相比人工饵料, 具有促进幼体生长, 提高幼体成活率等作用(杨贤庆等, 2015; 赵震宇等, 2017), 而将藻类残渣作为牡蛎稚贝的食物来源(GB/T 7714), 为微藻的资源化综合利用提供了一种新的策略(Chokshi et al, 2016)。
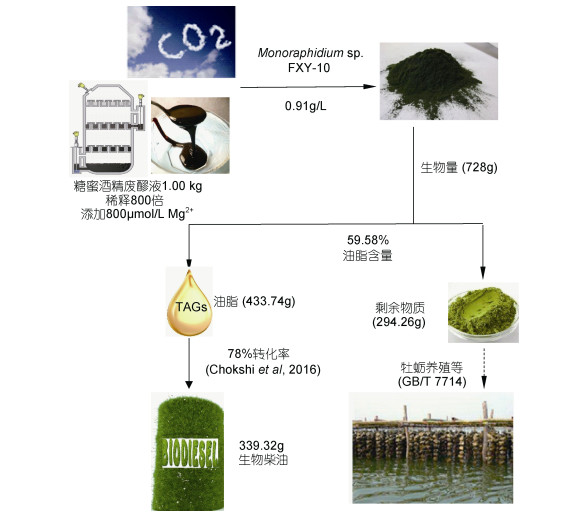 |
| 图 5 单针藻Monoraphidium sp. FXY-10的综合利用 Fig. 5 Comprehensive utilization of Monoraphidium sp. FXY-10 |
(1) Mg2+作为微藻生长过程中重要的金属离子, 促进了单针藻Monoraphidium sp. FXY-10的生长和油脂的积累。以MW作为培养基, 添加800μmol/L的Mg2+, 微藻的生物量和油脂含量最高分别达到0.91g/L和59.58%, 生物量产率和油脂产率分别为45.22和26.94mg/(L·d)。
(2) 在800μmol/L的Mg2+的作用下, 单针藻降低了MW中总氮、总磷及COD值, 其移除率分别为88.37%、93.69%和87.98%。
(3) 每千克MW经蒸馏水稀释800倍后, 添加800μmol/L Mg2+培养单针藻, 可制备339.32g的生物柴油, 同时单针藻残渣可以作为牡蛎稚贝的食物来源, 提高微藻的利用率。
王冰, 白萱, 王嘉丽, 等. 2018. 光合细菌对模拟海水养殖废水COD的去除能力研究. 大连民族大学学报, 20(3): 198-200, 209 DOI:10.3969/j.issn.1009-315X.2018.03.002 |
王盛林, 赵震宇, 刘平怀. 2017. 10种热带富油微藻生物量、总脂含量及脂肪酸组成分析. 中国油脂, 42(8): 93-97 DOI:10.3969/j.issn.1003-7969.2017.08.021 |
方正, 吕德义. 2017. 微藻制备生物柴油的研究进展. 现代化工, 37(9): 57-61 |
李林, 朱伟, 罗永刚. 2012. 钙、镁离子在水流作用下对铜绿微囊藻生长的影响. 环境科学与技术, 35(5): 9-13 DOI:10.3969/j.issn.1003-6504.2012.05.003 |
杨贤庆, 武琼, 胡晓, 等. 2015. 微藻综合加工利用研究进展. 食品工业科技, 36(10): 360-364 |
余光辉, 朱佳文, 张勇, 等. 2015. 化工厂污染区复垦后的土壤和蔬菜重金属含量与风险评价. 土壤通报, 46(3): 728-732 |
张森, 刘平怀, 王影, 等. 2014. 铁、镁及钙对微藻Desmodesmus sp. WC08生长和油脂积累的影响. 广东农业科学, 41(4): 126-130 DOI:10.3969/j.issn.1004-874X.2014.04.032 |
张跃彬, 高正卿. 2009. 蔗糖副产物滤泥、糖蜜酒精废醪液的开发利用. 中国糖料, (3): 63-64, 67 DOI:10.3969/j.issn.1007-2624.2009.03.024 |
周祖光. 2005. 糖蜜酒精生产废醪液资源化利用探析. 环境科学与技术, 28(2): 98-100 DOI:10.3969/j.issn.1003-6504.2005.02.040 |
郑先虎, 辛苑, 刘航, 等. 2017. 一株糖蜜酒精废水净化菌Lysinibacilus sp. S6的筛选与鉴定. 工业微生物, 47(3): 43-48 DOI:10.3969/j.issn.1001-6678.2017.03.007 |
赵震宇, 刘平怀, 王盛林, 等. 2017. 微藻资源综合开发与利用研究进展. 食品工业, 38(11): 275-278 |
甄茜, 蔡婕, 郭行, 等. 2017. 微藻在废水脱氮除磷中的应用. 水处理技术, 43(8): 7-12 |
魏鹏骥, 姜玥璐. 2018. Cd2+、Cu2+与Zn2+对威氏海链藻生长生理和油脂积累的影响. 中国海洋大学学报, 48(7): 47-54 |
Carioca J O B, Regis L V L, Peixoto M C, 2008. The hard choice for alternative biofuels to diesel in Brazil. Journal of Biotechnology, 136(Suppl): S13 |
Che R Q, Huang L, Xu J W et al, 2017. Effect of fulvic acid induction on the physiology, metabolism, and lipid biosynthesis-related gene transcription of Monoraphidium sp. FXY-10. Bioresource Technology, 227: 324-334 DOI:10.1016/j.biortech.2016.12.017 |
Chokshi K, Pancha I, Ghosh A et al, 2016. Microalgal biomass generation by phycoremediation of dairy industry wastewater:an integrated approach towards sustainable biofuel production. Bioresource Technology, 221: 455-460 DOI:10.1016/j.biortech.2016.09.070 |
Fernández-Linares L C, Guerrero Barajas C, Durán Páramo E et al, 2017. Assessment of Chlorella vulgaris and indigenous microalgae biomass with treated wastewater as growth culture medium. Bioresource Technology, 244: 400-406 DOI:10.1016/j.biortech.2017.07.141 |
Francisco Ë C, Jacob-lopes E, Neves D B et al, 2009. Microalgae as feedstock for biodiesel production:carbon dioxide sequestration, lipid production and biofuel quality. New Biotechnology, 25(Suppl): S278-S279 |
Francisco É C, Neves D B, Jacob-Lopes E et al, 2010. Microalgae as feedstock for biodiesel production:carbon dioxide sequestration, lipid production and biofuel quality. Journal of Chemical Technology & Biotechnology, 85(3): 395-403 |
Huang L, Xu J W, Li T et al, 2014. Effects of additional Mg2+ on the growth, lipid production, and fatty acid composition of Monoraphidium sp. FXY-10 under different culture conditions. Annals of Microbiology, 64(3): 1247-1256 DOI:10.1007/s13213-013-0768-9 |
Ketheesan B, Nirmalakhandan N, 2012. Feasibility of microalgal cultivation in a pilot-scale airlift-driven raceway reactor. Bioresource Technology, 108: 196-202 DOI:10.1016/j.biortech.2011.12.146 |
Ma C, Wen H Q, Xing D F et al, 2017. Molasses wastewater treatment and lipid production at low temperature conditions by a microalgal mutant Scenedesmus sp. Z-4. Biotechnology for Biofuels, 10: 111 DOI:10.1186/s13068-017-0797-x |
Nayak M, Karemore A, Sen R, 2016. Performance evaluation of microalgae for concomitant wastewater bioremediation, CO2 biofixation and lipid biosynthesis for biodiesel application. Algal Research, 16: 216-223 DOI:10.1016/j.algal.2016.03.020 |
Ren H Y, Liu B F, Kong F Y et al, 2014. Enhanced lipid accumulation of green microalga Scenedesmus sp. by metal ions and EDTA addition. Bioresource Technology, 169: 763-767 DOI:10.1016/j.biortech.2014.06.062 |
Stephenson P G, Moore C M, Terry M J et al, 2011. Improving photosynthesis for algal biofuels:toward a green revolution. Trends in Biotechnology, 29(12): 615-623 DOI:10.1016/j.tibtech.2011.06.005 |
Tong D, Hu C, Jiang K et al, 2011. Cetane Number Prediction of Biodiesel from the Composition of the Fatty Acid Methyl Esters. Journal of the American Oil Chemists Society, 88(3): 415-423 DOI:10.1007/s11746-010-1672-0 |
Yu X Y, Zhao P, He C A et al, 2012. Isolation of a novel strain of Monoraphidium sp. and characterization of its potential application as biodiesel feedstock. Bioresource Technology, 121: 256-262 DOI:10.1016/j.biortech.2012.07.002 |
Zhao Y T, Li D F, Ding K et al, 2016. Production of biomass and lipids by the oleaginous microalgae Monoraphidium sp. QLY-1 through heterotrophic cultivation and photo-chemical modulator induction. Bioresource Technology, 211: 669-676 DOI:10.1016/j.biortech.2016.03.160 |
Zhao Y T, Li D S, Xu J W et al, 2018. Melatonin enhances lipid production in Monoraphidium sp. QLY-1 under nitrogen deficiency conditions via a multi-level mechanism. Bioresource Technology, 259: 46-53 DOI:10.1016/j.biortech.2018.03.014 |
 2019, Vol. 50
2019, Vol. 50


