中国海洋湖沼学会主办。
文章信息
- 薛英楼, 高菲, 许强, 黄端杰, 王爱民, 孙涛. 2019.
- XUE Ying-Lou, GAO Fei, XU Qiang, HUANG Duan-Jie, WANG Ai-Min, SUN Tao. 2019.
- 黑海参(Holothuria atra)对环境沉积物的摄食选择及消化系统功能适应性研究
- STUDY ON FEEDING SELECTION OF ENVIRONMENTAL SEDIMENTS AND DIGESTIVE FUNCTION ADAPTABILITY OF HOLOTHURIA ATRA
- 海洋与湖沼, 50(5): 1070-1079
- Oceanologia et Limnologia Sinica, 50(5): 1070-1079.
- http://dx.doi.org/10.11693/hyhz20190200033
文章历史
-
收稿日期:2019-02-10
收修改稿日期:2019-04-24
黑海参(Holothuria atra)属于楯手目(Aspidochirotida)、海参科(Holothuriidae)、海参属(Holothuria), 分布于印度洋-太平洋海域, 多栖息于珊瑚礁浅水区域的海草床和砂质底(廖玉麟, 1997), 是热带珊瑚礁海域海参群落的代表种, 通常会形成优势种群。黑海参属沉积食性, 通过楯状触手黏附沉积物颗粒来摄取食物。沉积食性海参通过摄食扰动会显著加速沉积物有机质循环, 增加了沉积物的分解速率, 提升水中氮磷营养盐浓度, 从而对寡营养的珊瑚礁生境产生影响(Uthicke, 1999; Dissanayake et al, 2012)。
珊瑚礁海域生境类型多样, 不同海参具有各不相同的生境偏好。相应地, 其摄取的沉积物质量也各不相同, 比如绿刺参(Stichopus chloronotus)摄入的沉积物较细, 红腹海参(H. edulis)和黑海参(H. atra)摄入的沉积物较粗(Uthicke, 1999; Dissanayake et al, 2012)。在不同的季节, 海参摄入的沉积物粒度存在较大的差异, 如在海参的繁殖季节, 黑海参摄入的沉积物颗粒较非繁殖季节更细(Dar et al, 2006)。现有文献已证实多种海参对沉积物有机质存在选择性, 且沉积物有机质在不同粒级会存在较大差异。因此, 我们推测海参会在摄食与消化系统的结构与功能上对选择的特定粒度沉积物饵料进行适应, 从而满足其对有机质的需求。
动物的消化系统结构与功能会对其摄取的食物质量有最优的适应性, 从而实现食物营养的高效吸收。在对鱼类消化系统的研究中发现, 杂食性的鱼类肠道长, 适应食物中的纤维植物, 肉食性鱼类肠道短, 适应以肉类为主的高蛋白食物, 并且改变鱼类的食物营养结构, 其消化系统也会实现相应的改变, 从而实现对食物的高效吸收(张杏波等, 2012)。目前针对温带仿刺参(Apostichopus japonicus)食性偏好和消化生理功能的研究较多(姜令绪等, 2007; 秦搏等, 2015; wen et al, 2016)。相较于其他肉食性动物, 沉积食性海参在消化系统构成和食物组成方面存在极大的差异:沉积食性海参的胃部, 仅仅是肠道的膨大部位, 并不具备食物消化吸收的功能(Féral et al, 1982; 崔龙波等, 2000)。沉积食性海参的食物饵料中绝大部分都是无机颗粒, 可利用的有机质显著较低(宫魁等, 2012), 特别是热带珊瑚礁区大多属于寡营养海域, 沉积物粒度较粗, 有机质含量偏低。
目前, 国内外对黑海参的摄食选择和消化功能的适应性还没有形成较为系统的研究, 当前的研究多停留在黑海参如何在野外对食物饵料进行选择(Féral et al, 1982; Dissanayake et al, 2012)。因此, 通过研究热带珊瑚礁海域黑海参对食物摄食机理和消化系统结构的功能适应性, 有助于揭示珊瑚礁海参对独特生境的生态适应性。
本研究以三亚蜈支洲岛典型热带珊瑚礁海域的代表性海参种类——黑海参为研究对象, 首先通过现场采样比较其摄取沉积物的理化特征与环境沉积物的关系, 同时对黑海参摄食的触手进行微观的电镜观察, 比较其与温带仿刺参触手结构的差异; 在此基础上进一步分析摄入的沉积物质量在消化过程中的变化, 以及消化道不同区段组织结构和消化酶活性的差异。研究结果以期揭示黑海参对食物的选择能力以及肠道对摄入沉积物饵料的功能适应性。
1 材料与方法 1.1 样品采集与处理本次实验对象黑海参以及环境中的沉积物采于2017年10月30日, 采集地点(图 1)位于海南三亚蜈支洲岛周围海域(18.31°N, 109.76°E), 该海域位于我国热带地区, 为旅游区域, 海底生境和底栖生物资源实行严格保护, 海参的分布与自然环境较为接近。
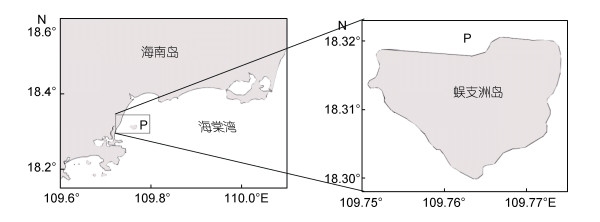 |
| 图 1 黑海参样品和环境沉积物采集区域 Fig. 1 Holothuria atra and the environmental sediment sampling area 注: P为采样点 |
通过潜水捕捞的方式在珊瑚礁砂质底的环境中获得黑海参6头, 所获得的黑海参重量在(100±28)g之间, 捕获后半个小时内冷藏运回岛上实验室。
1.1.2 环境沉积物样品采用自制的50mL针管采泥器, 在每头取样的黑海参口部周围半径10cm范围内收集表层1cm厚的沉积物, 共获得6管样品。
1.1.3 消化道内含物样品将采集到的3头黑海参放在塑料箱(40×30cm)中暂养5min, 立即用5mL的注射器注射3—5mL的氯化钾(0.35mol/L)促使海参排脏(缪婷等, 2017)。将海参排出的内脏分离出整个消化道后截成胃、前肠(内壁密布有纵向褶皱段)、中肠(缢缩前无褶皱段)、后肠(缢缩后无褶皱段)四部分, 将不同区段的内容物分别取出, 放置于-20℃冰柜中保存备用(侯媛媛等, 2019)。
1.1.4 消化酶活性和肠道组织学样品将3头黑海参置于实验室水槽(500L)中暂养24h, 然后注射氯化钾促使海参排脏获得肠道(操作与消化道内含物样品的获取过程相同)。肠壁组织用磷酸缓冲盐溶液(PBS)清洗后, 截取1cm长度用波恩氏液固定2h后, 转移至70%的酒精中保存。剩余部分放入5mL冻存管中液氮保存。
1.1.5 触手样品在水槽中待黑海参触手自然伸出后, 用剪刀剪取海参触手, 立即浸泡于5%的戊二醛中, 2h后转移到无水乙醇中保存, 备用。
1.2 样品分析方法 1.2.1 肠道组织学定性与定量分析采用石蜡包埋和HE染色的方法制作组织切片(朱峰, 2009), 本实验对该方法进行了改进, 操作过程简述如下。
样品先用波恩氏液固定24h, 然后转移到70%的酒精中保存。取用时, 用流水冲洗12h、梯度脱水(50%、70%、80%、85%、90%、95%、100%的酒精)、组织透明(50%的二甲苯酒精、纯二甲苯)、浸蜡、包埋、制块、切片、HE染色、封片、保存。
将制备好的组织切片在显微镜(Olympus cx23, 日本)下拍照测量, 每只黑海参肠道同一部位随机选取3张切片, 每张切片随机选取10个位点测量各组织层的厚度。
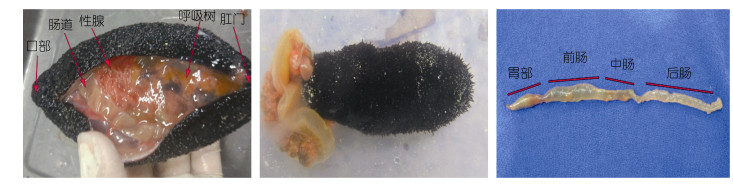 |
| 图 2 黑海参肠道 Fig. 2 Intestinal tract of Holothuria atra |
将消化道内含物和沉积物置于电热鼓风干燥箱(101-0A, 天津泰斯特公司)中60℃×24h烘干。通过标准筛(2、0.5、0.25、0.125、0.063mm)将消化道内含物和沉积物分为6个层级(参考海洋调查规范GB/T 12763.8-2007, 对应粒度为:砾石、粗砂、中砂、细砂、极细砂、粉砂)(国家海洋局, 2008)。过筛后样品重新置于电热鼓风干燥箱中60℃×1.5h烘干, 在干燥器中冷却后称量。称量后将样品放入箱式电阻炉中(SX2-4-10z, 上海博讯公司)采用灼烧重量法(500℃×5h)测定样品有机物含量。
1.2.3 消化酶活性分析本研究测定消化道不同区段四种酶的活性:脂肪酶、淀粉酶、纤维素酶、胰蛋白酶。该四种消化酶的活性, 采用南京建成生物工程研究所试剂盒进行测定。主要步骤如下:将消化道组织称重[(0.1±0.05)g], 置于玻璃匀浆器中, 加入4倍体积的预冷去离子水, 充分研磨5—8min (整个操作在冰水浴中完成), 获得匀浆液, 然后将匀浆液4℃ 4000r/min离心10min后, 取上清液(酶粗提液)。然后四种酶活性均严格按照试剂盒所述操作方法进行测定。四种消化酶都以1g肠道组织所含有的酶活力为单位数(U/g)。
1.2.4 海参触手结构分析将采集的黑海参触手冷冻干燥后, 放置于SEM扫描电镜(Hitachi S-4800, 日本)下观察, 测量触手表面单个乳突直径和乳突簇的直径, 并引用文献(赵鹏, 2010)中仿刺参的实验结果相互对比进行分析。
1.3 计算公式和统计方法黑海参消化道内含物和沉积物粒度重量占比的显著性差异分析采用t检验。不同样品有机物含量显著性差异用单因素方差分析进行检验。采用SPSS 18.0软件进行差异性分析, 显著性水平定义为P < 0.05。

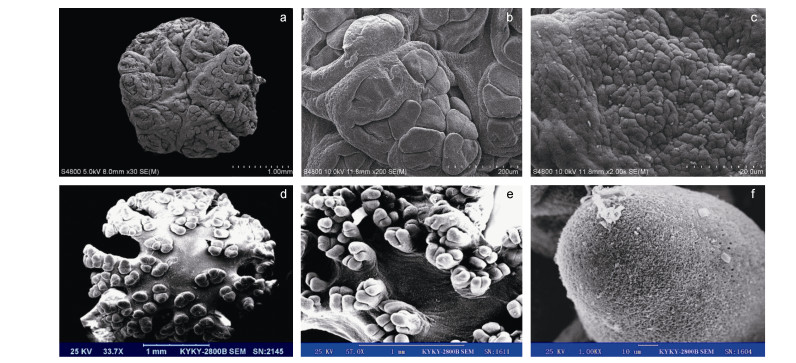
黑海参的触手结构显示, 单个乳突的直径为(100.87±22.97)μm, 每簇乳突的直径为(283.00±40.94) μm。黑海参同温带仿刺参触手比较结果显示, 黑海参单个乳突直径要显著小于仿刺参[(141.73±41.73)μm], 每簇乳突的直径则是仿刺参[(200.88±23.42)μm]显著小于黑海参(图 3a, 3d)。与仿刺参触手上的指状乳突不同, 黑海参触手乳突端部为扁平状(图 3b, 3e), 且其表面的微绒毛不明显, 而仿刺参乳突表面微绒毛较为丰富(图 3c, 3f)。
在各粒度中, 消化道内含物和沉积物都表现出随着粒径的增大, 重量占比也随之增大的趋势, 特别是在粒度为砾石、粗砂和中砂时, 在消化道内含物和沉积物中该部分重量占比分别达到了96.67%、83.78% (表 1)。在该部分消化道内含物中重量占比最高的是砾石, 其次是粗砂; 沉积物中重量占比最高的是粗砂, 其次是中砂。在粒度的重量分布中, 消化道内含物的极细砂和粉砂重量占比要显著低于沉积物, 除了这两个粒度外, 其他粒度的消化道内含物和沉积物的重量占比差异均不显著。
| 粒度 | 消化道内含物(%) | 沉积物(%) |
| 砾石(> 2mm) | 39.38±14.04a | 26.43±5.96a |
| 粗砂(0.5—2mm) | 30.79±5.53a | 29.25±1.94a |
| 中砂(0.25—0.5mm) | 26.52±8.81a | 28.10±2.05a |
| 细砂(0.125—0.25mm) | 4.79±3.72a | 9.33±3.15a |
| 极细砂(0.063—0.125mm) | 1.24±0.80a | 5.67±2.39b |
| 粉砂(< 0.063mm) | 0.45±0.45a | 1.23±0.47b |
| 注:不同上标字母表示统计学上有显著差异(P < 0.05) | ||
从实验数据中可以发现, 黑海参摄入的沉积物的颗粒较大, 重量主要集中在砾石、粗砂和中砂范围, 且该部分摄入的沉积物粒度分布与环境中的沉积物粒度分布相似。
2.3 胃内含物和沉积物有机物含量比较黑海参胃内含物各粒度有机物含量占比均显著高于沉积物, 其中细砂、极细砂和粉砂部分同其他粒度的有机物含量相比, 差异幅度较大, 差值为17.74%—23.22%(表 2)。对于不同粒度有机物含量的分析结果表明, 消化道内含物和沉积物中有机物含量较高的部分分布在较小的粒度(粒径 < 0.25mm)。消化道内含物和沉积物的有机物含量呈现出随粒径减小而逐渐增大的趋势。
| 粒度 | 沉积物 (%) | 胃内含物(%) | 前肠内含物(%) | 后肠内含物(%) |
| 砾石(> 2mm) | 3.09±0.08a | 5.84±0.25b | 3.74±0.35c | 4.12±0.61cd |
| 粗砂(0.5—2mm) | 2.88±0.35a | 5.70±0.92b | 3.58±0.30a | 3.27±0.51a |
| 中砂 (0.25—0.5mm) | 2.50±0.26a | 6.53±1.50b | 3.34±0.11a | 3.47±0.27a |
| 细砂 (0.125—0.25mm) | 4.58±0.43a | 27.61±6.94b | 6.94±2.10a | 5.68±0.03a |
| 极细砂 (0.063—0.125mm) | 5.20±1.1a | 22.94±6.20b | 10.07±2.85a | 9.54±3.67a |
| 粉砂(< 0.063mm) | 6.18±1.78a | 29.40±5.06b | 13.60±4.95ac | 14.71±6.95c |
| 总计 | 3.16±0.06a | 7.50±0.32b | 3.85±0.27cd | 3.79±0.25d |
在各个粒度中, 黑海参胃内含物的有机物含量都要显著高于前肠和后肠内含物, 特别是在粒径 < 0.25mm的范围内, 差异幅度最小值超过了12% (表 2)。胃内含物总有机物含量比前肠和后肠内含物总有机物含量高出1倍多, 达到7.50%。前肠和后肠内含物总有机物含量差异不大, 仅为0.1% (表 2)。
总体上看, 消化道内含物有机物含量沿胃、前肠、后肠逐渐降低, 并且都随着粒径缩小而增加。
2.5 消化道内含物和沉积物中不同粒度有机物贡献量比较单位重量(1g)的胃内含物中, 其有机物总量要高于沉积物, 突出体现在砾石、粗砂和中砂粒度, 差异范围在9.09—14.82mg (表 3)。单位重量胃内含物或沉积物中, 大粒度沉积物所贡献的有机物总量均较高, 如胃内含物中贡献最高的是砾石, 最低的是粉砂, 沉积物中最高的是粗砂, 最低的是粉砂。单位重量胃内含物或沉积物中不同粒度有机物贡献量均呈随粒径减小而降低的趋势。
| 粒度 | 沉积物 (mg) | 胃内含物(mg) | 前肠内含物(mg) | 后肠内含物(mg) |
| 砾石(> 2mm) | 8.17±1.78a | 22.99±2.75c | 15.47±5.91b | 12.97±5.06ab |
| 粗砂(0.5—2mm) | 8.46±1.39a | 17.55±1.31b | 10.12±1.78a | 10.28±3.48a |
| 中砂(0.25—0.5mm) | 7.03±0.98a | 17.02±1.24b | 8.26±3.35a | 9.69±2.82a |
| 细砂(0.12—0.25mm) | 4.29±1.55a | 13.24±2.07b | 2.66±1.62a | 3.56±2.34a |
| 极细砂(0.063—0.125mm) | 2.87±1.32a | 2.86±0.58a | 1.31±0.63ab | 0.95±0.56b |
| 粉砂(< 0.063mm) | 0.79±0.46ab | 1.33±0.74a | 0.67±0.43ab | 0.43±0.15b |
| 总计 | 31.61±0.69a | 74.99±3.24b | 38.49±2.66cd | 37.87±0.56d |
单位重量(1g)消化道内含物中, 胃内含物的总有机物量最高, 其次是前肠、后肠, 从胃到前肠总有机物量发生大幅度的减少, 比例减少了1倍左右, 减少量约为36.50mg (表 3)。
黑海参的后肠虽具有部分吸收功能, 但是对总有机物的吸收量极少, 仅为1mg (表 3)。后肠对极细砂和粉砂粒度的沉积物仍然具有部分消化能力, 在该部分粒度范围, 前肠内含物与胃内含物有机物量差异不显著, 但是后肠内含物的有机物量则显著低于胃内含物。
2.7 黑海参肠道对有机物的吸收食物颗粒经海参消化道过程中, 有机物含量发生了大幅度的减少。比较前后肠消化吸收效率的结果发现, 前肠有机物含量在各个粒度都发生了大幅度的减少, 其中吸收效率最高的是细砂, 达到74.86%, 吸收效率最低的是砾石, 仅为35.96% (图 4)。后肠吸收效率比前肠大幅下降, 仅在砾石、极细砂和粉砂粒度发现有机质被吸收。
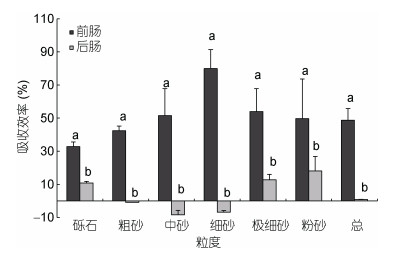 |
| 图 4 黑海参肠道内含物的有机质吸收效率(n=3) Fig. 4 Absorption efficiency of organic matter in gut content of H. atra (n=3) |
总体上看, 前肠具有较高的消化吸收效率, 吸收效率达到了48.67%, 后肠的吸收效率仅为1.56% (图 4)。
2.8 黑海参肠道组织学定量分析 2.8.1 肠道组织层厚度黑海参肠道组织定量分析发现, 在肠道区段中, 后肠的肠壁厚度(403.11μm)要显著高于前肠(291.12μm)和中肠(260.16μm)(图 6)。不同组织层比较发现, 前肠的黏膜层厚度显著大于中肠和后肠, 中肠的黏膜层厚度大于后肠, 但差异不显著。黑海参前肠黏膜层厚度为132.78μm, 中肠比前肠减少近一半, 后肠又比中肠减少一半, 仅为32.93μm (图 6)。黑海参前肠黏膜下层厚度(33.25μm)要显著低于中肠(226.11μm)和后肠(273.19um), 后肠则显著高于中肠; 后肠肌层厚度(35.42μm)显著高于前肠(27.61μm)和中肠(28.35μm)。浆膜层厚度在不同肠道区段间没有明显差别(图 6)。
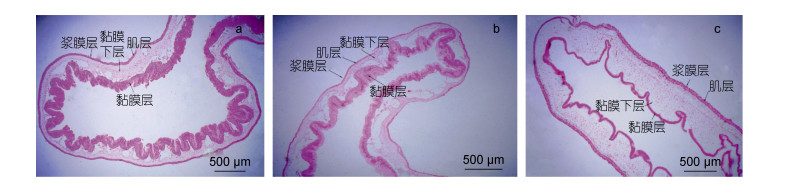 |
| 图 5 黑海参肠道组织 Fig. 5 Intestinal tissue of Holothuria atra 注: a:前肠; b:中肠; c:后肠 |
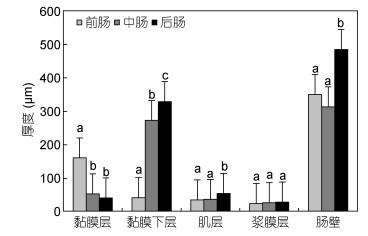 |
| 图 6 黑海参不同肠道区段组织层厚度(n=3) Fig. 6 The thickness of tissue layers in different intestinal segments of H. atra (n=3) |
黑海参前肠各组织层中, 黏膜层占比最大为56.33%, 其次是黏膜下层为22.87%, 浆膜层占比最小为7.05% (图 7)。中肠各组织层中, 厚度占比最大的为黏膜下层, 占比最小的为浆膜层, 其中黏膜下层厚度占比为67.36% (图 7)。后肠各组织层厚度占比与中肠较为相似, 占比最大的为黏膜下层, 最小的也为浆膜层。
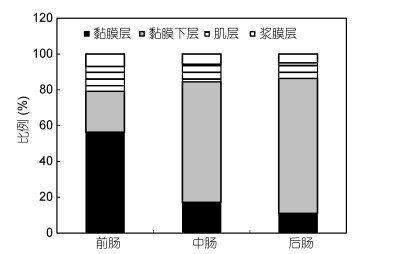 |
| 图 7 黑海参不同肠道区段组织层比例(n=3) Fig. 7 The proportion of tissue layer thickness in different intestinal segments of H. atra (n=3) |
黑海参前中后肠各组织层比较发现, 中肠的黏膜层比例相对于前肠明显减少, 肌层比例相对于前肠也有所减少。后肠的组织结构与中肠相似, 仅黏膜下层组织厚度占比稍高于中肠, 黏膜层则略低于中肠。
2.9 黑海参肠道不同区段消化酶活性本研究发现, 黑海参前肠四种消化酶的活性均显著高于中后肠。其中, 前肠淀粉酶活性为0.06U/g, 脂肪酶活性为5.37U/g, 胰蛋白酶活性为105.45U/g、纤维素酶活性为5.32U/g (图 8)。中肠淀粉酶、胰蛋白酶、纤维素酶略高于后肠, 后肠的脂肪酶略高于中肠, 但差异均不显著。
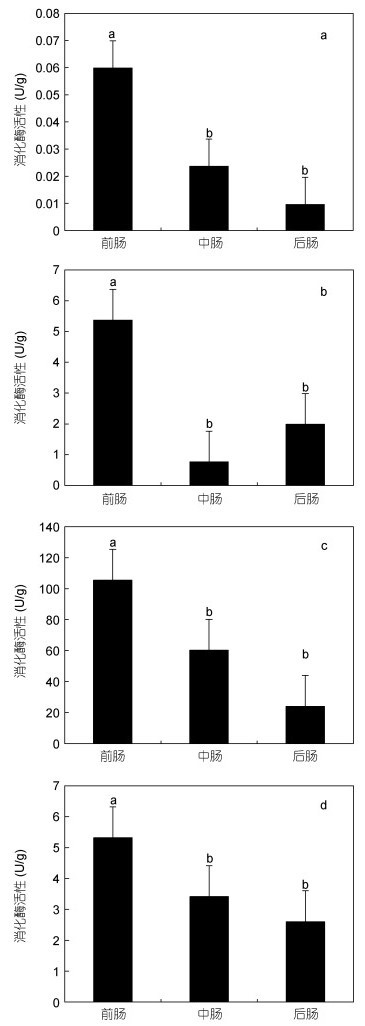 |
| 图 8 黑海参肠道不同区段消化酶活性(n=3) Fig. 8 Activity of four digestive enzymes of H. atra in different intestinal segments (n=3) 注: a:淀粉酶; b:脂肪酶; c:胰蛋白酶; d:纤维素酶 |
海参的触手结构同其摄食的沉积物存在一定的关联, 但是这种关联并不简单局限于机械作用(Roberts, 1979)。当前, 海参触手结构对沉积物粒度适应性的研究方向, 主要集中在通过SEM拍照测量触手单个乳突的直径、乳突簇的直径以及分析乳突表面的黏液组成(Roberts, 1979; 赵鹏, 2010)。相关报道指出, 单个乳突的直径与海参选择摄食的沉积物粒度之间的关系并不明显, 而乳突簇直径与海参选择的沉积物粒度间易于建立相关关系(Hammond, 1981)。仿刺参摄入的沉积物中砾石、粗砂和中砂的重量百分比仅为1.7%(赵鹏等, 2010), 而该部分粒度在黑海参胃内含物中则占到了96.69%, 远高于仿刺参。本研究通过对黑海参和仿刺参触手单个乳突和乳突簇的直径进行比较, 发现虽然黑海参的触手乳突直径要显著小于仿刺参, 但是乳突簇直径显著大于仿刺参。综上所述, 触手结构的差异可能是造成两种海参选择沉积物粒度差异的重要因素, 即在触手分泌黏液黏性相同的情况下, 黑海参由于乳突簇具有更大的表面积从而更适合摄食大颗粒沉积物。
3.2 摄食沉积物过程中粒径选择与有机质含量选择的平衡黑海参摄食过程中对沉积物会存在粒度选择性和有机质含量选择性, 两者达到较好的平衡才能保证海参营养获取的高效性。本研究发现, 黑海参消化道内含物中砾石、粗砂等粗颗粒部分的重量占比略高于沉积物, 而细颗粒部分(极细砂和粉砂等)重量占比显著低于沉积物, 表明黑海参对沉积物粒度存在弱的选择性, 更偏向于选择粗颗粒部分。该结果与红海地区10月份黑海参消化道内含物中砾石占比要高于与沉积物占比的结果相似(Dar et al, 2006)。本研究发现, 黑海参胃内含物各个粒度的有机物含量都要高于沉积物, 表明黑海参能够从环境中主动摄食高有机质含量的沉积物, 且摄入的高有机物含量的沉积物集中在细颗粒。有研究发现新西兰海参(Australostichopus mollis)也存在主动摄食高有机质沉积物的现象, 当环境中的沉积物有机物含量较低时, 新西兰海参会向高有机质地区迁移(Slater et al, 2011; Zamora et al, 2011)。本研究中, 单位重量(1g)沉积物样品中大部分的有机物均存在于粗颗粒部分。虽然粗颗粒部分有机质含量较细颗粒为低, 但因其在沉积物中占比大, 黑海参对粗颗粒的高效摄食也能保证其对有机质的需求, 具体表现在胃含物中粗颗粒有机质的量占据了其摄食沉积物的绝大部分。与此同时, 黑海参在消化吸收过程中对粗颗粒有机物的吸收效率也很高, 充分表现出了其对粗颗粒的选择和有机质的高效摄取达到了较好的平衡。
3.3 肠道结构功能对珊瑚砂沉积物的适应性通过对海参消化道组织的四种常规消化酶(脂肪酶、淀粉酶、胰蛋白酶、纤维素酶)的酶活分析发现, 黑海参消化道的前肠具有较高的酶活性, 而中后肠的酶活性较低。在仿刺参肠道消化能力的研究中也发现, 前肠上皮的蛋白酶、脂酶和非特异性酯酶活性较高, 而中后肠基本没有(崔龙波等, 2000)。黑海参胃内含物的有机物经过前后肠之后都有所减少, 减少幅度最大的还是在前肠。这表明虽然黑海参的整个肠道都具有一定的消化吸收能力, 但其主要的消化吸收场所是在前肠。该结果与仿刺参前肠是消化吸收的主要场所这一结论是一致的(崔龙波等, 2000)。在本研究中发现, 黑海参后肠内含物部分粒度的吸收效率呈现出负值, 其可能原因是, 在测定有机物含量的不同平行间存在均值误差。
肠道是海参消化吸收的主要部位, 肠道组织由四层构成, 包括黏膜层、黏膜下层、肌层和浆膜层(崔龙波等, 2000; 杨筱珍等, 2015), 其中黏膜层是消化吸收的主要部位(Kamenev et al, 2013)。本研究通过对黑海参肠道组织厚度和厚度比例的分析发现, 肠道组织厚度随不同区段呈现渐变趋势, 其中主要的变化集中在黏膜层和黏膜下层。黏膜层组织厚度为前肠>中肠>后肠, 黏膜下层则为前肠<中肠<后肠。黑海参前肠的四种消化酶具有最高的酶活性, 并且前肠是有机物吸收的主要部位。在中后肠消化吸收能力发生了转变, 消化吸收能力大幅度的减弱, 伴随这种消化吸收能力的变化, 黑海参肠道在黏膜层厚度上也相应发生了由厚向薄的变化。
海参的肠道黏膜层(也称消化上皮)主要由囊状细胞组成(Foster et al, 1996; Mashanov et al, 2001), 这些细胞似乎有多种功能, 包括分泌黏液物质进入消化管腔、通过微绒毛吸收营养、吞噬食物颗粒、产生负责管腔消化的酶、积累营养并将其运输到管腔间隙等(Mashanov et al, 2004; Kamenev et al, 2013)。在海参肠道的不同区段, 囊状细胞的主要功能存在较大的差异。在前肠, 囊状细胞合成和分泌黏液, 保护消化上皮不受机械损伤, 并通过黏液将消化酶固定, 防止消化酶的稀释, 在发育良好的微绒毛区域分泌消化酶对营养物质进行消化和吸收。在中肠, 黏液的合成和分泌减少, 与膜相关的营养消化和吸收水平下降。在后肠, 黏液的合成和分泌相对于中肠有所提升(Kamenev et al, 2013)。随着黏膜层上皮细胞在不同肠道区段分泌功能的变化, 其在组织层中的比例也会发生变化。Trefz (1958)在对黑海参的肠道研究中也发现, 后肠黏膜层比前肠黏膜层薄了三分之一到四分之一, 并且肠道中黏液细胞在前肠较少, 到了后肠则变的丰富。
肠道的黏膜下层主要由含有血管、纤维和疏松胶质的疏松结缔组织构成(涂永锋, 2004), 缺乏控制肠壁扩张的由胶原纤维组成的致密层, 通常黏膜下层在前肠较薄, 在后肠较厚(Féral et al, 1982)。在本实验中发现黑海参的中肠和后肠的黏膜下层相对于前肠有明显的增厚, 这样的肠道结构可能有利于黑海参肠道的相应扩大, 容纳更多即将被排泄的内含物。对于同为棘皮动物的海胆, 结缔组织在肠道的血液循环中也起到了重要的作用(Deridder et al, 1993), 且血液循环主要发生在前肠, 在后肠缺乏血液循环(Herreid II et al, 1976)。
黑海参肠道肌层中, 主要包括两种类型的肌层:环肌和纵肌。本实验中观察到, 前肠环肌较为发达, 纵肌缺乏; 中后肠环肌变薄, 纵肌增厚。有研究表明, 肠道中环肌的波动收缩可以形成肠道的蠕动, 从而推动食团向后移动(涂永锋等, 2004)。在前肠, 黑海参发达的环肌可能与食物的移动和运输相关。综上所述, 黑海参消化系统的结构和功能均与其摄食粗颗粒珊瑚砂饵料相适应, 并且其有机质利用非常高效, 这也是其适应珊瑚礁海域沉积物饵料环境的关键之一。
4 结论本文发现生活在热带珊瑚礁海域的黑海参, 其触手具有较仿刺参更为宽大的乳突簇, 适宜摄取大颗粒沉积物, 胃内含物分析发现其摄取的沉积物也多为粗颗粒, 且对有机质含量具有显著的主动选择性。黑海参可有效利用珊瑚礁区特有的粗颗粒沉积物饵料, 突出体现在对粗颗粒部分有机物的吸收效率、消化酶活性配伍以及各区段肠道组织层的结构适应性等方面。研究结果证实, 黑海参摄食器官和消化道独特的结构与功能保证了其在珊瑚砂粗颗粒底质生境中高效摄取有机物、保障个体的正常生长和发育。
朱峰, 2009.仿刺参Apostichopus japonicus胚胎发育和主要系统的组织学研究.青岛: 中国海洋大学硕士学位论文, 25-26 http://cdmd.cnki.com.cn/Article/CDMD-10423-2009171551.htm
|
杨筱珍, 李彤, 李萌, 等. 2015. 中华绒螯蟹(Eriocheir sinensis)肠道和肝胰腺5-羟色胺(5-HT)和5-羟色胺受体2(5-HTR2)的定位研究. 海洋与湖沼, 46(5): 1139-1145 |
张杏波, 梁旭方, 朱滔, 等. 2012. 食性对草鱼消化道发育及三种消化酶活性的影响. 水生生物学报, 36(3): 569-572 |
国家海洋局. 2008. GB/T 12763.8-2007海洋调查规范第8部分:海洋地质地球物理调查. 北京: 中国标准出版社
|
赵鹏, 2010.刺参Apostichopus japonicus摄食选择性的基础研究.青岛: 中国科学院研究生院(海洋研究所)硕士学位论文, 25 http://cdmd.cnki.com.cn/Article/CDMD-80068-2010147973.htm
|
赵鹏, 杨红生. 2010. 刺参对不同生境中沉积物粒度的选择. 海洋科学, 34(4): 11-16 |
侯媛媛, 陈慕雁. 2019. 仿刺参肠道神经定位初步研究. 中国海洋大学学报, 49(2): 30-35 |
姜令绪, 杨宁, 李建, 等. 2007. 温度和pH对刺参(Apostichopus japonicus)消化酶活力的影响. 海洋与湖沼, 38(5): 476-480 DOI:10.3321/j.issn:0029-814x.2007.05.013 |
宫魁, 王宝杰, 刘梅, 等. 2012. 仿刺参饲用海泥资源质量评价的初步研究. 饲料工业, 33(10): 38-41 |
秦搏, 常青, 陈四清, 等. 2015. 饲料中浒苔添加量以及处理方法对幼刺参生长、消化率、消化酶和非特异性免疫酶的影响. 水产学报, 39(4): 547-556 |
涂永锋, 宋代军. 2004. 鱼类肠道组织结构及其功能适应性. 江西饲料, (4): 16-19 DOI:10.3969/j.issn.1008-6137.2004.04.007 |
崔龙波, 董志宁, 陆瑶华. 2000. 仿刺参消化系统的组织学和组织化学研究. 动物学杂志, 35(6): 2-4 DOI:10.3969/j.issn.0250-3263.2000.06.001 |
廖玉麟. 1997. 中国动物志-棘皮动物门海参纲. 北京: 科学出版社, 99-100
|
缪婷, 孙丽娜, 杨红生, 等. 2017. HMG(High-Mobility Group Box Protein)在刺参(Apostichopus japonicus)肠道再生期间的表达情况分析. 渔业科学进展, 38(6): 148-154 |
Dar M A, Ahmad H O, 2006. The feeding selectivity and ecological role of shallow water holothurians in the Red Sea. SPC Beche-de-mer Information Bulletin, 24: 11-21 |
DeRidder C, Jangoux M, 1993. The digestive tract of the spatangoid echinoid Echinocardium cordatum (Echinodermata): morphofunctional study. Acta Zoologica, 74(4): 337-351 DOI:10.1111/j.1463-6395.1993.tb01248.x |
Dissanayake D C T, Stefansson G, 2012. Habitat preference of sea cucumbers: Holothuria atra and Holothuria edulis in the coastal waters of Sri Lanka. Journal of the Marine Biological Association of the United Kingdom, 92(3): 581-590 DOI:10.1017/S0025315411000051 |
Féral J P, Massin C, 1982. Digestive systems: holothuroidea. In: Jangoux M, Lawrence J M eds. Echinoderm Nutrition. Balkema: Rotterdam, 191-212
|
Foster G G, Hodgson A N, 1996. Feeding, tentacle and gut morphology in five species of southern African intertidal holothuroids (Echinodermata). South African Journal of Zoology, 31(2): 70-79 DOI:10.1080/02541858.1996.11448396 |
Hammond L S, 1981. An analysis of grain size modification in biogenic carbonate sediments by deposit feeding holothurians and echinoids (Eehinodermata). Limnology and Oceanography, 26(5): 898-906 DOI:10.4319/lo.1981.26.5.0898 |
Herreid Ⅱ C F, LaRussa V F, DeFesi C R, 1976. Blood vascular system of the sea cucumber, Stichopus moebii. Journal of Morphology, 150(2): 423-451 DOI:10.1002/jmor.1051500211 |
Kamenev Y O, Dolmatov I Y, Frolova L T et al, 2013. The morphology of the digestive tract and respiratory organs of the holothurian Cladolabes schmeltzii (Holothuroidea, Dendrochirotida). Tissue and Cell, 45(2): 126-139 DOI:10.1016/j.tice.2012.10.002 |
Mashanov V S, Dolmatov I Y, 2001. Ultrastructure of the alimentary canal in five-month-old Pentactulae of the holothurian Eupentacta fraudatrix. Russian Journal of Marine Biology, 27(5): 320-328 DOI:10.1023/A:1012508832422 |
Mashanov V S, Frolova L T, Dolmatov I Y, 2004. Structure of the digestive tube in the holothurian Eupentacta fraudatrix (Holothuroidea: Dendrochirota). Russian Journal of Marine Biology, 30(5): 314-322 DOI:10.1023/B:RUMB.0000046550.23343.b4 |
Roberts D, 1979. Deposit-feeding mechanisms and resource partitioning in tropical holothurians. Journal of Experimental Marine Biology and Ecology, 37(1): 43-56 DOI:10.1016/0022-0981(79)90025-X |
Slater M J, Jeffs A G, Sewell M A et al, 2011. Organically selective movement and deposit-feeding in juvenile sea cucumber, Australostichopus mollis determined in situ and in the laboratory. Journal of Experimental Marine Biology and Ecology, 409(1-2): 315-323 DOI:10.1016/j.jembe.2011.09.010 |
Trefz S M, 1958. The physiology of digestion of Holothuria atra Jager with special reference to its role in the ecology of coral reefs. Honolulu: Doctor Dissertation of University of Hawaii, 158
|
Uthicke S, 1999. Sediment bioturbation and impact of feeding activity of Holothuria (Halodeima) atra and Stichopus chloronotus, two sediment feeding holothurians, at Lizard Island, Great Barrier Reef. Bulletin of Marine Science, 64(1): 129-141 |
Wen B, Gao Q F, Dong S L et al, 2016. Effects of dietary inclusion of benthic matter on feed utilization, digestive and immune enzyme activities of sea cucumber Apostichopus japonicus (Selenka). Aquaculture, 458: 1-7 DOI:10.1016/j.aquaculture.2016.01.028 |
Zamora L N, Jeffs A G, 2011. Feeding, selection, digestion and absorption of the organic matterfrom mussel waste by juveniles of the deposit-feeding sea cucumber, Australostichopus mollis. Aquaculture, 317(1-4): 223-228 DOI:10.1016/j.aquaculture.2011.04.011 |
 2019, Vol. 50
2019, Vol. 50