
中国海洋湖沼学会主办。
文章信息
- 王倩, 郇聘, 刘保忠. 2019.
- WANG Qian, HUAN Pin, LIU Bao-Zhong. 2019.
- 笠贝soxb、mox基因的鉴定及在足原基发育中的表达模式
- EXPRESSION PATTERNS OF SOXB AND MOX GENES IN LOTTIA GOSHIMAI DURING THE FORMATION OF MOLLUSCAN FOOT
- 海洋与湖沼, 50(5): 1091-1097
- Oceanologia et Limnologia Sinica, 50(5): 1091-1097.
- http://dx.doi.org/10.11693/hyhz20190100023
文章历史
-
收稿日期:2019-01-25
收修改稿日期:2019-03-12
2. 青岛海洋科学与技术试点国家实验室 海洋生物学与生物技术功能实验室 青岛 266000;
3. 中国科学院大学 北京 100049
2. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266000, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
软体动物是仅次于节肢动物的第二大动物门类, 依不同的分类标准, 可分为七至八个纲(Smith et al, 2011; Wanninger et al, 2019)。软体动物成体形态多样化, 典型类群之间如头足纲(乌贼等)、腹足纲(螺类)、双壳纲(扇贝等)外部形态差别显著。然而, 这些动物实际上有类似的身体构成, 均包括贝壳、内脏团、足等几部分(Haszprunar et al, 2012)。各个纲之间的差别主要来自这些结构不同程度的特化, 例如贝壳可以形成螺旋状(腹足纲)或分作两片(双壳纲)或者完全消失(多数头足纲及部分腹足纲)等。足是除贝壳外软体动物最重要的器官之一, 不同软体动物的足也表现出极大的形态多样性, 例如在腹足纲动物中足多为腹侧一宽大的扁平肌肉组织, 双壳纲动物的足则多形成侧扁的挖掘器官, 掘足类动物的足呈圆锥形, 头足类中足则特化为腕(Lee et al, 2003; Haszprunar et al, 2012)。因此, 足是理解软体动物的身体构造、生存方式和发育的重要方面。另外, 足在许多经济软体动物中是主要的经济价值部位, 如鲍、蛤等。解析足的发育和生长等机制对于认识软体动物的形态建成机制, 开发其潜在经济价值有重要的意义。
软体动物在担轮幼虫期即开始出现足原基, 至面盘幼虫阶段足已经非常明显(Wanninger et al, 2001; Kay et al, 2002)。足原基在幼虫腹侧形成, 随着发育的进行逐渐长大, 并发育出类群特异性的外部形态, 如扁平状、侧扁形、圆锥形等。变态前, 幼虫以足附着到基质上爬行, 此时的足在形态上与成体的足已无显著的差别。从组织构成的角度来讲, 软体动物的足分为神经和肌肉两个主要组成部分, 他们分别起源于原肠胚时期的外胚层和中胚层。这两类组织在胚胎发育中如何迁移, 最终相互作用形成足原基是研究足发育的重要方面, 但至今调控此过程的分子机制尚不清楚。
soxb基因属于Sox转录因子基因家族, 在早期胚胎的神经外胚层细胞中表达, 在神经系统的发育中起重要作用(Focareta et al, 2016)。mox基因属于同源异形基因家族, 在中胚层细胞的早期发育中起重要作用(Candia et al, 1992; Cossu et al, 1996; Baylies et al, 1998)。软体动物足的神经和肌肉组织来自于早期发育中的神经外胚层和中胚层细胞, soxb和mox可以分别作为其标记基因。研究表明, 软体动物早期发育中soxb和mox基因分别在神经外胚层及中胚层中表达, 参与足部神经和肌肉系统发育的调控过程(Hinman et al, 2002; Le Gouar et al, 2004)。然而这些研究多关注发育晚期的幼虫阶段, 或仅关注神经发育, 缺乏其在早期足原基的发育过程中的表达信息。本研究鉴定了笠贝(Lottia goshimai)的soxb和mox基因, 研究了它们在早期幼虫神经和肌肉系统中的表达模式动态变化, 为理解软体动物足的发育过程提供了重要参考。
1 材料与方法 1.1 笠贝幼虫的培养及固定成体笠贝采集自青岛沿海, 待其自然排卵产精, 收集成熟的卵细胞在塑料器皿中, 加入精子悬液进行人工授精, 受精卵于25℃培养。分别取受精后10h、12h (hpf, hours post fertilization)担轮幼虫样品, 经4%多聚甲醛溶液固定后梯度甲醇脱水, 于–20℃保存。
1.2 soxb和mox同源基因的克隆和鉴定利用长牡蛎soxb、mox的序列信息, 从笠贝转录组中比对得到同源序列, 获得笠贝soxb和mox同源基因的cDNA全长, 并分别命名为lgo-soxb和lgo-mox。通过与已知soxb、mox基因进行序列比对, 确认所获序列包含完整的CDS。
1.3 soxb和mox同源基因序列特征和聚类分析分别对lgo-soxb和lgo-mox编码的氨基酸序列特征进行了生物信息学分析, 利用Expasy网站提供的工具(http://web.expasy.org/compute_pi/)预测了分子量和等电点, 使用SMART在线工具(http://smart.emblheidelberg.de/)预测了蛋白结构域, 利用NCBI中CD-Search在线工具(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)鉴定蛋白质保守结构域。利用MEGA软件分别对lgo-soxb、lgo-mox编码蛋白序列及其他种属动物的同源序列进行了聚类分析, 并以Neighbor-Joining法构建了演化树。
1.4 整装原位杂交以带有T7启动子序列的引物扩增笠贝的cDNA作为探针模板, 引物序列: lgo-soxb-F (TTGCGACCG ATCCTAGAGTGA)、lgo-soxb-R (TCCGTCTGTGGT GGCTTGT), lgo-mox-F (GGAAGATCCAGAGAGAA TGAATGCT)、lgo-mox-R (GTCCATCAACTCTATCT TTACCT ACTTTCG)。以上述反应的产物为模板, 使用地高辛标记的NTP混合物和T7 RNA聚合酶通过体外转录合成地高辛标记的RNA探针。整装原位杂交参照Thisse报道的方法进行(Thisse et al, 1993)。
1.5 扫描电子显微镜观察笠贝幼虫在2.5%戊二醛中固定后梯度脱水至100%乙醇, 然后经1︰1乙醇/乙酸异戊酯混合液过渡后转移至乙酸异戊酯中, 经二氧化碳临界点法干燥后喷金, 置于Hitachi S-3400N扫描电子显微镜下观察记录。
2 结果 2.1 笠贝足原基的形成过程笠贝的足原基最早在担轮幼虫阶段开始形成。我们选取了担轮幼虫阶段的两个时期, 观察了幼虫腹侧足原基的形成过程。如图 1所示, 在受精后10h的幼虫中, 足原基尚未形成, 腹侧组织主要是神经外胚层组织, 中央部分的凹陷的中线组织(midline)将其分为对称分布的两部分。在受精后12h的幼虫中, 中线组织已经消失, 腹侧组织愈合并显著隆起, 即为足原基。
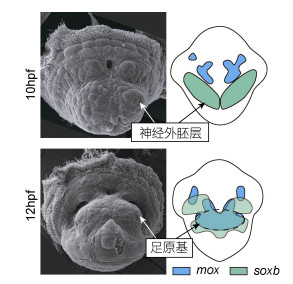 |
| 图 1 笠贝担轮幼虫的电镜图片与lgo-soxb和lgo-mox基因腹侧表达模式示意图 Fig. 1 Scanning electronic microscopic image of the trochophores of L. goshimai and the schematic diagrams showing the ventral expression of lgo-mox and lgo-soxb 注:在电子显微镜下, 幼虫腹侧的神经外胚层(neuroectoderm)和足原基(foot anlage)很显著。由于中胚层组织不在幼虫表面, 在电镜照片中不易确定其准确位置。10 hpf、12 hpf分别代表受精后10和12小时的幼虫。右侧基因表达示意图由原位杂交结果总结而来(见下文) |
lgo-soxb基因编码区全长1041bp, 编码一个长346个氨基酸的前体蛋白, 其理论分子量为38.70kDa, 理论等电点9.57。预测其中第79—149个氨基酸位点为HMG DNA结合结构域(图 2a)。多序列比对表明, lgo-soxb编码多肽的HMG结构域与SoxB亚家族分子有更高的序列相似性, 而与其他亚家族如SoxC、SoxD、SoxF等的相似性稍低(图 3a)。lgo-mox基因编码区全长771bp, 编码一个长256个氨基酸的前体蛋白, 其理论分子量为29.52kDa, 理论等电点8.83。预测其中第149—211个氨基酸位点为同源异形结构域(homeodomain) (图 2b)。多序列比对表明该部分的氨基酸序列组成与其余同源异形基因如Hox等十分相似(图 3b)。
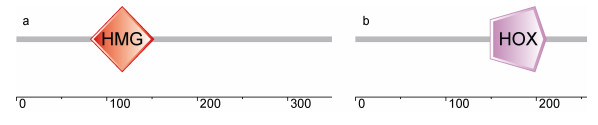 |
| 图 2 lgo-soxb (a)和lgo-mox (b)基因所编码多肽的结构示意图 Fig. 2 Schemes of the peptides encoded by lgo-soxb (a) and lgo-mox (b) |
 |
| 图 3 lgo-soxb和lgo-mox基因分别编码的HMG结构域(a)和同源异形结构域(b)的多序列比对分析 Fig. 3 Multi-alignment of the HMG box from Lgo-Soxb (a) and the homeodomain from Lgo-Mox (b) |
对笠贝中lgo-soxb和其他物种中的同源序列进行聚类分析, 以NJ法构建了演化树(图 4)。聚类分析确认Lgo-Soxb基因属于SoxB家族成员。如图 4所示, Lgo-Soxb先与牡蛎等其他软体动物的Soxb基因聚为一支, 再与人Soxb1基因(在哺乳动物中对应Sox1、Sox2、Sox3)分支聚在一起, 而其他的Sox基因家族成员分别聚为几支。
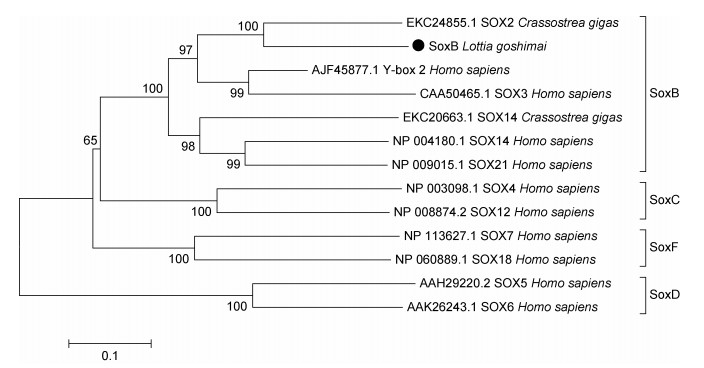 |
| 图 4 Neighbor-joining法构建的lgo-soxb的演化树 Fig. 4 The phylogenetic tree of lgo-soxb built by neighbor-joining method 注:节点处的数值表示1000次重复抽样所得的自举(bootstrap)值 |
对笠贝lgo-mox基因和其他同源异形基因如evx和scr进行了聚类分析, 构建了NJ树。如图 5所示, 聚类分析确认Lgo-Mox属于Mox基因。Lgo-Mox先与其他腹足类软体动物的Mox基因聚为一支, 再与双壳纲软体动物的Mox基因形成一支; 其他人、鼠等脊椎动物的Mox基因聚为一支, 果蝇的Mox基因(称作Btn)则单独聚为一支。而Evx基因和Scr基因则各自聚成两个分支, 与Mox基因分开。
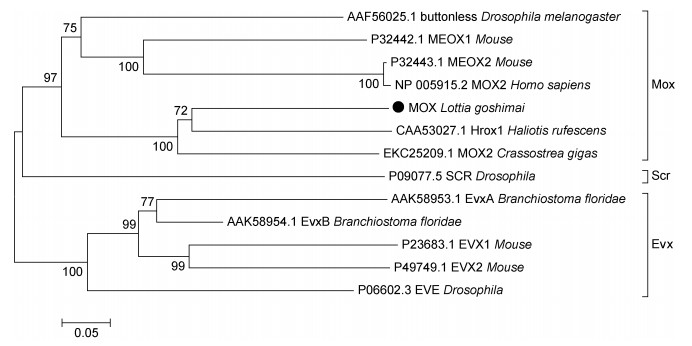 |
| 图 5 NJ法构建的lgo-mox的演化树 Fig. 5 The phylogenetic treeof lgo-mox built by neighbor-joining method 注:节点处的数值表示1000次重复抽样所得的自举(bootstrap)值 |
我们利用原位杂交技术观察了笠贝担轮幼虫时期(10hpf和12hpf)soxb和mox基因的表达规律。结果如图 6所示。10hpf幼虫中lgo-mox在腹侧内部区域表达(图 6b, c), 呈“Y”字形对称表达, 而在背侧无表达(图 6a); 发育到12hpf时, 在腹侧lgo-mox基因在足原基附近内部略有表达(图 6e, f), 区域相比于10hpf的位置略偏下且范围更大, 而在背侧出现了新的表达(图 6d)。
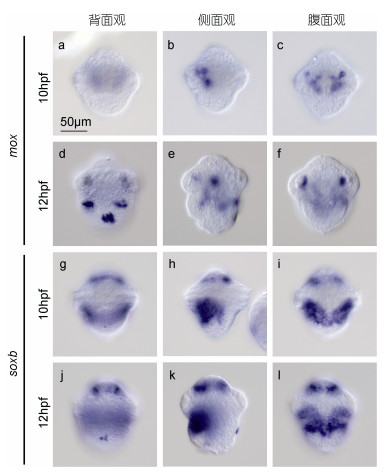 |
| 图 6 lgo-mox和lgo-soxb基因在笠贝幼虫中的表达模式 Fig. 6 Expression patterns of lgo-mox and lgo-soxb in L. goshimai larvae 注: 10hpf、12hpf分别代表受精后10h和12h的幼虫 |
lgo-soxb基因在10hpf幼虫中主要在腹侧呈现对称的两部分表达(图 6h, i), 在担轮环前部区域有表达(图 6g, h, i); 发育到12hpf时, lgo-soxb基因在腹侧足原基部位对称表达(图 6k, l), 呈现出随时间推移表达区域变大以及上移的特点; 其在担轮环前部区域仍有表达(图 6j, k. l), 而且在背侧也出现了新的表达(图 6j)。
2.5 笠贝胚胎形态变化与基因表达的一致性在这两个发育阶段, 笠贝lgo-soxb和lgo-mox在腹侧的表达展示出和足发育的相关性, 其示意图如图 1所示。与扫描电子显微镜观察揭示的形态学变化相符, 10hpf时足原基尚未形成, lgo-mox表达区域的下部和lgo-soxb表达区域的上部邻近但不重叠, 提示此时神经外胚层和中胚层的细胞并未混合在一起。幼虫发育至12hpf时, 足原基已经形成, 与之对应的是lgo-soxb和lgo-mox在腹侧的表达互相靠拢且呈现大片重叠区域, 提示此时中胚层细胞和神经外胚层细胞混合在一起, 共同组织形成了足原基。
3 讨论神经和肌肉分别来自动物胚胎早期分化形成的神经外胚层和中胚层细胞, soxb和mox分别是介导早期神经外胚层和中胚层分化的重要基因。有研究表明, 这两个基因在软体动物神经外胚层及中胚层中表达, 可能参与足部的发育(Hinman et al, 2002; Le Gouar et al, 2004)。因此作者选取了soxb基因和mox基因作为标记基因, 通过分析它们表达模式研究早期幼虫中神经和肌肉系统动态变化。尽管面盘幼虫期才出现明显的足, 然而前期观察表明足的发育起始于更早的发育阶段, 因此作者选取了处于10hpf和12hpf的笠贝担轮幼虫。结果表明, 在该时期中神经和肌肉标记基因的表达表现出显著的动态变化, 可能是足早期发育的关键时期, 为了解足的发育模式提供了重要参考。
10hpf的担轮幼虫代表了足发育的起始阶段。如图 1和图 6所示, 在该时期, 神经外胚层和中胚层细胞尚未重叠。这表明, 组成贝类足部的神经和肌肉细胞起源于早期胚胎不同的部位, 这也和细胞谱系分析的结果相一致(Dictus et al, 1997)。在后续发育阶段, 二者相向运动并重叠在一起, 展示了原始的神经和肌肉组织迁移并重组形成足原基的动态过程, 这是对腹足类动物足发育最初阶段发育细节的首次描述, 在其他类群软体动物中是否遵循这种规律尚需进一步研究。尽管不同软体动物的同源器官(如足和贝壳)差别很大, 但它们的早期发育可能有很多相似之处。例如贝壳的结构和形态差别极大, 然而不同软体动物贝壳早期的发育过程十分相似, 均来自原肠胚背部的一部分外胚层细胞, 甚至在担轮幼虫阶段的贝壳结构都极为相似(Wanninger et al, 2001; Nederbragt et al, 2002a; Mouëza et al, 2006)。由于足均来自腹侧的外胚层和中胚层细胞, 可以推测, 不同类群软体动物的足可能有一些共同的发育机制。另外, 有理由相信, 存在一个完善的信号系统协同调控这两类细胞的相向运动。组成足原基的神经和肌肉组织藉由何种信号迁移, 是研究足发育的下一个重要问题。与此同时, 神经外胚层和中胚层(肌肉)细胞必须有机的组织在一起才能形成功能性的足。在后续的发育中这两类细胞如何协同作用, 以至于互相调控对方的分化、增殖和迁移, 也是重要的研究方向。
作为广泛的神经外胚层和中胚层分化的调节基因, lgo-soxb和lgo-mox的表达不局限于足原基的部位, 提示其还参与了其他发育过程。例如, 幼虫担轮环前部位置lgo-soxb的表达表明这些部位存在正在分化的神经组织, 这些细胞可能与眼及脑神经节的发育相关。担轮环后部表达lgo-soxb的细胞除参与足原基形成外, 可能还参与其他躯干部位神经组织(如咽部神经节、脏神经节等)的形成。对于lgo-mox基因, 其早期表达部位与已知的中外胚层部位大体相符(Nederbragt et al, 2002b; Kozin et al, 2016), 提示其可能调控外胚层来源的中胚层组织。中外胚层是包括软体动物在内的螺旋卵裂动物(Spiralia)发育中十分重要的组织, 是这类动物中胚层组织的两大来源之一(另一个是中内胚层)(Boyer et al, 1996; Lyons et al, 2014; Osborne et al, 2018)。研究表明, 中外胚层细胞并不表达一些典型的中胚层标记基因如brachyury等, 但是却又同时表达twist、mox等重要的中胚层分化相关基因, 体现出这类组织不同于典型中内胚层组织的一些特色之处(Nederbragt et al, 2002b; Lyons et al, 2014)。我们的结果表明, 这些中胚层细胞起源于胚孔上方两侧的两团细胞, 可能来自于卵裂期的3a和3b细胞, 与已有的认识相符(Lyons et al, 2014)。我们的结果展示了这些细胞的迁移过程, 可为中胚层细胞的分化命运研究提供参考。例如, 一些表达lgo-mox基因的细胞分布在担轮环前部, 可能参与幼虫面盘肌肉和其他中胚层来源组织的发育(Wanninger et al, 1999; Osborne et al, 2018)。
4 结论软体动物的足来自于发育早期的外胚层和中胚层细胞, soxb和mox基因可以作为标记基因来研究这两类组织的迁移、分化等发育过程。笠贝中这两个基因的表达变化表明, 将要形成足的神经外胚层和中胚层细胞起源于不同部位, 在发育过程中逐渐互相接近并重叠, 至担轮幼虫晚期共同作用形成足原基。这些结果展示了足原基最初阶段的形成过程, 为深入了解软体动物足的发育机制提供了重要的支撑。
Baylies M K, Bate M, Gomez M R, 1998. Myogenesis:a view from Drosophila. Cell, 93(6): 921-927 DOI:10.1016/S0092-8674(00)81198-8 |
Boyer B C, Henry J Q, Martindale M Q, 1996. Dual origins of mesoderm in a basal spiralian:cell lineage analyses in the polyclad turbellarian Hoploplana inquilina. Developmental Biology, 179(2): 329-338 DOI:10.1006/dbio.1996.0264 |
Candia A F, Hu J, Crosby J et al, 1992. Mox-1 and Mox-2 define a novel homeobox gene subfamily and are differentially expressed during early mesodermal patterning in mouse embryos. Development, 116(4): 1123-1136 |
Cossu G, Tajbakhsh S, Buckingham M, 1996. How is myogenesis initiated in the embryo?. Trends in Genetics, 12(6): 218-223 DOI:10.1016/0168-9525(96)10025-1 |
Dictus W J A G, Damen P, 1997. Cell-lineage and clonal-contribution map of the trochophore larva of Patella vulgata (Mollusca). Mechanisms of Development, 62(2): 213-226 DOI:10.1016/S0925-4773(97)00666-7 |
Focareta L, Cole A G, 2016. Analyses of Sox-B and Sox-E family genes in the cephalopod Sepia officinalis:revealing the conserved and the unusual. PLoS One, 11(6): e0157821 DOI:10.1371/journal.pone.0157821 |
Haszprunar G, Wanninger A, 2012. Molluscs. Current Biology, 22(13): R510-R514 DOI:10.1016/j.cub.2012.05.039 |
Hinman V, Degnan B, 2002. Mox homeobox expression in muscle lineage of the gastropod Haliotis asinina:evidence for a conserved role in bilaterian myogenesis. Development Genes and Evolution, 212(3): 141-144 DOI:10.1007/s00427-002-0223-6 |
Kay M C, Emlet R B, 2002. Laboratory spawning, larval development, and metamorphosis of the limpets Lottia digitalis and Lottia asmi (Patellogastropoda, Lottiidae). Invertebrate Biology, 121(1): 11-24 |
Kozin V V, Filimonova D A, Kupriashova E E et al, 2016. Mesoderm patterning and morphogenesis in the polychaete Alitta virens (Spiralia, Annelida):Expression of mesodermal markers Twist, Mox, Evx and functional role for MAP kinase signaling. Mechanisms of Development, 140: 1-11 DOI:10.1016/j.mod.2016.03.003 |
Le Gouar M, Guillou A, Vervoort M, 2004. Expression of a SoxB and a Wnt2/13 gene during the development of the mollusc Patella vulgata. Development Genes and Evolution, 214(5): 250-256 DOI:10.1007/s00427-004-0399-z |
Lee P N, Callaerts P, De Couet H G et al, 2003. Cephalopod Hox genes and the origin of morphological novelties. Nature, 424(6952): 1061-1065 DOI:10.1038/nature01872 |
Lyons D C, Henry J Q, 2014. Ins and outs of spiralian gastrulation. The International Journal of Developmental Biology, 58(6-8): 413-428 |
Mouëza M, Gros O, Frenkiel L, 2006. Embryonic development and shell differentiation in Chione cancellata (Bivalvia, Veneridae):an ultrastructural analysis. Invertebrate Biology, 125(1): 21-33 DOI:10.1111/ivb.2006.125.issue-1 |
Nederbragt A J, Lespinet O, Van Wageningen S et al, 2002b. A lophotrochozoan twist gene is expressed in the ectomesoderm of the gastropod mollusk Patella vulgata. Evolution and Development, 4(5): 334-343 DOI:10.1046/j.1525-142X.2002.02020.x |
Nederbragt A J, Van Loon A E, Dictus W J A G, 2002a. Expression of Patella vulgata Orthologs of engrailed and dpp-BMP2/4 in adjacent domains during molluscan shell development suggests a conserved compartment boundary mechanism. Developmental Biology, 246(2): 341-355 DOI:10.1006/dbio.2002.0653 |
Osborne C C, Perry K J, Shankland M et al, 2018. Ectomesoderm and epithelial-mesenchymal transition-related genes in spiralian development. Developmental Dynamics, 247(10): 1097-1120 DOI:10.1002/dvdy.v247.10 |
Smith S A, Wilson N G, Goetz F E et al, 2011. Resolving the evolutionary relationships of molluscs with phylogenomic tools. Nature, 480(7377): 364-367 DOI:10.1038/nature10526 |
Thisse C, Thisse B, Schilling T F et al, 1993. Structure of the zebrafish snail1 gene and its expression in wild-type, spadetail and no tail mutant embryos. Development, 119(4): 1203-1215 |
Wanninger A, Haszprunar G, 2001. The expression of an engrailed protein during embryonic shell formation of the tusk-shell, Antalis entalis (Mollusca, Scaphopoda). Evolution & Development, 3(5): 312-321 |
Wanninger A, Ruthensteiner B, Lobenwein S et al, 1999. Development of the musculature in the limpet Patella (Mollusca, Patellogastropoda). Development Genes and Evolution, 209(4): 226-238 DOI:10.1007/s004270050247 |
Wanninger A, Wollesen T, 2019. The evolution of molluscs. Biological Reviews, 94(1): 102-115 DOI:10.1111/brv.2019.94.issue-1 |
 2019, Vol. 50
2019, Vol. 50


