中国海洋湖沼学会主办。
文章信息
- 陈寅儿, 郑学斌, 高心明, 王景倩, 谢庆平, 詹炜, 楼宝, 竺俊全. 2019.
- CHEN Yin-Er, ZHENG Xue-Bin, GAO Xin-Ming, WANG Jing-Qian, XIE Qing-Ping, ZHAN Wei, LOU Bao, ZHU Jun-Quan. 2019.
- 小黄鱼(Larimichthys polyactis)消化道形态与组织学结构特征及其消化酶活性的研究
- MORPHOLOGY, HISTOLOGY AND DIGESTIVE ENZYMES OF THE DIGESTIVE TRACT OF THE SMALL YELLOW CROAKER LARIMICHTHYS POLYACTIS
- 海洋与湖沼, 50(5): 1116-1126
- Oceanologia et Limnologia Sinica, 50(5): 1116-1126.
- http://dx.doi.org/10.11693/hyhz20190200043
文章历史
-
收稿日期:2019-02-25
收修改稿日期:2019-04-02
2. 浙江省海洋水产研究所 舟山 316100;
3. 浙江省农业科学院 杭州 310016
2. Marine Fisheries Research Institute of Zhejiang, Zhoushan 316100, China;
3. Zhejiang Academy of Agricultural Sciences, Hangzhou 310016, China
消化道是食物消化、营养物质吸收的重要场所。鱼类消化道形态及组织学结构、组织化学特性及其消化酶活性等是消化生物学基础研究内容的几个方面, 对这些方面的详细研究, 有助于了解消化道各部分结构与功能的关系、食性与消化道形态结构的相关性以及消化吸收的生理机制(徐革锋等, 2009; Wilson et al, 2010)。目前, 有关海产硬骨鱼类消化道形态学、组织学、组织化学及酶学等方面的研究已涉及较多种类, 如在三尖鱾(Girella tricuspidata) (Anderson, 1986)、金头鲷(Sparus aurata) (Cataldi et al, 1987)、大黄鱼(Larimichthys crocea) (林树根等, 2002)、牙鲆(Paralichthys olivaceus) (施志仪等, 2006)、褐菖鲉(Sebastiscus marmoratus) (石戈等, 2007)、长鳍篮子鱼(Siganus canaliculatus) (赵峰等, 2008)、鲻鱼(Mugil cephalus) (于娜等, 2011)、网纹石斑鱼(Epinephelus chlorostigma) (Hassan, 2013)、双色鳗鲡(Anguilla bicolor)(Nasruddin et al, 2014)等鱼类中均见这些方面研究报道。
小黄鱼(Larimichthys polyactis)属鲈形目、石首鱼科、黄鱼属, 曾与大黄鱼(Larimichthys crocea)、乌贼(Sepia officinalis)及带鱼(Trichiurus haumela)等并称为“四大海产”(李建生等, 2009), 该种鱼主要分布于渤海、黄海、东海及朝鲜半岛西岸海区(仲霞铭等, 2011), 主食浮游甲壳类, 兼食底栖生物和小型鱼类(王凯等, 2012)。由于小黄鱼自然资源因捕捞过度而衰退。因此, 其人工繁殖及增养殖开发引起重视。目前, 浙江省海洋水产研究所等单位已取得小黄鱼人工育苗及养殖试验的成功。有关小黄鱼生物学研究, 已见生长特性(Ma et al, 2017; Xiong et al, 2017)、遗传多样性(郑文娟等, 2012; Liu et al, 2017)、性腺发育特征(Han et al, 2010)、精子生理特性(Le et al, 2011a, b)等方面的报道, 但其消化系统的组织学、组织化学及消化酶活性等方面尚未见研究报道。本研究采用解剖、石蜡切片、AB-PAS反应及酶活检测技术, 观察分析了养殖小黄鱼(幼鱼)消化道的形态及组织学结构、黏液细胞定位及消化酶活性分布, 旨在了解小黄鱼消化道结构特点及其功能, 积累小黄鱼消化生物学基础资料。
1 材料与方法 1.1 材料实验用小黄鱼(Larimichthys polyactis)取自浙江省海洋水产研究所西轩岛试验场, 6月龄鱼共30尾, 平均体长11.68±1.12cm, 体重27.75±8.06g, 暂养于水槽中, 停食24h后供实验用。
1.2 方法 1.2.1 解剖观察活体解剖10尾小黄鱼, 观察消化系统的形态结构特征, 并拍照。测量肠道长度, 肝胰脏重, 计算比肠长(肠长/体长)及比肝胰脏重(肝胰脏重/体重)。
1.2.2 组织切片及组织化学观察活体解剖6尾小黄鱼, 取舌、食道、胃、前肠、中肠及后肠等组织, 用波恩氏液(Bouin’s)固定24h, 酒精梯度脱水、二甲苯透明、石蜡包埋, YD-202型切片机切片, 厚度6—8μm, 苏木精-伊红染色法(Haematoxylin-eosin, H.E)染色, 中性树胶封片, DS-Ri2型尼康显微镜观察与摄像, 用图像分析软件Photoshop测量消化道各段黏膜褶皱高、黏膜下层厚、环肌层厚、纵肌层厚及浆膜层厚等数值。
活体解剖6尾小黄鱼, 取舌、食道、胃、前肠、中肠及后肠组织, 作常规石蜡切片(厚度6—8μm), 爱先蓝-糖原(AB-PAS)染色法染色, 显微观察消化道黏液细胞类型。Ⅰ型黏液细胞呈红色, 爱先蓝(AB) (pH 2.5)反应阴性, 过碘酸-雪夫(PAS)反应阳性, 含中性黏多糖; Ⅱ型呈蓝色, 爱先蓝(AB)反应阳性, 过碘酸-雪夫(PAS)反应阴性, 含酸性黏多糖; Ⅲ型呈紫红色, 爱先蓝(AB)、过碘酸-雪夫(PAS)反应均为阳性, 以中性黏多糖为主, 含少量酸性黏多糖; Ⅳ型呈蓝紫色, 爱先蓝(AB)、过碘酸-雪夫(PAS)反应均为阳性, 以酸性黏多糖为主, 含少量中性黏多糖(安利国等, 2001; 刘亚秋等, 2017)。各组织分别取3张切片进行显微观察, 每张切片选取6个视野观察黏液细胞数量, 各种黏液细胞密度计算以每一视野中500μm×500μm范围内细胞个数为准。
1.2.3 消化酶活性测定活体解剖6尾小黄鱼, 取肝胰脏、胃、前肠、中肠及后肠等组织, 液氮中快速冷冻后置于–80℃冰箱保存。消化酶活性测定时, 从冰箱中取出6尾鱼的组织, 置于冰上, 两两随机混合成3组后, 按质量比1/4加入组织匀浆液匀浆, 然后于4℃离心机2500r/min离心15min, 取上清液, 用酶活检测试剂盒(购自南京建成科技有限公司)检测消化酶及可溶性蛋白, 用全波长酶标仪(Thermo, Multiskan GO 1510)和紫外分光光度计(SHIMADZU SPECTROPH OTOMETER UV- 1800)测定吸光度, 实验重复3次。
37℃条件下, pH 8.0, 1mg蛋白中的胰蛋白酶每1min吸光度值变化0.003为一个胰蛋白酶活力单位。37℃条件下, 组织中每1mg蛋白每1min分解蛋白生成1μg氨基酸为1个胃蛋白酶活力单位; 37℃条件下, 每1mg组织蛋白在反应体系中与底物反应1min, 每消耗1μmol底物为1个脂肪酶活力单位; 37℃条件下, 组织中每1mg蛋白与底物作用30min, 水解10mg淀粉为1个淀粉酶活力单位; 37℃条件下, 每1mg组织蛋白与基质作用15min产生1mg酚为1个碱性磷酸酶活力单位。
1.2.4 数据处理实验数据均以平均值±标准差(Mean±SD)表示。采用单因素方差分析进行显著性分析(SPSS19.0), 显著性水平为0.05。
2 结果 2.1 消化道外形特征小黄鱼消化系统主要由消化管及肝胰脏组成。肝胰脏位于体腔前端, 分左右两叶, 右叶明显大于左叶。消化道由口咽腔(舌)、食道、胃及肠组成。口端位、口裂较大, 口咽腔底部具舌, 舌前端游离; 食道粗短, 壁较厚; 胃呈卜型, 与前肠相连处的幽门部有11—13条指状盲囊, 绕肠呈环形排列; 肠呈“S”型弯曲, 以第一转折、第二转折处为界划分为前、中、后肠, 前肠肠径稍大于中肠及后肠, 前肠长度与中肠相近, 后肠较前、中肠稍长, 肠末端以肛门开口于体外(图 1)。测得10尾鱼体长在10.8—13.5cm之间, 肠指数为0.63±0.10, 肝体比为(2.11±0.54)%。
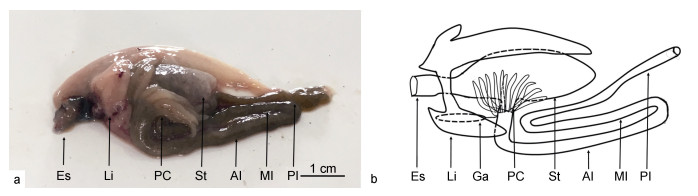 |
| 图 1 小黄鱼消化系统组成及消化道外形 Fig. 1 The composition of digestive system and morphology of digestive tract of L. polyactis 注: a.小黄鱼消化系统解剖图; b.小黄鱼消化系统外形示意图; AI.前肠anterior intestine; Es.食道esophagus; Ga.胆囊gallbladder; St.胃stomach; Li.肝胰脏liver; MI.中肠middle intestine; PC.幽门盲囊pyloric caecum; PI.后肠posterior intestine |
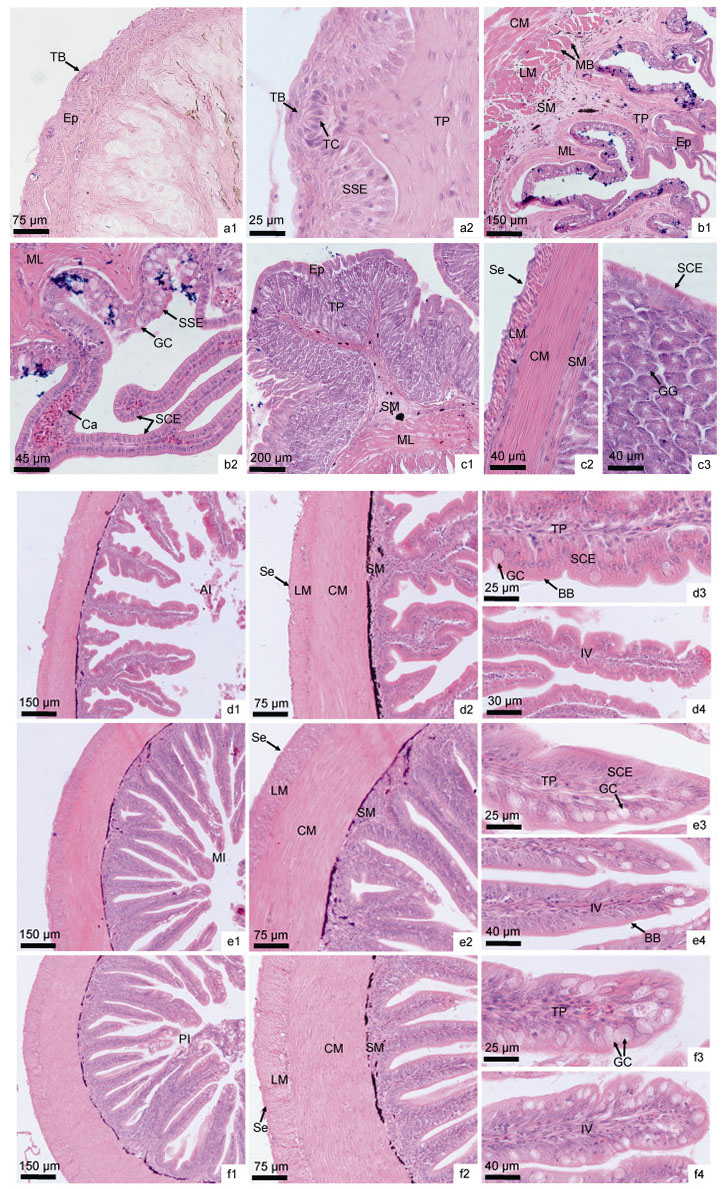
舌 小黄鱼舌由基舌骨突出部分外覆黏膜层构成, 黏膜层由复层扁平上皮和固有膜结缔组织构成, 上皮层中有味蕾分布, 味蕾中央可见梭形的味细胞, 味蕾底部由固有膜隆起所支持(图 2-a1, a2)。固有膜下的黏膜下层为疏松结缔组织(图 2-a1)。
 |
|
图 2 小黄鱼消化道组织学结构 Fig. 2 Histological structure of digestive tract of L. polyactis 注: a1:舌; a2:示舌上皮中味蕾及固有膜; b1:示食道各层结构; b2:示食道复层扁平上皮及单层柱状上皮; c1:胃横切; c2:示胃部上皮、胃腺、黏膜下层、肌层及浆膜层; d1:前肠横切; d2:示前肠四层结构; d3示前肠杯状细胞、单层柱状上皮、固有膜及纹状缘; d4:示前肠肠绒毛; e1:中肠横切; e2:示中肠四层结构; e3:示中肠杯状细胞、单层柱状上皮及固有膜; e4:示中肠纹状缘及肠绒毛; f1:后肠横切; f2:示后肠四层结构; f3示后肠杯状细胞及固有膜; f4:示后肠肠绒毛 AI:前肠anterior intestine; BB:纹状缘brush border; Ca:毛细血管capillary; CM:环肌circular muscle; Ep:上皮epithelium; GC:杯状细胞goblet cell; GG:胃腺gastric gland; Ⅳ:肠绒毛intestinal villus; LM:纵肌longitudinal muscle; MI:中肠middle intestine; ML:肌层muscular layer; PI:后肠posterior intestine; SCE:单层柱状上皮single columnar epithelium; Se:浆膜serosa; SM:黏膜下层sub mucosa; SSE:复层扁平上皮stratified squamous epithelium; TB:味蕾taste bud; TC:味细胞taste cell; TP:固有膜tunica propria |
食道 食道壁从内向外由黏膜层、黏膜下层、肌层和浆膜构成。黏膜层及黏膜下层共同向肠腔突起形成皱襞; 黏膜层上皮为复层扁平上皮, 即由多层细胞组成, 表面被覆一层扁平上皮细胞, 其下分布有较多杯状细胞及其他类型黏液细胞, 上皮层下为固有膜结缔组织(图 2-b1, b2); 部分皱襞的顶面及侧面向肠腔形成次级突起, 有的突起细长而分支, 突起的表面为单层柱状上皮, 中央为结缔组织, 毛细血管发达(图 2-b2); 黏膜下层为较厚的结缔组织, 其间分布有毛细血管。肌层较发达, 为横纹肌, 内纵外环, 环肌较纵肌厚。外层为薄层浆膜(图 2-b1, b2, 表 1)。
| 形态指数(μm) | 食道 | 胃 | 前肠 | 中肠 | 后肠 |
| 黏膜褶皱高 | 639.79±72.26a | 291.81±14.82d | 382.69±12.53c | 456.76±37.55b | 502.29±25.31b |
| 黏膜下层厚 | 393.27±17.78a | 82.81±3.64b | 14.87±1.29c | 14.75±0.29c | 8.37±1.13c |
| 环肌层厚 | 278.41±9.59a | 137.87±3.44c | 114.28±4.05d | 151.82±3.16c | 175.49±17.36b |
| 纵肌层厚 | 50.62±8.99b | 71.79±3.51a | 34.46±3.86c | 56.42±7.75b | 72.47±6.76a |
| 浆膜层厚 | 43.40±4.68b | 47.47±0.40a | 3.67±0.37c | 4.60±0.19c | 2.44±0.15c |
| 注:表中同行间不同上标字母表示差异显著(P < 0.05) | |||||
胃 胃壁从内向外由黏膜层、黏膜下层、肌层及浆膜组成(图 2-c1), 其内表面观有许多皱襞。黏膜层由上皮及固有膜构成(图 2-c1), 上皮由单层柱状上皮细胞紧密排列而成(图 2-c3); 固有膜较厚, 其内分布有大量单管状胃腺, 胃腺之间被结缔组织围隔开, 胃腺切面观大小相近, 由腺细胞围成, 中央为腺腔, 开口于胃小凹(图 2-c1, c3)。黏膜下层为结缔组织, 内有血管分布。肌层较发达, 为平滑肌, 内环外纵, 环肌较纵肌厚。浆膜层薄(图 2-c2, 表 1)。
肠道 肠道壁由黏膜层、黏膜下层、肌层和浆膜组成。
(1) 前肠 黏膜层向肠腔内突起形成指状绒毛, 为肠绒毛(图 2-d1), 由单层柱状上皮及固有膜组成, 上皮游离面具发达的纹状缘, 上皮层内散布有杯状细胞等黏液细胞(图 2-d3, d4), 固有膜主要由结缔组织构成, 与黏膜下层分界不明显(图 2-d2, d3); 肌层由内环肌及外纵肌组成, 均为平滑肌, 且环肌较纵肌发达; 浆膜层薄(图 2-d2, 表 1)。
(2) 中肠 与前肠相比, 肠绒毛变窄、变长, 排列较紧密(图 2-e1), 上皮层中杯状细胞等黏液细胞数量增多, 且主要分布于肠绒毛前端或近前端, 纹状缘发达(图 2-e3, e4); 肌层比前肠厚, 内环外纵, 环肌层厚于纵肌层; 黏膜下层及浆膜层结构同前肠(图 2-e2, 表 1)。
(3) 后肠 肠绒毛形态及分布特征与中肠相似(图 2-f1), 但其上皮层杯状细胞等黏液细胞数量较前、中肠多, 纹状缘不及前、中肠发达(图 2-f3, f4); 肌层厚度大于前、中肠, 内环外纵排列, 环肌比纵肌发达; 黏膜下层及浆膜层结构与前、中肠相似(图 2-f2, 表 1)。
2.2.2 消化道黏液细胞类型及分布观察表明, 舌上皮中有Ⅰ型、Ⅱ型、Ⅲ型及Ⅳ型4种类型的黏液细胞, 而且分布密度较低(图 3-a)(表 2)。食道中黏液细胞主要分布于皱襞表面的复层上皮中, 有Ⅰ型、Ⅱ型及Ⅲ型3种类型, 且体积较大, 其中Ⅱ型黏液细胞分布密度最高, 其次是Ⅰ型黏液细胞(图 3-b)。胃部分布有较多Ⅰ型和Ⅱ型黏液细胞, Ⅰ型黏液细胞主要分布于胃黏膜上皮的表层, Ⅱ型黏液细胞主要分布于黏膜下层的结缔组织中(图 3-c)。肠道中黏液细胞分布于黏膜上皮中, 均以Ⅱ型为主, 前肠及中肠均有4种类型黏液细胞, 后肠只有Ⅱ型和Ⅲ型黏液细胞, 前、中、后肠Ⅱ型黏液细胞及总黏液细胞密度均呈递增趋势(图 3-d, e, f)(表 2)。
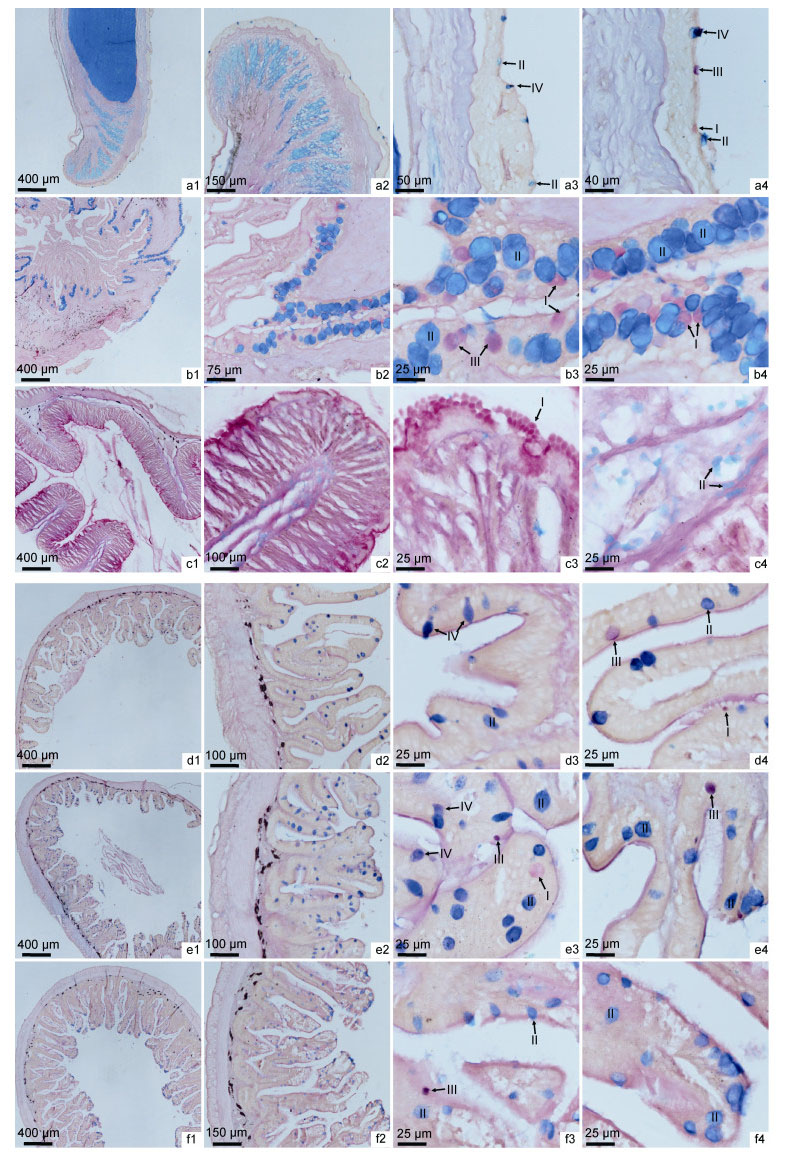 |
| 图 3 小黄鱼消化道黏液细胞分布 Fig. 3 Distribution of mucous cells in digestive tract of L. polyactis 注: a1, a2:示舌组织中黏液细胞整体分布情况; a3:示舌上皮中Ⅱ型及Ⅳ型黏液细胞; a4:示舌上皮中4种类型黏液细胞; b1, b2:示食道中黏液细胞整体分布情况; b3:示食道黏膜层基底部Ⅰ型、Ⅱ型及Ⅲ型黏液细胞; b4:示食道黏膜层基底部Ⅰ型和Ⅱ型黏液细胞; c1, c2:示胃组织中黏液细胞整体分布情况; c3:示胃黏膜层上表面Ⅰ型黏液细胞; c4:示胃黏膜下层结缔组织中Ⅱ型黏液细胞; d1, d2:示前肠黏液细胞整体分布情况; d3:示前肠上皮层中Ⅱ型和Ⅳ型黏液细胞; d4:示前肠上皮层中Ⅰ型、Ⅱ型及Ⅲ型黏液细胞; e1, e2:示中肠黏液细胞整体分布情况; e3:示中肠上皮层中4种类型黏液细胞; e4:示中肠上皮层中Ⅱ型和Ⅲ型黏液细胞; f1, f2:示后肠黏液细胞整体分布情况; f3:示后肠上皮层中Ⅱ型和Ⅲ型黏液细胞; f4:示后肠上皮层中Ⅱ型黏液细胞。Ⅰ: Ⅰ型黏液细胞typeⅠ; Ⅱ: Ⅱ型黏液细胞typeⅡ; Ⅲ: Ⅲ型黏液细胞typeⅢ; Ⅳ: Ⅳ型黏液细胞typeⅣ |
| 类型 | 舌 | 食道 | 胃 | 前肠 | 中肠 | 后肠 |
| Ⅰ型 | 0.33±0.58bc | 17.00±3.61bb | 238.67±18.90aa | 2.03±1.01cc | 0.67±1.15cc | 0bc |
| Ⅱ型 | 2.35±1.15af | 122.01±8.06ab | 229.34±12.22aa | 46.66±7.37ae | 70.38±2.52ad | 100.29±1.53ac |
| Ⅲ型 | 0.33±0.54bc | 8.00±2.00ca | 0bc | 2.27±1.53cb | 0.34±0.57cc | 0.68±0.60bc |
| Ⅳ型 | 2.07±1.10ac | 0bc | 0bc | 14.00±2.65ba | 6.67±1.53bb | 0bc |
| 总数 | 5.21±1.05e | 147.07±11.30b | 468.56±22.27a | 65.57±9.85d | 78.09±5.67d | 101.17±1.73c |
| 注:表中上标字母表示不同组织同型黏液细胞密度差异, 下标字母表示同组织不同类型黏液细胞密度差异, 显著性水平(P < 0.05) | ||||||
消化酶活性检测结果表明, 肝胰脏及胃肠道中胰蛋白酶活性总体高于胃蛋白酶、脂肪酶、淀粉酶及碱性磷酸酶的活性(图 4—图 8)。
 |
| 图 4 小黄鱼肝胰脏及胃肠中胰蛋白酶活性 Fig. 4 The trypisn activities in liver pancreas and gastrointestine of L. polyactis 注:不同上标字母表示差异显著, 显著性水平为P < 0.05。下同 |
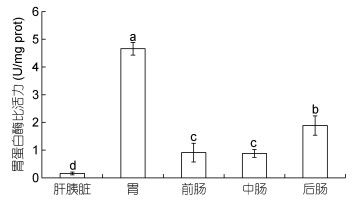 |
| 图 5 小黄鱼肝胰脏及胃肠中胃蛋白酶活性 Fig. 5 The pepsin activities in liver pancreas and gastrointestine of L. polyactis |
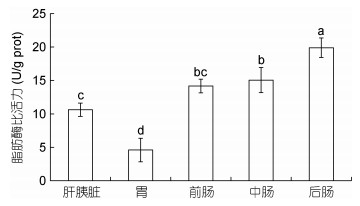 |
| 图 6 小黄鱼肝胰脏及胃肠中脂肪酶活性 Fig. 6 The lipase activities in liver pancreas and gastrointestine of L. polyactis |
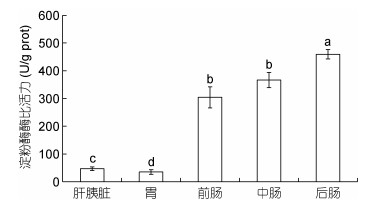 |
| 图 7 小黄鱼肝胰脏及胃肠中淀粉酶活性 Fig. 7 The amylase activities in liver pancreas and gastrointestine of L. polyactis |
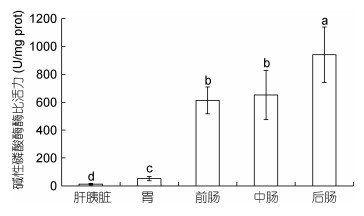 |
| 图 8 小黄鱼肝胰脏及胃肠中碱性磷酸酶活性 Fig. 8 The phosphatase activities in liver pancreas and gastrointestine of L. polyactis |
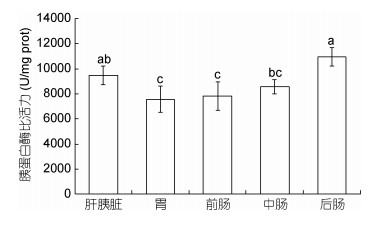
后肠的酶活性最高, 比活力为10955.32±735.08U/mg prot, 与胃及前、中肠酶活性差异显著(P < 0.05);肝胰脏及中肠酶活性次之, 比活力分别为9482.98±726.12U/mg prot及8576.97±572.37U/ mg prot; 胃及前肠酶活性稍低于中肠, 比活力分别为7563.73±1068.56U/mg prot及7843.95±1133.54U/mg prot, 两者差异不显著(P > 0.05) (图 4)。
2.3.2 胃蛋白酶胃中酶活性显著高于肠及肝胰脏(P < 0.05), 其比活力为4.66±0.23U/mg prot; 后肠酶活性次之, 且显著低于胃(P < 0.05), 其比活力为1.89±0.35U/mg prot; 前肠及中肠酶活性比后肠低(P < 0.05), 比活力分别为0.91±0.34U/mg prot及0.88± 0.14U/mg prot; 肝胰脏中酶活性最低, 比活力为0.16±0.05U/mg prot(图 5)。
2.3.3 脂肪酶后肠酶活性显著高于前肠、中肠、肝胰脏及胃(P < 0.05), 其比活力为19.89±1.45U/g prot; 前肠及中肠酶活性次之, 其比活力分别为14.16± 1.03U/g prot及15.04±1.88U/g prot, 两者差异不显著(P > 0.05);肝胰脏酶活性稍低于前肠, 其比活力为10.62±0.99U/g prot; 胃中酶活性最低, 其比活力为4.60±1.75U/g prot(图 6)。
2.3.4 淀粉酶后肠酶活性显著高于前肠、中肠、肝胰脏及胃(P < 0.05), 其比活力为459.52±16.77U/g prot。前肠及中肠酶活性次之, 其比活力分别为304.05±37.85U/g prot及366.75±27.76U/g prot, 两者差异不显著(P > 0.05);肝胰脏及胃中酶活性显著低于肠(P < 0.05), 其比活力分别为46.81±6.50U/g prot及35.29±8.11U/g prot, 两者差异显著(P < 0.05)(图 7)。
2.3.5 碱性磷酸酶后肠中酶活性显著高于前肠、中肠、肝胰脏及胃(P < 0.05), 其比活力为941.18± 199.00U/mg prot; 前肠及中肠酶活性次之, 其比活力分别为613.00±96.36U/mg prot及651.72±176.41U/mg prot, 两者差异不显著(P > 0.05);胃及肝胰脏中酶活性显著低于肠(P < 0.05), 其比活力分别为51.91± 15.10U/mg prot及12.41±5.29U/mg prot, 两者差异显著(P < 0.05)(图 8)。
3 讨论鱼类消化道外形特征与食性密切相关, 表 3列举了部分海水鱼类的消化道外 形特征及其食性。一般来说, 肉食性鱼类口裂较大, 如龙头鱼(Harpodon nehereus)(陈惠群等, 2004)、网纹石斑鱼(Epinephelus chlorostigma)(Hassan, 2013)、褐菖鲉(S. marmoratus) (石戈等, 2007)及本研究的小黄鱼等; 而植食性或杂食性鱼类口裂较小, 如长鳍篮子鱼(S. canaliculatus) (赵峰等, 2008)、黄斑篮子鱼(S. oramin)(区又君等, 2013)等。硬骨鱼类中有胃鱼类的胃有I型、V型、U型、Y型、卜型等多种形态(苏锦祥, 1993; Wilson et al, 2010), Y型及卜型胃在肉食性鱼类中较常见(表 3), 体积较大, 可容纳较多食物(王迎春等, 1997; 陈惠群等, 2004; Andrade et al, 2017)。本研究的小黄鱼胃呈卜型, 一次能摄取较多食物。幽门盲囊的结构及功能与肠道较为相似(Andrade et al, 2017), 小黄鱼幽门盲囊较发达, 可能具有扩大消化吸收面积的作用。通常, 肉食性鱼类肠道较短, 而杂食性及草食性鱼类肠道相对较长(Wilson et al, 2010; Canan et al, 2012; Andrade et al, 2017), 因此肠指数能在一定程度上反应鱼类的食性。本研究的小黄鱼口裂较大、胃卜型, 肠指数较小(0.63), 这些特点与其肉食性相适应。
| 种名 | 口裂 | 胃 | 盲囊 | 肠指数 | 食性 | 参考文献 |
| 鲻鱼M. cephalus | — | — | 2条 | 约3.0 | 杂食(偏值食) | 于娜等, 2011 |
| 长鳍篮子鱼S. canaliculatus | 小 | Y型 | 3—4条 | 2.64 | 杂食(偏值食) | 赵峰等, 2008 |
| 黄斑篮子鱼S. oramin | 小 | V型 | 5—6条 | 2.73 | 杂食(偏植食) | 区又君等, 2013 |
| 棕眶锯雀鲷Stegastes fuscus | — | Y型 | 3条 | 2.18 | 杂食(偏植食) | Canan et al, 2012 |
| 条石鲷Oplegnathus fasciatus | — | V型 | 4条 | 0.78 | 杂食(偏肉食) | 王健鑫等, 2006 |
| Menticirrhus saxatilis | — | Y型 | 7条 | 0.7 | 肉食 | Kobelkowsky et al, 2007 |
| 真鲷Pagrosomus major | — | V型 | 4条 | 0.6 | 肉食 | 喻子牛等, 1997 |
| 金头鲷S. aurata | — | Y型 | 4条 | 0.5—0.6 | 肉食 | Cataldi et al, 1987 |
| 网纹石斑鱼E. chlorostigma | 大 | U型 | 30—36条 | — | 肉食 | Hassan, 2013 |
| 褐菖鮋S. marmoratus | 较大 | Y型 | 8—9条 | 0.54 | 肉食 | 石戈等, 2007 |
| 龙头鱼H. nehereus | 大 | 卜型 | 18—23条 | 0.59 | 肉食 | 陈惠群等, 2004 |
| 平鲷Rhabdosargus sarba | 大 | 卜型 | 8—10条 | 0.48 | 肉食 | 勾效伟等, 2008 |
| 小黄鱼L. polyactis | 较大 | 卜型 | 11—13条 | 0.63 | 肉食 | 本研究 |
| 注:表中划“—”栏目表示数据缺少 | ||||||
小黄鱼舌表面为复层扁平上皮, 具有较好的耐磨性, 上皮细胞间散布少量各种类型黏液细胞, 其分泌的黏液具一定的润滑及保护等作用, 上皮内含有味蕾, 在食物甄别与选择方面发挥一定作用。小黄鱼食道皱襞较发达, 被覆复层扁平上皮, 内含大量Ⅱ型黏液细胞及部分Ⅰ型和Ⅲ型黏液细胞, Ⅱ型黏液细胞分泌的酸性黏多糖可在食道的内表面形成一道有效的屏障, 防止细菌等微生物入侵及坚硬食物对食道黏膜的机械损伤(杨佳文等, 1999; Schroers et al, 2009; Takiue et al, 2013), 而Ⅰ型和Ⅲ型黏液细胞分泌的中性黏多糖有助于食物颗粒转化为食糜(Sarasquete et al, 2001; Cohen et al, 2014), 促进食道对食物的初步分解和吸收; 小黄鱼食道的部分皱襞具次级突起, 被覆单层柱状上皮, 上皮下的固有膜内毛细血管丰富, 由此推测小黄鱼食道可能具有吸收营养物质的作用。据研究, 大黄鱼(L. crocea)(林树根等, 2002)、真鲷(Chrysophrys major)(喻子牛等, 1997)、金头鲷(S. aurata)(Cataldi et al, 1987)食道内均含有单层柱状上皮区域, 柱状细胞内嗜伊红颗粒丰富, 这些细胞被认为与食道的初步消化吸收作用相关。
小黄鱼胃黏膜上皮分布有较多Ⅰ型黏液细胞, 据研究, 褐牙鲆(Paralichthys olivaceus)(张伟妮等, 2009)及褐菖鲉(S. marmoratus)(石戈等, 2007)的胃黏膜上皮有大量Ⅰ型黏液细胞分布。Ⅰ型黏液细胞分泌的中性黏多糖在胃黏膜表面形成保护层, 能有效缓解盐酸、酸性蛋白酶类等物质对胃黏膜的侵蚀(Scocco et al, 1996; Wilson et al, 2010)。小黄鱼胃内还分布有较多的Ⅱ型黏液细胞, 分泌的酸性黏多糖在维持胃内酸性环境和稳定酸性蛋白酶类活性方面起重要作用(Reifel et al, 1979; Sarasquete et al, 2001)。据研究, 平鲷(R. sarba)(勾效伟等, 2008)、褐菖鲉(S. marmoratus)(石戈等, 2007)胃内Ⅱ型黏液细胞分布于胃黏膜上皮内, 黄斑篮子鱼(S. oramin)(区又君等, 2013)及黄鳍鲷(Sparus latus)(王永翠等, 2012)胃内Ⅱ型黏液细胞分布于黏膜层中上部的胃腺区域内, 而本研究的小黄鱼胃内Ⅱ型黏液细胞则分布于黏膜下层的结缔组织内。小黄鱼胃腺较发达, 这与长鳍篮子鱼(S. canaliculatus)(章龙珍等, 2010)、平鲷(R. sarba) (勾效伟等, 2008)、大黄鱼(L. crocea)(林树根等, 2002)等鱼类具发达的胃腺相同, 胃腺分泌的胃蛋白酶原和盐酸, 在蛋白质的消化吸收方面发挥重要作用(喻子牛等, 1997)。小黄鱼胃组织中胃蛋白酶和胰蛋白酶活性较高, 而脂肪酶和淀粉酶活性较低, 这与肉食性鱼类消化酶活性特点相符(徐革锋等, 2009)。
小黄鱼肠道分布有Ⅱ型黏液细胞, 并且由前往后呈增多趋势, 分泌的酸性黏多糖在润滑食物残渣及抑制或杀死由肛门入侵至后肠的细菌或病原微生物等方面发挥良好作用(张伟妮等, 2009; 路珍等, 2016)。肠道内还分布有Ⅰ型和Ⅲ型黏液细胞, 分泌的中性黏多糖不仅有调节肠道pH的作用, 还能与碱性磷酸酶相结合, 参与肠道大分子物质的运输与吸收(Clarke et al, 1980; Sarasquete et al, 2001; Takiue et al, 2013)。小黄鱼肠道黏液细胞的总密度由前往后呈递增趋势, 这与欧洲鳗鲡(Anguilla anguilla)(林旋等, 2008)、褐牙鲆(P. olivaceus)(张伟妮等, 2009)、金头鲷(S. aurata)(Cataldi et al, 1987)、四指马鲅(Eleutheronema tetradactylum)(谢木娇等, 2015)等海水鱼类相同。小黄鱼肠上皮表面有纹状缘, 增加了消化吸收表面积(Dai et al, 2007; Wilson et al, 2010); 纹状缘还与肽酶、二糖酶等消化酶的分布有关, 可促进消化吸收进程(Nasruddin et al, 2014)。小黄鱼肠道黏膜褶皱高度及肌层厚度由前往后均呈增高趋势, 并存在显著差异(表 1), 中、后肠黏膜褶皱增高有利于增大肠道与食糜或食物残渣的接触面积, 促进营养物质的吸收, 而肌层的增厚可增强肠道的收缩和蠕动能力, 促进食物残渣形成粪便并排出。小黄鱼肠道中淀粉酶、脂肪酶及碱性磷酸酶活性较高, 表明肠道在脂类、糖类及无机盐等的消化及吸收方面发挥重要作用(Tengjaroenkul et al, 2000; 刘亚秋等, 2017)。小黄鱼肠道中胰蛋白酶活性也较高, 表明肠道在蛋白质的消化吸收方面也起较重要作用。有较多研究指出, 鱼类肠道消化吸收作用主要在前、中肠, 后肠的消化吸收作用较弱(Kozarić et al, 2004; 徐革锋等, 2009; Pérez-Jiménez et al, 2009; 刘亚秋等, 2017)。而小黄鱼肠道的蛋白酶、脂肪酶及淀粉酶等的活性均以后肠最高。据研究, 大黄鱼(L. crocea) (朱爱意等, 2006)及Dentex dentex (Pérez-Jiménez et al, 2009)肠道消化酶活性也是后肠最高, 这可能是消化道中的食糜由前往后流动的过程中带动了黏液中的消化酶类也向后移动并累积于后肠之故(Pérez-Jiménez et al, 2009)。另有学者对高首鲟(Acipenser transmontanus)消化道的研究认为, 其后肠的消化吸收能力高于肠道其它部位(Buddington et al, 1986a, b; Domeneghini et al, 1999)。小黄鱼后肠的消化吸收能力是否高于前、中肠, 有待于进一步研究证实。
4 结论小黄鱼口裂较大, 胃卜型, 肠指数小于1, 体现肉食性鱼类消化道形态结构特点。口咽腔(舌)及食道上皮具有较好的保护作用。胃中分布的中性和酸性黏液细胞分别起保护胃黏膜和维持胃内酸性环境的作用, 发达的胃腺与较高的胃蛋白酶活性保证了胃部在蛋白质消化吸收方面发挥重要作用。肠道内分布有较高活性的胰蛋白酶、淀粉酶、脂肪酶及碱性磷酸酶, 在蛋白质、脂类、糖类、无机盐等物质的消化吸收方面起重要作用。小黄鱼消化道各段组织结构及酶活性特点与其肉食性相适应。
于娜, 李加儿, 区又君. 2011. 野生鲻鱼和养殖鲻鱼消化系统的组织学观察. 海洋渔业, 33(2): 151-158 DOI:10.3969/j.issn.1004-2490.2011.02.005 |
王凯, 章守宇, 汪振华, 等. 2012. 马鞍列岛海域小黄鱼的食性. 水生生物学报, 36(6): 1188-1192 |
王永翠, 李加儿, 区又君, 等. 2012. 野生与养殖黄鳍鲷消化道中粘液细胞的类型及分布. 南方水产科学, 8(5): 46-51 DOI:10.3969/j.issn.2095-0780.2012.05.007 |
王迎春, 周勤, 段晓英. 1997. 八种海产硬骨鱼类消化系统的比较解剖研究. 海洋湖沼通报, (3): 46-51 |
王健鑫, 石戈, 李鹏, 等. 2006. 条石鲷消化道的形态学和组织学. 水产学报, 30(5): 618-626 |
区又君, 李加儿, 勾效伟, 等. 2013. 黄斑篮子鱼消化道组织学和组织化学研究. 南方水产科学, 9(5): 51-57 DOI:10.3969/j.issn.2095-0780.2013.05.009 |
勾效伟, 区又君, 廖锐. 2008. 平鲷消化系统形态学、组织学及组织化学研究. 南方水产, 4(5): 28-36 DOI:10.3969/j.issn.2095-0780.2008.05.005 |
石戈, 王健鑫, 刘雪珠, 等. 2007. 褐菖鲉消化道的组织学和组织化学. 水产学报, 31(3): 293-302 |
朱爱意, 褚学林. 2006. 大黄鱼(Pseudosciaena crocea)消化道不同部位两种消化酶的活力分布及其受温度、pH的影响. 海洋与湖沼, 37(6): 561-567 DOI:10.3321/j.issn:0029-814X.2006.06.014 |
仲霞铭, 张虎, 汤建华, 等. 2011. 江苏近岸海域小黄鱼时空分布特征. 水产学报, 35(2): 238-246 |
刘亚秋, 李新辉, 王志坚. 2017. 大鳞副泥鳅肠道黏液细胞及消化酶活性分布特征研究. 水生生物学报, 41(5): 1048-1053 |
安利国, 孟广勋, 杨桂文, 等. 2001. 鲤稚幼体早期发育过程中粘液细胞的发生和变化. 水生生物学报, 25(2): 191-194 DOI:10.3321/j.issn:1000-3207.2001.02.014 |
苏锦祥. 1993. 鱼类学与海水鱼类养殖. 2版. 北京: 中国农业出版社, 61-62
|
李建生, 林龙山, 程家骅. 2009. 东海北部秋季小黄鱼分布特征及其与底层温度和盐度的关系. 中国水产科学, 16(3): 348-356 DOI:10.3321/j.issn:1005-8737.2009.03.006 |
杨佳文, 安利国. 1999. 鱼类粘液细胞研究进展. 水产学报, 23(4): 403-408 |
张伟妮, 林旋, 林树根, 等. 2009. 褐牙鲆消化道粘液细胞的类型及分布. 福建农林大学学报(自然科学版), 38(3): 280-284 |
陈惠群, 焦海峰, 竺俊全, 等. 2004. 龙头鱼的外形特征与消化系统结构. 宁波大学学报(理工版), 17(4): 389-392 DOI:10.3969/j.issn.1001-5132.2004.04.004 |
林旋, 张伟妮, 林树根, 等. 2008. 欧洲鳗鲡皮肤、鳃及消化道粘液细胞的分布与类型. 福建农业学报, 23(1): 39-43 DOI:10.3969/j.issn.1008-0384.2008.01.009 |
林树根, 陈文烈, 钟秀容, 等. 2002. 大黄鱼消化道器官显微与亚显微结构. 水产学报, 26(5): 396-401 |
郑文娟, 来育洪, 尤昕煜, 等. 2012. 舟山小黄鱼线粒体DNA D-loop区序列变异的遗传多样性分析. 动物学研究, 33(3): 329-336 |
赵峰, 章龙珍, 庄平, 等. 2008. 长鳍篮子鱼的外形特征与消化系统结构. 海洋渔业, 30(3): 202-206 DOI:10.3969/j.issn.1004-2490.2008.03.002 |
施志仪, 陈晓武, 顾一峰. 2006. 牙鲆消化道组织学观察及内分泌细胞分布. 中国水产科学, 13(5): 851-855 DOI:10.3321/j.issn:1005-8737.2006.05.025 |
徐革锋, 陈侠君, 杜佳, 等. 2009. 鱼类消化系统的结构、功能及消化酶的分布与特性. 水产学杂志, 22(4): 49-55 DOI:10.3969/j.issn.1005-3832.2009.04.013 |
章龙珍, 杨金海, 赵峰, 等. 2010. 长鳍篮子鱼消化道显微与超微结构观察. 水产学报, 34(2): 271-277 |
喻子牛, 孔晓瑜. 1997. 真鲷消化道的组织学和形态学研究. 水产学报, 21(2): 113-119 |
谢木娇, 区又君, 李加儿, 等. 2015. 四指马鲅稚鱼、幼鱼和成鱼消化道黏液细胞组织化学研究. 中国细胞生物学学报, 37(9): 1226-1234 |
路珍, 绳秀珍, 唐小千, 等. 2016. 浸泡免疫迟钝爱德华氏菌疫苗诱导牙鲆黏液细胞的动态变化. 水产学报, 40(3): 414-427 |
Anderson T A, 1986. Histological and cytological structure of the gastrointestinal tract of the luderick, Girella tricuspidata (pisces, kyphosidae), in relation to diet. Journal of Morphology, 190(1): 109-119 DOI:10.1002/jmor.1051900110 |
Andrade I M, Guimarães J P, Rotundo M M et al, 2017. Morphology of the digestive tract of the Whitemouth croaker Micropogonias furnieri (Desmarest, 1823) (Perciformes:Sciaenidae). Acta Zoologica, 98(2): 136-143 DOI:10.1111/azo.12156 |
Buddington R K, Doroshov S I, 1986a. Development of digestive secretions in white sturgeon juveniles (Acipenser transmontanus). Comparative Biochemistry and Physiology Part A:Physiology, 83(2): 233-238 DOI:10.1016/0300-9629(86)90567-0 |
Buddington R K, Doroshov S I, 1986b. Structural and functional relations of the white sturgeon alimentary canal (Acipenser transmontanus). Journal of Morphology, 190(2): 201-213 DOI:10.1002/jmor.1051900205 |
Canan B, Do Nascimento W S, Da Silva N B et al, 2012. Morphohistology of the digestive tract of the damsel fish Stegastes fuscus (Osteichthyes:Pomacentridae). The Scientific World Journal, 2012: 787316 |
Cataldi E, Cataudella S, Monaco G et al, 1987. A study of the histology and morphology of the digestive tract of the sea-bream, Sparus aurata. Journal of Fish Biology, 30(2): 135-145 DOI:10.1111/j.1095-8649.1987.tb05740.x |
Clarke A J, Witcomb D M, 1980. A study of the histology and morphology of the digestive tract of the common eel (Anguilla anguilla). Journal of Fish Biology, 16(2): 159-170 DOI:10.1111/j.1095-8649.1980.tb03695.x |
Cohen S, Diaz M V, Díaz A O, 2014. Histological and histochemical study of the digestive system of the Argentine anchovy larvae (Engraulis anchoita) at different developmental stages of their ontogenetic development. Acta Zoologica, 95(4): 409-420 DOI:10.1111/azo.12038 |
Dai X, Shu M, Fang W, 2007. Histological and ultrastructural study of the digestive tract of rice field eel, Monopterus albus. Journal of Applied Ichthyology, 23(2): 177-183 DOI:10.1111/j.1439-0426.2006.00830.x |
Domeneghini C, Arrighi S, Radaelli G et al, 1999. Morphological and histochemical peculiarities of the gut in the white sturgeon, Acipenser transmontanus. European Journal of Histochemistry, 43(2): 135-145 |
Han K L, Le M H, An C M et al, 2010. Reproductive cycle of yellow croaker Larimichthys polyactis in southern waters off Korea. Fisheries Science, 76(6): 971-980 DOI:10.1007/s12562-010-0288-5 |
Hassan A A, 2013. Anatomy and histology of the digestive system of the carnivorous fish, the brown-spotted grouper, Epinephelus chlorostigma (Pisces; Serranidae) from the Red Sea. Life Science Journal, 10(2): 2149-2164 |
Kobelkowsky A, Pantoja-Escobar O, 2007. Morphology of the digestive system of Menticirrhus saxatilis (Teleostei:Sciaenidae). Hidrobiológica, 17(2): 159-168 |
Kozarić Z, Kužir S, Nejedli S et al, 2004. Histochemical distribution of digestive enzymes in hake, Merluccius merluccius L. 1758. Veterinarski Arhiv, 74(4): 299-308 |
Le M H, Lim H K, Min B H et al, 2011a. Effects of varying dilutions, pH, temperature and cations on spermatozoa motility in fish Larimichthys polyactis. Journal of Environmental Biology, 32(3): 271-276 |
Le M H, Lim H K, Min B H et al, 2011b. Semen properties and spermatozoan structure of yellow croaker, Larimichthys polyactis. The Israeli Journal of Aquaculture-Bamidgeh, 63: 560 |
Liu B J, Zhang B D, Gao T X et al, 2017. Signatures of temporal genetic differentiation of the small yellow croaker (Larimichthys polyactis) revealed by microsatellite markers. Fisheries Research, 194: 50-54 DOI:10.1016/j.fishres.2017.05.005 |
Ma Q Y, Jiao Y, Ren Y P, 2017. Linear mixed-effects models to describe length-weight relationships for yellow croaker (Larimichthys polyactis) along the North coast of China. PLoS One, 12(2): e0171811 DOI:10.1371/journal.pone.0171811 |
Nasruddin N S, Azmai M N A, Ismail A et al, 2014. Histological features of the gastrointestinal tract of wild Indonesian shortfin eel, Anguilla bicolor bicolor (McClelland, 1844), captured in Peninsular Malaysia. The Scientific World Journal, 2014: 312670 |
Pérez-Jiménez A, Cardenete G, Morales A E et al, 2009. Digestive enzymatic profile of Dentex dentex and response to different dietary formulations. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 154(1): 157-164 |
Reifel C W, Travill A A, 1979. Structure and carbohydrate histochemistry of the intestine in ten teleostean species. Journal of Morphology, 162(3): 343-359 DOI:10.1002/jmor.1051620305 |
Sarasquete C, Gisbert E, Ribeiro L et al, 2001. Glyconjugates in epidermal, branchial and digestive mucous cells and gastric glands of gilthead sea bream, Sparus aurata, Senegal sole, Solea senegalensis and Siberian sturgeon, Acipenser baeri development. European Journal of Histochemistry, 45(3): 267-278 |
Schroers V, Van Der Marel M, Neuhaus H et al, 2009. Changes of intestinal mucus glycoproteins after peroral application of Aeromonas hydrophila to common carp (Cyprinus carpio). Aquaculture, 288(3-4): 184-189 DOI:10.1016/j.aquaculture.2008.12.013 |
Scocco P, Ceccarelli P, Menghi G, 1996. Glycohistochemistry of the Tilapia spp. stomach. Journal of Fish Biology, 49(4): 584-593 |
Takiue S, Akiyoshi H, 2013. Light and scanning electron microscope examination of the digestive tract in peppered moray eel, Gymnothorax pictus (Elopomorpha). The Anatomical Record, 296(3): 443-451 DOI:10.1002/ar.22652 |
Tengjaroenkul B, Smith B J, Caceci T et al, 2000. Distribution of intestinal enzyme activities along the intestinal tract of cultured Nile tilapia, Oreochromis niloticus L. Aquaculture, 182(3-4): 317-327 DOI:10.1016/S0044-8486(99)00270-7 |
Wilson J M, Castro L F C, 2010. Morphological diversity of the gastrointestinal tract in fishes. Fish Physiology, 30: 1-55 DOI:10.1016/S1546-5098(10)03001-3 |
Xiong Y, Yang J, Jiang T et al, 2017. Early life history of the small yellow croaker (Larimichthys polyactis) in sandy ridges of the South Yellow Sea. Marine Biology Research, 13(9): 993-1002 DOI:10.1080/17451000.2017.1319067 |
 2019, Vol. 50
2019, Vol. 50


