
中国海洋湖沼学会主办。
文章信息
- 王志刚, 刘士力, 李贤露, 吕卓云, 毛丽盈, 唐超然, 郑荣泉. 2019.
- WANG Zhi-Gang, LIU Shi-Li, LI Xian-Lu, LÜ Zhuo-Yun, MAO Li-Ying, TANG Chao-Ran, ZHENG Rong-Quan. 2019.
- 翘嘴红鲌(Erythroculter ilishaeformis)果糖-1, 6-二磷酸醛缩酶(ALDO-C)基因定位、克隆及表达分析
- LOCATION, CLONING AND EXPRESSION ANALYSIS OF ALDO-C GENE IN ERYTHROCULTER ILISHAEFORMIS
- 海洋与湖沼, 50(5): 1138-1145
- Oceanologia et Limnologia Sinica, 50(5): 1138-1145.
- http://dx.doi.org/10.11693/hyhz20190300049
文章历史
-
收稿日期:2019-03-10
收修改稿日期:2019-04-14
2. 浙江省野生动物生物技术与保护利用重点实验室 金华 321004;
3. 浙江师范大学行知学院 金华 321004;
4. 浙江省淡水水产研究所 农业农村部淡水渔业健康养殖重点实验室/浙江省淡水水产遗传育种重点实验室 湖州 313001
2. Key Lab of Wildlife Biotechnology and Conservation and Utilization of Zhejiang Province, Jinhua 321004, China;
3. Xingzhi College, Zhejiang Normal University, Jinhua 321004, China;
4. Agriculture Ministry Key Laboratory of Healthy Freshwater Aquaculture/Key Laboratory of Freshwater Aquatic Animal Genetic and Breeding of Zhejiang Province, Zhejiang Institute of Freshwater Fisheries, Huzhou 313001, China
翘嘴红鲌(Erythroculter ilishaeformis), 隶属于鲤形目(Cypriniformes)、鲤科(Cyprinidae), 体型较大, 是大型淡水经济鱼类鳊鲌亚科(Abramidinae)中最大的一种鱼。其肉质鲜美, 鳞下富含脂肪, 氨基酸含量高而备受青睐(Baruselli et al, 2010)。蛋白质是饲料中最昂贵且对鱼类生长影响较大的组分(Kim et al, 2002; Lee et al, 2002)。翘嘴红鲌最大生长的饲料蛋白质水平为48%—54% (王桂芹, 2005), 一般肉食性鱼类的最适蛋白质需求量为40%—53% (Khan et al, 1993; 钱雪桥等, 2002)。翘嘴红鲌是无胃的鲤科肉食性鱼类, 对蛋白质的利用能力不是很高(赵吉伟等, 2001; 王桂芹等, 2004)。因此翘嘴红鲌饲料转化率相关的基因克隆和饲料转化率较高品种的培育对翘嘴红鲌养殖业的发展具有重要意义。
果糖-1, 6-二磷酸醛缩酶(fructose-1, 6-bispho- sphate aldolase, ALDO)是生物体新陈代谢过程中的一种关键的酶(Rutter et al, 1966; Penhoet et al, 1996), 醛缩酶普遍存在于动植物体内, 在一些高等植物的线粒体、叶绿体中已经发现了多种醛缩酶(Martin et al, 1998)。在脊索动物中发现有三种醛缩酶, 分别为A型、B型、C型三种, 它催化3-磷酸甘油醛和磷酸二羟丙酮的醇醛缩合反应可逆的生成果糖-1, 6-二磷酸。该反应是生物体内碳代谢和糖代谢途径中的一步重要反应, 直接影响生物体内能量的积累(Fujita et al, 2014; Ji et al, 2016; Cao et al, 2017)。
本研究采用RACE技术成功克隆翘嘴红鲌ALDO-C基因cDNA全序列, 并通过对其核苷酸序列的比较分析, 利用原位杂交技术初步探究ALDO-C基因在翘嘴红鲌中的功能, 以期为翘嘴鲌人工选育奠定技术基础, 同时为鲌亚科鱼类起源及进化机制研究提供理论依据。
1 材料与方法 1.1 实验材料实验所用的翘嘴红鲌均从浙江省淡水所同塘养殖的10月龄翘嘴红鲌(4尾亲本繁殖)中随机选取3健康、无病的鱼, 取脑、肾、肌肉、性腺、肝等组织置于1.5mL冻存管中经液氮速冻后保存于–80℃。3′RACE: SMARTTM RACE cDNA Amplification Kit (Clontech)。RNA extraction with TRIzol。
1.2 RNA提取及检测根据组织基因RNA提取试剂盒说明书提取样本RNA, 随后分别进行1%琼脂糖凝胶电泳和Drop2000分光光度计检测RNA质量和浓度。其OD260/OD280= 2.038, RNA浓度为1.1μg/μL。
1.3 cDNA的合成根据PrimeScript Ⅱ RTase试剂盒说明书将提取的RNA进行反转录合成cDNA, 反转录体系为Oligo dT Primer or Random 6 mers 1μL, dNTP Mixture (10mmol/L each) 1μL, 模板RNA 5μL以下(视浓度而定, 可变), 补足RNase Free dH2O 10μL, 65℃保温5min后, 冰上迅速冷却至少1min。之后再加入5×PrimeScript Ⅱ Buffer 4μL, RNase Inhibitor 0.5μL, PrimeScript Ⅱ RTase 1μL, RNase Free dH2O 4.5μL, 混匀, 42℃反应30—60min, 95℃反应5min, –80℃保存。
1.4 翘嘴红鲌ALDO-C基因cDNA克隆将3组织来源的cDNA进行混合, 以之为模板, 利用A-F1/A-R1, A-F2/A-R2(表 1)进行高保真PCR扩增, 反应条件为: 94℃ 5min; 35 cycles of 94℃ 30′′, 60℃ 30′′, 72℃ 2′; 72℃ 5′。电泳结果显示有较为特异性的PCR条带, 对条带进行割胶回收, 所有回收片段30μL洗脱, 4μL电泳检测。回收的PCR条带单一, 浓度适中。对其进行双向测序。
| 引物 | 序列(5′—3′) | 备注 |
| A-F1 | CTCCCTCAGAGTTGGCAATCATG | 3′RACE |
| A-R1 | GACAACCCTAAAGTACAGAAG | 3′RACE |
| A-F2 | CCAGCTTCCGCCAGCCAATAGTATAG | 3′RACE |
| A-R2 | GAGAGGGAGAGCATGATACACTC | 3′RACE |
| A-F3 | TAAGTCATTCCAATTCAGGCAC | 3′RACE |
| qALDO-F | CCCAGTACAAGAAGGACGGA | 荧光定量 |
| qALDO-R | GCATAACGGGCCAGAACATT | 荧光定量 |
| β-actin | TCAGGGTGTGATGGTTGGTATGG AGGGGCCACACCACGGAGTTCATT |
对照 |
根据翘嘴红鲌RACE序列所得氨基酸序列, 用Primer3 Input设计引物qALDOC-F、qALDOC-R(表 1), 扩增目的片段为88bp, 保持与内参基因β-actin长度大致相同(Bai et al, 2014)。反应程序qRT-PCR分析采用Real-time PCR试剂盒KOD qPCR Mix进行。20μL反应体系: cDNA模板2μL, KOD qPCR Mix 10μL, 上游引物和下游引物(10μmol/L)各0.8μL, 以ddH2O补充至20μL。放入ABI StepOnePlus实时荧光定量PCR仪。扩增程序如下: 95℃ 30s; 95℃ 5s, 60℃ 30s, 40个循环; 95℃ 15s, 60℃ 1min, 95℃ 15s获得溶解曲线。内参基因为β-actin, 每个孔做3个技术重复, 采用2–ΔΔCt法(Livak et al, 2001)分别计算其在各个组织中的相对表达量, 重复做3次独立反应。相关引物序列见表 1, 使用Origin8软件绘制柱状图。
1.6 原位杂交首先使用二甲苯溶液进行3次脱蜡反应, 每次5min。反应结束后, 利用乙醇去除溶液中的二甲苯, 乙醇(100%, 96%, 70%)依次上下浸洗10次, 反应5min; 加入PBS混合反应2—5min。将切片斜置(标记末端向下), 置于空气中干燥。其次, 进行蛋白酶处理。将40mL 2×SSC加入试管中, 水浴预热, 再加入1g蛋白酶K, 直至完全溶解, 配得浓度为25mg/mL的蛋白酶K消化溶液; 将配制好的蛋白酶K溶液加入染色缸, 37℃水浴槽中预热, 孵育20min; 在室温下利用2×SSC漂洗切片3次, 每次1min; 进行梯度酒精脱水(–20℃预冷), 乙醇(70%, 96%, 100%)依次上下浸洗10次, 反应1min。再次, 杂交反应。在每张载玻片上滴加50—100μL的杂交液(探针浓度为10μm, ALDO-C探针序列: 5′-TCACCGCATCGTGGCACCTGGCAAGGGCATCCTGGCTGCAGATGAGTCCA-DIG-3′); 盖上22×22盖玻片, 用胶水封片(防止干片), 并置于杂交仪上, 95℃ 5min, 37℃, 反应12—16h。反应结束后, 用镊子小心的把封片胶撕掉(避免玻片刮花组织样本), 把玻片放入室温5×SSC中, 根据杂交温度在如下溶液梯度中洗片: 5×SSC 5min 37℃; 1×SSC 5min 37℃; 0.2×SSC 5min 37℃; 0.2×SSC 5min室温。室温下加入1×PBS混合反应5min。接着, 进行免疫检测。反应体系如下:将玻片甩干, 在室温湿盒上滴加封闭液, 封闭15min; 用纸吸干封闭液, 每张切片使用30—60μL罗丹明抗-地高辛抗体或FITC卵白素, 室温下孵育1h;室温下1×PBS洗3次, 每次2min; 取出切片, 斜置切片使液体排出(Lim et al, 2017)。最后, 对细胞核进行染色。每张切片加DAB显色液/DAPI染色液, 覆盖盖玻片并在室温下孵育2—5min (Somfai et al, 2006); 用苏木精衬染, 酒精脱水, 二甲苯透明, 树脂封片后显微镜拍照(为防淬灭, 封片剂封片后荧光显微镜拍照)。
1.7 生物信息学分析测序所得序列通过NCBI Blast进行对比所得序列相似度跟草鱼较高, 则认为是翘嘴红鲌序列, DNAMAN6.0进行序列拼接获得全长, 利用NCBI ORF Finder查找基因开放阅读框。预测信号肽, 计算分子质量等电点, 以及分析蛋白理化性质和功能位点预测等氨基酸序列分析参照艾加林等(2018)方法进行分析。
从GenBank下载草鱼Ctenopharyngodon idella GenBankK: M192252.1, 白鲢Hypophthalmichthys molitrix GenBank: HM124741.1, 斑马鱼Danio rerio GenBank: AF533647.1, 金鱼Carassius auratus GenBank: U36777.1, 墨西哥脂鲤Astyanax mexicanus Sequence: XM 007259600.3, 橙线雀Acanthochromis polyacanthus XM 022214917.1, 普氏野马Equus przewalskii XM 008527762.1, 人Homo sapiens XM 011524556.2的氨基酸序列, 用邻位法1000次构建系统进化树。使用GENEDOX.EXE进行氨基酸序列对比。
2 结果 2.1 ALDO-C基因克隆与分析以翘嘴红鲌的cDNA为模板, 用RACE等技术克隆翘嘴红鲌脑组织的ALDO-C基因, 获得ALDO-C基因全长cDNA1945bp, 其中ORF区975bp, 5'非编码区933bp, 3'非编码区37bp(如图 1)。ALDO-C蛋白由325个氨基酸组成, 其分子量(Mw)和等电点(pI)分别为80430.16和5.04。NetNGlyc分析显示翘嘴红鲌ALDO-C基因的编码蛋白不存在O-糖基化位点。通过ProP进行蛋白酶水解位点分析显示:翘嘴红鲌ALDO-C氨基酸序列无预测信号肽裂解位点, 也无预测的前肽裂解位点。采用NetPhos 3.1和NetNGlyc 1.0预测功能位点, 结果显示, 翘嘴红鲌ALDO-C氨基酸序列中有8个丝氨酸磷酸化位点、13个苏氨酸磷酸化位点和3个酪氨酸磷酸化位点。SOPMA分析表明, 翘嘴红鲌ALDO-C氨基酸二级结构中α-螺旋占50%、延伸链占14.51%、β转角占6.48%、无规则卷曲占29.01%。用TMHMM软件对ALDO氨基酸序列的跨膜结构域进行预测, ALDO-C编码的蛋白整条肽链均位于膜外, 即ALDO蛋白不存在跨膜结构域。蛋白质疏水性/亲水性的预测和分析是进行蛋白质二级结构预测及功能域划分的一个必要过程。运用ProtScale预测ALDO-C氨基酸序列的疏水性/亲水性, 结果表明多肽链第954位的Thr具有最低分值–0.600, 第607位Cys具有最高分值2.267, 依据氨基酸分值越低亲水性越强, 分值越高氨基酸疏水性越高的规律可以看出第607位的Cys疏水性较强, 第954的Thr亲水性较强; 就整体看, 疏水性氨基酸均匀分布在整个肽链中, 且多于亲水性氨基酸, 因此, 整个多肽链表现为疏水性, 无明显的亲水区域, 可认为ALDO是疏水性蛋白。
 |
| 图 1 翘嘴红鲌ALDO-CcDNA序列及编码氨基酸序列 Fig. 1 The sequence of ALDO-C cDNA and the coding amino acid sequence of E. ilishaeformis |
使用DNAMAN8.0进行多重序列同源比对, 将ALDO-C基因编码的氨基酸序列与部分鱼类的ALDO-C基因进行比对, 并计算ALDO-C蛋白序列与比对序列之间的同源相似性。Blast结果显示, 翘嘴红鲌ALDO-C基因与草鱼(Ctenopharyngodon idella)相似度为97.13%, 与斑马鱼(Danio rerio)同源性为90.67%, 与鲢鱼(Hypophthalmichthys molitrix)同源性97.33%, 与鲤科同源性在90%—98%之间, 与鲢鱼同源性最高(图 2)。ALDO-C基因属于ALDO家族基因成员。进化树结果如图 3所示, 该基因的系统进化关系与传统的物种进化地位基本一致。
 |
| 图 2 不同物种ALDO-C蛋白序列比对分析 Fig. 2 The alignment of ALDO-C protein sequences in different species 注: 1. Erythroculter ilishaeformis; 2. Ctenopharyngodon idella; 3. Danio rerio; 4. Carassius auratus; 5. Amia calva |
 |
| 图 3 基于ALDO-C基因氨基酸序列构建的翘嘴红鲌及其他鱼类的系统发育树 Fig. 3 Phylogenetic tree of E. ilishaeformis and other fishes based on the amino acid sequence of ALDO-C gene |
定量PCR扩增得到的ALDO-C基因长度为160bp, 以翘嘴红鲌β-actin基因为对照, ALDO-C基因在肾、肝、肌肉、性腺中均有表达, 在脑中微量表达, 且在肾中表达量最高, 显著高于其他组织(图 4)。肌肉中表达量高于肝和性腺(P < 0.05), 肝和性腺中的表达没有显著差异(P > 0.05)。
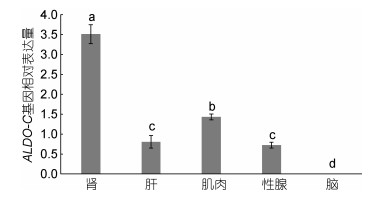 |
| 图 4 ALDO-C基因相对表达量 Fig. 4 Relative expression of ALDO-C gene |
肾参与机体代谢废物的排出、水盐代谢及酸碱平衡等过程(沈文, 2016)。H.E染色结果:细胞核被苏木精染成鲜明的蓝色, 软骨基质、钙盐颗粒呈深蓝色, 黏液呈灰蓝色。细胞浆被伊红染成深浅不同的粉红色至桃红色, 胞浆内嗜酸性颗粒呈反光强的鲜红色。胶原纤维呈淡粉红色, 弹力纤维呈亮粉红色, 红血球呈橘红色, 蛋白性液体呈粉红色(Sun et al, 2014)。肾细胞界限较清晰, 着色较浅近端小管在肾小体周围分布较多(图 5a)。原位杂交定位结果显示, 阳性表达部位呈棕色或棕黄色。阳性表达部位呈棕色或棕黄色, ALDO-C在翘嘴红鲌肾近端小管中呈强阳性表达(图 5b), 在远端小管和集合管中呈弱阳性表达。
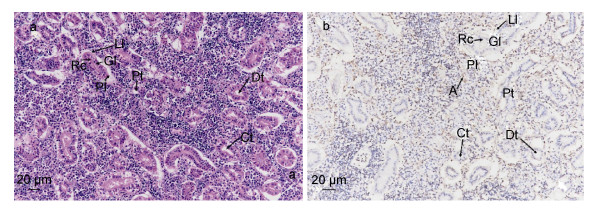 |
| 图 5 翘嘴红鲌肾中ALDO-C基因的组织表达定位 Fig. 5 Tissue expression of ALDO-C gene in the kidney of E. ilishaeformis 注: a.肾H.E染色200×; b.肾原位杂交对照组。C1.集合管; Dt.远端小管; Gl.肾小球; Ll.肾小囊脏层; Pl.肾小囊壁层; Pt.近端小管; Rc.肾小体; A. ALDO在集合管的表达 |
近年来, 翘嘴鲌养殖规模的不断扩大, 浙江省养殖面积已达到2000hm2以上(刘士力等, 2017)。养殖水环境差, 病害多、鱼价低迷, 而配合饲料的价格又不断上涨, 养殖户效益普遍下降, 因此选育出抗病性强及饲料转化率高的新品种具有重要的经济意义。而分子标记辅助育种被认为是最有效的育种方式之一(孙效文等, 2009)。
果糖1, 6-二磷酸醛缩酶催化果糖1, 6-二磷酸可逆的裂解为两个丙糖, 磷酸二羟丙酮和3-磷酸甘油醛。该反应既存在于糖酵解/糖异生途径中又存在于磷酸戊糖循环途径中, 为生物体物质合成代谢提供能量ATP和底物, 因此果糖1, 6-二磷酸醛缩酶对细胞生命活动起到至关重要的作用(张芃芃等, 2001; Barik, 2019)。Wang等(2019)通过ALDO-B的异位表达降低癌细胞中的FBP水平破坏氧化还原稳态, 阻止癌症增殖。该酶在酶在糖信号、激素和胁迫响应过程中具有重要的功能。在脊椎动物中鉴定出三种醛缩酶同工酶, 其编码不同的基因(Lebherz et al, 1969)。醛缩酶A参与糖酵解骨骼肌和早期胚胎发育; 醛缩酶B参与肝脏、肾脏和胃肠道中的葡萄糖代谢; 醛缩酶C主要作为糖酵解关键酶(Lebherz et al, 1969)。醛缩酶的结构和功能已初步在人类和小鼠中进行了研究, 重点研究醛缩酶B基因突变与遗传性果糖不耐症(Cross et al, 1988)。此外, 醛缩酶A的上调在肝癌患者的肝组织中观察到C基因和醛缩酶B基因的下调(Schapira et al, 1963)。在鱼类研究中, 已在鲷鱼(Llewellyn et al, 1995)和大西洋鲑(Llewellyn et al, 1998)中克隆得到醛缩酶B基因, 在金鱼克隆得到缩醛酶C基因(Berardini et al, 1997)。曹婷婷等(2012)对草鱼的EST库中醛缩酶B基因编码区序列片段进行扩增, 测序对比等获得了三个SNP位点。用296尾草鱼进行生长性状关联分析, 结果显示三个位点两两组成的7种双倍型在体质量、体宽、体长的5个生长重要指标上有显著差异, 结果得出醛缩酶B可以作为草鱼育种的候选基因。目前为止, 还少有报道证明ALDO-C基因在鱼类生长发育及抗病性过程中发挥重要功能。
本研究通过RACE技能成功克隆ALDO-C基因, 获得ALDO-C基因全长cDNA 1945bp, 其中ORF区975bp, 5'非编码区933bp, 3′非编码区37bp。ALDO-C蛋白由325个氨基酸组成。其分子量(Mw)和等电点(pI)分别为80430.16和5.04。翘嘴红鲌ALDO-C氨基酸序列中有8个丝氨酸磷酸化位点、13个苏氨酸磷酸化位点和3个酪氨酸磷酸化位点, 这些位点对该基因功能的实现有很大的影响, 为ALDO-C功能的研究提供结构基础。该氨基酸的二级结构有助于更深一步研究该蛋白质的稳定性结构、主要定位及功能作用的发掘。同时通过qRT-PCR检测ALDO-C在翘嘴红鲌各组织中的表达量。选取最高表达组织, 进行原位杂交基因定位, 检测到ALDO-C在翘嘴红鲌肾近端小管中呈强阳性表达, 在远端小管和集合管中呈弱阳性表达。
肾是硬骨鱼类机体造血的主要器官, 同时也是重要的免疫器官。肾参与机体代谢废物的排出、水盐代谢及酸碱平衡等过程。肾小球滤液进入近端小管后, 滤液中大部分Na+、K+、Cl–等离子和水被重吸收, 葡萄糖、氨基酸全部被重吸收。猜测ALDO-C基因可能通过控制肾小球的重吸收功能, 来调控生物体内碳代谢和糖代谢。
4 结论本文采用RACE技术克隆了翘嘴红鲌ALDO-C的CDS序列。通过qRT-pcr和原位杂交的方法确定了ALDO-C在肾中高表达, 在肾近端小管中呈阳性表达, 暗示了ALDO-C基因与肾的重吸收功能有密切关系, 其具体机制值得进一步的深入研究。该研究结果可为今后鲌类遗传育种提供参考资料。
王桂芹, 2005.翘嘴红鲌蛋白质营养生理学的研究.上海: 上海海洋大学博士学位论文, 38—42 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y773291
|
王桂芹, 周洪琪, 董永利, 等. 2004. 翘嘴红鲌幼鱼最适蛋白需求量的研究. 吉林农业大学学报, 26(5): 556-560 DOI:10.3969/j.issn.1000-5684.2004.05.023 |
艾加林, 栗志民, 刘建勇. 2018. 九孔鲍MSTN基因cDNA克隆及表达. 水产学报, 42(6): 817-827 |
刘士力, 贾永义, 蒋文枰, 等. 2017. 翘嘴鲌生长激素(GH)基因与侧翼区的克隆及分析. 浙江农业学报, 29(8): 1281-1289 DOI:10.3969/j.issn.1004-1524.2017.08.08 |
孙效文, 鲁翠云, 贾智英, 等. 2009. 水产动物分子育种研究进展. 中国水产科学, 16(6): 981-990 DOI:10.3321/j.issn:1005-8737.2009.06.020 |
沈文. 2016. 肾脏功能MRI的进展和挑战. 中华放射学杂志, 50(3): 161-164 DOI:10.3760/cma.j.issn.1005-1201.2016.03.001 |
张芃芃, 马为民, 杨春松等, 2001.丙糖磷酸异构酶基因(ALD)、果糖-1, 6-二磷酸醛缩酶基因(TPI)在鱼腥藻7120中的克隆.见: 中国藻类学会第十一次学术讨论会论文摘要集.昆明: 中国藻类学会 http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGHI200111001154.htm
|
赵吉伟, 叶继丹. 2001. 饲料蛋白质含量对翘嘴红鲌生长影响的初步研究. 水产学杂志, 14(2): 21-23 DOI:10.3969/j.issn.1005-3832.2001.02.006 |
钱雪桥, 崔奕波, 解绶启, 等. 2002. 养殖鱼类饲料蛋白需要量的研究进展. 水生生物学报, 26(4): 410-416 DOI:10.3321/j.issn:1000-3207.2002.04.014 |
曹婷婷, 白俊杰, 于凌云, 等. 2012. 草鱼醛缩酶B基因部分序列的SNP多态性及其与生长性状的关联分析. 水产学报, 36(4): 481-488 |
Bai Z Y, Lin J Y, Ma K Y et al, 2014. Identification of housekeeping genes suitable for gene expression analysis in the pearl mussel, Hyriopsis cumingii, during biomineralization. Molecular Genetics and Genomics, 289(4): 717-725 DOI:10.1007/s00438-014-0837-1 |
Barik S, 2019. How universal is the transcription regulatory moonlighting role of fructose 1, 6-bisphosphate aldolase?. Journal of Theoretical Biology, 464: 112-114 DOI:10.1016/j.jtbi.2018.12.037 |
Baruselli P S, Ferreira R M, Sá Filho M F et al, 2010. Bovine embryo transfer recipient synchronisation and management in tropical environments. Reproduction, Fertility and Development, 22(1): 67-74 DOI:10.1071/RD09214 |
Berardini T Z, Drygas-Williams M, Callard G V et al, 1997. Identification of neuronal isozyme specific residues by comparison of goldfish aldolase C to other aldolases. Comparative Biochemistry and Physiology Part A:Physiology, 117(4): 471-476 DOI:10.1016/S0300-9629(96)00396-9 |
Cao W, Chang T J, Li X Q et al, 2017. Dual effects of fructose on ChREBP and FoxO1/3α are responsible for AldoB up-regulation and vascular remodelling. Clinical Science, 131(4): 309-325 DOI:10.1042/CS20160251 |
Cross N C P, Tolan D R, Cox T M, 1988. Catalytic deficiency of human aldolase B in hereditary fructose intolerance caused by a common missense mutation. Cell, 53(6): 881-885 DOI:10.1016/S0092-8674(88)90349-2 |
Fujita H, Aoki H, Ajioka I et al, 2014. Detailed expression pattern of aldolase C (Aldoc) in the cerebellum, retina and other areas of the CNS studied in Aldoc-Venus knock-in mice. PLoS One, 9(1): e86679 DOI:10.1371/journal.pone.0086679 |
Ji S R, Zhang B, Liu J et al, 2016. ALDOA functions as an oncogene in the highly metastatic pancreatic cancer. Cancer Letters, 374(1): 127-135 DOI:10.1016/j.canlet.2016.01.054 |
Khan M S, Ang K J, Ambak M A et al, 1993. Optimum dietary protein requirement of a Malaysian freshwater catfish, Mystus nemurus. Aquaculture, 112(2-3): 227-235 DOI:10.1016/0044-8486(93)90448-8 |
Kim K W, Wang X J, Bai S C, 2002. Optimum dietary protein level for maximum growth of juvenile olive flounder Paralichthys olivaceus (Temminck et Schlegel). Aquaculture Research, 33(9): 673-679 DOI:10.1046/j.1365-2109.2002.00704.x |
Lebherz H G, Rutter W J, 1969. Distribution of fructose diphosphate aldolase variants in biological systems. Biochemistry, 8(1): 109-121 |
Lee S M, Park C S, Bang I C, 2002. Dietary protein requirement of young Japanese flounder Paralichthys olivaceus fed isocaloric diets. Fisheries Science, 68(1): 158-164 DOI:10.1046/j.1444-2906.2002.00402.x |
Lim A S T, Lim T H, 2017. Fluorescence in situ hybridization on tissue sections. In: Wan T S K ed. Cancer Cytogenetics: Methods and Protocols. New York: Humana Press, 119—125
|
Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method. Methods, 25(4): 402-408 DOI:10.1006/meth.2001.1262 |
Llewellyn L, Ramsurn V P, Sweeney G E et al, 1995. Cloning and characterisation of a fish aldolase B gene. Biochimica et Biophysica Acta (BBA)-Gene Structure and Expression, 1263(1): 75-78 DOI:10.1016/0167-4781(95)00096-Y |
Llewellyn L, Sweeney G E, Ramsurn V P et al, 1998. Cloning and unusual expression profile of the aldolase B gene from Atlantic salmon. Biochimica et Biophysica Acta (BBA)-Gene Structure and Expression, 1443(3): 375-380 DOI:10.1016/S0167-4781(98)00229-2 |
Martin W, Herrmann R G, 1998. Gene transfer from organelles to the nucleus:how much, what happens, and why?. Plant Physiology, 118(1): 9-17 |
Penhoet E, Rajkumar T, Rutter W J, 1966. Multiple forms of fructose diphosphate aldolase in mammalian tissues. Proceedings of the National Academy of Sciences of the United States of America, 56(4): 1275-1282 DOI:10.1073/pnas.56.4.1275 |
Rutter W J, Hunsley J R, Groves W E et al, 1966. Fructose diphosphate aldolase. Methods in Enzymology, 9: 479-498 DOI:10.1016/0076-6879(66)09099-2 |
Schapira F, Dreyfus J C, Schapira G, 1963. Anomaly of aldolase in primary liver cancer. Nature, 200(4910): 995-997 DOI:10.1038/200995a0 |
Somfai T, Dinnyés A, Sage D et al, 2006. Development to the blastocyst stage of parthenogenetically activated in vitro matured porcine oocytes after solid surface vitrification (SSV). Theriogenology, 66(2): 415-422 DOI:10.1016/j.theriogenology.2005.11.023 |
Sun C Y, He M L, Ko W K W et al, 2014. Mechanisms for luteinizing hormone induction of growth hormone gene transcription in fish model:crosstalk of the cAMP/PKA pathway with MAPK-and PI3K-dependent cascades. Molecular and Cellular Endocrinology, 382(2): 835-850 DOI:10.1016/j.mce.2013.10.017 |
Wang J, Wu Q, Qiu J X, 2019. Accumulation of fructose 1, 6-bisphosphate protects clear cell renal cell carcinoma from oxidative stress. Laboratory Investigation DOI:10.1038/s41374-019-0203-3 |
 2019, Vol. 50
2019, Vol. 50


