
中国海洋湖沼学会主办。
文章信息
- 王小凤, 申慧婷, 孙小玲, 于荣贤, 刘兵, 苏秀榕. 2019.
- WANG Xiao-Feng, SHEN Hui-Ting, SUN Xiao-Ling, YU Rong-Xian, LIU Bing, SU Xiu-Rong. 2019.
- 金枪鱼(Thunnus sp.)胰腺酶解液对H2O2诱导的胰岛素瘤细胞(INS-1)氧化损伤的保护作用
- IN-SILICO ANALYSIS AND IN VIVO TESTS OF ANTI-OXIDATION EFFECT OF TUNA PANCREAS HYDROLYSATE ON INS-1 CELL
- 海洋与湖沼, 50(5): 1146-1153
- Oceanologia et Limnologia Sinica, 50(5): 1146-1153.
- http://dx.doi.org/10.11693/hyhz20190300053
文章历史
-
收稿日期:2019-03-14
收修改稿日期:2019-04-23
2. 宁波大学食品与药学学院 宁波 315211;
3. 深圳市荣格保健品有限公司 深圳 518118
2. College of Food and Pharmaceutical Sciences, Ningbo University, Ningbo 315211, China;
3. Shenzhen Rongge Health Products Co., Ltd., Shenzhen 518118, China
活性肽是含有数个到数十个氨基酸的多肽类物质。目前的研究发现, 富含生物活性肽的酶解液具有药用价值, 例如, 牡蛎肽在降血糖、抗肿瘤等方面具备特殊的生理活性(方磊等, 2018); 扇贝裙边活性肽可以改善小鼠对血糖浓度的调节能力, 对机体的糖耐受能力具有一定的增强作用(延海莹等, 2018)。金枪鱼(Thunnus sp.)营养价值很高, 含有丰富的DHA和EPA(马振华等, 2006), 但在加工过程会产生大量下脚料, 包括鱼头和内脏等, 其中胰腺作为金枪鱼主要的消化腺, 蛋白质含量丰富, 质量约占内脏下脚料的27%(鳃除外)。为提高金枪鱼下脚料的利用率, 利用胰腺来制备生物活性肽、实现金枪鱼加工废弃物高值化利用。由于酶解液是组成、丰度和肽链长度均不同的多肽混合物, 传统借助细胞模型、动物模型等来筛选和验证多肽酶解液的功能, 是一项费时费力的工作(Han et al, 2018)。因此, 迫切需要一种可以直接高通量预测酶解液中活性肽功能的策略, 减少酶解液功能筛选过程中的工作量和不确定性。Discovery Studio(以下简称DS)是新一代分子建模软件。最近研究表明, 通过DS软件对灵芝次生代谢产物进行预测分析。董丽莎利用DS软件中CDOCKER模块将所得的优势肽与抗氧化相关的Kelch样环氧氯丙烷相关蛋白-1(Keap1)进行分子对接, 研究黑线鳕鱼皮胶原蛋白酶解多肽对UVB诱导HaCaT光损伤的抑制作用, 并通过细胞实验得到验证(董丽莎等, 2018)。
本研究中以金枪鱼(Thunnus sp.)胰腺为原料, 制备酶解液, 利用MALDI-TOF/TOF-MS测定金枪鱼胰腺酶解液中的多肽组分及其丰度, 通过Discovery Studio软件预测优势肽的功能, 最后通过细胞实验进行验证, 为酶解液的功能组分鉴定提供了新的思路。
1 材料与方法 1.1 材料金枪鱼(Thunnus sp.)胰腺取于宁波今日食品有限公司; 胰岛素瘤细胞(INS-1)细胞株购于上海瑞路生物技术有限公司; RPMI-1640培养基购于美国Hyclone公司; 胎牛血清(Fetal bovine serum, FBS)购于美国Gemini公司; 二甲基亚砜(DMSO)购于美国Amresco公司; 噻唑蓝[3-(4, 5-dimethylthiazol-2-yl) -2, 5-diphenyl, MTT]购于美国Sigma公司; β-巯基乙醇购于美国Gibco公司; AnnexinV-PI双染凋亡检测试剂盒购于美国BD Pharmingen公司; 大鼠胰岛素(INS)ELISA试剂盒购于宁波百川生物公司; 磷酸盐缓冲液(Phoshate Buffered Saline, PBS)、100U/mL青霉素和100μg/mL链霉素、胰酶、RIPA细胞裂解液和Hanks缓冲液购于上海碧云天公司。
1.2 方法 1.2.1 金枪鱼胰腺活性肽的制备将金枪鱼胰腺清洗、沥干后于组织搅碎机打碎, 经胰蛋白酶在酶浓度为1.23%, 温度为52.95℃条件下水解1.75h, 随后100℃加热10min灭酶活, 4000r/min离心10min获得上清液, 采用1kDa的超滤膜(购于美国Millipore公司)截留酶解液, 制备低分子量多肽, 并在真空冷冻干燥机(美国LABCONCO公司)中冷冻干燥24h得到活性肽冻干粉(Han et al, 2018)。用无糖RPMI-1640培养基溶解活性肽冻干粉并过滤除菌, 制成浓度为10mg/mL的储备液备用。
1.2.2 多肽组成分析在质谱仪分析前, 将酶解产物加入60μL含有0.2%甲酸和2mmol/L醋酸钠的甲醇/水(50/50, V/V)中, 将样品(0.5mL)直接置于MALDI板上, 并与等量体积的二羟基苯甲酸混合(Je et al, 2009)。使用MALDI-TOF/TOF串联质谱(MALDI- TOF/TOF购于美国Applied Biosystem公司)获得多肽质谱图。结果用MASOT数据库和NCBI分析得到多肽的序列。用一级质谱法测定其准确分子量, 用二级质谱法测定其氨基酸序列(董丽莎等, 2018)。
1.2.3 金枪鱼胰腺多肽功能预测 1.2.3.1 构建多肽结构和反向找靶首先, 利用DS软件构建多肽的结构, 用DS中“构建和编辑蛋白”(“Build and Edit Protein”)模块将1.2.2获得的多肽氨基酸序列输入, 并通过“配体优化”(“Minimize Ligands”)模块中的Full Minimization功能将其能量最优化, 以获得最佳能量的多肽3D结构; 然后, 使用DS中的“准备配体”(“Prepare Ligands”)程序生成多个构象。该过程使用DS配体分析工具执行。在这项工作中, 我们使用Pharma DB作为目标数据库, 参数被设置为PharmaDB药效团的形状, 输入药物中最具选择性的药物团, 其他参数设置为默认值。
1.2.3.2 分子对接从蛋白数据库(PDB)中获得具有Fit-value值大于3的药效团进行模拟对接。将Fit- value值大于3的蛋白在DS中打开后, 去水加氢, 并用“准备蛋白”(Prepare Protein)模块对蛋白进行预处理, 包括缺失的loop的补充, 在不同pH条件下的质子化状态等。该过程使用“分子对接”(Receptor-Ligand Interactions)模块的CDOCKER工具执行。在此过程中, 从PDB中下载蛋白作为受体, 将多肽设置为配体。配体受体复合物的能量评分决定了配体和受体蛋白是否结合。
1.2.4 多肽对INS-1细胞氧化损伤的作用 1.2.4.1 细胞悬液的制备INS-1细胞用含10%胎牛血清、50μmol/L的巯基乙醇、1% 100U/mL青霉素和100μg/mL链霉素的RPMI-1640培养液(即为10%FBS培养基)于37℃、5% CO2细胞培养箱中贴壁培养(CO2培养箱购于上海精密仪器仪表有限公司)。每2d更换一次培养基, 当细胞生长到覆盖培养瓶底壁表面的70%—80%时, 用0.05%含EDTA的胰酶消化, 离心后计数, 调整到105个/mL备用。
1.2.4.2 多肽对氧化损伤INS-1细胞增殖活性的作用对细胞进行分组, 分为正常对照组(10% FBS的INS培养基100μL/孔); 模型组(H2O2氧化损伤组, 80μL含10% FBS的INS培养基和20μL 200μmol/L H2O2); 活性肽高剂量组(HDAP, 1mg/mL的酶解液10μL、70μL含10% FBS的INS培养基和20μL 200μmol/L H2O2)和活性肽低剂量组(LDAP, 0.1mg/mL的酶解液10μL、70μL含10% FBS的INS培养基和20μL 200μmol/L H2O2), 将1.2.4.1制备的处于对数生长期的细胞悬液接种于96孔培养板中, 每组细胞都有3个复孔, 培养24h后, 每孔加入50μL 2mg/mL MTT, 4h后弃培养液, 加入150μL二甲亚砜(DMSO), 在570nm波长处检测(酶标仪为美国Molecular Devices公司)测各孔吸光度值(董丽莎等, 2018)。
增殖率计算公式如下:

将INS-1细胞按“1.2.4.2”项下分组处理, 以105/mL接种于96孔板, 培养48h后, 利用AnnexinV-PI双染凋亡检测试剂盒做细胞凋亡处理, 将样品于冰上避光放置, 并于1h内于激发波长488nm, 发射波长525nm条件下利用流式细胞仪检测细胞凋亡水平(流式细胞仪购于美国Beckman Coulter公司), 并用Modfit LT软件分析凋亡率(李晔等, 2012)。
1.2.4.4 多肽对氧化损伤INS-1细胞胰岛素分泌的影响选取对数生长期的INS-1细胞, 按“1.2.4.2”项下分组处理, 按105/孔接种于24孔板中, 培养24h后去除原培养液, 以无糖Hanks液洗涤3次, 分别添加含5.6mmol/L或16.7mmol/L葡萄糖的Hanks液50μL, 37℃孵育1h后, 分别收集上清液, 采用ELISA法测定上清液中的胰岛素含量(郑书国等, 2015)。
1.2.5 数据分析数据用SPSS 19.0统计软件进行单因素方差分析, 结果以平均值±标准差形式表示, P值小于0.05则认为差异显著。
2 结果与分析 2.1 金枪鱼胰腺酶解液多肽组成和丰度利用MALDI-TOF/TOF-MS从胰蛋白酶的水解液中共检测到988个峰, 其中有3个相对较强的质谱峰, 其质核比(m/z)分别为556.2504、511.2240和570.2549。选择它们作为母离子进行二级质谱处理, 得到3个优势多肽, 分别为G-PQV-R、G-LPP-K和E-HE-R(表 1和图 1)。
| 序号 | MH+ 理论值 |
MH+ 实际值 |
峰面积 | 百分比(%) | 理论氨基酸序列 |
| 1 | 555.3129 | 555.2446 | 13979.94 | 0.8615 | G-PQV-R |
| 2 | 510.3166 | 510.2117 | 21644.74 | 1.3351 | G-LPP-K |
| 3 | 569.2558 | 569.2475 | 14979.42 | 0.9231 | E-HE-R |
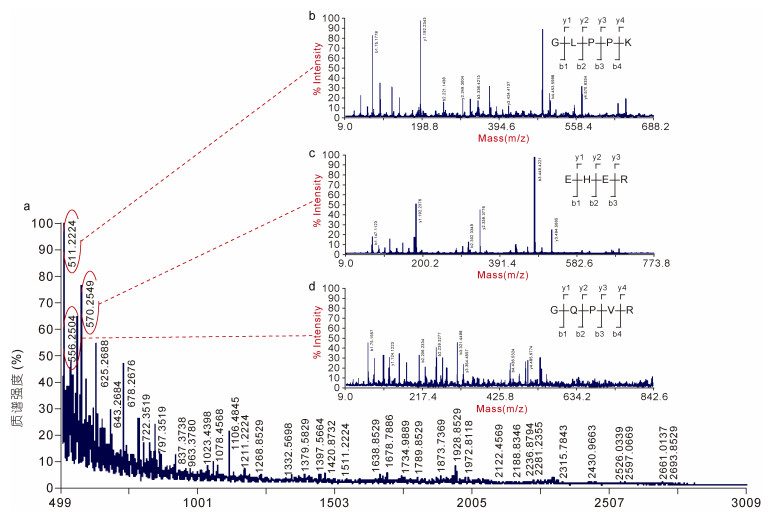 |
| 图 1 金枪鱼胰腺酶解液多肽的质谱分析图 Fig. 1 The mass spectrometric analysis of polypeptides in the enzymatic hydrolysate of tuna pancreas 注: a.一级质谱(MS); b.质核比511.2224碎片的二级质谱; c.质核比570.2549碎片的二级质谱; d.质核比556.2504碎片的二级质谱 |
通过DS软件的反向找靶功能, 对这三种多肽的活性进行筛选结果如表 2所示, G-PQV-R与编号为5dad-02, 1m4d-05和1tyr-06的药效团结合; G-LPP-K与编号为5dad-01和1o86-01的药效团结合; E-HE-R与编号为5dad-01, 1m48-04和3d9k-08的药效团结合。编号为5dad的药效团是Keap1蛋白, 它是细胞氧化应激的重要调节因子。三种多肽均可与Keap1结合, 且Fit-value值均为最高。因此, 我们初步推测Keap1是三种优势多肽的潜在靶标蛋白。
| 多肽序列 | 药效团编号 | 药效团 | Fit-value | 生物学功能 |
| G-PQV-R | 5dad-02 | Kelch样环氧氯丙烷相关蛋白1(Keap1) | 3.566 | 抗氧化 |
| 1m4d-05 | 氨基糖苷类乙酰转移酶 | 3.25 | 氨基糖苷抗性 | |
| 1tyr-06 | 转甲状腺素蛋白 | 3.17 | 抑制肿瘤和炎症 | |
| G-LPP-K | 5dad-01 | Kelch样环氧氯丙烷相关蛋白1(Keap1) | 3.69 | 抗氧化 |
| 1o86-01 | 血管紧张素转化酶 | 3.33 | 治疗高血压 | |
| E-HE-R | 5dad-01 | Kelch样环氧氯丙烷相关蛋白1(Keap1) | 3.62 | 抗氧化 |
| 1m48-04 | 白细胞介素2 | 3.28 | 调节免疫反应 | |
| 3d9k-08 | SCAF8蛋白 | 3.14 | mRNA加工 |
经过反向找靶, 初步推测优势多肽G-PQV-R、G-LPP-K和E-HE-R的靶标蛋白为Keap1。为了进一步确认上述推测, 使用DS软件中的分子对接模块, 对G-PQV-R、G-LPP-K和E-HE-R与Keap1之间的互相作用进行验证。CDOCKER分子对接主要根据受体与配体相互作用的能量(CDOCKER interaction energy, ECI), 范德华力(van der Waals Energy, EVDW)等信息来确定结合程度。ECI值越低表示分子对接过程中受体与配体的相互作用越小, 结合的越紧密。如表 3所示, 配体小分子G-LPP-K与受体蛋白结合所需的能量最低, 结合最紧密。如图 2可看出, 参与G-LPP-K配体小分子与Keap1中的相互作用的氨基酸残基共16个, 其中配体小分子与赖氨酸, 精氨酸和天冬氨酸形成电荷吸引力, 与苏氨酸, 天冬氨酸, 精氨酸, 谷氨酰胺, 赖氨酸和丝氨酸形成氢键能, 与甘氨酸和谷氨酰胺形成碳氢键能, 与异亮氨酸, 酰胺酸和苯丙氨酸形成烷基键能和PI烷基键能; G-QPV-R配体小分子与Keap1中的相互作用的氨基酸残基共14个, 其中配体小分子与精氨酸和天冬氨酸形成电荷吸引力, 与苏氨酸, 甘氨酸, 谷氨酰胺和赖氨酸形成氢键能, 与异亮氨酸, 酪氨酸, 亮氨酸和色氨酸形成烷基键能和PI烷基键能; E-HE-R配体小分子与Keap1中的相互作用的氨基酸残基共10个, 其中配体小分子与天冬酰胺, 苏氨酸, 天冬氨酸, 甘氨酸和谷氨酰胺形成电荷吸引力, 与苯丙氨酸和谷氨酰胺形成碳氢键能。综上所述, 金枪鱼胰腺酶解液中的优势多肽可以通过多种作用力与靶标蛋白Keap1结合, 预测其具有抗氧化的活性功能。
| 多肽序列 | -ECI (kJ/mol) | -EVDW(kJ/mol) | 氨基酸残基数 |
| G-PQV-R | 114.329 | 34.9688 | 14 |
| G-LPP-K | 81.533 | 17.6716 | 16 |
| E-HE-R | 86.2967 | 13.4166 | 10 |
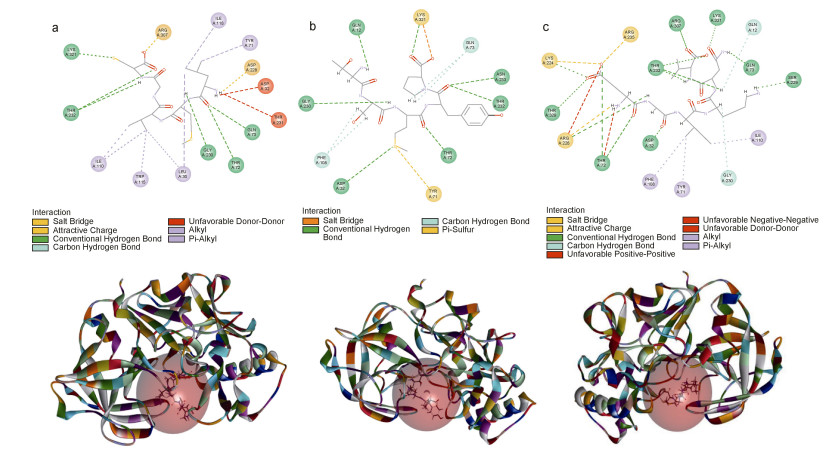 |
| 图 2 优势肽和靶标蛋白Keap1分子对接结果 Fig. 2 Molecular docking results of dominant peptide and target protein Keap1 注: a.优势肽G-LPP-K和靶标蛋白Keap1分子对接结果; b.优势肽E-HE-R和靶标蛋白Keap1分子对接结果; c.优势肽G-QPV-R和靶标蛋白Keap1分子对接结果 |
与对照组(细胞活力为100%±1.3%)相比, 模型组的细胞活力显著下降(P < 0.01), 仅为对照组的22%±2.3%;经高、低剂量金枪鱼胰腺酶解液处理后, 细胞活力较模型组显著升高(P < 0.01), 且细胞活力随胰腺酶解液浓度的增加而增加。分别将细胞活力恢复到对照组的63%±1.5%和44%± 2.8%(图 3)。金枪鱼胰腺酶解液可以增强氧化损伤的INS-1细胞的细胞活力, 对氧化损伤的INS-1细胞的增殖具有一定的促进作用。
 |
| 图 3 金枪鱼胰腺酶解液对H2O2诱导的INS-1细胞增殖的影响 Fig. 3 Effect of tuna pancreatic active peptide on the proliferation of INS-1 cells induced by H2O2 注: **. P < 0.01与正常对照组比较; ##. P < 0.01与模型组比较 |
由图 4可知, 与正常对照组(细胞凋亡率6.43%±0.79%)相比, 模型组细胞凋亡率显著升高到79.17%±4.56% (P < 0.01)。与模型组相比, 金枪鱼胰腺酶解液高剂量和低剂量处理使得细胞凋亡率显著降低, 分别降低到43.2%±1.73% (P < 0.01)和28.9%±1.32% (P < 0.01)。金枪鱼胰腺酶解液能够显著抑制H2O2诱导的INS-1细胞凋亡。但是, 随着胰腺酶解液浓度的增加, 对细胞凋亡的抑制活性反而降低。
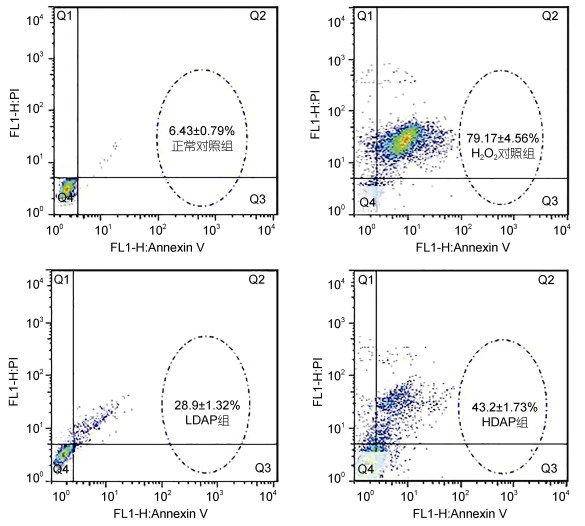 |
| 图 4 金枪鱼胰腺酶解液对H2O2诱导的INS-1细胞凋亡的影响 Fig. 4 Effect of tuna pancreatic active peptide on INS-1 cells apoptosis induced by H2O2 |
胰岛素由人体胰脏胰岛分泌的。正常时, 葡萄糖摄入增加促进胰岛分泌胰岛素增多, 葡萄糖摄入不足胰岛素分泌会明显减少。由图 5可知, 当葡萄糖浓度为5.6mmol/L时, 与正常对照组(24h的胰岛素分泌量为3.75±0.02mIU/L)相比, 模型组胰岛素分泌量显著减少到2.65±0.35mIU/L (P < 0.01), 金枪鱼胰腺酶解液高剂量和低剂量处理后, 胰岛素分泌量较模型组显著升高, 分别为3.45±0.23mIU/L (P < 0.01)和3.15± 0.19mIU/L (P < 0.01)。当葡萄糖浓度为16.7mmol/L时, 与正常对照组(24h胰岛素分泌量为6.15±0.02mIU/L)相比, 模型组胰岛素分泌量显著减少到3.65± 0.24mIU/L (P < 0.01), 金枪鱼胰腺酶解液高剂量和低剂量处理后, 胰岛素分泌量较模型组显著升高到5.75±0.18mIU/L (P < 0.01)和4.95±0.22mIU/L (P < 0.01)。随着葡萄糖摄入量增加, 胰岛素分泌水平整体增加, 金枪鱼胰腺酶解液能够显著改善氧化损伤的INS-1细胞的胰岛素分泌, 且改善效果呈剂量效应增加。
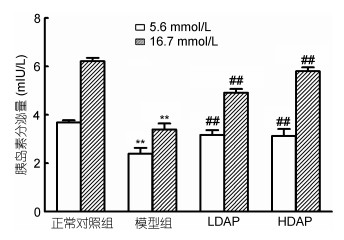 |
| 图 5 金枪鱼胰腺多肽对H2O2诱导INS-1细胞胰岛素分泌的影响 Fig. 5 Effect of tuna pancreatic active peptide on insulin secretion in INS-1 cells 注:与正常对照组比较, **P < 0.01;与H2O2对照组比较, ##P < 0.01 |
分子对接方法已成为药物设计中比较成熟的方法, 它能够准确预测蛋白质受体与配体间的结合位点, 指导和解释实验现象(段爱霞等, 2009)。刘广斌等(2016)已通过DS模拟Hsrad51蛋白与多肽brc4的分子对接, 为研究Hsrad51蛋白与其他重复基元的分子对接以及相互作用提供了重要依据。成功预测独活寄生汤对TNF-α和IL-1β作用的活性成分(郑春松等, 2012)。反向找靶是研究多肽功能和药物作用活性位点的重要工具(Chen et al, 2014; Grienke et al, 2015)。通过反向找靶预测多肽功能, 如抗高血压、细胞生长调节、抗肿瘤活性、免疫系统调节等(Han et al, 2018)。
金枪鱼的胰腺质量约占内脏下脚料的27%(鳃除外), 并且胰腺蛋白质含量丰富。其多肽G-LPP-K, E-HE-R和G-QPV-R为金枪鱼胰腺酶解液的优势肽, 反向找靶技术预测了G-LPP-K, E-HE-R和G-QPV-R三种多肽均可与Keap1结合, 细胞学实验结果表明, 金枪鱼胰腺酶解液高剂量和低剂量处理后, 细胞活力较H2O2氧化损伤组显著提高, 凋亡率从79.17%分别下降到43.2%和28.9%;胰岛素的分泌量从3.65mIU/L分别增加到5.75mIU/L和4.95mIU/L。金枪鱼胰腺活性肽具有显著的抗氧化活性, 对H2O2损伤INS-1细胞具有明显的保护作用, 促进INS-1细胞的胰岛素分泌。
大量研究表明氧化应激与多种慢性病和急性病有着密切的联系, 常见的有心血管疾病、癌症、神经紊乱、糖尿病、缺血再灌注和衰老(Ryoo et al, 2001)。而生物活性肽以多种方式发挥其抗氧化的特性, 包括清除自由基、抑制ROS的产生以及抑制促炎细胞因子的释放等(蔡江佳等, 2015; 童茜茜等, 2016)。金枪鱼胰腺酶解液使机体形成了一个复杂的氧化应激反应系统, 调控上游区域的抗氧化反应元件(ARE), 以缓解氧化损伤对机体的损伤(Itoh et al, 2003)。Nrf2是调节氧化应激的关键转录因子(Stewart et al, 2003), Keapl-Nrf2/ARE作为一种有效的抗氧化调节途径, 抑制Keap1活性激活Nrf2/ARE信号通路的抗氧化应激, 在细胞防御和降低机体氧化应激中发挥了重要作用(Rubiolo et al, 2008)。因此, 多肽可以通过抑制Keap1的活性, 实现细胞抗氧化的目的。
多肽的特定生理功能与其分子结构中的氨基酸数量、组成、排列顺序及分子构象密切相关(Zhang et al, 2010)。在本实验中, 金枪鱼胰腺酶解多肽的分子对接结果显示, 与Keap1相互作用的共同氨基酸有赖氨酸, 精氨酸, 天冬氨酸, 苏氨酸, 谷氨酰胺, 丝氨酸, 甘氨酸, 异亮氨酸, 络氨酸, 苯丙氨酸。其中, 络氨酸, 苯丙氨酸, 异亮氨酸为疏水性氨基酸, 天冬氨酸为酸性氨基酸, 其组成的独特的空间结构, 使得金枪鱼胰腺酶解多肽较单独的疏水性氨基酸和酸性氨基酸, 具有更强的抗氧化性能(杨兵等, 2011; 王宁丽等, 2016; 张晶等, 2016)。
4 结论金枪鱼胰腺水解多肽G-PQV-R、G-LPP-K和E-HE-R能增强氧化损伤的INS-1细胞的细胞活力, 促进这些细胞的增殖, 抑制细胞凋亡, 改善氧化损伤的INS-1细胞的胰岛素分泌, 且改善效果呈剂量效应增加。
马振华, 李霞. 2006. 中西太平洋金枪鱼资源. 水产科学, 25(10): 537-540 DOI:10.3969/j.issn.1003-1111.2006.10.013 |
王宁丽, 徐月敏, 刘毅, 等. 2016. 鱼皮低聚肽氨基酸组成及抗氧化活性研究. 食品研究与开发, 37(2): 31-35 DOI:10.3969/j.issn.1005-6521.2016.02.008 |
方磊, 李国明, 徐姗姗, 等. 2018. 牡蛎生物活性肽的研究进展. 食品安全质量检测学报, 9(7): 1548-1553 DOI:10.3969/j.issn.2095-0381.2018.07.015 |
延海莹, 刘盟梦, 乔乐克, 等. 2018. 扇贝裙边活性肽的制备及其降血糖活性研究. 食品工业, 39(3): 117-121 DOI:10.3969/j.issn.2095-7386.2018.03.022 |
刘广斌, 赵东欣, 马丽, 等. 2016. 计算机模拟HsRAD51蛋白与多肽BRC4分子对接. 化学研究, 27(1): 97-101 |
李晔, 陈蕾, 李振, 等. 2012. 浙江枝吻纽虫(Dendrorhynchus zhejiangensis)凝溶胶蛋白基因的原核表达产物抗肿瘤活性的研究. 海洋与湖沼, 43(4): 756-760 |
杨兵, 夏先林, 吴文旋. 2011. 不同水平的氨基酸对小香鸡免疫性能与抗氧化性能的影响. 江西农业学报, 23(8): 158-160, 171 DOI:10.3969/j.issn.1001-8581.2011.08.053 |
张晶, 张怡一, 徐斐然, 等. 2016. 菜籽多肽体外和细胞内抗氧化性评价及氨基酸分析. 食品科学, 37(13): 36-41 DOI:10.7506/spkx1002-6630-201613007 |
郑书国, 赵梦秋, 吴元洁, 等. 2015. 丹蛭降糖胶囊对波动高糖诱导的INS-1细胞凋亡和胰岛素分泌的影响. 中成药, 37(4): 722-727 DOI:10.3969/j.issn.1001-1528.2015.04.007 |
郑春松, 叶蕻芝, 许惠凤, 等. 2012. 分子对接法预测独活寄生汤对TNF-α和IL-1β作用的活性成分. 福建中医药大学学报, 22(4): 28-30 DOI:10.3969/j.issn.1004-5627.2012.04.009 |
段爱霞, 陈晶, 刘宏德, 等. 2009. 分子对接方法的应用与发展. 分析科学学报, 25(4): 473-477 |
董丽莎, 李妍妍, 张红燕, 等. 2018. 黑线鳕鱼皮胶原蛋白胰蛋白酶酶解多肽对UVB诱导HaCaT光损伤的抑制作用. 食品科学, 39(10): 185-192 DOI:10.7506/spkx1002-6630-201810029 |
童茜茜, 徐嘉杰, 王峰, 等. 2016. 小球藻精油对人结肠癌细胞增殖和凋亡的作用. 中国食品学报, 16(5): 25-31 |
蔡江佳, 李晔, 张云云, 等. 2015. 鱿鱼皮胶原蛋白对H2O2诱导MC3T3-E1损伤的修复作用. 中国食品学报, 15(1): 6-12 |
Chen S J, Ren J L, 2014. Identification of a potential anticancer target of danshensu by inverse docking. Asian Pacific Journal of Cancer Prevention, 15(1): 111-116 DOI:10.7314/APJCP.2014.15.1.111 |
Grienke U, Kaserer T, Pfluger F et al, 2015. Accessing biological actions of Ganoderma secondary metabolites by in silico profiling. Phytochemistry, 114: 114-124 DOI:10.1016/j.phytochem.2014.10.010 |
Han J J, Tang S S, Li Y Y et al, 2018. In silico analysis and in vivo tests of the tuna dark muscle hydrolysate anti-oxidation effect. RSC Advances, 8(25): 14109-14119 DOI:10.1039/C8RA00889B |
Itoh K, Wakabayashi N, Katoh Y et al, 2003. Keap1 regulates both cytoplasmic-nuclear shuttling and degradation of Nrf2 in response to electrophiles. Genes to Cells, 8(4): 379-391 DOI:10.1046/j.1365-2443.2003.00640.x |
Je J Y, Lee K H, Lee M H et al, 2009. Antioxidant and antihypertensive protein hydrolysates produced from tuna liver by enzymatic hydrolysis. Food Research International, 42(9): 1266-1272 DOI:10.1016/j.foodres.2009.06.013 |
Rubiolo J A, Mithieux G, Vega F V, 2008. Resveratrol protects primary rat hepatocytes against oxidative stress damage:activation of the Nrf2 transcription factor and augmented activities of antioxidant enzymes. European Journal of Pharmacology, 591(1-3): 66-72 DOI:10.1016/j.ejphar.2008.06.067 |
Ryoo Y W, Suh S I, Mun K C et al, 2001. The effects of the melatonin on ultraviolet-B irradiated cultured dermal fibroblasts. Journal of Dermatological Science, 27(3): 162-169 DOI:10.1016/S0923-1811(01)00133-5 |
Stewart D, Killeen E, Naquin R et al, 2003. Degradation of transcription factor Nrf2 via the ubiquitin-proteasome pathway and stabilization by cadmium. Journal of Biological Chemistry, 278(4): 2396-2402 DOI:10.1074/jbc.M209195200 |
Zhang J H, Zhang H, Wang L et al, 2010. Isolation and identification of antioxidative peptides from rice endosperm protein enzymatic hydrolysate by consecutive chromatography and MALDI-TOF/TOF MS/MS. Food Chemistry, 119(1): 226-234 DOI:10.1016/j.foodchem.2009.06.015 |
 2019, Vol. 50
2019, Vol. 50


