
中国海洋湖沼学会主办。
文章信息
- 孙潇雯, 赵海龙, 赵丽丽, 徐莹, 汪东风. 2019.
- SUN Xiao-Wen, ZHAO Hai-Long, ZHAO Li-Li, XU Ying, WANG Dong-Feng. 2019.
- 岩藻黄素纳米复合物的制备及抗氧化、抗肿瘤活性研究
- PREPARATION OF FUCOXANTHIN NANOCOMPLEXS AND THEIR ANTIOXIDANT AND ANTITUMOR ACTIVITY
- 海洋与湖沼, 50(6): 1233-1240
- Oceanologia et Limnologia Sinica, 50(6): 1233-1240.
- http://dx.doi.org/10.11693/hyhz20190500088
文章历史
-
收稿日期:2019-05-08
收修改稿日期:2019-05-20
2. 中国海洋大学 船舶中心 青岛 266003;
3. 青岛明月海藻集团有限公司 海藻活性物质国家重点实验室 青岛 266400
2. Research Vessel Center, Ocean University of China, Qingdao 266003, China;
3. State Key Laboratory of Bioactive Seaweed Substances, Qingdao Brightmoon Seaweed Group Co Ltd, Qingdao 266400, China
岩藻黄素(fucoxanthin, 图 1)是自然界中含量最丰富的类胡萝卜素, 主要分布在裙带菜、昆布、羊栖菜等褐藻, 以及三角褐指藻、金色奥杜藻、新月筒柱藻等微藻中, 约占自然界中类胡萝卜素总量的10% (Zhu et al, 2016)。研究表明, 岩藻黄素具有抗癌、减肥、抗炎和治疗糖尿病等活性(汪曙晖等, 2010; Peng et al, 2011; Sathasivam et al, 2018), 对人类健康具有重要意义, 具备开发成功能食品或者膳食补充剂的潜能。
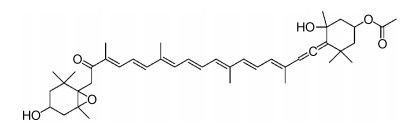 |
| 图 1 岩藻黄素结构 Fig. 1 The structure of fucoxanthin |
岩藻黄素市场前景十分广阔, 但却因其高度不饱和结构, 存在水溶性差、环境敏感性强等缺陷(Muthuirulappan et al, 2013; Zhao et al, 2014; Zhu et al, 2016), 这限制了它在食品工业中的应用范围。可以通过设计和构建一种保护性运载体系以增加其在水基质中的溶解度和稳定性, 克服应用限制。目前, 基于岩藻黄素稳态化技术构建的岩藻黄素运载体系非常少, 其中以脂质型载体和表面活性剂型载体为主, 如固体脂质纳米颗粒、微乳、纳米乳等。Dai等(2014)利用以中链甘油三酯为油相, 以吐温80和PEG400为表面活性剂, 制备了负载岩藻黄素的O/W微乳, 储存4周后仍保留约95%的岩藻黄素。徐丽青等(2014)以吐温80为乳化剂, 采用高压微射流制备岩藻黄素纳米乳, 显著增加了岩藻黄素在酸性条件下的稳定性。Koo等(2016)通过电喷雾系统构建了岩藻黄素-壳聚糖-酪蛋白纳米颗粒, 有效提高了岩藻黄素在水中的溶解度和稳定性。在前期研究中, 我们以吐温80为乳化剂, 以乳清分离蛋白或阿拉伯树胶为主要材料, 采用喷雾干燥技术制备了单一壁材的岩藻黄素载体, 有效提高了其贮藏、热稳定性和耐模拟胃酸特性(Sun et al, 2018)。然而在构建这些载体时, 由于大量使用表面活性剂, 带来极大的安全隐患; 而引入高能设备可以降低表面活性剂的使用量, 却增加了生产成本。因此, 安全有效的运载体系亟需进行研发。
在前期研究的基础上, 本研究期望利用简单、环保的复凝聚法, 以乳清分离蛋白和阿拉伯树胶为基础高分子材料, 构建岩藻黄素纳米复合物载体, 并评价纳米包埋对岩藻黄素水溶性和生物活性的影响。本文研究结果对促进岩藻黄素功能食品的研发具有重要意义。
1 材料与方法 1.1 实验材料干制裙带菜(Undaria pinnatifida)由山东佳宜水产食品有限公司提供。乳清分离蛋白(whey protein isolated, WPI)购于美国Hilmar Ingredients公司。阿拉伯胶(gum Arabic, GA)购于北京索莱宝生物科技公司。DMEM培养基、胎牛血清(fetal bovine serum, FBS)均购于以色列BI公司。四唑盐(MTT)、二甲基亚砜(DMSO)购于北京白鲨易科技有限公司。
1.2 岩藻黄素的制备将干燥的裙带菜用中药粉碎机粉碎2—3min, 粉末粒度在50—300目之间。利用本课题组建立的提取纯化方法制备高纯度岩藻黄素(汪东风等, 2017): 40℃水浴、75%乙醇浸提、AB-8大孔树脂纯化等流程制备天然岩藻黄素。通过HPLC检测岩藻黄素浓度, 测定条件如下:检测器: DAD; 色谱柱: ZORBAX Eclipse XDB-C18 column (4.6mm×250mm, 5μm); 柱温: 25℃; 检测波长: 450nm; 流速: 0.8mL/min; 流动相A:乙腈/水(80/20, v/v); 流动相B: MTBE。流动相梯度变化程序: 0—10min, 流动相B从0线性增加到10%, 然后恒定10min, 最后在5min内返回至初始条件。采用外标法分析所制备岩藻黄素的浓度。
1.3 岩藻黄素纳米复合物的制备分别制备10mg/mL的WPI、GA储备液。用0.1mol/L NaOH溶液调节WPI储备液pH至8.0, 磁力搅拌2h后, 在4℃环境中静置过夜, 以使WPI充分水合(Hébrard et al, 2013)。根据上一步检测的浓度, 用乙醇将岩藻黄素稀释至1mg/mL。取100mL WPI(1%, w/v)溶液, 加入2mL岩藻黄素溶液, 室温低速搅拌30min。然后边搅拌边滴加50mL GA(1%, w/v)溶液, 用1mol/L HCl溶液调节pH至4.08, 继续搅拌2h以完成反应。将制备的岩藻黄素纳米复合物冻干后, 密封避光保存备用。
1.4 岩藻黄素纳米复合物表征 1.4.1 透射电镜观察通过透射电镜(TEM)观察颗粒的形态和大小。吸取5μL新制备的溶液滴在铜网的碳支撑膜上, 滴加邻钨酸染色5min, 用滤纸吸去多余溶液。室温干燥后, 用TEM观察拍照, 并通过Image J测量纳米颗粒大小。
1.4.2 粒度分析在25℃的条件下, 用马尔文Nano-ZS90粒径分析仪测定纳米复合物悬液的粒径和多分散指数PDI值。
1.4.3 包封率测定(Wang et al, 2014)称取0.5g岩藻黄素纳米复合物, 用正己烷萃取颗粒表面的岩藻黄素; 另称取0.5g岩藻黄素纳米复合物, 加入适量等体积混合的正己烷/丙酮混合液, 涡旋振荡, 4000g离心5min, 取上层有机相, 重复操作两次至水相无色, 合并有机相即为纳米复合物中总的岩藻黄素。经氮吹除去有机相, 加入乙腈复溶, 过0.22μm滤膜后用HPLC检测岩藻黄素浓度, 测定条件参见1.2。按公式(1)计算纳米复合物中岩藻黄素的包埋率EE:
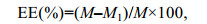 (1)
(1)其中, M和M1分别表示纳米复合物中岩藻黄素的总质量和纳米复合物表面未被包埋的岩藻黄素的质量。
1.4.4 红外光谱鉴定分别取单一岩藻黄素样品和岩藻黄素纳米复合物与KBr粉末研磨混合, 并压制成透明小圆片, 使用傅里叶变换红外光谱仪(FTIR), 扫描400—4000/cm范围内的光谱图。
1.5 ABTS自由基(ABTS+)清除活性测定参考Li等(2019)报道的ABTS+脱色试验测定岩藻黄素和岩藻黄素纳米复合物的抗氧化作用。取等体积7.4mmol/L ABTS溶液与2.6mmol/L过硫酸钾溶液混合, 室温避光反应16h, 然后用0.1mmol/L PBS缓冲液进行稀释, 使之在734nm处吸光值为0.70±0.02。分别用乙醇和0.1mmol/L PBS缓冲液(pH 7.4)溶解单一岩藻黄素和纳米复合物, 调整岩藻黄素至合适浓度。取40μL样品与4mL ABTS+工作液混匀, 避光反应7min后, 在734nm处测其吸光值。用0.1mmol/L PBS缓冲液作为对照组。按照公式(2)计算样品的ABTS+清除率:
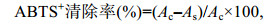 (2)
(2)其中, Ac和As分别是对照组和样品组的吸光值。
然后将岩藻黄素及其纳米复合物进行不同处理(热处理: 90℃水浴加热处理1h;酸处理:将分散体系pH调至2, 处理2h;紫外辐射处理:紫外灯辐照处理3h), 测定其清除ABTS+的能力, 评估其抗氧化稳定性。
1.6 抑制肿瘤细胞增殖实验将处于对数生长期的HT29细胞接种于96孔板内, 每孔4×104个细胞。在37℃, 5% CO2环境中孵育。岩藻黄素溶于DMSO中(DMSO在溶液中的最终浓度小于0.1%, v/v), 岩藻黄素纳米复合物溶于PBS缓冲液制备受试液母液。细胞孵育24h后, 分别加入100μL无血清DMEM溶解的不同浓度(0、3.30、6.59、13.18、19.77、26.36、32.5μg/mL)的单一岩藻黄素或其纳米复合物, 每组6个复孔。继续培养24h后, 用37℃预热的PBS缓冲液清洗细胞, 然后每孔加入100μL无血清DMEM培养基和10μL 5mg/mL的MTT-PBS溶液。孵育4h, 弃去溶液, 每孔加入50μL DMSO, 振荡10min促溶。于570nm波长下测定吸光值, 计算细胞活力[公式(3)]:
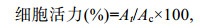 (3)
(3)其中, Ac和At分别是对照组和实验组的吸光值。
1.7 统计分析实验结果表示为x±SD。数据统计分析采用SPSS单因素方差分析(One-Way ANOVA), P < 0.05表示差异显著, 使用Origin 8.0.6.1统计作图。
2 结果 2.1 岩藻黄素纳米复合物的表征本研究通过透射电镜表征了岩藻黄素纳米复合物的微观结构特征, 如图 2所示。单一岩藻黄素在水中形成不规则的聚集体(图 2a), 粒径超过200nm。而岩藻黄素纳米复合物呈规则的球形(图 2b), 平均粒径为44nm。
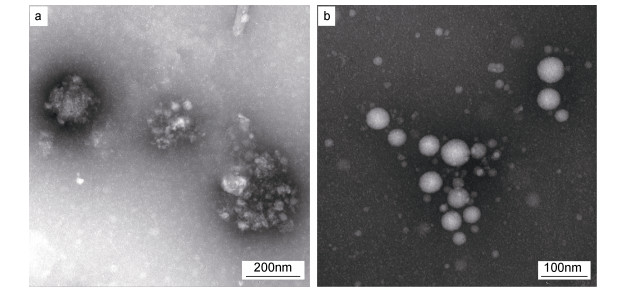 |
| 图 2 游离岩藻黄素(a)和岩藻黄素纳米复合物(b)透射电镜图片 Fig. 2 TEM images of fucoxanhtin (a) and fucoxanthin nanocomplex (b) |
通过动态光散射对单一岩藻黄素和岩藻黄素纳米复合物进行粒度分析, 结果如图 3所示。由电镜图可知, 游离岩藻黄素分散在水中形成聚集体。聚集体水合动力学半径为316.9nm (图 3a); 包埋处理组粒径下降明显(图 3b), 其水合半径为140.60nm±2.57nm。采用PDI法对纳米复合物的粒径分布情况进行分析, 数值越小表示分布越均匀。如图 3c所示, 岩藻黄素水分散体系的PDI为0.45±0.03。然而, 负载岩藻黄素的纳米复合物的PDI低于0.3, 表明纳米颗粒尺寸分布均匀, 且分布范围较窄。
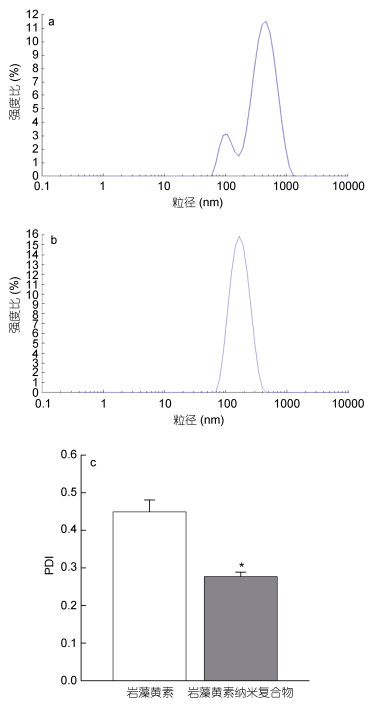 |
| 图 3 游离岩藻黄素(a)和岩藻黄素纳米复合物(b)粒度分布图、多分散指数PDI (c) Fig. 3 The particle size distribution of fucoxanthin (a), fucoxanthin nanocomplexes (b) and PDI (c) |
纯化的岩藻黄素制品色谱图如图 4所示, 色谱图中有4个峰, 主峰Ⅰ为全反式岩藻黄素, 保留时间为12.57min; 峰Ⅱ—Ⅳ为其同分异构体。经HPLC测定和计算得, 0.5g岩藻黄素纳米复合物中岩藻黄素的总量为6.25mg, 同质量的复合物表面的岩藻黄素质量为0.43mg。代入公式(1)计算后得出, 制备的岩藻黄素纳米复合物的包埋率为93.12%。
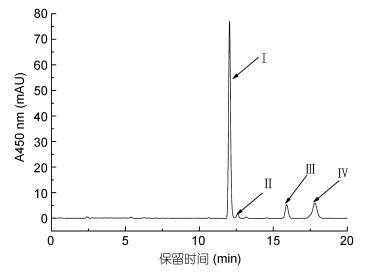 |
| 图 4 纯化岩藻黄素的液相色谱图 Fig. 4 HPLC chromatogram of purified fucoxanthin |
用红外光谱法研究了岩藻黄素与高分子材料的化学结合状况, 结果见图 5。对于单一岩藻黄素, 红外吸收光谱在1928/cm处有一个特征峰, 这是岩藻黄素独特官能团联烯键(C=C=C)的特征峰; 在2858/cm处的峰代表-C-H的伸缩振动, 1363/cm处的峰代表-C-H的弯曲振动, 3011/cm处的峰代表=C-H的弯曲振动, 均是类胡萝卜素的特征峰; 在1732/cm (-C=O拉伸), 1032/cm (-C-O拉伸), 是酯类的特征峰; 在1657/cm表示酮类物质(C=O)的存在。此外, 峰值968/cm为C、C共轭体系中C-H键面外弯曲振动的吸收峰, 是反式取代乙烯的特征峰。而在WPI-Fx-GA纳米复合物中, 岩藻黄素在3011、2858、1928、1732、1363以及1032/cm等特征峰均未出现。
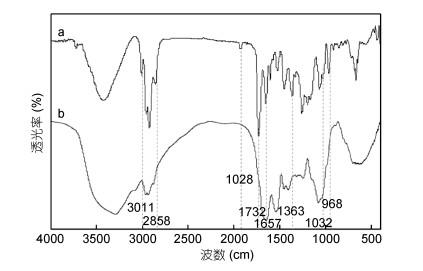 |
| 图 5 单一岩藻黄素(a)和岩藻黄素纳米复合物(b)的红外光谱图 Fig. 5 FTIR scanning spectra of fucoxanthin (a) and the fucoxanthin nanocomplex (b) |
为评价纯化岩藻黄素及其纳米复合物的抗氧化能力, 进行了ABTS+清除还原能力的测定。如图 6所示, 随着岩藻黄素浓度从15μg/mL增加到60μg/mL, 岩藻黄素的还原能力缓慢增加, 60μg/mL游离岩藻黄素的ABTS+清除能力为38.19%。而岩藻黄素纳米复合物表现出更高的抗氧化活性, 同样浓度为60μg/mL的纳米复合物清除了55.11%的ABTS+。对照组中WPI和WPI-GA, 均对ABTS+表现出一定的清除能力。因此, 我们可以得出结论, 经WPI和GA包埋处理显著提高了岩藻黄素清除ABTS+的能力, 明显高于单一的岩藻黄素。
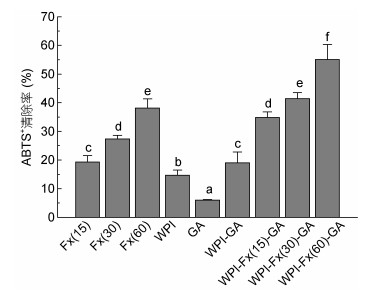 |
| 图 6 岩藻黄素和纳米复合物对ABTS+的清除能力 Fig. 6 ABTS+ scavenging activity of fucoxanthin and nanocomplexes 注: WPI浓度为16mg/mL, GA浓度为8mg/mL, 与纳米复合物中浓度一致; 不同的字母代表有显著性的差异P < 0.05。 |
考虑到岩藻黄素在不利的环境条件下很容易发生降解, 如紫外线照射, 高温和低pH等。因此, 采用ABTS+脱色试验评价包埋处理对岩藻黄素自由基清除能力的影响。结果表明, 经酸处理、加热处理和紫外光处理后, 单一岩藻黄素对ABTS+的清除能力明显降低(IC50=130.85—158.24μg/mL)。纳米微胶囊化可以稳定岩藻黄素的抗氧化活性, 酸处理和加热处理对纳米复合物清除自由基的能力有着类似影响, 均显著增加了IC50。紫外辐射处理结果比较出乎意料, 纳米复合物的ABTS+清除活性反而升高(表 1)。
| 样品 | ABTS+半数清除率IC50(μg/mL) | |||
| 对照组 | 酸处理 | 加热处理 | 紫外辐射 | |
| 单一岩藻黄素 | 79.38 ± 0.47bA | 158.24 ± 1.28bD | 146.72 ± 0.77bC | 130.85 ± 0.91bB |
| 岩藻黄素纳米复合物 | 52.49 ± 0.35aB | 75.53 ± 0.44aD | 61.59 ± 0.40aC | 29.65 ± 0.22aA |
| 注:数据表示为平均值±标准差(n=3)。A—D在同一行字母中, a、b在同一列字母中, 相同表示差异不显著(P > 0.05), 不同则表示差异显著(P < 0.05)。 | ||||
研究表明, 与其他类胡萝卜素相比, 结肠癌细胞对岩藻黄素作用更为敏感(Hosokawa et al, 2004)。本研究采用MTT法研究了单一岩藻黄素和岩藻黄素纳米复合物对结肠癌细胞HT29存活率的影响, 同时以未处理的癌细胞作为对照。如图 7所示, 不同浓度的岩藻黄素对细胞存活率的影响存在明显差异, 当岩藻黄素浓度增加到32.95μg/mL, 癌细胞存活率降至2.17%。而经岩藻黄素纳米复合物处理后, HT29细胞增殖率受到明显抑制, 并且呈剂量依赖性。但是在与HT29细胞作用相同时间下, 纳米包埋过程降低了其对细胞的毒性, 当岩藻黄素浓度为32.95μg/mL时, 癌细胞活力仍为63.72%。
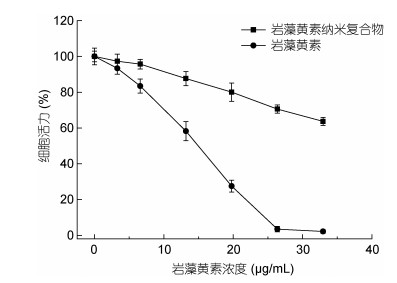 |
| 图 7 岩藻黄素在经纳米包埋前后对HT29细胞存活率的影响 Fig. 7 Effect of fucoxanthin and fucoxanthin nanocomplexs on HT29 cell viability |
岩藻黄素是一种脂溶性色素, 由于其较强的疏水性, 在细胞水环境中、加工过程中或者食品体系中受分子间作用力驱动, 自发组装形成聚集体(Simonyi et al, 2003; Gómez-Loredo et al, 2014), 因此表现出极低的水溶性。通过透射电镜观察到, 当将岩藻黄素乙醇溶液滴加到去离子水中时, 形成了形状不规则的聚集体; 而岩藻黄素与WPI、GA结合后, 形成光滑的球状颗粒。以上现象说明WPI和GA对岩藻黄素形成了比较好的包埋效果。
岩藻黄素与WPI、GA结合后, 形成的颗粒粒径小于200nm, 因此可认为形成的复合物属于纳米复合物(Steichen et al, 2013)。并且溶液体系的PDI低于0.3, 表明岩藻黄素纳米复合物符合单分散标准, 粒度分布单一(Sponton et al, 2015)。通过动态光散射分析单一岩藻黄素和复合物的粒径, 数据略大于透射电镜下观察到的粒径大小, 主要是由于采用该方法测量的是水合动力学粒径, 而透射电镜测量的是干燥状态的粒径。
3.2 岩藻黄素纳米复合物结构分析红外光谱学可用于高效表征复合物结构中生物活性基团的存在或新键的形成。与单一岩藻黄素相比, 岩藻黄素纳米复合物的光谱中多个岩藻黄素的特征吸收峰消失, 如1928/cm (联烯键伸缩振动峰)、1032和1732/cm附近的特征峰(酯键伸缩振动峰), 表明岩藻黄素被包封在纳米颗粒内部, 并通过与WPI、GA基团之间发生相互作用, 有效遮蔽了联烯键及六元环上的乙酰基等活性基团(Koo et al, 2016; Li et al, 2018; Sun et al, 2018)。岩藻黄素经纳米包埋后, 实现了对活性基团的有效保护, 有利于提高其贮藏稳定性和对光、热等不利条件的耐受能力, 使得岩藻黄素在食品体系中的应用范围大大增加。
3.3 岩藻黄素纳米复合物抗氧化活性分析在本实验条件下, 单一岩藻黄素对ABTS+的清除能力较低。研究认为岩藻黄素中共轭碳链和联烯键的存在是赋予其抗氧化活性的主要因素, 然而, 岩藻黄素分子中的乙酰基可能导致其ABTS+清除活性相对较低(Sachindra et al, 2007)。纳米包埋的岩藻黄素反而表现出更高的抗氧化活性, 结合红外光谱结果知乙酰基被遮蔽可能是提高纳米复合物清除ABTS+的原因之一。此外, 乳清蛋白中的半胱氨酸、色氨酸和蛋氨酸等氨基酸残基具有较强的抗氧化活性(Elias et al, 2005; Xu et al, 2013)。而本研究所用的纳米复合物中乳清蛋白对ABTS+表现出较高的清除能力, 这一结果与Ma等人研究相似(Ma et al, 2018)。因此, 我们得出结论, 乳清蛋白在提高ABTS+清除能力中起着关键作用。
纳米包埋可以稳定岩藻黄素的抗氧化活性, 减少酸处理和热处理对纳米复合物清除自由基能力的不利影响。然而, 经紫外光照射处理3h后, 纳米复合物对ABTS+清除率增加了38%。Fu等(2018)发现WPI经紫外光照射3h后, 其清除ABTS+的能力增加至未处理WPI的3.4倍。因此我们推测, WPI受到较高频率的紫外线辐射会发生电离和化学键断裂(Kuan et al, 2013), 导致更多的还原性氨基酸残基暴露, 提高蛋白质的抗氧化活性, 同时可以更好地防止岩藻黄素的降解, 因此提高了纳米复合物的抗氧化活性。
3.4 岩藻黄素纳米复合物的细胞毒性分析纳米包埋前后的岩藻黄素的细胞毒性效应通过HT29细胞进行评价, 结果发现单一岩藻黄素及其纳米复合物均显著降低了HT29细胞的生存活力, 且呈剂量依赖性。经单一岩藻黄素或岩藻黄素纳米复合物处理组中, 随着岩藻黄素浓度增加, 二者均明显表现出抑制HT29细胞增殖的作用。岩藻黄素即使被包埋到纳米复合物中, 仍能保持其抗癌潜能, 却与单一岩藻黄素抗HT29细胞增殖活性效果存在显著差异。这一显著差异可能是由于纳米复合物释放岩藻黄素是一个缓释过程, 与对照组相比, 对癌细胞的作用较慢所致, 这方面需要进一步的研究(Rahaiee et al, 2017)。本研究结果表明, 即使将岩藻黄素包埋在WPI-GA纳米颗粒中, 也能够对癌细胞的增殖产生影响。
4 结论本研究采用复凝聚法成功制备了岩藻黄素纳米复合物, 实验结果表明, 该方法制备的纳米颗粒增加了岩藻黄素在水中的溶解性, 而且可以有效保护岩藻黄素的抗氧化稳定性, 并且对岩藻黄素具有缓释作用。该流程为岩藻黄素相关产品的开发提供了技术支持, 为传统海藻加工产业提供新的经济增长点, 对于我国蓝色产业发展具有十分重要的意义。
汪东风, 陈晓利, 张莉等, 2017-03-08.高纯度岩藻黄素制备技术: 中国, CN106478553A
|
汪曙晖, 薛长湖. 2010. 岩藻黄素的结构、性质和功能. 食品工业科技, 31(6): 408-410, 407 |
徐丽青, 朱雪梅, 熊华. 2014. 高压微射流制备岩藻黄素纳米乳液的影响因素及其理化分析. 食品科学, 35(24): 45-50 DOI:10.7506/spkx1002-6630-201424009 |
Dai J, Kim S M, Shin I S et al, 2014. Preparation and stability of fucoxanthin-loaded microemulsions. Journal of Industrial and Engineering Chemistry, 20(4): 2103-2110 DOI:10.1016/j.jiec.2013.09.039 |
Elias R J, McClements D J, Decker E A, 2005. Antioxidant activity of cysteine, tryptophan, and methionine residues in continuous phase β-lactoglobulin in oil-in-water emulsions. Journal of Agricultural and Food Chemistry, 53(26): 10248-10253 DOI:10.1021/jf0521698 |
Fu X J, Wusigale, Cheng H et al, 2018. Mechanism for improved protection of whey protein isolate against the photodecomposition of folic acid. Food Hydrocolloids, 79: 439-449 DOI:10.1016/j.foodhyd.2018.01.020 |
Gómez-Loredo A, Benavides J, Rito-Palomares M, 2014. Partition behavior of fucoxanthin in ethanol-potassium phosphate two-phase systems. Journal of Chemical Technology and Biotechnology, 89(11): 1637-1645 DOI:10.1002/jctb.4514 |
Hébrard G, Hoffart V, Cardot J M et al, 2013. Development and characterization of coated-microparticles based on whey protein/alginate using the Encapsulator device. Drug Development and Industrial Pharmacy, 39(1): 128-137 DOI:10.3109/03639045.2012.660950 |
Hosokawa M, Kudo M, Maeda H et al, 2004. Fucoxanthin induces apoptosis and enhances the antiproliferative effect of the PPARγ ligand, troglitazone, on colon cancer cells. Biochimica et Biophysica Acta (BBA)-General Subjects, 1675(1-3): 113-119 DOI:10.1016/j.bbagen.2004.08.012 |
Koo S Y, Mok I K, Pan C H et al, 2016. Preparation of fucoxanthin-loaded nanoparticles composed of casein and chitosan with improved fucoxanthin bioavailability. Journal of Agricultural and Food Chemistry, 64(49): 9428-9435 DOI:10.1021/acs.jafc.6b04376 |
Kuan Y H, Bhat R, Patras A et al, 2013. Radiation processing of food proteins-a review on the recent developments. Trends in Food Science & Technology, 30(2): 105-120 |
Li H, Xu Y, Sun X et al, 2018. Stability, bioactivity, and bioaccessibility of fucoxanthin in zein-caseinate composite nanoparticles fabricated at neutral pH by antisolvent precipitation. Food Hydrocolloids, 84: 379-388 DOI:10.1016/j.foodhyd.2018.06.032 |
Li H, Wang D F, Liu C Z et al, 2019. Fabrication of stable zein nanoparticles coated with soluble soybean polysaccharide for encapsulation of quercetin. Food Hydrocolloids, 87: 342-351 DOI:10.1016/j.foodhyd.2018.08.002 |
Ma S, Wang C N, Guo M R, 2018. Changes in structure and antioxidant activity of β-lactoglobulin by ultrasound and enzymatic treatment. Ultrasonics Sonochemistry, 43: 227-236 DOI:10.1016/j.ultsonch.2018.01.017 |
Muthuirulappan S, Francis S P, 2013. Anti-cancer mechanism and possibility of nano-suspension formulation for a marine algae product fucoxanthin. Asian Pacific Journal of Cancer Prevention, 14(4): 2213-2216 DOI:10.7314/APJCP.2013.14.4.2213 |
Peng J, Yuan J P, Wu C F et al, 2011. Fucoxanthin, a marine carotenoid present in brown seaweeds and diatoms:metabolism and bioactivities relevant to human health. Marine Drugs, 9(10): 1806-1828 DOI:10.3390/md9101806 |
Rahaiee S, Hashemi M, Shojaosadati S A et al, 2017. Nanoparticles based on crocin loaded chitosan-alginate biopolymers:antioxidant activities, bioavailability and anticancer properties. International Journal of Biological Macromolecules, 99: 401-408 DOI:10.1016/j.ijbiomac.2017.02.095 |
Sachindra N M, Sato E, Maeda H et al, 2007. Radical scavenging and singlet oxygen quenching activity of marine carotenoid fucoxanthin and its metabolites. Journal of Agricultural and Food Chemistry, 55(21): 8516-8522 DOI:10.1021/jf071848a |
Sathasivam R, Ki J S, 2018. A review of the biological activities of microalgal carotenoids and their potential use in healthcare and cosmetic industries. Marine Drugs, 16(1): 26 DOI:10.3390/md16010026 |
Simonyi M, Bikádi Z, Zsila F et al, 2003. Supramolecular exciton chirality of carotenoid aggregates. Chirality, 15(8): 680-698 DOI:10.1002/chir.10282 |
Sponton O E, Perez A A, Carrara C R et al, 2015. Linoleic acid binding properties of ovalbumin nanoparticles. Colloids and Surfaces B:Biointerfaces, 128: 219-226 DOI:10.1016/j.colsurfb.2015.01.037 |
Steichen S D, Caldorera-Moore M, Peppas N A, 2013. A review of current nanoparticle and targeting moieties for the delivery of cancer therapeutics. European Journal of Pharmaceutical Sciences, 48(3): 416-427 DOI:10.1016/j.ejps.2012.12.006 |
Sun X W, Xu Y, Zhao L L et al, 2018. The stability and bioaccessibility of fucoxanthin in spray-dried microcapsules based on various biopolymers. RSC Advances, 8(61): 35139-35149 DOI:10.1039/C8RA05621H |
Wang B, Adhikari B, Barrow C J, 2014. Optimisation of the microencapsulation of tuna oil in gelatin-sodium hexametaphosphate using complex coacervation. Food Chemistry, 158: 358-365 DOI:10.1016/j.foodchem.2014.02.135 |
Xu D X, Wang X Y, Jiang J P et al, 2013. Influence of pH, EDTA, α-tocopherol, and WPI oxidation on the degradation of β-carotene in WPI-stabilized oil-in-water emulsions. LWT-Food Science and Technology, 54(1): 236-241 DOI:10.1016/j.lwt.2013.05.029 |
Zhao D, Kim S M, Pan C H et al, 2014. Effects of heating, aerial exposure and illumination on stability of fucoxanthin in canola oil. Food Chemistry, 145: 505-513 DOI:10.1016/j.foodchem.2013.08.045 |
Zhu J X, Sun X W, Chen X L et al, 2016. Chemical cleavage of fucoxanthin from Undaria pinnatifida and formation of apo-fucoxanthinones and apo-fucoxanthinals identified using LC-DAD-APCI-MS/MS. Food Chemistry, 211: 365-373 DOI:10.1016/j.foodchem.2016.05.064 |
 2019, Vol. 50
2019, Vol. 50


