中国海洋湖沼学会主办。
文章信息
- 韩郁烨, 郭萃, 段雪萍, 管旭冉, 姜勇, 邵红兵, 矫玉田, 汪岷. 2019.
- HAN Yu-Ye, GUO Cui, DUAN Xue-Ping, GUAN Xu-Ran, JIANG Yong, SHAO Hong-Bing, JIAO Yu-Tian, WANG Min. 2019.
- 北欧海微微型真核浮游生物的多样性和群落结构及其与环境因子的关系
- BIODIVERSITY AND COMMUNITY STRUCTURE OF PICOEUKARYOTES AND INTERACTION WITH ENVIRONMENTAL FACTORS IN THE NORDIC SEAS
- 海洋与湖沼, 50(6): 1263-1270
- Oceanologia et Limnologia Sinica, 50(6): 1263-1270.
- http://dx.doi.org/10.11693/hyhz20190400074
文章历史
-
收稿日期:2019-04-17
收修改稿日期:2019-05-25
2. 中国海洋大学海洋生物多样性与进化研究所 青岛 266003;
3. 中国海洋大学极地海洋过程与全球海洋变化重点实验室 青岛 266003
2. Institute of Evolution and Marine Biodiversity, Ocean University of China, Qingdao 266003, China;
3. Key Lab of Polar Oceanography and Global Ocean Change, Ocean University of China, Qingdao 266003, China
微微型真核浮游生物(picoeukaryotes)是指粒径介于0.2—3μm之间的单细胞真核生物, 广泛分布于各海域的真光层(Massana, 2011)。微微型真核浮游生物在海洋生态系统中是主要的初级生产者, 其异养活动也具有重要意义(Sherr et al, 2000; 白美娜等, 2019)。微微型真核浮游生物作为海洋微食物环的重要组成部分, 在海洋生态系统的能量流动和物质循环中发挥了重要作用(杨琳等, 2012)。21世纪初, 随着分子生物学的发展人们首次从基因水平上开展了微微型真核浮游生物分子多样性的研究(Moon-van der Staay et al, 2001)。目前, 高通量测序技术已普遍应用于世界各海域微微型真核浮游生物多样性的研究之中, 高纬度海域的微微型真核浮游生物相关研究也取得了一定的进展(De Vargas et al, 2015; Mahé et al, 2015; Wang et al, 2018)。有研究报道, 北冰洋海域中微微型真核浮游生物的多样性较高, 并且微单胞藻是该海域重要的生物类群, 在能量流动及物质循环中发挥了重要的作用(Lovejoy et al, 2007)。此外, 在北极海域中还发现了大量的浮游硅藻, 但其分布受温度和纬度的影响, 且不同海域分布差异较大(刘莹, 2013)。在白令海和楚科奇海中存在大量的异养鞭毛虫和纤毛虫, 都具有较高的摄食率, 是极地微食物环的重要组成部分(郭超颖等, 2011)。
北欧海(The Nordic Seas)连接着北冰洋和北大西洋, 位于格陵兰-苏格兰海岭以北, 弗拉姆海峡-斯匹次卑尔根-北挪威断面以南, 其面积约为2.5×106平方公里, 占世界海洋面积的0.75%。北欧海表层洋流最显著的特征是存在两支入流:来自大西洋沿挪威陆坡向北流动的挪威海大西洋暖流和来自北冰洋的沿弗拉姆海峽向南流动的东格陵兰寒流(邵秋丽, 2015)。北欧海的特殊地理位置及复杂的洋流分布决定了其是全球热盐环流的重要组成部分, 在北极乃至全球的气候系统中具有重要影响(史文奇等, 2017)。
在过去几十年中, 随着全球气温的升高, 北冰洋中海冰融化, 总冰量和海冰覆盖范围明显减少, 大量的极地水注入到北欧海, 直接影响了北欧海的水文物理过程(Hoff et al, 2016)。同样地, 这些环境变化会对北欧海的物种多样性、群落组成和代谢过程产生巨大的影响。目前对北欧海的研究多集中关注其水文特征及内部海洋物理过程(Sarnthein et al, 2018), 也有关于北欧海热液系统附近的微生物群落结构的研究(Olsen et al, 2015; Le Moine Bauer et al, 2018), 但是还未有微微型真核浮游生物的多样性和群落结构的报道。本文选取北欧海的一个典型断面, 利用扩增子高通量测序技术, 从环境样品的分子水平上研究该海域中微微型真核浮游生物的多样性和群落结构, 并结合环境因子(温度、盐度和营养盐浓度)来分析其相关性和群落分布规律。本研究对未来气候变化加剧的背景下深入了解北欧海微微型真核浮游生物的分布特征、环境响应和变化趋势具有重要意义。
1 材料与方法 1.1 研究区域与样品采集本研究于2017年6月选取北欧海5个站位进行采样(图 1)。使用安装在温盐深仪(CTD, Seabird 917)上的Niskin采水瓶采集表层海水, 每个站点取样2L。采集的水样依次经200μm孔径的筛绢和3μm孔径的Millipore聚碳酸酯滤膜预过滤后, 经0.2μm孔径的Millipore聚碳酸酯滤膜过滤。将过滤后的0.2μm滤膜放入含有2mL细胞裂解液的冻存管中保存(500mL: 100mmol/L Tris, 40mmol/L EDTA, 100mmol/L NaCl, 1% SDS)。最后经液氮速冻处理, 保存在-80℃冰箱中。
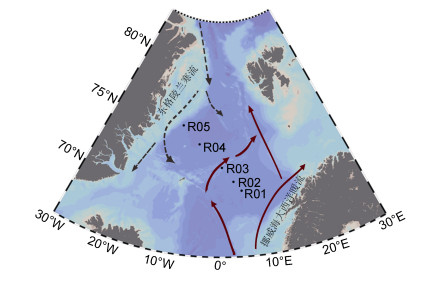 |
| 图 1 北欧海研究站位示意图 Fig. 1 Location of sampling stations in the Nordic Seas 注:黑色虚线代表来自北冰洋的东格陵兰寒流; 红色实线代表来自大西洋的挪威海大西洋暖流 |
水文和环境参数由船载CTD测得, 营养盐数据由中国海洋大学梁生康课题组提供, 测定参考全球海-气通量合作研究计划(Joint Global Ocean Flux Study, JGOFS)国际通用标准进行(Knap et al, 1996)。
1.2 样品分析 1.2.1 DNA提取使用酚氯仿法提取样品中的总DNA, 提取方法参照Stoeck等(2003), DNA提取完成后用荧光定量仪(Qubit 3.0)检测其浓度和纯度, 质量合格的DNA置于-80℃超低温冰箱保存备用。
1.2.2 PCR扩增选择18S rRNA基因上的V4区进行扩增, 使用带Barcode的特异引物528F-706R(5′- GCGGTAATTCCAGCTCCAA-3′, 5′-AATCCRAGAATT TCACCTCT-3′) (Cheung et al, 2008)。扩增使用ABI GeneAmp®9700型PCR仪, 扩增方案为:总体系共30μL, 包含15μL PCR混合液(New England Biolabs), 2μL H2O, 3μL的双向引物(2μmol/L), 10ng模板DNA。PCR扩增条件为: 98℃预变性1min, 98℃变性10s, 50℃退火30s, 72℃延伸30s, 循环30次, 最后72℃再延伸5min。对每个样品进行三次重复实验, 以减小PCR反应过程中产生的偏差。
1.2.3 高通量测序PCR的产物用2%琼脂糖凝胶电泳检测, 并且用凝胶回收试剂盒(AXYGEN公司)切胶回收指定产物。检测合格产物纯化后送至诺禾致源科技股份有限公司利用Ion S5TMXL平台进行高通量测序, 测序方式为单端测序, 平均读取长度为306bp。
1.3 数据处理 1.3.1 序列优化及OTU聚类使用Cutadapt软件对测序得到的原始序列进行过滤, 去除Barcode、引物序列和嵌合体序列后, 过滤掉长度短于200bp、序列平均质量低于20的序列, 得到有效序列。使用Usearch (version7.1 http://drive5.com/uparse/)进行序列分析, 相似度在97%以上的序列被划分为同一个操作分类单元(operational taxonomic units, OTU), 使用Silva数据库(http://www.arb-silva.de/)对序列进行注释, 并进行生物信息学分析。
1.3.2 Alpha多样性根据各样品测序的结果, 使用R(v3.5.2)中“Vegan”程序包绘制稀释曲线并计算多样性指数。
1.3.3 群落组成与主导类群分析将OTU相对丰度数据进行标准化处理后, 通过PRIMER 6.0, 基于Bray-Curtis距离矩阵, 进行CLUSTER聚类, 并通过PERMANOVA检验来检测各分组之间是否存在显著差异。
1.3.4 生物群落、优势种和环境因子之间相互作用关系分析运用Canoco 5.0对微微型真核浮游生物的相对丰度进行典范对应分析(canonical correspondence analysis, CCA), 其中对环境因子进行log(x+1)转化, 避免极值的影响, 并采用蒙特卡洛排序检验(999次)对排序结果进行统计学检验。用SPSS 22.0进行皮尔森(Pearson)相关性分析, 计算优势类群与环境变量之间的相关性。
2 结果 2.1 水文条件2017年北欧海各站位表层海水温度的变化范围为-1.03—7.98℃, 整体上呈现出明显的由东南向西北逐渐减少的趋势。其中, 最低温度出现在R05站, 是研究海域中唯一海水水温低于0℃的站位, 处于研究海域的西北部。表层海水的盐度变化范围为33.41—35.30, 平均值为34.70。酸碱度的变化范围为7.98—8.28, 平均值为8.12。溶解氧的变化范围为9.61—12.54mg/L, 平均值为11.05mg/L。营养盐分布方面, 研究海域各站位的铵盐变化范围为0.02—1.21μmol/L, 平均值为0.41μmol/L, 最低值出现在R05站。硝酸盐的变化范围为0.06—9.23μmol/L, 平均值为4.74μmol/L。亚硝酸盐的变化范围为0.03—0.18μmol/L, 平均值为0.09μmol/L。磷酸盐的变化范围为0.13—0.54μmol/L, 平均值为0.31μmol/L。硅酸盐的变化范围为5.29—10.88μmol/L, 平均值为8.54μmol/L。其中, 硝酸盐、亚硝酸盐和磷酸盐的最大值都出现在R02站。溶解无机氮的变化范围为0.05—9.52μmol/L, 其主要存在形式为硝酸盐。溶解有机碳的变化范围为31.99—78.95μmol/L, 平均值为63.66μmol/L, 最小值出现在R02站(表 1)。
| 站位 | 温度(℃) | 盐度 | 酸碱度 | 溶解氧(mg/L) | 铵盐 | 硝酸盐 | 亚硝酸盐 | 磷酸盐 | 硅酸盐 | 溶解无 机氮 | 溶解有 机氧 |
| R01 | 7.98 | 35.29 | 7.98 | 9.61 | 0.31 | 4.94 | 0.10 | 0.38 | 8.16 | 5.35 | 69.03 |
| R02 | 6.16 | 35.30 | 8.01 | 9.98 | 0.11 | 9.23 | 0.18 | 0.54 | 9.81 | 9.52 | 31.99 |
| R03 | |||||||||||
| R04 | 1.44 | 34.78 | 8.19 | 12.08 | 1.21 | 0.06 | 0.05 | 0.17 | 10.88 | 1.32 | 78.95 |
| R05 | –1.03 | 33.41 | 8.28 | 12.54 | 0.02 | 0.03 | 0.13 | 5.29 | 0.05 | 74.69 |
因此, 依据各站位的水文特征, 可将其分为两组:呈现出相对较高的温度、盐度和营养盐浓度的受暖流影响的高水温站位(R01、R02、R03)和水文环境与之相反的受寒流影响的低水温站位(R04、R05)。
2.2 Alpha多样性稀释曲线分析表明, 随着样本测序量的增加, 各样本的稀释曲线基本趋向平缓, 测序覆盖率(coverage)达99.7%以上, 说明测序结果合理, 能够真实地反映出海水中微微型真核浮游生物群落(图 2)。样品中OTU的数量范围为380—571, 其中R01站中的OTU数量最高, R04站的OTU数量最低。Chao 1指数和Ace指数呈现出相似的趋势, R01站出现最大值, R05站出现最小值。Shannon指数反映出R01站的多样性最低, R02站的多样性最高(表 2)。
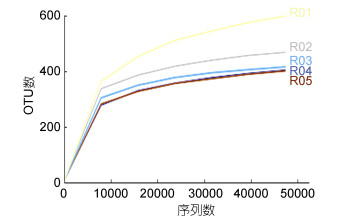 |
| 图 2 97%相似水平下样品的稀释曲线 Fig. 2 Rarefaction curves at the 97% similarity level |
| 站位 | 序列数 | OTU数 | 多样性指数 | ||||
| Ace | Chao 1 | Shannon | Simpson | 覆盖率 | |||
| R01 | 47164 | 571 | 705.106 | 726.016 | 4.876 | 0.87 | 0.997 |
| R02 | 43516 | 440 | 526.859 | 502.164 | 6.664 | 0.975 | 0.999 |
| R03 | 45944 | 395 | 450.778 | 443 | 6.082 | 0.958 | 0.999 |
| R04 | 46044 | 378 | 453.911 | 431.109 | 5.797 | 0.954 | 0.999 |
| R05 | 46825 | 380 | 450.006 | 430.098 | 5.621 | 0.954 | 0.999 |
在超群(Super group)的分类上, 从整体上来看, 囊泡虫类(Alveolata)和后鞭毛类(Opisthokonta)在5个站中广泛分布, 分别占总序列的54.61%和21.55%。不等鞭毛类(Stramenopiles)、Hacrobia和泛植物群(Archaeplastida)在5个站也都存在, 分别占10.20%、6.37%和5.75%。从各站位水平看, R01站中由囊泡虫类主导, 所占比例明显高于其他站位, 占79.45%。R02和R03两个站位的微微型真核生物群落组成相似, 都是由囊泡虫类和后鞭毛类主导。R04站中Hacrobia所占比例明显高于其他站位, 为13.35%。R05站中不等鞭毛类占较高的比例, 为26.04% (图 3a)。
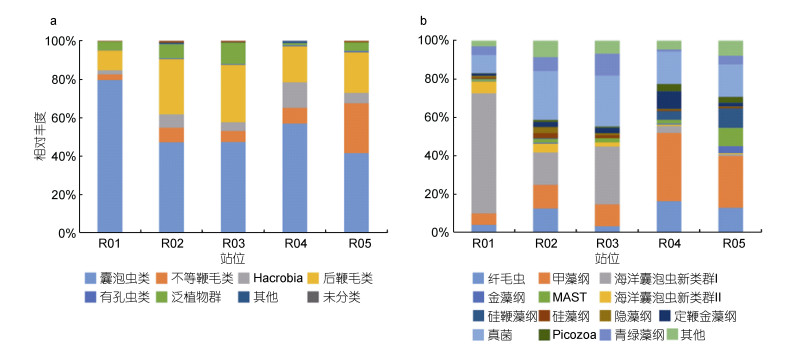 |
| 图 3 各站位微微型真核浮游生物在超群、群分类上各类群的相对丰度百分比 Fig. 3 Relative abundance of picoeukaryotes at super group and group level at each station |
在群(group)的分类上, 从整体上来看, 甲藻纲(Dinophyceae)、海洋囊泡虫新类群Ⅰ (MALV-Ⅰ)和真菌(Fungi)在各站中都有较高的相对丰度, 分别占18.42%、23.01%和18.86%。从各站位水平看, R01站中MALV-Ⅰ所占的比例较高, 可占62.57%。R02和R03两个站位的组成相似, 真菌所占的比例较高, 分别为25.36%和26.52%。R04和R05站中甲藻纲占优势, 分别为35.38%和26.99%。此外, 硅鞭藻纲(Dictyochophyceae)在R04和R05站中所占比例比其他站位高, 分别为4.56%和10.18%。R04站中定鞭金藻纲(Haptophyceae)所占比例较其他站高, 为9.07%; R05站中海洋不等鞭毛类(Marine Stramenopiles, MAST)所占比例较高, 为9.69%(图 3b)。
2.4 聚类分析2017年5个站中北欧海微微型真核浮游生物群落结构的聚类结果如图 4。基于Bray-Curtis距离, 在50%的相似度上, 可分成两组: R01、R02和R03三个高水温站聚为一组; R04和R05两个低水温站聚为一组(PERMANOVA检验: P < 0.01)。
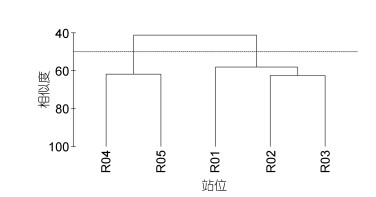 |
| 图 4 基于Bray-Curtis距离对各站的微微型真核浮游生物群落结构进行聚类 Fig. 4 Hierarchical clustering based on Bray-Curtis distance of picoeukaryotic structure at each station |
北欧海微微型真核浮游生物(OTU水平)与环境因子的典型相关分析(CCA)表明(图 5), 前两个轴对微微型真核浮游生物群落结构变化的解释量分别为38.37%和22.99%, 所以累计可在61.26%程度上解释群落结构的变化。温度对R01、R02和R03三个站的群落变化有显著地正相关作用, 对R04和R05两个站的群落变化有显著地负相关作用。
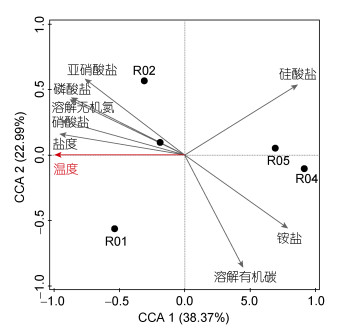 |
| 图 5 微微型真核浮游生物群落结构与环境因子之间的典型相关分析(CCA) Fig. 5 CCA analysis between picoeukaryotic structure and environmental factors |
优势类群(相对丰度 > 1%)与环境因子相关性分析结果(表 3), 优势类群中海洋囊泡虫新类群Ⅱ (MALV-Ⅱ)与温度存在显著正相关, 与溶解氧和pH存在显著负相关; MAST与盐度存在显著负相关; 硅鞭藻纲与盐度存在显著负相关, 与pH存在显著正相关; 硅藻纲(Bacillariophyceae)与溶解有机碳存在显著负相关, Picozoa与溶解氧存在显著正相关。
| 海洋囊泡虫新类群Ⅱ | MAST | 硅鞭藻纲 | 硅藻纲 | Picozoa | |
| 温度 | 0.977* | -0.786 | -0.95 | 0.424 | -0.916 |
| 盐度 | 0.777 | -0.971* | -0.987* | 0.47 | -0.643 |
| 溶解氧 | -0.984* | 0.711 | 0.921 | -0.503 | 0.951* |
| 酸碱度 | -0.968* | 0.788 | 0.959* | -0.492 | 0.911 |
| 溶解无机氮 | 0.778 | -0.625 | -0.846 | 0.86 | -0.773 |
| 铵盐 | -0.333 | -0.45 | -0.071 | -0.367 | 0.53 |
| 亚硝酸盐 | 0.71 | -0.591 | -0.805 | 0.907 | -0.71 |
| 硝酸盐 | 0.683 | -0.09 | -0.872 | 0.854 | -0.752 |
| 磷酸盐 | 0.817 | -0.616 | -0.851 | 0.831 | -0.816 |
| 硅酸盐 | 0.176 | -0.851 | -0.647 | 0.358 | 0.008 |
| 溶解有机碳 | -0.493 | 0.321 | 0.566 | -0.984* | 0.547 |
| 注: *在置信度(双侧)为0.05时, 是显著相关; **在置信度(双侧)为0.01时, 是极显著相关 | |||||
北欧海气候寒冷, 平均温度多为10℃以下。两种不同特性的海水在此交汇:北欧海的西部海域受低温低盐的极地水直接影响, 东部海域则受高温高盐的北大西洋暖流直接影响(Swift et al, 1981)。本研究中, 2017年北欧海表层海水的温度和盐度均显示由西北向东南逐渐增加的趋势, 符合之前的研究结果(史文奇等, 2017)。根据北欧海海域水团特性及各站位的水文环境参数, 可以将本次研究的5个站位大致划分为两组, 受暖流影响的高水温组站位R01、R02和R03, 受寒流影响的低水温组站位R04和R05 (Swift et al, 1981)。复杂的水文环境塑造了被划分海区不同的微微型真核浮游生物多样性, 本研究中高水温组站位的OTU数量和Chao 1指数均比低水温组站位高。有研究报道, 北欧海中受暖流影响的海域浮游植物相对较多, 初级生产力高, 因此该海域的微微型真核浮游生物的丰富度及多样性比其他海域高(商丽等, 2017)。本研究中, R01站的多样性最低, 推测由于R01位于罗弗敦海盆内部, 与其他站位相比物质交换较少导致。
对微微型真核浮游生物的群落结构研究表明, 该海域囊泡虫类在5个站中广泛分布, 占比超过一半。该发现与之前研究显示夏季北冰洋海冰中囊泡虫类可占总样本的31%—51%的结果相一致(Luo et al, 2018)。其中, 甲藻纲在低水温站位R04和R05相对丰度较高, 而海洋囊泡虫新类群Ⅰ和Ⅱ则在高水温站位R01、R02和R03中相对丰度较高。本研究显示, 裸甲藻属(Gymnodinium)是甲藻纲中相对丰度较高的属, 而这一类群在北冰洋的中心海域分布广泛, 因此推测寒流可能带来一些极地的微微型真核浮游生物类群(郭超颖等, 2011)。此外, 在北极斯瓦尔巴特群岛的研究中发现, 冬季甲藻纲的相对丰度和多样性均比夏季高, 本研究中低水温站位的甲藻纲相对丰度较高, 也证明了甲藻纲的分布与温度密切相关(Sørensen et al, 2012)。海洋囊泡虫新类群Ⅰ和Ⅱ是寄生类群, 已被证实在南极的真光层中是多样性及相对丰度最高的类群之一。在本研究中, 这两个类群在受高水温站位中相对丰度(平均相对丰度分别为36.51%和4.27%)明显高于低水温站位(平均相对丰度分别为2.29%和0.63%), 且统计分析表明温度对囊泡虫新生类群Ⅱ的分布存在显著地正相关作用, 因此可以推测北大西洋暖流带来的高温、高盐和高营养盐的海水更适宜这些类群的生长。
真菌作为海洋中重要的寄生类群, 广泛分布于各种海洋生态系统中, 是营养物质循环的重要参与者。本研究中的优势类群为子囊菌(Ascomycota)和担子菌(Basidiomycota), 而北极西部海域的研究中发现壶菌门是优势类群, 可能因为该海域真菌的分布受北冰洋环流的影响, 因此与本研究结果有差异(Hassett et al, 2017)。北欧海中真菌分布广泛, 在高水温站位分布较多, 以往研究表明光照及宿主藻类是影响真菌分布的关键因素(Hassett et al, 2017; 吴月等, 2019)。
本研究显示北欧海五个站位中不等鞭毛类在的分布相对较少, 仅占10.20%。其中, 硅藻纲的相对丰度较低, 但在夏季北极斯瓦尔巴群岛的周围海域中发现大量的硅藻, 以中心硅藻纲为主(石涵琨等, 2013)。对比环境因子发现本研究中北欧海的平均温度(3.64℃)和盐度(34.70)均高于受冰川融水影响的斯瓦尔巴群岛周围海域的温度(-1.5—0.5℃)和盐度(26—33.5), 因此不适宜的水文环境可能是北欧海硅藻丰度较低的主要原因。特别的是, 硅鞭藻集中分布于R04和R05两个低水温站位。在夏季的北极研究中发现, 硅鞭藻的丰度最大值可达为29×103cell/L, 其易在水温较低的海域生长繁殖, 具有耐寒性, 因而成为极地海域重要而独特的生物类群(Sukhanova et al, 2009)。本研究中, 低水温站位R04和R05 (0.2℃)与北冰洋微微型真核浮游生物的生长温度相近, 并且东格陵兰寒流可能带来一些极地生物类群, 导致R04和R05站中硅鞭藻的丰度较高。
此外, 北欧海微微型真核浮游生物中青绿藻也具有广泛分布。研究表明, 青绿藻广泛分布于北冰洋各海域, 其中的微单胞藻可占北冰洋海域光合类群丰度的93%, 是北冰洋初级生产力的主要贡献者(Lovejoy et al, 2007)。2012年楚科奇海微微型真核浮游植物的研究表明青绿藻可占35.9% (吴月等, 2019)。在本研究中, 青绿藻的相对丰度为5.75%, 明显低于上述北极海域, 可能由于北欧海较为复杂且寒暖流交汇的水文环境造成。但青绿藻在北欧海的占比仍高于其他光合类群, 如硅藻、金藻等, 在北欧海仍是重要的初级生产者。
北欧海中微微型真核浮游生物的群落结构有着明显的区域差异, 聚类结果显示高水温站位R01、R02和R03的群落结构相似, 低水温站位R04和R05的群落结构更为相似。目前, 温度、盐度、光照和营养盐被普遍认为是影响微微型真核浮游生物群落组成结构的重要原因。有研究报道, 温度和盐度是影响北极王湾地区微微型真核浮游生物分布的主要环境因子(高小艳, 2011)。典型相关分析也证实了温度是影响微微型真核浮游生物群落结构的重要因素, 这与之前的研究结果一致(孙辉等, 2014; Zhang et al, 2015)。此外, 水团输送(如入流分支的影响)可造成区域营养盐及浮游植物的分布差异(辜帆等, 2018)。本文推测三个高水温站位受北大西洋暖流直接影响, 具有相对较高的温度、盐度和营养盐浓度, 而两个低水温站位受东格陵兰寒流影响, 水文条件更接近北极, 因此造成了北欧海内微微型真核浮游生物的群落结构存在区域差异。
近年来, 全球变暖严重影响了全球高纬度海域, 北欧海海域的大气和海洋过程发生明显的变化:海冰覆盖面积逐渐变少; 输出到格陵兰海的深层水减少; 北欧海的表层、中层以及深层水都逐渐向淡水转换。有研究表明, 海冰融化可造成表层浮游生物细胞粒径的微型化, 从而增加微微型真核浮游生物的贡献率(吴月等, 2019)。这些变化会对北欧海的生态系统产生深远影响, 微微型真核浮游生物又是高纬度海洋生态系统中最易受影响的生物类群, 鉴于其对环境变化的敏感性及在海洋生态系统中的重要作用, 有必要对北欧海微微型真核浮游生物进行长期的监测及研究。
4 结论对北欧海海域微微型真核浮游生物的研究发现:囊泡虫类和后鞭毛类在北欧海中广泛分布, 分别占54.61%和21.55%。其中, 甲藻纲、海洋囊泡虫新类群Ⅰ和真菌在各站中都有较高的相对丰度, 分别占18.42%、23.01%和18.86%。依据各站位的水文特征, 可将其分为两组:呈现出相对较高的温度、盐度和营养盐浓度的受暖流影响的高水温站位(R01、R02、R03), 和水文环境与之相反的受寒流影响的低水温站位(R04、R05)。本研究发现, 甲藻和硅鞭藻的相对丰度在低水温站位显著高于高水温站位, 而海洋囊泡虫新类群Ⅰ则呈现相反的分布趋势。聚类分析表明, 在北欧海洋流活动影响下导致的环境因子变化, 尤其是温度的变化, 是影响北欧海海域微微型真核浮游生物的群落结构的关键因素。此外, 洋流还可能带来某些(如裸甲藻、硅鞭藻等)微微型真核浮游生物类群, 进一步导致其群落结构的区域差异。
石涵琨, 罗玮, 高颖, 等. 2013. 夏季北极斯瓦尔巴群岛周边海域微型浮游生物群落分布特征及环境影响初探. 海洋开发与管理, 30(1): 39-45 |
史文奇, 赵进平. 2017. 北欧海溢流的水文特征和变化机理综述. 地球科学进展, 32(3): 245-261 |
白美娜, 江涛, 陈飞羽, 等. 2019. 大亚湾大鹏澳牡蛎养殖临近海域自养微微型浮游生物种群分布特征. 海洋与湖沼, 50(1): 129-138 |
刘莹, 2013.夏季北冰洋海域微微型和微型浮游生物的多样性及其群落结构研究.上海: 上海海洋大学硕士学位论文. http://cdmd.cnki.com.cn/Article/CDMD-10264-1014013369.htm
|
孙辉, 汪岷, 汪俭, 等. 2014. 养殖活动对超微型浮游生物分布影响的研究. 海洋与湖沼, 45(6): 1272-1279 |
杨琳, 汪岷, 刘冠群, 等. 2012. 胶州湾微微型浮游植物丰度及其与环境因子的相关性分析. 海洋与湖沼, 43(5): 967-975 |
吴月, 曹叔楠, 何剑锋, 等. 2019. 北极楚科奇海微微型真核浮游生物群落结构及其环境相关性分析. 极地研究, 31(1): 25-33 |
邵秋丽, 2015.北欧海溢流源区的水文特征及溢流水输送形式研究.青岛: 中国海洋大学博士学位论文 http://cdmd.cnki.com.cn/Article/CDMD-10423-1015712741.htm
|
高小艳, 2011.北极海域微型浮游真核生物的多样性、生态分布及微微型青绿藻(picoprasinophytes)的生态地位.武汉: 华中农业大学硕士学位论文 http://med.wanfangdata.com.cn/Paper/Detail?id=DegreePaper_Y2004139
|
郭超颖, 王桂忠, 张芳, 等. 2011. 北冰洋微型浮游生物分布及其多样性. 生态学报, 31(10): 2897-2905 |
商丽, 史晓翀, 王晓宇, 等. 2017. 北欧海海水可培养细菌多样性. 微生物学报, 57(9): 1323-1331 |
辜帆, 金海燕, 庄燕培, 等. 2018. 2012年夏季水团输送对挪威-格陵兰海营养盐及浮游植物群落结构的影响. 极地研究, 30(1): 22-31 |
Cheung M K, Chu K H, Li C P et al, 2008. Genetic diversity of picoeukaryotes in a semi-enclosed harbour in the subtropical western Pacific Ocean. Aquatic Microbial Ecology, 53(3): 295-305 |
De Vargas C, Audic S, Henry N et al, 2015. Eukaryotic plankton diversity in the sunlit ocean. Science, 348(6237): 1261605 DOI:10.1126/science.1261605 |
Hassett B T, Ducluzeau A L L, Collins R E et al, 2017. Spatial distribution of aquatic marine fungi across the western Arctic and sub-arctic. Environmental microbiology, 19(2): 475-484 DOI:10.1111/1462-2920.13371 |
Hoff U, Rasmussen T L, Stein R et al, 2016. Sea ice and millennial-scale climate variability in the Nordic seas 90 kyr ago to present. Nature Communications, 7: 12247 DOI:10.1038/ncomms12247 |
Knap A H, Michaels A, Close A R et al, 1996. Protocols for the joint global ocean flux study (JGOFS) core measurements. JGOFS Report Nr. 19. UNESCO, Paris, France
|
Le Moine Bauer S, Stensland A, Daae F L et al, 2018. Water masses and depth structure prokaryotic and T4-Like viral communities around hydrothermal systems of the Nordic Seas. Frontiers in Microbiology, 9: 1002 DOI:10.3389/fmicb.2018.01002 |
Lovejoy C, Vincent W F, Bonilla S et al, 2007. Distribution, phylogeny, and growth of cold-adapted picoprasinophytes in arctic seas. Journal of Phycology, 43(1): 78-89 DOI:10.1111/j.1529-8817.2006.00310.x |
Luo W, Li H R, Gao X Y et al, 2018. Microbial eukaryotic diversity with emphasis on picoprasinophytes under the sea ice of the central Arctic Ocean in summer. Current Science, 115(9): 1709-1713 DOI:10.18520/cs/v115/i9/1709-1713 |
Mahé F, Mayor J, Bunge J et al, 2015. Comparing high- throughput platforms for sequencing the V4 region of SSU- rDNA in environmental microbial eukaryotic diversity surveys. Journal of Eukaryotic Microbiology, 62(3): 338-345 DOI:10.1111/jeu.12187 |
Massana R, 2011. Eukaryotic picoplankton in surface oceans. Annual Review of Microbiology, 65: 91-110 DOI:10.1146/annurev-micro-090110-102903 |
Moon-van der Staay S Y, De Wachter R, Vaulot D, 2001. Oceanic 18S rDNA sequences from picoplankton reveal unsuspected eukaryotic diversity. Nature, 409(6820): 607-610 DOI:10.1038/35054541 |
Olsen B R, Troedsson C, Hadziavdic K et al, 2015. The influence of vent systems on pelagic eukaryotic micro-organism composition in the Nordic Seas. Polar Biology, 38(4): 547-558 DOI:10.1007/s00300-014-1621-8 |
Sarnthein M, Küssner K, Tiedemann R et al, 2018. A benthic 14C record of peak glacial vs. deglacial deep-water formation in the Nordic Seas-AMOC implications. In: Proceedings of the 20th EGU General Assembly Conference Abstracts. Vienna, Austria: EGU, 8957
|
Sherr E B, Sherr B F, 2000. Marine microbes: an overview. In: Kirchman D L ed. Microbial Ecology of the Oceans. London: Wiley-Liss, 13-46
|
Sørensen N, Daugbjerg N, Gabrielsen T M, 2012. Molecular diversity and temporal variation of picoeukaryotes in two Arctic fjords, Svalbard. Polar Biology, 35(4): 519-533 DOI:10.1007/s00300-011-1097-8 |
Stoeck T, Epstein S, 2003. Novel eukaryotic lineages inferred from small-subunit rRNA analyses of oxygen-depleted marine environments. Applied and Environmental Microbiology, 69(5): 2657-2663 DOI:10.1128/AEM.69.5.2657-2663.2003 |
Sukhanova I N, Flint M V, Pautova L A et al, 2009. Phytoplankton of the western Arctic in the spring and summer of 2002: structure and seasonal changes. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 56(17): 1223-1236 DOI:10.1016/j.dsr2.2008.12.030 |
Swift J H, Aagaard K, 1981. Seasonal transitions and water mass formation in the Iceland and Greenland seas. Deep Sea Research Part A. Oceanographic Research Papers, 28(10): 1107-1129 DOI:10.1016/0198-0149(81)90050-9 |
Wang S, Lin Y J, Gifford S et al, 2018. Linking patterns of net community production and marine microbial community structure in the western North Atlantic. The ISME Journal, 12(11): 2582-2595 DOI:10.1038/s41396-018-0163-4 |
Zhang F, He J F, Lin L et al, 2015. Dominance of picophytoplankton in the newly open surface water of the central Arctic Ocean. Polar Biology, 38(7): 1081-1089 DOI:10.1007/s00300-015-1662-7 |
 2019, Vol. 50
2019, Vol. 50


