中国海洋湖沼学会主办。
文章信息
- 董道英, 孔凡娜, 崔正彩, 孙斌. 2019.
- DONG Dao-Ying, KONG Fan-Na, CUI Zheng-Cai, SUN Bin. 2019.
- 条斑紫菜酵母双杂交文库的构建及PyMAPK5互作蛋白的筛选
- CONSTRUCTION OF A TWO-HYBRID LIBRARY OF PYROPIA YEZOENSIS AND SCREENING OF PYMAPK5 INTERACTION PROTEIN
- 海洋与湖沼, 50(6): 1271-1280
- Oceanologia et Limnologia Sinica, 50(6): 1271-1280.
- http://dx.doi.org/10.11693/hyhz20190400070
文章历史
-
收稿日期:2019-04-05
收修改稿日期:2019-05-27
促分裂原活化激酶(mitogen-activated protein kinase, MAPK)是真核生物信号转导中重要的组成部分, 能将细胞膜表面受体感知的信号经过一系列级联反应转变为细胞内信号, 在植物生长发育、增殖分化以及应对逆境胁迫中发挥重要作用(Colcombet et al, 2008; Meng et al, 2013)。MAPK级联通路由MAPKKK-MAPKK-MAPK三种激酶组成(Bergmann et al, 2004), MAPKKK构成MAPK最大的家族组分(Chaiwongsar et al, 2006), 其接收膜上的信号后, 通过磷酸化MAPKK活化环的S/T-X3-5-S/T基序中的两个氨基酸将信号传递到MAPKK。MAPKK是双特异性激酶, 在被MAPKKK激活后, 进一步通过激活环中T-X-Y基序的双磷酸化来激活MAPK(Lukowitz et al, 2004; Ichimura et al, 2006)。磷酸化的MAPK能激活下游的靶蛋白, 如特定的转录因子、细胞骨架蛋白、蛋白激酶等, 启动各种效应分子共同参与细胞的生理活动(Zhang et al, 2001; Zwerger et al, 2001)。
MAPK广泛参与干旱、渗透压、温度等非生物胁迫, 干旱胁迫下水稻OSMAPK5激酶活性增加, 对失水胁迫的耐受性增强(Xiong et al, 2003)。棉花的GhMPK2基因过表达, 干旱条件下植株水分流失降低(Agrawal et al, 2002):黄瓜中CsNMAPK在高盐和渗透压胁迫下其转录水平上调, 在烟草中过表达后, 盐度和渗透压胁迫下的种子发芽率明显高于野生型(Xu et al, 2010):玉米根在5—25℃温度升高期间, ZmMPK5转录水平和激酶水平均增加(Berberich et al, 1999), 响应高温胁迫:而4℃处理玉米幼苗根部, ZmMPK5、ZmMPK6、ZmMPK7在2h内的表达量均升高, 响应低温胁迫(Wu et al, 2011)。
目前对MAPK互作蛋白的研究在拟南芥和水稻等高等植物中较为深入。水稻OSMPK1与41种蛋白质存在相互作用(Singh et al, 2012)。拟南芥AtMPK3可能的下游靶蛋白有48个, AtMPK6可能的下游靶蛋白有39个(Lee et al, 2008), 其中AtMPK6通过磷酸化转录因子MYB41的Ser 251位点, 增强植株的耐盐性(Hoang et al, 2012)。干旱条件下, 拟南芥MPK6转录和蛋白水平表达上调, 并激活细胞核中的转录因子DCP1, 对失水胁迫做出快速反应(Xu et al, 2012)。柑橘PtrMAPK转录水平在干旱和低温条件下显著上调, 并活化抗氧化系统, 在烟草中过表达PtrMAPK基因, 编码活性氧清除酶的基因(NtSOD、NtAPX、NtCAT等)转录水平显著上调, 水分胁迫下细胞内活性氧的积累明显降低。早期研究也表明, MAPK级联可调节玉米和烟草中ROS相关基因的表达, 应对非生物胁迫(Huang et al, 2011)。
条斑紫菜生活在潮间带地区, 随潮汐变化承受着失水、高温、强光、渗透压等环境因子的胁迫, 实验室前期进行了MAPK基因家族分析, 鉴定出15个MAPK基因, 均含有高等植物MAPK的11个保守结构域, 其磷酸化位点除TEY和TDY两种基序外, 还存在TAY、TQY、TTY、TSH、TAH和TQA这六种新类型的基序。失水胁迫下的研究表明条斑紫菜MAPK家族中PyMAPK5在失水胁迫下显著上调表达, 但是其作用的下游蛋白仍然不清晰, 本研究通过酵母双杂交技术进行PyMAPK5互作蛋白的筛选, 为阐述PyMAPK5参与的下游途径及其机制奠定基础, 同时为研究潮间带海藻逆境胁迫机制提供参考。
1 材料与方法 1.1 材料 1.1.1 植物材料条斑紫菜(Pyropia yezoensis) RZ纯系, 由本实验室保存。
1.1.2 菌株和质粒酵母Y2H Gold菌株, BD空载质粒pGBKT7, AD空载质粒pGADT7, 对照质粒pGBKT7-53, pGBKT7-Lam, pGADT7-T(以上质粒和菌株均购于宝日医生物技术有限公司)。
1.1.3 实验试剂植物总RNA提取试剂盒(OMEGA, 美国): RNase-free柱上DNA消化酶(OMEGA, 美国):普通琼脂糖凝胶DNA回收试剂盒(天根生化科技(北京)有限公司):质粒小提取试剂盒(天根生化科技(北京)有限公司): Clone Miner Ⅱ cDNA文库构建试剂盒(Thermo, 美国), FastTrack MAG mRNA分离试剂盒(Thermo, 美国), 快速凝胶提取和PCR纯化组合试剂盒(Thermo, 美国): SD/-Trp培养基, SD/-Trp/-Leu培养基, SD/-Trp/-Leu/-His/-Ade x-α-gal, AbA培养基(Clontech, 美国)。
1.2 方法 1.2.1 材料处理用条斑紫菜RZ纯系叶状体作为实验材料, 在光照为35—45μmol photons/(m2·s), 光周期为12L:12D, 10℃通气培养。挑选叶片长度为5cm, 生长状态良好的藻体置于2L的通气瓶中驯养3—5天, 分别进行温度胁迫和失水胁迫处理。温度胁迫设置如下: -8、0、10、16、24℃培养4h, 其中10℃培养为对照组:失水胁迫实验条件设置如下:对照、失水30%、失水70%、失水80%后复水30min。所有处理均设置3组平行, 处理见表 1。
| 样品名称 | 处理条件 | |
| 对照组(正常培养) | 盐度33的消毒海水, 10℃, 4h | |
| 失水率30% | 置于密闭培养皿中达到失水30%的重量, 10℃ | |
| 失水率70% | 置于密闭培养皿中达到失水70%的重量, 10℃ | |
| 失水率80%后复水30min | 置于密闭培养皿中达到失水80%的重量, 10℃, 然后放在盐度33的消毒海水中30min | |
| -8℃ | 盐度33消毒海水, -8℃, 4h | |
| 0℃ | 盐度33消毒海水, 0℃, 4h | |
| 16℃ | 盐度33消毒海水, 16℃, 4h | |
| 24℃ | 盐度33消毒海水, 24℃, 4h |
按照RNA提取试剂盒说明书提取用于建库所有处理下样品的总RNA后进行等量混合, 并进行质检。按照Oligotex mRNA Midi Kit说明书进行mRNA分离纯化, 并检测质量。
1.2.3 cDNA文库(Uncut型)的构建参照CloneMiner说明书进行cDNA第一条链及第二条链的合成, 用T4连接酶将cDNA与三框attB1重组接头连接, 以构建含有三种读码框的cDNA文库。用分级柱进行cDNA的分级分离和收集。
1.2.4 初级文库的构建参照Gateway说明书, 进行BP重组反应, 将带有重组接头的cDNA片段重组到载体pDONR222上, 采用电转化的方法转化到大肠杆菌DH10B感受态细胞中, 将转化产物37℃、250rpm震荡培养1h, 得到初级文库菌液。取转化后细菌原液10μL稀释1000倍后, 取50μL涂布LB/Amp固体培养基, 第二天计数进行初级文库滴度鉴定, 随机挑取96个克隆进行PCR鉴定, 计算重组率, 计算如公式(1)所示。
 (1)
(1)将初级文库菌液扩大培养并抽提质粒, 稀释后将其与pGADT7-DEST进行LR重组, 得到重组质粒按照1.2.4步骤进行转化, 并进行相同的滴度鉴定以及重组率鉴定。剩余菌液加入20%甘油保存, 为次级文库菌液。菌液进行质粒抽提得到次级文库质粒, 可直接用于酵母双杂交共转化。
1.2.6 诱饵载体构建用BamH Ⅰ和EcoR Ⅰ双酶切BD质粒载体pGBKT7后进行胶回收, 设计引物扩增PyMAPK5完整ORF, 并运用同源重组的方法将回收的载体与目的片段进行连接。引物序列如下, 其中斜体部分表示同源臂区段:
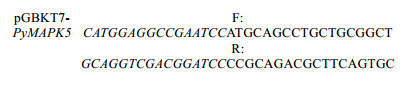
用In-Fusion酶将PyMAPK5片段和上述酶切载体连接, 转化至大肠杆菌DH5α感受态, 涂布于LB/Kan固体培养基上, 过夜培养, 挑取单克隆测序, 将测序结果比对完全一致的菌液提取质粒, -20℃保存备用。
1.2.7 诱饵蛋白自激活检测和毒性检测参照Clontech Yeastmaker TM Yeast Transformation System 2说明书中小规模转化的方法, 在YPDA培养基活化Y2H Gold酵母菌株, 严格按照要求制备酵母感受态细胞。按表 2所示将实验组, 空载对照, 阳性对照和阴性对照进行共转化。转化液溶于0.9% NaCl, 分别取100μL涂布于SD/-Trp/-Leu, SD/-Trp/-Leu/x-α-gal/AbA选择性培养基, 实验组在SD/-Trp/-Leu有菌落生长, 而在SD/-Trp/-Leu /x-α-gal/AbA培养基上无菌落生长即无自激活现象。另从培养基上随机挑取实验组和空载质粒组菌落于SD/-Trp/-Leu液体培养基30℃震荡培养, 分别在不同时间测定其一天内的光密度(optical density, OD)值, 若二者生长状况无明显差异, 则说明pGBKT7-PyMAPK5对酵母细胞无毒。
| 实验组别 | 预期结果 |
| pGBKT7-PyMAPK5 + pGADT7 pGBKT7 + pGADT7(空载) | 不变蓝 不变蓝 |
| pGBKT753+pGADT7-T(阳性对照) | 变蓝 |
| pGBKT7lam+ pGADT7-T(阴性对照) | 不变蓝 |
制备新鲜的感受态细胞, 参照1.2.7转化步骤, 按照pGBKT7- PyMAPK5:文库质粒=2:1的量进行大规模共转化, 转化液溶于10mL 0.9% NaCl, 取10μl稀释100倍涂布于SD/-Trp/-Leu固体培养基进行滴度鉴定, 剩余菌液每个板200μL涂于SD/-Trp/-Leu /x-α-gal/AbA选择性培养基, 其中SD/-Trp/-Leu培养基为Trp和Leu氨基酸缺陷, 而两个载体上分别有合成Trp和Leu的基因, 可用于筛选共转化成功的质粒:酵母菌株上具有报告基因AURI-C和MEL1, 前者的表达使酵母菌株具有AbA(抗生素金担子素)抗性, 后者可表达α半乳糖苷酶, 水解底物x-α-gal呈现蓝色, 只有蛋白互作才能激活报告基因的表达, 在SD/-Trp/-Leu /x-α-gal/AbA选择培养基上生长出蓝色菌落。30℃培养5—7天观察菌落生长至大小约2—3mm。为进一步降低假阳性, 挑取变蓝的菌落再次转移到SD/-Trp/-Leu /x-α-gal/AbA选择培养基上筛选, 选8h内再次变蓝的菌落进行菌落PCR, 送上海生工测序并将返回序列比对分析。
1.2.9 候选互作蛋白基因GO (Gene Ontology)富集分析将筛选到的互作蛋白的cDNA序列从条斑紫菜基因组信息调出, 依据在线网站(www.omicshare.com/tools)进行GO富集, 并分析其参与的生物学过程和功能。
1.2.10 候选互作蛋白基因表达谱分析根据实验室已有的条斑紫菜RZ纯系在不同水分胁迫下的表达谱数据(https://www.ncbi.nlm.nih.gov/sra/?term=PRJNA235353), 对候选互作蛋白的表达谱数据(正常培养, 失水20%、30%、40%、50%、60%、70%、80%, 失水50%后复水30min, 失水80%后复水30min和失水80%后复水60min)进行分析, 均一化处理后进行热图制作。
1.2.11 候选互作蛋白验证选取候选蛋白微管蛋白tubulin、捕光蛋白light- harvesting protein、光系统Ⅱ蛋白photosystem Ⅱ protein进行质粒提取, 并与PyMAPK5诱饵质粒共转化酵母细胞进行一对一验证。
2 结果与分析 2.1 条斑紫菜酵母双杂交cDNA文库的构建不同处理条件下条斑紫菜RNA提取, 电泳结果如图 1, 条带清晰无弥散, 显示RNA提取较完整, 且浓度在100—300ng/μL之间, A260/280为1.9—2.0, A260/A230为2.0—2.2之间:将8个处理条件下的RNA进行等量混合, 并进行mRNA分离纯化: mRNA长度主要分布在0.5—2.0kb之间, 呈弥散状, 浓度检测为15ng/μL, 总量为3μg, 达到建库要求。
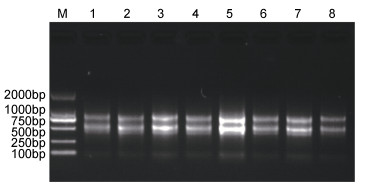 |
| 图 1 不同处理条件下条斑紫菜RNA的1%琼脂糖凝胶电泳检测 Fig. 1 1% agarose gel analysis of RNA under different treatment conditions 注: 1: -8℃: 2: 0℃: 3: 16℃: 4: 24℃: 5:对照: 6:失水30%: 7:失水70%: 8:失水80%后复水30min |
将cDNA与pDONR222载体进行BP重组后电转化大肠杆菌DH10B, 37℃过夜培养即得到初级文库菌液。取细菌原液10μL稀释1000倍, 取50μL涂于LB固体培养基, 第二天计数即得到初级文库库容, 库容鉴定为2.0×107CFU:随机选取96个克隆进行PCR检测, 空载8个, 重组率91.6%, 即为初级文库重组率, 部分电泳结果如下(图 2)。结果表明文库覆盖率较高, 均达到初级文库要求。
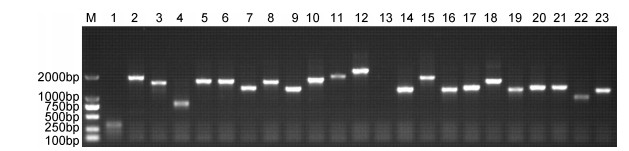 |
| 图 2 初级文库中插入片段PCR鉴定 Fig. 2 PCR identification of inserts in the primary library 注: M: DL2000 marker: 1—23:随机挑取的初级文库菌落 |
将初级文库菌液过夜培养后进行质粒抽提, 与pGADT7-DEST载体进行LR重组, 电转化大肠杆菌DH10B, 37℃过夜培养后取细菌原液10μL稀释1000倍, 取50μL涂于LB固体培养基, 第二天计数即得到次级文库库容, 库容鉴定为1.44×107CFU。随机选取96个克隆进行PCR检测, 空载8个, 重组率为91.6%, 部分电泳结果如下(图 3), 库容在107以上显示较高的库容, 对转录本覆盖率103以上。满足次级文库要求, 可用于后续文库筛选实验。
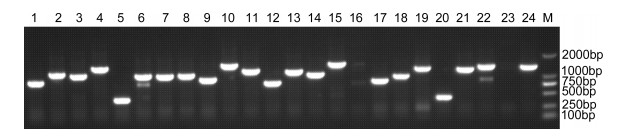 |
| 图 3 次级文库中插入片段PCR鉴定 Fig. 3 PCR identification of inserts in the secondary library 注: M: DL2000 marker: 1—24:随机挑取的次级文库菌落 |
将扩增出的PyMAPK5基因与酶切后的pGBKT7连接, 转化大肠杆菌感受态细胞, 并测序比对结果与基因组序列完全一致。
将实验组、空载对照组、阳性对照和阴性对照分别转化Y2H Gold酵母感受态细胞, 涂于SD/-Trp/- Leu和SD/-Trp/-Leu /x-α-gal/AbA选择性培养基30℃培养3—5天, 结果显示四组均在SD/-Trp/-Leu上生长, 只有阳性对照在SD/-Trp/-Leu/x-α-gal/AbA上生长(图 4), 说明该诱饵蛋白无自激活活性, 可进行下一步实验。将在SD/-Trp/-Leu培养基上培养3—5天的实验组和空载对照组随机挑取直径相当的酵母菌落, 在SD/-Trp液体培养基震荡培养24h, 并记录OD600, 结果表明二者OD600均达到0.8以上, 且生长速度并无明显差异(图 5), 表明诱饵蛋白对酵母细胞无毒性。
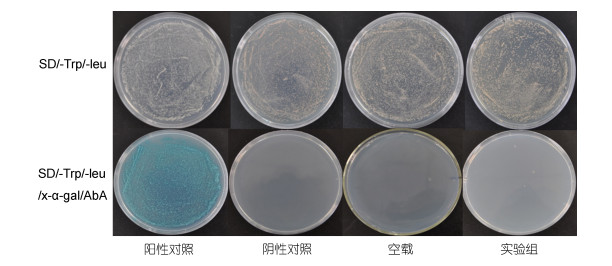 |
| 图 4 pGBKT7-PyMAPK5诱饵蛋白自激活检测 Fig. 4 Self-activation assay of pGBKT7-PyMAPK5 bait protein |
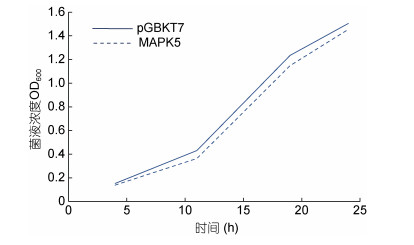 |
| 图 5 pGBKT7-PyMAPK5诱饵蛋白毒性检测 Fig. 5 Toxicity test of pGBKT7-PyMAPK5 bait protein |
将pGBKT7-PyMAPK5质粒和文库质粒共转化Y2H Gold酵母感受态细胞, 稀释100倍涂布于SD/- Trp/-Leu培养基上, 生长3—5天, 统计平板上的菌落数为209个, 计算得到转化效率为1.25×104CFU/μg。将筛选得到的阳性克隆再次转移到SD/- Trp/-Leu/x- α-gal/AbA选择性培养基上, 得到37个阳性克隆, 如图 6:选取阳性克隆进行PCR鉴定, 部分PCR结果如图 7, 阳性克隆片段大小主要集中在500—2000bp, 最终得到测序成功的阳性克隆共26个。
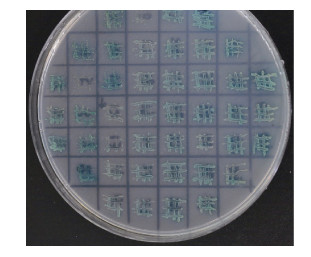 |
| 图 6 PyMAPK5筛选得到的阳性克隆 Fig. 6 Positive colonies screened by PyMAPK5 |
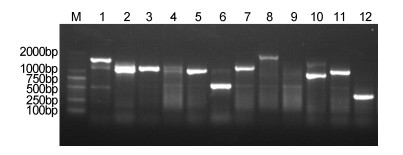 |
| 图 7 PyMAPK5部分候选互作蛋白酵母菌落PCR检测 Fig. 7 PCR detection of yeast colonies screened by PyMAPK5 partial candidate interaction 注: M: DL2000 marker: 1—12:候选蛋白部分阳性克隆 |
将测序比对正确的序列进行比对分析, 26个候选蛋白的注释结果如表 3所示, 其中丙氨酸乙醛酸转氨酶和假设蛋白Py06157.t1两个基因重复出现两次。注释到的蛋白质集中在与光合作用的蛋白质, 能量代谢相关的蛋白以及细胞骨架蛋白。值得注意的是8条序列为未知蛋白或假设蛋白, 其具体的作用有待进一步挖掘。
| 基因号 | 出现次数 | 非冗余蛋白序列数据库功能注释 |
| Py06157.t1 | 2 | hypothetical protein |
| Py05333.t1 | 2 | alanine-glyoxylate aminotransferase |
| Py04248.t1 | 1 | tubulin beta-4B chain isoform X1 |
| Py06259.t1 | 1 | hypothetical protein SDRG |
| Py03902.t1 | 1 | photosystem Ⅱ 12 kDa extrinsic protein |
| Py02495.t1 | 1 | Ham1 family |
| Py02924.t1 | 1 | predicted protein |
| Py11159.t1 | 1 | light-harvesting complex protein |
| Py06810.t1 | 1 | light-harvesting protein |
| Py11123.t1 | 1 | GDP-D-mannose |
| Py04643.t2 | 1 | glyceraldehyde 3-phosphate dehydrogenase |
| Py03379.t1 | 1 | integrin alpha-D |
| Py06158.t1 | 1 | hypothetical protein |
| Py04108.t1 | 1 | AMP-activated protein kinase |
| Py10293.t1 | 1 | acid-thiol ligase |
| Py03784.t1 | 1 | GTP-binding protein |
| Py10177.t1 | 1 | hypothetical protein SOVF |
| Py02555.t1 | 1 | hypothetical protein AURANDRAFT |
| Py03593.t1 | 1 | hypothetical protein BRAFLDRAFT |
| Py03097.t1 | 1 | hypothetical protein Gasu |
| Py08028.t1 | 1 | hypothetical protein PLEOSDRAFT |
| Py05176.t1 | 1 | PhosphomethylPyrimidine synthase |
| Py09446.t1 | 1 | hypothetical protein EMIHUDRAFT |
| Py03353.t1 | 1 | vacuolar ATPase subunit DVA41 |
| Py03374.t1 | 1 | Similar to Ubiquitin-60S ribosomal protein |
| Py00802.t1 | 1 | hypothetical protein M408DRAFT |
将PyMAPK5筛选到的26个候选互作蛋白基因进行GO富集(图 8), 结果显示其富集在生物学过程、细胞组分和分子功能三方面。生物学过程主要包括核苷三磷酸代谢过程(显著富集的蛋白质有甘油醛3-磷酸脱氢酶, Ham1家族), 细胞前体代谢物和ATP代谢过程(ATP酶亚基、AMP激活的蛋白激酶、光系统Ⅱ蛋白显著富集), 以及核糖体生物发生(如泛素-60S核糖体蛋白及某些注释的未知蛋白):细胞组分主要包括细胞内组分(GTP结合蛋白、GDP-甘露糖、微管蛋白β异构体、叶绿体异构体X3等)和细胞内膜以及细胞器组分(光捕获蛋白、核糖体蛋白等):分子功能主要参与包括有机化合物的结合(显著富集AMP激活的蛋白激酶α亚基、GTP结合蛋白、磷酸甲基嘧啶合成酶), 催化活性(假设蛋白SDRG、丙氨酸-乙醛酸氨基转移酶)和GTP酶活性等功能。表明PyMAPK5可能广泛作用于不同的生物学过程, 从而调控条斑紫菜应答逆境胁迫。
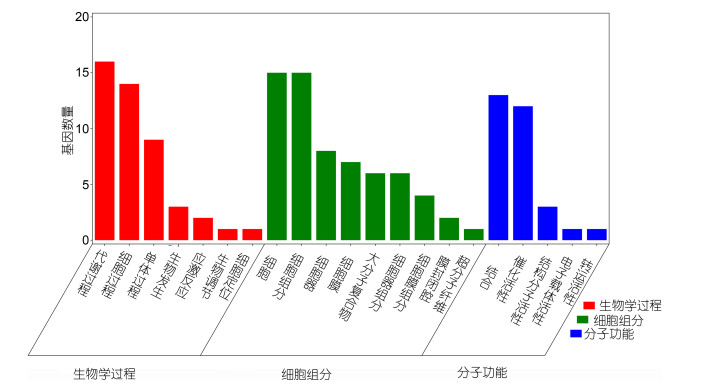 |
| 图 8 PyMAPK5候选互作蛋白GO注释 Fig. 8 Gene ontology annotation of PyMAPK5 candidate interaction protein |
PyMAPK5候选互作蛋白不同失水胁迫下的表达量(图 9)分析显示, 可分为3种表达模式, 其中13个基因对复水响应敏感, 失水条件下表达下降, 复水后表达量显著上升, 包括微管蛋白、光系统Ⅱ蛋白、AMP蛋白激酶、甘油醛3-磷酸脱氢酶、GTP结合蛋白、核糖体蛋白、捕光蛋白复合体以及部分未知蛋白: 8个基因在条斑紫菜失水早期(10%—30%)表达量显著升高, 随失水程度增加表达量降低, 但在复水后表达量又增加, 包括假设蛋白Gasu、丙氨酸-乙醛酸氨基转移酶、ATP酶、甲基嘧啶合成酶及假设蛋白等: 5个基因在失水过程中表达量升高, 尤其是在失水60%—80%之间表达量显著增加, 复水过程表达量降低, 如捕光蛋白、酸-硫醇连接酶、Ham1家族和未知蛋白等。
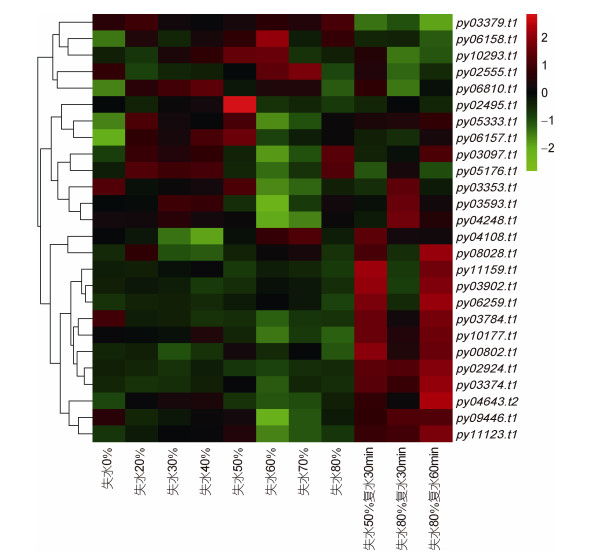 |
| 图 9 PyMAPK5互作蛋白基因失水胁迫下表达谱分析 Fig. 9 The expression profile of PyMAPK5interaction protein gene under water stress |
将候选蛋白中的微管蛋白tubulin、捕光蛋白light-harvesting protein、光系统Ⅱ蛋白的重组质粒与PyMAPK5诱饵质粒共转化酵母感受态细胞, 转化液依次稀释10-1、10-2、10-3涂布于SD/-Trp/-Leu/-His/- Ade/x-α-gal/AbA选择性培养基上, 如图 10。结果表明三个候选蛋白与PyMAPK5的互作均呈现阳性, 表明本研究筛选结果具有较高的阳性率。
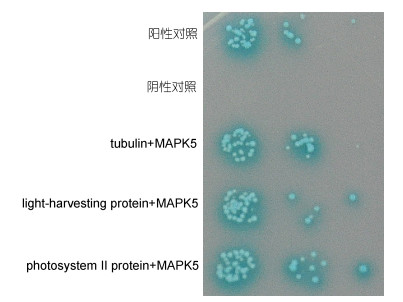 |
| 图 10 PyMAPK5候选互作蛋白SD/-Trp/-Leu /-His/- Ade/x-α-gal/AbA培养基一对一验证 Fig. 10 One-to-one verification of PyMAPK2 candidate interaction protein on the SD/-Trp/-Leu/-His/-Ade/x-α-gal/AbA |
MAPK级联反应在植物中发挥重要的作用, 而对MAPK底物的研究已经成为如今研究的热点之一(Zhang et al, 2018)。本研究通过对PyMAPK5互作蛋白的研究, 有助于认识MAPK磷酸化蛋白的特点, 并找到其信号传导的最终作用对象, 进一步解析MAPK参与条斑紫菜失水胁迫的生物学过程。为此, 本研究采用Invitrogen体系首次构建了高质量的条斑紫菜酵母双杂交cDNA文库(库容1.44×107CFU), 与水稻酵母双杂交cDNA文库库容(2.9×106)、大豆(1.7×106)、玉米(2.56×107)相比(Singh et al, 2012; 崔晓艳等, 2013; 雷海英等, 2018), 本研究酵母双杂交文库覆盖度较高, 为条斑紫菜相关基因互作蛋白的筛选奠定了基础。
本研究筛选到26个与PyMAPK5相互作用的候选蛋白, 包括参与光合作用的相关蛋白、微管蛋白、GTP结合蛋白、AMP蛋白激酶、核糖体蛋白、假设蛋白等, 并一对一验证了微管蛋白、捕光蛋白、光系统Ⅱ蛋白与PyMAPK5的互作。其中候选互作蛋白β-tubulin属于微管蛋白, 微管和微丝共同组成植物细胞的骨架系统, 微管骨架重组可调控细胞形状改变、细胞分裂和响应不同刺激的信号传导等过程(Volkmann et al, 1999; Inoue et al, 2007)。植物微管蛋白可以通过在MAPK蛋白激酶的磷酸化作用下, 对细胞周期进行调节(Blume et al, 2008)。烟草研究中, MAPK/NTF6被激活后, 可以磷酸化微管结合蛋白NTMAP65-1中579位的苏氨酸残基, 调节有丝分裂M期及后期纺锤体的行为(Sasabe et al, 2006):拟南芥的AtMAPK4参与微管蛋白磷酸化调节, 在细胞减数分裂中起作用(Zeng et al, 2011; Hoehenwarter et al, 2013)。苜蓿丝裂原活化蛋白激酶SIMK, 其活性变化调节微管蛋白细胞骨架变化, 对细胞极性生长起直接作用(Sangwan et al, 2002)。本研究发现tubulin可能与PyMAPK5互作, 推测逆境胁迫可能激发PyMAPK5对微管蛋白的磷酸化, 进一步改变了细胞骨架的结构从而适应非生物胁迫, 但是二者具体的作用过程仍需进一步验证。
逆境胁迫往往导致植物光合作用活性氧大量积累, 叶绿体中活性氧积累可导致类囊体膜降解(Lee et al, 2009)。烟草的MAPK激活后, 植物在黑暗中不会积累H2O2, 细胞死亡延迟(Liu et al, 2007):拟南芥MPK4敲除后, 叶绿体中活性氧代谢失衡, 类囊体系统重排, PSⅡ被损伤(Gawroński et al, 2014)。此外, 拟南芥MEKK1和MPK4级联通路参与活性氧稳态的调节, MPK4的激活导致编码质体或叶绿体蛋白的相关基因下调表达, 抑制光合作用(Pitzschke et al, 2009)。以上研究均表明MAPK的活化有助于降低植物细胞内活性氧水平, 减少逆境胁迫下活性氧带来的光损伤, 从而增强植物的适应性。本研究发现捕光蛋白和光系统Ⅱ蛋白可能作为PyMAPK5的互作蛋白, 推测其可能被条斑紫菜PyMAPK5激活, 引发相应表达量的改变, 共同参与逆境胁迫下光合作用的调节, 维持ROS稳定, 以响应失水等逆境胁迫, 具体的调节过程也需进一步研究。
近年来酵母双杂交技术广泛应用于互作蛋白筛选, 但是对于条斑紫菜互作蛋白的筛选是首次应用, 本研究筛选到了PyMAPK5的候选蛋白, 后续实验会进一步进行体外BIFC或Co-IP等方法的验证, 并进一步研究条斑紫菜PyMAPK5的生物学通路和调控机制。藻类中未见关于MAPK与本研究筛选到的互作蛋白的相关报道, 故本研究也为藻类中MAPK互作蛋白的研究提供一定的参考。
4 结论本研究首次构建了条斑紫菜酵母双杂交cDNA文库, 以PyMAPK5为诱饵蛋白进行了互作蛋白的筛选, 得到26个候选互作蛋白, 并通过GO富集初步解析了候选蛋白的功能, 热图分析了失水胁迫下候选蛋白的表达量差异, 一对一验证证明微管蛋白、捕光蛋白、光系统Ⅱ蛋白与PyMAPK5互作均为阳性结果, 本研究为进一步解析条斑紫菜PyMAPK5的分子调控机制奠定了基础。
崔晓艳, 陈新, 栾鹤翔, 等. 2013. 大豆花叶病毒诱导的应用于膜蛋白酵母双杂交的大豆cDNA文库构建. 植物病理学报, 43(5): 556-560 |
雷海英, 白凤麟, 段永红, 等. 2018. 玉米酵母双杂交cDNA文库的构建及ZmCEN互作蛋白的筛选. 西北植物学报, 38(4): 598-606 |
Agrawal G K, Rakwal R, Iwahashi H, 2002. Isolation of novel rice (Oryza sativa L.) multiple stress responsive MAP kinase gene, OsMSRMK2, whose mRNA accumulates rapidly in response to environmental cues. Biochemical and Biophysical Research Communications, 294(5): 1009-1016 DOI:10.1016/S0006-291X(02)00571-5 |
Berberich T, Sano H, Kusano T, 1999. Involvement of a MAP kinase, ZmMPK5, in senescence and recovery from low-temperature stress in maize. Molecular and General Genetics MGG, 262(3): 534-542 DOI:10.1007/s004380051115 |
Bergmann D C, Lukowitz W, Somerville C R, 2004. Stomatal development and pattern controlled by a MAPKK kinase. Science, 304(5676): 1494-1497 DOI:10.1126/science.1096014 |
Blume Y B, Lloyd C W, Yemets A I, 2008. Plant tubulin phosphorylation and its role in cell cycle progression. In: Blume Y B, Baird W V, Yemets A I et al eds. The Plant Cytoskeleton: A Key Tool for Agro-Biotechnology. Dordrecht: Springer, 145-159
|
Chaiwongsar S, Otegui M S, Jester P J et al, 2006. The protein kinase genes MAP3K ɛ 1 and MAP3K ɛ 2 are required for pollen viability in Arabidopsis thaliana. The Plant Journal, 48(2): 193-205 DOI:10.1111/j.1365-313X.2006.02863.x |
Colcombet J, Hirt H, 2008. Arabidopsis MAPKs: a complex signalling network involved in multiple biological processes. Biochemical Journal, 413(2): 217-226 DOI:10.1042/BJ20080625 |
Gawroński P, Witoń D, Vashutina K et al, 2014. Mitogen-activated protein kinase 4 is a salicylic acid-independent regulator of growth but not of photosynthesis in Arabidopsis. Molecular Plant, 7(7): 1151-1166 DOI:10.1093/mp/ssu060 |
Hoang M H T, Nguyen X C, Lee K et al, 2012. Phosphorylation by AtMPK6 is required for the biological function of AtMYB41 in Arabidopsis. Biochemical and Biophysical Research Communications, 422(1): 181-186 DOI:10.1016/j.bbrc.2012.04.137 |
Hoehenwarter W, Thomas M, Nukarinen E et al, 2013. Identification of novel in vivo MAP kinase substrates in Arabidopsis thaliana through use of tandem metal oxide affinity chromatography. Molecular & Cellular Proteomics, 12(2): 369-380 |
Huang X S, Luo T, Fu X Z et al, 2011. Cloning and molecular characterization of a mitogen-activated protein kinase gene from Poncirus trifoliata whose ectopic expression confers dehydration/drought tolerance in transgenic tobacco. Journal of Experimental Botany, 62(14): 5191-5206 DOI:10.1093/jxb/err229 |
Ichimura K, Casais C, Peck S C et al, 2006. MEKK1 is required for MPK4 activation and regulates tissue-specific and temperature-dependent cell death in Arabidopsis. Journal of Biological Chemistry, 281(48): 36969-36976 DOI:10.1074/jbc.M605319200 |
Inoue T, Hiratsuka M, Osaki M et al, 2007. SIRT2, a tubulin deacetylase, acts to block the entry to chromosome condensation in response to mitotic stress. Oncogene, 26(7): 945-957 DOI:10.1038/sj.onc.1209857 |
Lee J S, Huh K W, Bhargava A et al, 2008. Comprehensive analysis of protein-protein interactions between Arabidopsis MAPKs and MAPK kinases helps define potential MAPK signalling modules. Plant Signaling & Behavior, 3(12): 1037-1041 |
Lee R H, Hsu J H, Huang H J et al, 2009. Alkaline α-galactosidase degrades thylakoid membranes in the chloroplast during leaf senescence in rice. New Phytologist, 184(3): 596-606 DOI:10.1111/j.1469-8137.2009.02999.x |
Liu Y D, Ren D T, Pike S et al, 2007. Chloroplast-generated reactive oxygen species are involved in hypersensitive response-like cell death mediated by a mitogen-activated protein kinase cascade. The Plant Journal, 51(6): 941-954 DOI:10.1111/j.1365-313X.2007.03191.x |
Lukowitz W, Roeder A, Parmenter D et al, 2004. A MAPKK Kinase gene regulates extra-embryonic cell fate in Arabidopsis. Cell, 116(1): 109-119 DOI:10.1016/S0092-8674(03)01067-5 |
Meng X Z, Zhang S Q, 2013. MAPK cascades in plant disease resistance signaling. Annual Review of Phytopathology, 51: 245-266 DOI:10.1146/annurev-phyto-082712-102314 |
Pitzschke A, Djamei A, Bitton F et al, 2009. A major role of the MEKK1-MKK1/2-MPK4 pathway in ROS signalling. Molecular Plant, 2(1): 120-137 DOI:10.1093/mp/ssn079 |
Sangwan V, Örvar B L, Beyerly J et al, 2002. Opposite changes in membrane fluidity mimic cold and heat stress activation of distinct plant MAP kinase pathways. The Plant Journal, 31(5): 629-638 DOI:10.1046/j.1365-313X.2002.01384.x |
Sasabe M, Soyano T, Takahashi Y et al, 2006. Phosphorylation of NtMAP65-1 by a MAP kinase down-regulates its activity of microtubule bundling and stimulates progression of cytokinesis of tobacco cells. Genes & Development, 20(8): 1004-1014 |
Singh R, Lee M O, Lee J E et al, 2012. Rice mitogen-activated protein kinase interactome analysis using the yeast two-hybrid system. Plant Physiology, 160(1): 477-487 DOI:10.1104/pp.112.200071 |
Volkmann D, Baluška F, 1999. Actin cytoskeleton in plants: from transport networks to signaling networks. Microscopy Research & Technique, 47(2): 135-154 |
Wu T, Kong X P, Zong X J et al, 2011. Expression analysis of five maize MAP kinase genes in response to various abiotic stresses and signal molecules. Molecular Biology Reports, 38(6): 3967-3975 DOI:10.1007/s11033-010-0514-3 |
Xiong L Z, Yang Y N, 2003. Disease resistance and abiotic stress tolerance in rice are inversely modulated by an abscisic acid-inducible mitogen-activated protein kinase. The Plant Cell, 15(3): 745-759 DOI:10.1105/tpc.008714 |
Xu H N, Li K Z, Yang F J et al, 2010. Overexpression of CsNMAPK in tobacco enhanced seed germination under salt and osmotic stresses. Molecular Biology Reports, 37(7): 3157-3163 DOI:10.1007/s11033-009-9895-6 |
Xu J, Chua N H, 2012. Dehydration stress activates Arabidopsis MPK6 to signal DCP1 phosphorylation. The EMBO Journal, 31(8): 1975-1984 DOI:10.1038/emboj.2012.56 |
Zeng Q N, Chen J G, Ellis B E, 2011. AtMPK4 is required for male-specific meiotic cytokinesis in Arabidopsis. The Plant Journal, 67(5): 895-906 DOI:10.1111/j.1365-313X.2011.04642.x |
Zhang M M, Su J B, Zhang Y et al, 2018. Conveying endogenous and exogenous signals: MAPK cascades in plant growth and defense. Current Opinion in Plant Biology, 45: 1-10 |
Zhang S Q, Klessig D F, 2001. MAPK cascades in plant defense signaling. Trends in Plant Science, 6(11): 520-527 DOI:10.1016/S1360-1385(01)02103-3 |
Zwerger K, Hirt H, 2001. Recent advances in plant MAP kinase signalling. Biological Chemistry, 382(8): 1123-1131 |
 2019, Vol. 50
2019, Vol. 50


