
中国海洋湖沼学会主办。
文章信息
- 郭东杰, 张芳, 王朋鹏, 吴强. 2019.
- GUO Dong-Jie, ZHANG Fang, WANG Peng-Peng, WU Qiang. 2019.
- 2019年5月黄海及东海北部大型水母分布特征
- DISTRIBUTION AND BIOMASS OF LARGE JELLYFISH IN THE YELLOW SEA AND NORTHERN EAST CHINA SEA IN MAY 2019
- 海洋与湖沼, 50(6): 1292-1301
- Oceanologia et Limnologia Sinica, 50(6): 1292-1301.
- http://dx.doi.org/10.11693/hyhz20190700148
文章历史
-
收稿日期:2019-07-24
收修改稿日期:2019-08-19
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266071;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071;
5. 中国水产科学研究院黄海水产研究所 山东省渔业资源与生态环境重点实验室 青岛 266071
2. Laboratory of Marine Ecology and Environmental Sciences, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
5. Key Laboratory for Fishery Resources and Eco-Environment, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China
20世纪末21世纪初以来, 由于全球变化和人类活动的影响, 黄东海大型水母的数量出现明显的波动, 在个别年份出现暴发的现象, 对我国近海生态系统的结构和功能产生重要影响, 对我国的海洋生态环境安全造成严重威胁(Dong et al, 2010; 孙松, 2012)。水母作为一种胶质类浮游动物, 是鱼类卵、幼鱼等的主要消费者, 也是鱼类饵料生物的主要捕食者。因此, 水母是海洋食物链的重要一环, 维持着海洋生态系统的平衡(Robison et al, 2005; 张芳等, 2009)。大型水母暴发会导致中上层小型鱼类减少, 破坏生态系统中上层的能量平衡, 造成渔业资源捕捞量的下降; 也会导致网具爆破、网眼堵塞等现象发生, 影响海洋渔业生产安全(程家骅等, 2004; Pauly et al, 2009)。大型水母暴发不但会破坏生态系统的结构和功能, 同时会造成核电站进水口的堵塞, 威胁人类生命安全, 影响滨海工业和旅游业的发展(张芳等, 2017)。
在我国近海海域, 暴发的大型水母种类主要是沙海蛰、霞水母、海月水母等(Dong et al, 2010; Zhang et al, 2012; 董婧等, 2013)。笔者所在课题组对黄东海大型水母的种群特征开展了长达十多年的长期监测, 通过大量的室内模拟实验和大规模海上现场调查, 对不同年份不同阶段大型水母的基础生物学信息有比较清楚的认识, 在大型水母的生活史、分布以及生殖策略等方面进行了比较系统的探讨(张芳, 2008; 王彦涛等, 2012; 孙松, 2012; Zhang et al, 2012; Sun et al, 2015)。国内学者研究发现, 东海北部夏季和秋季大型水母的暴发往往伴随着经济鱼类资源量的下降以及渔业资源群落结构的改变(单秀娟等, 2011; 李建生等, 2015)。左涛等(2016)对黄海及东海北部进行调查时指出, 2015年5月份大型水母的生物量与渔业生物生物量大致相等。对大型水母年际变化和暴发机制研究离不开资料的长期积累, 因此积累每年的大型水母生物量等信息必不可少。另外, 每年的5月是大型水母种群补充的重要时期, 因此调查此时的大型水母的种群特征信息对分析其野外种群发生机制有重要的意义。
本研究于2019年5月对黄海及东海北部海域大型水母生物学信息进行大面调查, 获取了大型水母种类组成、伞径及生物量密度等信息; 并与历史调查结果进行分析和比较, 构建黄海及东海北部大型水母的5月份的分布格局, 弥补历史资料的不足。本研究可为进一步积累大型水母的种群动态的基础信息、研究大型水母的年际变化机制, 以及开展我国近海海域大型水母的预测预报工作提供重要的基础。
1 材料与方法 1.1 调查海域及站位设置2019年5月10日—6月11日, 利用中国水产科学院黄海水产研究所“北斗”号渔业资源调查船底拖网, 对整个黄海以及东海北部海域大型水母丰度、生物量、出现情况、伞径等种群特征进行调查。调查包括19个平行断面, 103个站位, 站位按0.5°×0.5°设定。调查站位见图 1。为对比黄海及东海北部不同海域水母种群特征的差异, 将整个调查海域划分为黄海北部、黄海中部、黄海南部和东海北部。
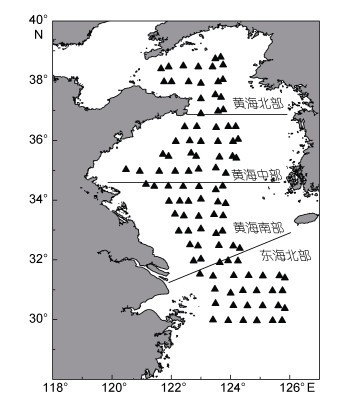 |
| 图 1 调查站位分布及分区 Fig. 1 Sampling stations and divisions of the survey area |
水母样品采用底拖网的方式进行采集, 拖网速度控制在3kn左右, 每个站位的拖网时间为0.3—1h。出现水母生物量过大, 超出船的拖曳能力, 或极端天气时, 适当缩短拖曳的时间。拖网结束, 现场记录水母的种类、数量, 并对水母的伞径进行随机测量, 大型水母的丰度(ind./km2)、生物量(kg/km2)根据Zhang等(2012)报道由现场测量的伞径计算得出。同步的温度、盐度等环境因子由Seabird-25PLUS型CTD测定。
1.3 数据统计本研究数据统计、处理所用软件为Surfer 13、SPSS Statistics 22。非参数Kruskal-Wallis检验用来对比不同海域(东海北部、黄海南部、中部及北部)大型水母伞径大小是否有差异; Spearman相关性分析用来检验大型水母的伞径、生物量与温度、盐度的关系。
2 结果 2.1 温盐分布特征调查期间, 整个调查海区的表层温度的分布范围为10.57—22.04℃, 底层温度的分布范围为5.21— 20.95℃; 表层盐度的分布范围为27.09—33.44, 底层盐度的分布范围为30.63—34.33(表 1)。其中在黄海中部、南部交界处及黄海北部海域出现两个底层温度的低值。在黄海南部及东海北部海域出现盐度的低值区, 显著小于盐度均值。
| 海域 | 温度(℃) | 盐度 | |||
| 表层 | 底层 | 表层 | 底层 | ||
| 黄海北部 | 10.57—14.23 | 5.21—8.90 | 30.96—32.41 | 32.13—32.50 | |
| 黄海中部 | 13.27—19.11 | 7.10—13.48 | 31.43—32.95 | 31.92—33.28 | |
| 黄海南部 | 15.18—20.70 | 9.51—18.13 | 28.70—33.07 | 30.63—33.42 | |
| 东海北部 | 17.48—22.04 | 12.15—20.95 | 27.09—33.44 | 31.27—34.33 | |
本航次中, 捕获的主要大型水母包括:沙海蛰(Nemopilema nomurai), 白色霞水母(Cyanea nozakii), 洋须水母(Ulmaridae)及多管水母(Aequorea spp.)。在所有调查的103个站位中, 有29个站位出现沙海蛰, 占所有调查站位的28.2%;有18个站位出现霞水母, 占所有调查站位的17.5%;有19个站位出现洋须水母, 占所有调查站位的18.4%;有52个站位出现多管水母, 占所有调查站位的50.5%。
2.3 丰度、生物量分布本航次期间, 沙海蛰在东海北部离岸海域出现高密度区, 黄海南部海域沙海蛰生物量较低, 黄海中部、北部海域未出现沙海蛰(图 2a)。沙海蛰生物量最大值出现在站位(125.61°E, 30.50°N), 丰度和生物量密度分别为3429.20ind./km2、6422.16kg/km2; 生物量最小值出现在站位(122.63°E, 32.538°N), 丰度和生物量密度分别为16.60ind./km2、0.60kg/km2。东海北部沙海蛰丰度和生物量均值分别为(652.87±1101.715)ind./km2、(997.17±1644.72)kg/km2, 黄海南部丰度和生物量均值分别为(243.75±718.09)ind./km2、(106.32±249.87)kg/km2。
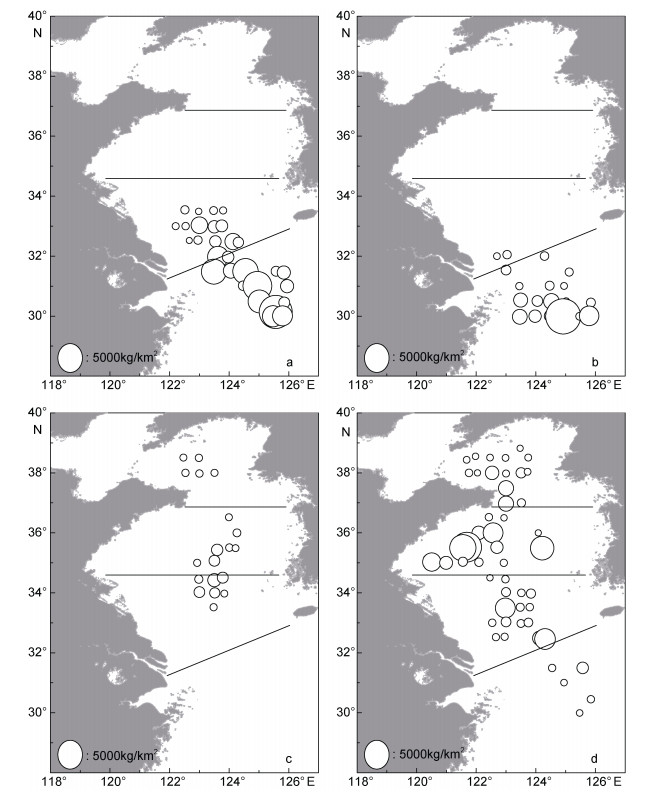 |
| 图 2 2019年5月黄海及东海北部大型水母生物量分布 Fig. 2 Distributions of biomass (kg/km2) of large jellyfish in the Yellow Sea (YS) and northern part of East China Sea (ECS) in May, 2019 注: a.沙海蛰; b.白色霞水母; c.洋须水母; d.多管水母 |
白色霞水母在东海北部(30°—31.5°N)出现生物量高值区, 站位出现频率较高; 黄海南部海域仅在最南端两个站位发现白色霞水母; 黄海中部、北部海域未发现白色霞水母(图 2b)。白色霞水母生物量最大值出现在站位(124.89°E, 30.00°N), 丰度和生物量密度分别为14753.32ind./km2、7417.49kg/km2; 生物量最小值出现在站位(122.753°E, 32.00°N), 丰度和生物量密度分别为10.28ind./km2、5.99kg/km2。东海北部白色霞水母丰度和生物量均值分别为(896.90±2803.84)ind./km2、(442.05±1412.48)kg/km2, 黄海北部丰度和生物量均值分别为(2.42±11.47)ind./km2、(1.96±9.68)kg/km2。
洋须水母在黄海及东海北部集中出现在两部分海域, 一是黄海南部、中部海域, 该海域站位生物量密度较高; 二是黄海北部海域, 该海域洋须水母数量较少, 生物量较低(图 2c)。洋须水母生物量最大值出现在站位(123.50°E, 34.385°N), 丰度和生物量密度分别为1375.99ind./km2、449.94kg/km2; 最小值出现在站位(123.83°E, 33.92°N), 丰度和生物量密度分别为25.07ind./km2、8.62kg/km2。黄海南部海域分布比较集中, 洋须水母丰度和生物量均值分别为(98.10± 275.99)ind./km2、(36.50±97.98)kg/km2; 中部海域洋须水母丰度和生物量均值分别为(53.90±181.88)ind./km2、(19.59±61.20)kg/km2; 黄海北部海域洋须水母丰度和生物量均值分别为(5.27±10.16)ind./km2、(4.30±7.12)kg/km2。
另外, 多管水母在黄海及东海北部海域分布较为广泛, 黄海中部近岸海域站位多管水母数量较多, 出现丰度及生物量高值区; 其次是黄海南部及东海北部, 黄海北部海域的生物量最低, 但该海域多管水母的站位出现频率最高, 为72.2%(图 2d)。多管水母生物量最大值出现在站位(121.72°E, 35.57°N), 丰度和生物量密度分别为19651.65ind./km2、4901.42kg/km2; 最小值出现在站位(124.08°E, 36.00°N), 丰度和生物量密度分别为7.80ind./km2、1.21kg/km2。东海北部多管水母丰度和生物量均值分别为(392.44±1784.46)ind./km2、(107.78± 510.88)kg/km2, 黄海南部丰度和生物量均值分别为(1030.93±3134.56)ind./km2、(158.06±459.28)kg/km2, 黄海中部丰度和生物量均值分别为(2034.20± 4439.131)ind./km2、(475.29±1139.11)kg/km2, 黄海北部丰度和生物量均值分别为(717.54±1774.44)ind./km2、(86.21±207.50)kg/km2。
| 海域 | 沙海蛰 | 白色霞水母 | 洋须水母 | 多管水母 | 总计 | |
| 平均生物量密度(kg/km2) | 东海北部 | 997.17 | 442.05 | - | 107.78 | 1547.00 |
| 黄海南部 | 106.32 | 1.96 | 36.50 | 158.06 | 302.84 | |
| 黄海中部 | - | - | 19.59 | 475.29 | 494.88 | |
| 黄海北部 | - | - | 4.30 | 86.21 | 90.51 |
沙海蛰个体伞径最大值为88cm, 出现在站位(124.09°E, 32.5°N); 最小值为3cm, 出现在站位(122.90°E, 32.5°N), 平均值为(24.85±14.36)cm(图 3a)。东海北部的沙海蛰个体, 伞径介于13—78cm之间, 均值为(32.70±11.07)cm; 黄海南部海域个体, 伞径介于3—88cm之间, 均值为(16.40±12.61)cm (图 4a)。整个调查海域, 沙海蛰个体伞径分布不均匀, 在黄海南部长江口外侧海域(122.58°—124.09°E, 32.5°—33°N), 采集到大量伞径小于10cm的水母幼体。非参数Kruskal-Wallis检验结果(H=127.059, df=1, P=0.000 < 0.01)显示, 东海北部海域沙海蛰个体伞径显著大于黄海南部海域。
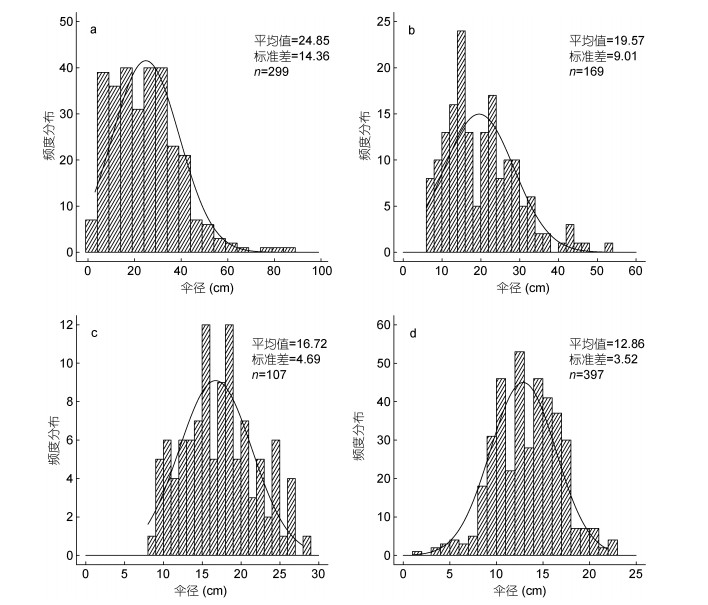 |
| 图 3 2019年5月黄海及东海北部大型水母个体伞径大小百分比 Fig. 3 Frequency of occurrence of bell diameters of large jellyfish in the Yellow Sea (YS) and northern part of East China Sea (ECS) in May 2019 注: a.沙海蛰; b.白色霞水母; c.洋须水母; d.多管水母 |
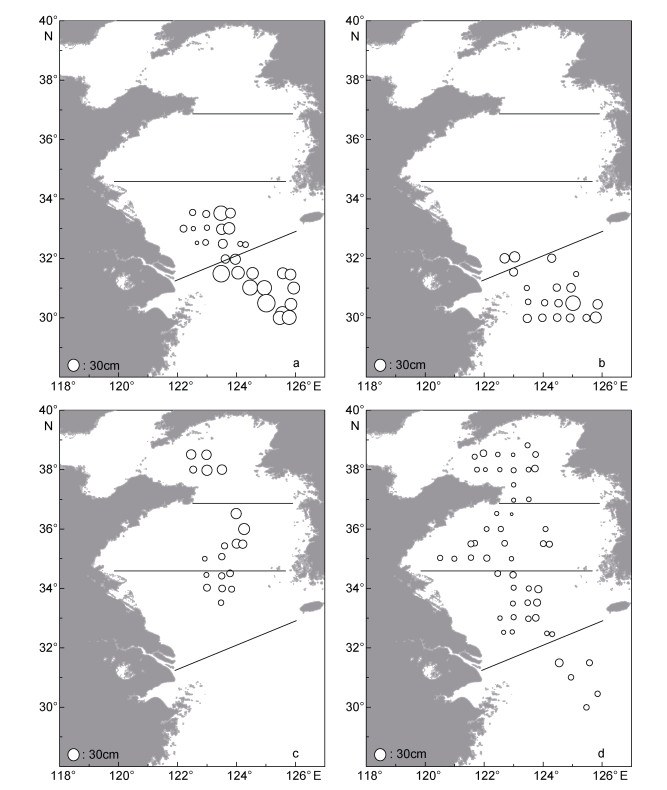 |
| 图 4 2019年5月黄海及东海北部大型水母平均伞径分布 Fig. 4 Distributions of bell diameters (cm) of large jellyfish in the Yellow Sea(YS) and northern part of East China Sea (ECS) in May, 2019 注: a.沙海蛰; b.白色霞水母; c.洋须水母; d.多管水母 |
白色霞水母个体伞径最大值为52cm, 出现在站位(123.40°E, 30.02°N); 最小值为6cm, 出现在站位(123.40°—124.10°E, 30.02°—31.05°N), 平均值为(19.57±9.00)cm(图 3b)。东海北部的霞水母个体, 伞径介于6—52cm之间, 均值为(19.38±9.00)cm; 黄海南部白色霞水母个体较少, 均值为(25.6±7.40)cm (图 4b)。调查发现, 在长江口附近海域出现伞径在6—8cm之间的幼体, 外海海域多出现伞径较大、较为成熟的个体。非参数Kruskal-Wallis检验结果(H=3.298, df=1, P=0.068 > 0.05)显示, 东海北部与黄海南部个体伞径之间没有差异。
洋须水母个体伞径最大值为28cm, 出现在站位(124.26°E, 36.07°N); 最小值为8cm, 出现在站位(122.94°E, 34.50°N), 平均值为(16.72±4.69)cm(图 3c)。黄海南部及中部海域, 洋须水母个体伞径介于8—28cm之间, 均值为(16.23±4.52)cm; 黄海北部海域个体伞径介于14—26cm之间, 均值为(21.44± 4.03)cm (图 4c)。调查发现, 洋须水母个体伞径大小在调查海域分布不均匀, 在黄海南部与中部海域交界处(123°E, 35°N)采集到少量伞径小于10cm的洋须水母个体。非参数Kruskal-Wallis检验结果(H = 9.568, df = 1, P = 0.002 < 0.01)显示, 黄海北部海域洋须水母个体显著大于黄海中部及南部海域个体。
多管水母个体伞径最大值为22cm, 出现在站位(121.91°E, 35.5°N)和(123.75°E, 33.51°N); 最小值为3cm, 出现在站位(123.00°E, 36.93°N)和(122.86°E, 36.5°N), 平均值为(12.86±3.52)cm (图 3d)。东海北部多管水母个体伞径介于10—21cm之间, 均值为(14.65±2.70)cm; 黄海南部个体伞径介于8—22cm之间, 均值为(13.29±3.10)cm; 黄海中部个体伞径介于3—22cm之间, 均值为(12.84±3.82)cm; 黄海北部个体伞径介于4—17cm之间, 均值为(11.62±3.21)cm (图 4d)。调查发现, 东海北部海域多管水母个体均为大于10cm的较为成熟的个体, 伞径分布较为均匀; 在山东半岛东部海域(122.45—123.00°E, 36.491— 37.43°N)以及站位(122.91°E, 38.5°N)发现伞径在3— 4cm的个体。非参数Kruskal-Wallis检验结果(H = 19.853, df = 3, P = 0.000 < 0.01)显示, 各海区伞径大小差异显著。
2.5 伞径与温度、盐度相关性为了讨论四种大型水母种群特征的影响因素, 对采集到的大型水母伞径信息与温度、盐度进行了Spearman相关分析。结果显示, 温度、盐度对大型水母伞径影响显著。其中, 沙海蛰和多管水母与表层温度、表层盐度及底层盐度呈现正相关关系; 白色霞水母与表层温度及底层盐度呈现负相关关系, 与表层盐度呈现正相关关系; 洋须水母与底层温度、底层盐度呈现负相关关系。沙海蛰幼水母体出现在底层温度范围为13.42—16.43℃、底层盐度范围为30.63— 32.34的黄东海交界海域, 东海北部高温、高盐海域个体伞径较大; 白色霞水母幼水母体出现在底层温度、底层盐度较高的近岸海域, 分布中心底温、底盐范围分别为19.61—20.95℃、33.92—34.33, 低温、低盐的离岸海域个体伞径较大; 洋须水母幼水母体出现在底层温度为10.14—10.65℃, 底层盐度范围为33.17—33.36的黄海海域, 北部底温底盐更低海域个体伞径较大; 多管水母幼水母体出现在底层温度较低的山东半岛外侧海域, 底温、底盐范围分别为5.53—12.28℃、31.94—32.33, 南部高温、高盐海域个体伞径较大。
| 水母种类 | 相关性分析 | |||
| 表层温度 | 表层盐度 | 底层温度 | 底层盐度 | |
| 沙海蛰Nemopilema nomurai | 0.136* | 0.411** | 0.093 | 0.558** |
| 白色霞水母 Cyanea nozakii | −0.258** | 0.167* | −0.113 | −0.166* |
| 洋须水母Ulmaridae | −0.035 | −0.205 | −0.503** | −0.529** |
| 多管水母 Aequorea spp. | 0.232** | 0.178** | 0.065 | 0.230** |
根据本文调查结果, 该种仅在调查海域南部出现, 主要集中分布于黄海南部和东海北部离岸海域。东海北部沙海蛰生物量较大, 在离岸海域形成生物量高值区, 最大生物量达到6422.16kg/km2, 个体伞径介于13—78cm之间, 均值为32.70cm。黄海南部海域沙海蛰生物量较低, 伞径个体介于3—88cm之间, 均值为16.40cm (图 2a, 图 4a)。调查过程中, 在长江口外侧、黄东海交界处海域(122.58°—124.09°E, 32.50°—33.00°N)采集到较多(n=25)伞径小于10cm的沙海蛰幼体, 最小个体伞径为3cm, 最早于5月下旬出现在站位(123.00°E, 33.03°N)。张芳(2008)在2006年6月中旬在对长江口毗邻海域调查时发现, 沙海蛰幼体主要分布在122.00°—123.00°E、32.50°—33.00°N, 伞径均值为(10.0±4.4)cm; 2007年5月初仅在在黄、东海交界处(124°E, 33°N)发现沙海蛰幼体, 伞径长5—10cm。左涛等(2016)在2015年5月份对黄海及东海北部海域调查时发现, 沙海蛰个体仅出现在东海北部海域以及黄海南部(33°N以南)的站位; 沙海蛰幼体主要分布在122.50°—124.00°E, 32.00°—32.50°N海域, 站位伞径均值10cm。对比发现, 沙海蛰幼体的伞径分布差异很可能是长江口外侧海域沙海蛰发生源地及发生时间的时空差异造成的。根据左涛等(2016)调查结果, 2015年5月份沙海蛰出现站位底层温度范围10.82—17.68℃, 本航次调查结果显示, 2019年5月份沙海蛰出现站位底层温度范围为10.07—18.56℃, 幼水母体分布中心的底层温度13.42—16.43℃。对于沙海蛰而言, 水温的变化是促使其横裂生殖的诱因(Kawahara et al, 2006; Feng et al, 2015a), 在野外状态下当自然海区温度上升到10—18℃时, 开始横裂生殖(Feng et al, 2015a, 2015b)。因此不同年份温度的变化是导致黄东海沙海蛰的首先出现水母体时间和地点差异的重要原因。
3.1.2 白色霞水母根据本文结果, 该种主要分布在调查海域南部, 主要分布在东海北部海域。在东海北部海域(124.92°—125.79°E, 30.00°N)形成白色霞水母生物量高值区, 伞径介于6—52cm之间, 均值为19.38cm; 黄海南部海域, 仅在最南端两个站位出现数量较少的(n=5)白色霞水母, 伞径介于16—34cm, 均值为25.6cm(图 2b, 图 4b)。调查过程中, 在东海北部近岸海域(123.45°—124.05°E, 29.98°—30.00°N)采集到伞径介于6—7cm的白色霞水母幼体(n=7), 最早出现时间为5月下旬。霞水母具有偏暖水高盐的生态习性, 主要分布在31°N以南的暖水高盐水域, 最适温度为17—26℃(周永东等, 2004; 程家骅等, 2005; 张芳, 2008; Zhang et al, 2012)。周永东等(2004)在1999—2003年前对黄、东海调查时发现, 白色霞水母最早于4月份出现在浙江近海海域, 5月份开始迅速向外扩散, 逐渐遍布浙江中北部近岸海区; 张芳(2008)在2007年5月对长江口毗邻海域进行调查时发现, 白色霞水母出现在(123.50°E, 30.00°N)附近海域, 伞径均值为16.0cm; 左涛等(2016)在2015年5月对黄海及东海北部海域调查时发现, 白色霞水母出现于31°N以南东海北部近岸海域, 生物量密度介于80—300kg/km2, 未采集到伞径小于20cm白色霞水母个体; 而2019年5月份白色霞水母的分布范围更广, 生物量也更高, 为5.99—7417.49kg/km2。对比不同年份白色霞水母在东海北部海域分布特点, 发现该种在东海北部最早出现的时间会有差异, 最早出现的海域变化不大, 且是以浙江北部近海为中心; 对比2015年与2019年5月份东海北部海域底层温度和盐度的分布特征, 发现相同站位底层盐度变化不大, 相同站位2019年底层温度平均上升1℃。因此, 作者推测不同年份, 白色霞水母首先出现水母体的时间会有差异, 地点变化不大; 同时, 温度的上升很可能是导致2019年5月白色霞水母生物量与2015年同期相比上升的原因。
3.1.3 洋须水母根据本文调查结果, 该种主要分布在黄海海域水深较深海域。黄海中部、南部海域形成生物量高值区, 伞径介于8—28cm之间, 均值为16.24cm; 黄海北部海域采集到少量(n=10)的洋须水母个体, 伞径介于14—26cm之间, 均值为21.44cm (图 2c, 图 4c)。调查过程中, 在黄海南部与中部海域交界处(123°E, 35°N)采集到少量伞径小于10 cm的洋须水母个体, 出现时间为5月中下旬。根据Zhang等(2012)报道, 2007年5月洋须水母是主要的优势种类, 主要分布在黄海中部受黄海冷水团控制的海域, 高密度区底层温度和底层盐度范围为9—10℃和33—34之间; 左涛等(2016)在2015年5月对黄东海海域进行调查时发现, 洋须水母主要分布在黄海中部海域, 最小个体伞径为9cm, 伞径呈现沿纬度增加的趋势; 在黄海北部海域采集到的少量伞径较大的洋须水母个体。张芳(2008)指出, 在黄海冷水团存在的时期, 洋须水母是其很好的指示种类, 洋须水母的分布变化可作为黄海冷水团消长的标志。黄海冷水团具有南北两个冷中心, 北黄海冷团中心位置比较稳定, 位于北黄海中部偏西海域; 南黄海冷团中心位置变化较大, 大致位于124°E以西、35.50°—36.45°N海域(翁学传等, 1989)。根据洋须水母伞径分布调查结果, 结合黄海冷水团分布特征, 作者推测, 在黄海中部及北部海域中心分别存在两个洋须水母种群源头, 并且受温度的影响, 北部海域洋须水母水母体出现时间更早。对比2015年与2019年5月洋须水母在黄海及东海北部分布特征, 黄海中部及北部海域站位分布基本相似, 2019年生物量更低; 2019年黄海南部海域洋须水母分布站位明显增加, 生物量更高。由于天气以及海况原因, 本航次对黄海南部深水海域调查时间为6月上旬, 此时黄海中部冷水团尚处于成长阶段, 作者认为, 洋须水母在黄海南部海域分布的差异很可能是由于本航次调查时间的滞后造成的。
3.1.4 多管水母根据本文调查结果, 该种为调查海域数量的第一优势种类(其丰度占大型水母总丰度的70%), 在整个调查海区均有分布, 站位出现频率为50.5%。黄海中部海域(35.5°N)近岸海域出现生物量高值区, 站位丰度值在10000ind./km2以上, 平均生物量为4264.66kg/km2, 站位伞径均值为15cm (图 2d, 图 4d)。调查过程中, 在山东半岛东部近岸海域(122.43°—123.00°E, 36.50°—36.97°N)采集到伞径小于5cm的多管水母幼体, 出现时间为5月中旬。周永东等(2004)在2000年5月对黄东海进行调查时发现, 在125°E、32°N附近海域出现伞径7—10cm的多管水母个体。王彦涛等(2012)在2011年4月对黄东海大面调查时发现, 墨绿多管水母仅在调查海域南部出现, 伞径与温度、盐度呈正相关关系, 最高丰度出现在长江口冲淡水外侧东海北部区域; 并提出, 墨绿多管水母来源于舟山群岛附近海域。张芳(2008)在2007年5月份对黄海海域进行调查时发现, 山东半岛南岸站位多管水母生物量达到8262kg/km2。左涛等(2016)在2015年对黄东海调查时发现, 多管水母主要分布在两处海域。在黄海中部山东半岛南岸(121.5°E, 35.5°N)海域出现生物量大于20000kg/km2的极高密度区, 伞径介于3—12cm, 站位平均伞径最小值出现在黄海中部话语; 东海北部外海海域站位分布比较密集, 个体伞径介于6—18cm, 未出现黄海中部的极高密度区。本航次, 5月份从东海北部到黄海北部, 随着温度的降低, 多管水母的平均伞径逐渐降低, Pearson相关性检验结果显示, 多管水母的伞径与表层温度及盐度均显示极显著的正相关关系, 这与前文报道结果相符; 本文未对多管水母种进行区分, 多管水母幼体仅在调查海域北部出现, 作者推测, 黄海及东海北部海域存在多个多管水母源地, 并且南部海域多管水母水母体出现时间早于北部海域; 相比于2007年和2015年, 2019年多管水母的数量较少。
3.2 2019年和2015年不同海域生物量的年间差异本航次各大型水母种类的生物量密度地理分布特征为:东海北部主要是沙海蛰、白色霞水母和多管水母; 黄海南部四种大型水母均有分布; 黄海中部和北部主要是洋须水母和多管水母。其中, 东海北部海域大型水母的生物量最高, 平均值为1547.00kg/km2, 以沙海蛰和白色霞水母贡献最多, 在离岸海域形成高密度区; 黄海中部海域大型水母的生物量次之, 平均值为494.88kg/km2, 主要是多管水母, 在山东半岛南部海域形成密度高值区; 黄海南部大型水母生物量较低, 平均值为302.84kg/km2, 主要由多管水母、沙海蛰和洋须水母贡献; 黄海北部海域大型水母生物量最低, 平均值为90.51kg/km2, 主要是多管水母(表 2)。与2015年同期相比(表 4), 东海北部海域沙海蛰生物量从44.04kg/km2上升到997.17kg/km2, 白色霞水母和多管水母生物量出现小幅增加, 海域整体生物量增加明显; 黄海南部出现少量白色霞水母, 生物量较低, 沙海蛰、洋须水母和多管水母生物量均有所增加, 海域整体生物量增加; 黄海中部洋须水母和多管水母均有所减少, 海域整体生物量降低明显; 黄海北部出现少量多管水母, 洋须水母的生物量有所减少, 海域整体生物量增加。对比整个调查海域, 黄海及东海北部海域大型水母生物量增加, 生物量高值区由黄海中部变为东海北部, 生物量密度优势种从多管水母变为沙海蛰。
| 海域 | 沙海蛰 | 白色霞水母 | 洋须水母 | 多管水母 | 总计 | |
| 平均生物量密度(kg/km2) | 东海北部 | 22.02 | 24.94 | - | 19.47 | 66.43 |
| 黄海南部 | 0.29 | - | 0.79 | 1.52 | 2.60 | |
| 黄海中部 | - | - | 266.11 | 1101.03 | 1367.14 | |
| 黄海北部 | - | - | 17.33 | - | 17.33 |
本航次采集到的大型水母主要包括沙海蛰、白色霞水母、洋须水母和多管水母四种, 其中, 以沙海蛰生物量最高, 多管水母数量最多。5月份, 沙海蛰和白色霞水母主要分布在调查海域南部, 东海北部离岸海域为生物量高值区, 个体伞径较大; 洋须水母主要分布于黄海深海海域; 多管水母分布范围较广, 山东半岛东部为生物量高值区, 北部海域个体较小。对比2015年同期调查发现, 沙海蛰和白色霞水母在调查海域南部生物量增加明显, 洋须水母和多管水母整体生物量有所降低。整体来说, 2019年5月份黄海及东海北部大型水母生物量分布对比2015年同期有所增加。
致谢 本次调查搭载中国水产科学院黄海水产研究所承担的青岛海洋科学与技术试点国家实验室共享航次, 海上水母样品采集和CTD数据的获取得到“北斗”渔业调查船全体船员的大力支持, 谨致谢忱。
王彦涛, 孙松, 王世伟, 等. 2012. 2011年春季黄、东海墨绿多管水母(Aequorea coerulescens)分布特征. 海洋与湖沼, 43(6): 1096-1102 |
左涛, 王俊, 吴强, 等. 2016. 2015年5月黄海及东海北部大型水母分布及生物量估算. 海洋与湖沼, 47(1): 195-204 |
孙松. 2012. 对黄、东海水母暴发机理的新认知. 海洋与湖沼, 43(3): 406-410 |
李建生, 凌建忠, 程家骅. 2015. 东、黄海沙海蜇暴发对游泳动物群落结构的影响. 海洋渔业, 37(3): 208-214 DOI:10.3969/j.issn.1004-2490.2015.03.002 |
张芳, 2008.黄东海胶质浮游动物水母类研究.青岛: 中国科学院大学海洋研究所博士学位论文 http://d.wanfangdata.com.cn/Thesis/Y1613291
|
张芳, 孙松, 李超伦. 2009. 海洋水母类生态学研究进展. 自然科学进展, 19(2): 121-130 DOI:10.3321/j.issn:1002-008X.2009.02.001 |
张芳, 李超伦, 孙松, 等. 2017. 水母灾害的形成机理、监测预测及防控技术研究进展. 海洋与湖沼, 48(6): 1187-1195 |
周永东, 刘子藩, 薄治礼, 等. 2004. 东、黄海大型水母及其调查监测. 水产科技情报, 31(5): 224-227 DOI:10.3969/j.issn.1001-1994.2004.05.018 |
单秀娟, 庄志猛, 金显仕, 等. 2011. 长江口及其邻近水域大型水母资源量动态变化对渔业资源结构的影响. 应用生态学报, 22(12): 3321-3328 |
翁学传, 张以恳, 王从敏, 等. 1989. 黄海冷水团的变化特征. 青岛海洋大学学报, 19(1): 119-131 |
董婧, 姜连新, 孙明, 等. 2013. 渤海与黄海北部大型水母生物学研究. 北京: 海洋出版社
|
程家骅, 丁峰元, 李圣法, 等. 2005. 东海区大型水母数量分布特征及其与温盐度的关系. 生态学报, 25(3): 440-445 DOI:10.3321/j.issn:1000-0933.2005.03.009 |
程家骅, 李圣法, 丁峰元, 等. 2004. 东、黄海大型水母暴发现象及其可能成因浅析. 现代渔业信息, 19(5): 10-12 DOI:10.3969/j.issn.1004-8340.2004.05.003 |
Dong Z J, Liu D Y, Keesing J K, 2010. Jellyfish blooms in China: Dominant species, causes and consequences. Marine Pollution Bulletin, 60(7): 954-963 DOI:10.1016/j.marpolbul.2010.04.022 |
Feng S, Wang S W, Sun S et al, 2015b. Strobilation of three scyphozoans (Aurelia coelurea, Nemopilema nomurai, and Rhopilema esculentum) in the field at Jiaozhou Bay, China. Marine Ecology Progress Series, 591: 141-153 |
Feng S, Zhang G T, Sun S et al, 2015a. Effects of temperature regime and food supply on asexual reproduction in Cyanea nozakii and Nemopilema nomurai. Hydrobiologia, 754(1): 201-214 DOI:10.1007/s10750-015-2279-0 |
Kawahara M, Uye S, Ohtsu K et al, 2006. Unusual population explosion of the giant jellyfish Nemopilema nomurai (Scyphozoa: Rhizostomeae) in East Asian waters. Marine Ecology Progress Series, 307: 161-173 DOI:10.3354/meps307161 |
Pauly D, Graham W, Libralato S et al, 2009. Jellyfish in ecosystems, online databases, and ecosystem models. Hydrobiologia, 616(1): 67-85 DOI:10.1007/s10750-008-9583-x |
Robison B H, Reisenbichler K R, Sherlock R E, 2005. Giant larvacean houses: Rapid carbon transport to the deep sea floor. Science, 308(5728): 1609-1611 DOI:10.1126/science.1109104 |
Sun S, Zhang F, Li C L et al, 2015. Breeding places, population dynamics, and distribution of the giant jellyfish Nemopilema nomurai (Scyphozoa: Rhizostomeae) in the Yellow Sea and the East China Sea. Hydrobiologia, 754(1): 59-74 DOI:10.1007/s10750-015-2266-5 |
Zhang F, Sun S, Jin X S et al, 2012. Associations of large jellyfish distributions with temperature and salinity in the Yellow Sea and East China Sea. Hydrobiologia, 690(1): 81-96 DOI:10.1007/s10750-012-1057-5 |
 2019, Vol. 50
2019, Vol. 50


