中国海洋湖沼学会主办。
文章信息
- 黄萌萌, 雷宇桐, 王高杨, 康婷, 许学伟. 2019.
- HUANG Meng-Meng, LEI Yu-Tong, WANG Gao-Yang, KANG Ting, XU Xue-Wei. 2019.
- 三疣梭子蟹(Portunus trituberculatus)含新型关键识别基序DPY/WTD单结构域C型凝集素PtCTL-6的免疫功能研究
- CHARACTERIZATION OF SINGLE CRD CONTAINING C-TYPE LECTIN WITH NOVEL MOTIF DPY/WTD FROM PORTUNUS TRITUBERCULATUS
- 海洋与湖沼, 50(6): 1302-1308
- Oceanologia et Limnologia Sinica, 50(6): 1302-1308.
- http://dx.doi.org/10.11693/hyhz20190700131
文章历史
-
收稿日期:2019-07-03
收修改稿日期:2019-07-23
2. 浙江理工大学 生命科学与医药学院 杭州 310018
2. College of Life Sciences and Medicine, Zhejiang Sci-Tech University, Hangzhou 310018, China
C型凝集素是一类能与糖分子特异性结合的蛋白。区别于其他类型的凝集素, 它们的活性依赖于Ca2+, 且含有一个或多个长约115—130个氨基酸残基糖识别结构域(Carbohydrate-recognition domain, CRD)(Weis et al, 1998)。根据CRD的序列、一级结构和功能特征, 可将C型凝集素分为6个家族, 每一家族成员都具有同源的氨基酸序列。大多数C型凝集素可以与D型甘露糖(D-mannose)、D型葡萄糖(D-glucose)这一类的Man型配体(Man-type ligands)或D型半乳糖(D-galactose)及其衍生物(Gal型配体, Gal-type ligands)结合(Zelensky et al, 2005)。同时, 它还能识别“非己”, 激活胞内信号通路并调节细胞因子的表达而促进机体对微生物的清除、激活补体系统、介导细胞间的粘附、促进细胞凋亡和介导形态发生(Vasta et al, 2007)。目前, 已有1000多个C型凝集素相继被鉴定, 其生物学功能的多样性和广泛性备受研究者们的关注。
三疣梭子蟹(Portunus trituberculatus)以其生长快、个体大、肉质鲜美等特点, 1981年已被列为我国海洋水产养殖对象(孙颖民等, 1984)。近年来, 梭子蟹养殖产业规模呈逐年增加趋势。然而, 弧菌病、甲壳溃疡病、丝状细菌病、固着类纤毛虫病、丝状藻类附着症、乳化病、颤抖病等病害问题严重困扰梭子蟹养殖产业的发展(Ye et al, 2016; 李蒙等, 2019)。传统的抗生素防治虽可部分解决这一问题, 但是长期盲目滥用药物已经导致细菌产生严重的耐药性, 而且蟹类病害暴发的病因也日趋多样化。这就迫切需要从三疣梭子蟹自身的免疫防御系统入手研究其抗病机制进而开发新型的抗菌药物进行免疫防治。
目前人们逐渐关注甲壳动物C型凝集素的研究, 发现了数量众多的凝集素并系统地研究了他们的免疫活性, 发现能参与“非己”识别, 如中华绒螯蟹的EsCTL能结合革兰氏阴性菌、革兰氏阳性菌以及真菌(Huang et al, 2014)。在之前研究工作中我们发现三疣梭子蟹PtCTL-2和PtCTL-3具备广谱的“非己”识别活性, 同时能促进血淋巴细胞对异物的包囊化作用(Huang et al, 2017)。在本研究中, 我们对三疣梭子蟹来源的PtCTL-6进行了鉴定以及功能验证。采用分子生物学及免疫学技术系统研究其PAMPs结合活性、菌结合活性、凝菌活性, 对其分子识别机制进行了初步探索。该论文研究结果有助于人们理解甲壳动物C型凝集素结构多样性与功能间的关系。
1 实验材料与方法 1.1 三疣梭子蟹与微生物三疣梭子蟹由浙江省宁波市养殖场提供, 平均体重为(150±10)g, 于25℃清洁过滤海水暂养一周后进行试验。
藤黄微球菌(Micrococcus luteus)、金黄色葡萄球菌(Staphylococcus aureus)和大肠杆菌(Escherichia coli)购于北京微生物培养收集中心, 河弧菌(Vibrio vulnificus)、副溶血弧菌(Vibrio parahaemolyticus)和酿酒酵母(Saccharomyces cerevisiae)购于全球生物资源中心(美国), 毕赤酵母(P. pastoris GS115)购于Invitrogen公司。
1.2 RNA的分离纯化和cDNA的合成采用Trizol (Invitrogen)试剂提取三疣梭子蟹组织总RNA, 采用1%琼脂糖凝胶电泳检测RNA的完整性。采用DNaseI(Promega)处理分解组织DNA, 再采用M-MLV(Promega)反转录酶试剂盒合成cDNA模板并保存于−80℃备用。
1.3 PtCTL-6基因的序列分析根据实验室已测得转录组数据进行blast比对获得PtCTL-6基因全长, 序列已在线提交至NCBI数据库, 其GenBank序列号为MK967509。利用ExPASy软件(http://web.expasy.org/compute_pi/)对该基因编码蛋白分子量和等电点进行预测, 利用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/)对信号肽序列进行预测, 利用SMART(http://smart.embl-heidelberg.de/)在线预测该基因编码多肽链的功能域。
1.4 PtCTL-6功能域序列的克隆用带有限制性内切酶NdeI的正向引物PtF (5′-GGAATTCCATATGCACAAGCGTTATGCGTGCCC-3′)和XhoI的反向引物PtR (5′-CCGCTCGAGTT ATTGTTCGTTGCTATCGCTA-3′)扩增PtCTL-6去掉信号肽后成熟肽的cDNA序列, 并将PCR产物连接至pMD-18T载体(Takara)。
1.5 PtCTL-6基因重组表达载体的构建使用内切酶NdeI和XhoI对重组克隆载体pMD-18T-PtCTL-6进行双酶切, 得目的片段PtCTL-6;在T4连接酶的作用下与被同种酶处理过的表达载体pET-32a(+)连接, 转入大肠杆菌感受态细胞BL21(DE3)中。通过菌落PCR验证重组表达载体是否构建成功。
1.6 重组蛋白PtCTL-6的诱导表达挑选一个阳性转化子过夜活化培养16h, 转接进诱导表达体系, 37℃培养3h后加入诱导剂异丙基硫代半乳糖苷(IPTG)至终浓度为0.5mmol/L, 并于16℃持续培养20h。通过SDS-PAGE分析蛋白表达情况。
1.7 重组蛋白PtCTL-6表达产物的纯化将加入IPTG诱导表达后的菌液进行离心收集, 收集菌体加入TBS (50mmol/L Tris-HCl, 150mmol/L NaCl)溶液进行超声破碎; 将破碎后的菌液以10000g转速进行离心, 分别收集沉淀和上清液, 通过SDS-PAGE分析蛋白是否可溶表达。采用镍-琼脂糖凝胶(Ni-NTA)法对蛋白质溶液进行纯化。获得纯化蛋白后采用PEG-20000将其浓缩, 并用Bradford法测定蛋白浓度。
1.8 PAMPs结合活性分析将PAMPs用碳酸氢钠包被液过夜包被于96孔酶标板中; 将酶标板中液体倒掉并清洗, 每孔加入BSA进行封闭孵育; 用2倍稀释法每孔加入100μL重组蛋白孵育; 倒去重组蛋白并清洗, 加入抗6×His标签多克隆抗体并孵育; 最后清洗掉未结合的抗体并使用EL-TMB显色试剂盒进行显色, 酶标仪测其在450nm波长下的吸光度(OD450)。
1.9 菌结合活性分析将各类微生物培养至对数生长期, 离心后TBS洗两次并重悬至104CFU, 其后方法同1.8。
1.10 凝菌活性检测将不同微生物菌株进行过夜培养并离心收集菌体, 将不同微生物分别用TBS重悬, 加入终浓度为0.1mg/mL的异硫氰酸荧光素(FITC), 置于暗处染色30min; 染色后采用TBS洗去未结合FITC染料, 并采用TBS-Ca2+ (50mmol/L Tris-HCl, 150mmol/L NaCl, 1mmol/L CaCl2)重悬菌体; 取10μL菌悬液与25μL重组蛋白混匀, 室温孵育1h后, 制装片于荧光显微镜下观察。
1.11 糖结合特异性检测取各种糖(单糖终浓度为100mmol/L)与PtCTL-6蛋白(30μmol/L)混匀, 取染完色的金黄色葡萄球菌用TBS-Ca2+重悬; 取10μL菌悬液和25μL与糖溶液孵育好的重组蛋白混匀, 室温孵育1h后, 制装片于荧光显微镜下观察糖对凝集活性的抑制情况。
1.12 统计分析实验结果所有数据均采用单因素方差分析(one-way analysis of variance, ANOVA)进行检验, 以测试组别之间存在的差异。数据显示为3个平行样的平均值±标准差(n=3), 采用t检验, 其中P < 0.05表示差异显著, P < 0.01表示差异极显著。所有统计分析均采用SPSS 18软件计算, 图表制作采用Origin 8绘制。
2 结果 2.1 三疣梭子蟹C型凝集素PtCTL-6的基因序列分析如图 1所示, 三疣梭子蟹PtCTL-6基因cDNA编码区序列全长为981bp, SMART检索表明该蛋白包含信号肽序列(1—26)、低密度脂蛋白受体(LDLa)功能域(27—68)和CRD功能域(151—312)。预测该多肽链大小为36.8kDa, 等电点pI为5.4。
 |
| 图 1 PtCTL-6的cDNA及其编码的氨基酸序列 Fig. 1 The cDNA and deduced amino acids sequence of PtCTL-6 注:灰色阴影标示为SMART预测的LDLa结构域, 虚线标示为SMART预测的CLECT结构域, 实线标示为信号肽序列, 蓝色加粗斜体序列为关键氨基酸序列, 终止子用“*”表示 |
将原核表达重组质粒pET-32a(+)-PtCTL-6转化入大肠杆菌BL21(DE3)中, 经IPTG诱导表达后, 利用SDS-PAGE检测重组蛋白PtCTL-6的表达(图 2a), 结果发现:该蛋白在16℃诱导20h时检测到可溶性表达。由于重组蛋白带有硫氧还蛋白Trx标签, 故其分子量大于理论分子量, 约为45kDa。利用Ni-NTA亲和层析技术对超声破碎菌体上清中的重组蛋白进行分离纯化, 蛋白电泳检测显示在目的条带位置有一条单一主带(图 2), 这与预期结果一致。经PEG- 20000浓缩后测其浓度约为15μmol/L。
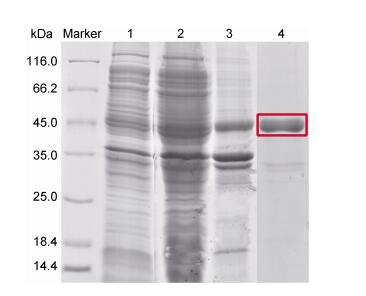 |
| 图 2 PtCTL-6在大肠杆菌BL21(DE3)中表达及纯化的SDS-PAGE结果分析 Fig. 2 The SDS-PAGE analysis of expression and purification of PtCTL-6 注: 1:未诱导大肠杆菌超声破碎液; 2:诱导后大肠杆菌超声破碎液; 3:诱导后大肠杆菌超声破碎上清液; 4:纯化后重组蛋白PtCTL-6;红色框内为目标蛋白 |
为了检测PtCTL-6能否识别病原相关分子模式(PAMP), 我们分别使用不同浓度的重组蛋白与β-肽聚糖(β-glucan)、肽聚糖(PGN)和脂多糖(LPS)这些真菌与细菌细胞壁来源的糖进行孵育, 然后进行ELISA检测。结果表明, 随着重组蛋白PtCTL-6浓度的增加, 与三种PAMPs的结合逐渐增强, 并且在浓度为15μmol/L时, 与β-glucan (图 3a)、LPS (图 3b)和PGN (图 3c)的结合率到达最大值。
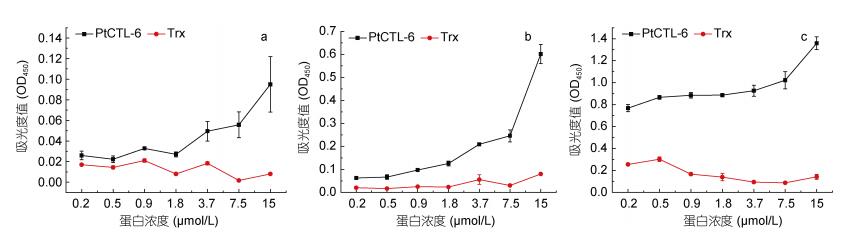 |
| 图 3 PtCTL-6与三种PAMPs结合活性的分析 Fig. 3 The PAMPs binding activity of PtCTL-6 注: a: PtCTL-6与β-glucan结合曲线; b: PtCTL-6与LPS结合曲线; c:PtCTL-6与PGN结合曲线 |
为了检测PtCTL-6是否能直接识别并结合不同微生物进行相互作用, 本文分别将重组蛋白与革兰氏阳性菌代表菌2株(金黄色葡萄球菌、藤黄微球菌)、革兰氏阴性菌3株(大肠杆菌、河弧菌、副溶血弧菌)以及真菌(酿酒酵母、毕赤酵母)进行孵育, 进行ELISA检测, 与对照组吸光度值进行t检验发现差异显著, 表明蛋白均能与这些微生物结合(图 4)。
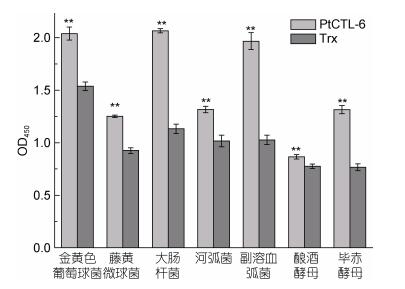 |
| 图 4 PtCTL-6的菌结合谱 Fig. 4 The microbe binding spectrum of PtCTL-6 注:结果差异极显著(P < 0.01)标注** |
通过将微生物与重组蛋白进行孵育并观察菌体是否有块状凝集物, 本文发现PtCTL-6与酿酒酵母与毕赤酵母两种真菌孵育后出现了块状凝集物, 其他菌株均与阴性对照组无区别(图 5)。由此, 我们得出结论, 重组蛋白PtCTL-6对酿酒酵母与毕赤酵母有选择性的凝集作用。
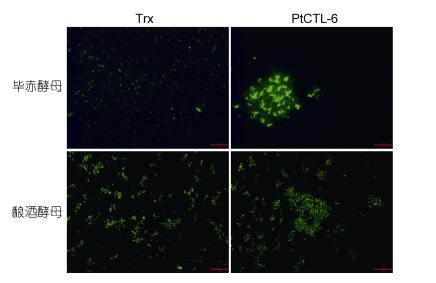 |
| 图 5 PtCTL-6的凝菌活性结果 Fig. 5 The agglutination activity of PtCTL-6 |
选取酿酒酵母检测重组蛋白PtCTL-6的单糖结合特异性(图 6)。发现添加D-甘露糖和D-岩藻糖后重组蛋白PtCTL-6对酿酒酵母的凝集作用被明显抑制, 而添加D-半乳糖、D-乳糖、L-甘露糖、L-岩藻糖和N-乙酰氨基葡糖胺后PtCTL-6的凝菌活性未受影响(未提供该图片), 该结果表明PtCTL-6能特异性结合D-甘露糖和D-岩藻糖。
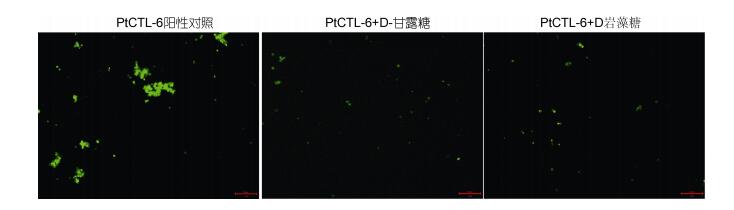 |
| 图 6 PtCTL-6的单糖结合特异性分析 Fig. 6 The carbohydrate binding specificity of PtCTL-6 |
C型凝集素在机体的正常生理发育和内环境稳态的维持起着重要的作用。它能抵御病原入侵, 参与多种免疫应答反应, 在固有免疫与获得性免疫中尤为重要(Renwrantz et al, 1983; Weis et al, 1998; Brown et al, 2018)。近年来, 从不同种类的甲壳动物如大西洋中脊盲虾(Liu et al, 2019)、南美白对虾(Zhang et al, 2019)、菲律宾蛤仔(Li et al, 2019)等, 鉴定出C型凝集素。
本研究鉴定了三疣梭子蟹中含LDLa结构域的C型凝集素PtCTL-6。PtCTL-6含有一个LDLa结构域和一个CRD结构域, LDLa结构域含有富含半胱氨酸的重复序列, 在哺乳动物胆固醇代谢中起重要作用。在固有免疫中, LDLa能够干扰群体感应系统, 通过载脂蛋白B和金黄色葡萄球菌的自身诱导信息素结合, 阻止信号转导(Peterson et al, 2008)。通常, C型凝集素含有一个以上的CRD用以识别糖类, CRD大约由130个左右的氨基酸组成, 它们的氨基酸序列、排序与组成会影响C型凝集素识别与结合糖类的能力(Drickamer et al, 1993; Cambi et al, 2005)。与脊椎动物相比, 无脊椎动物似乎含有更多种基序(Wang et al, 2011), PtCTL-6有两个特征化的关键基序, 分别是DPY和WTD, 该种关键基序并未在无脊椎动物中有过报道。
作为一种重要的模式识别受体, C型凝集素能够识别并结合PAMPs。PtCTL-6能够识别并结合革兰氏阴性菌的PGN, 革兰氏阳性菌的LPS和真菌的β-glucan。进一步的研究表明, PtCTL-6能识别多种微生物, 对其细胞壁有显著的结合活性。三疣梭子蟹其他C型凝集素如PtCTL-2具备类似的免疫识别活性, 对多种PAMPs和微生物有结合活性; 而同样来自三疣梭子蟹的PtCTL-3则对PAMPs无结合活性(Huang et al, 2017)。说明三疣梭子蟹不同C型凝集素在“非己”识别过程中出现分工, 能更加有效地识别外来入侵者。
同时, C型凝集素一大特征是能够识别并非共价结合细胞表面的特定糖类配体, 并通过结合糖蛋白与复合糖凝集细胞(Söderhäll et al, 1992; Lis et al, 1998)。“乳化病”是梭子蟹养殖过程容易发生的危害较大的一种暴发性流行病。经鉴定, 酵母菌为该病病原(许文军等, 2005)。本研究发现PtCTL-6能有效凝集酿酒酵母和毕赤酵母。PtCTL-6或许能有助于清除酵母菌, 维持三疣梭子蟹的健康。
本研究初步探索了PtCTL-6的分子识别机制, 发现该分子的凝集活性能被D-甘露糖和D-岩藻糖显著抑制。表明PtCTL-6能通过识别并结合微生物细胞壁的该两种糖进而识别并结合“非己”成分。不同于脊椎动物C型凝集素的凝集素——糖配体结合模式, 无脊椎动物C型凝集素的往往具备更加广泛和非特异性的糖结合模式, 例如含EPD基序的AiCTL-7能同时识别D-甘露糖和D-半乳糖(Huang et al, 2015); 同样三疣梭子蟹来源的PtCTL-2能结合D-半乳糖、D-乳糖、N-乙酰氨基葡糖胺等5种糖(Huang et al, 2017)。
4 结论综上所述, 本研究克隆鉴定了一个三疣梭子蟹的C型凝集素PtCTL-6, 并探究了它的PAMPs识别能力与凝集能力。该C型凝集素具备新型的糖识别基序DPY/WTD, 首次发现于三疣梭子蟹。PtCTL-6具有广谱识别活性, 并能选择性凝集酵母菌。初步探究其分子识别机制发现该分子具备新型糖识别机制, 能识别并结合D-甘露糖和D-岩藻糖。目前, 甲壳亚门中的C型凝集素的免疫机制仍未明朗(Zhang et al, 2019)。因此, 发现新的C型凝集素并研究其免疫机制与功能有助于理解其结构多样性与功能多样性间的关系, 同时有助于理解C型凝集素在机体内的协作与分工, 利于探究免疫系统的进化过程。
许文军, 徐汉祥, 施慧, 等. 2005. 梭子蟹假丝酵母菌病初步研究. 水产学报, 29(6): 831-836 |
孙颖民, 宋志乐, 严瑞深, 等. 1984. 三疣梭子蟹生长的初步研究. 生态学报, 4(1): 57-64 |
李蒙, 王金凤, 黄骞, 等. 2019. 三疣梭子蟹含硒谷胱甘肽过氧化物酶基因克隆及其表达分析. 海洋与湖沼, 50(1): 149-158 |
Brown G D, Willment J A, Whitehead L, 2018. C-type lectins in immunity and homeostasis. Nature Reviews Immunology, 18(6): 374-389 DOI:10.1038/s41577-018-0004-8 |
Cambi A, Koopman M, Figdor C G, 2005. How C-type lectins detect pathogens. Cellular Microbiology, 7(4): 481-488 DOI:10.1111/j.1462-5822.2005.00506.x |
Drickamer K, Taylor M E, 1993. Biology of animal lectins. Annual Review of Cell Biology, 9: 237-264 DOI:10.1146/annurev.cb.09.110193.001321 |
Huang Y, An L, Hui K M et al, 2014. An LDLa domain-containing C-type lectin is involved in the innate immunity of Eriocheir sinensis. Developmental & Comparative Immunology, 42(2): 333-344 |
Huang M M, Mu C K, Wu Y H et al, 2017. The functional characterization and comparison of two single CRD containing C-type lectins with novel and typical key motifs from Portunus trituberculatus. Fish & Shellfish Immunology, 70: 398-407 |
Huang M M, Zhang H, Jiang S et al, 2015. An EPD/WSD motifs containing C-type lectin from Argopectens irradians recognizes and binds microbes with broad spectrum. Fish & Shellfish Immunology, 43(1): 287-293 |
Li D D, Nie H T, Dong S S et al, 2019. Molecular cloning and expression analysis of C-type lectin (RpCTL) in Manila clam Ruditapes philippinarum after lipopolysaccharide challenge. Fish & Shellfish Immunology, 86: 981-993 |
Lis H, Sharon N, 1998. Lectins:carbohydrate-specific proteins that mediate cellular recognition. Chemical Reviews, 98(2): 637-674 DOI:10.1021/cr940413g |
Liu X L, Ye S, Cheng C Y et al, 2019. Identification and characterization of a symbiotic agglutination-related C-type lectin from the hydrothermal vent shrimp Rimicaris exoculata. Fish & Shellfish Immunology, 92: 1-10 |
Peterson M M, Mack J L, Hall P R et al, 2008. Apolipoprotein B Is an innate barrier against invasive Staphylococcus aureus infection. Cell Host & Microbe, 4(6): 555-566 |
Renwrantz L, Stahmer A, 1983. Opsonizing properties of an isolated hemolymph agglutinin and demonstration of lectin-like recognition molecules at the surface of hemocytes from Mytilus edulis. Journal of Comparative Physiology, 149(4): 535-546 DOI:10.1007/BF00690013 |
Söderhäll K, Cerenius L, 1992. Crustacean immunity. Annual Review of Fish Diseases, 2: 3-23 DOI:10.1016/0959-8030(92)90053-Z |
Vasta G R, Ahmed H, Tasumi S et al, 2007. Biological roles of lectins in innate immunity:molecular and structural basis for diversity in self/non-self recognition. In:Lambris J D ed. Current topics in Innate Immunity. New York:Springer, 27: 389-406 |
Wang L, Huang M, Zhang H et al, 2011. The immune role of C-type lectins in molluscs. Invertebrate Survival Journal, 8(2): 241-246 |
Weis W I, Taylor M E, Drickamer K, 1998. The C-type lectin superfamily in the immune system. Immunological Review, 163(1): 19-34 |
Ye Y F, Meng X J, Mu C K et al, 2016. Acute metabolic response of Portunus trituberculatus to Vibrio alginolyticus infection. Aquaculture, 463: 201-208 DOI:10.1016/j.aquaculture.2016.05.041 |
Zelensky A N, Gready J E, 2005. The C-type lectin-like domain superfamily. The FEBS Journal, 272(24): 6179-6217 DOI:10.1111/j.1742-4658.2005.05031.x |
Zhang X, Pan L Q, Yu J H et al, 2019. One recombinant C-type lectin (LvLec) from white shrimp Litopenaeus vannamei affected the haemocyte immune response in vitro. Fish & Shellfish Immunology, 89: 35-42 |
 2019, Vol. 50
2019, Vol. 50


